子痫前期孕妇血清锌水平与临床指标、炎症指标的相关性及其对HUVEC炎症反应的影响▲
高丽娜 董 燕 刘小玲 何晓春 张玉芳 张 莉 孙 俊 刘小晖
(甘肃省妇幼保健院产二科,甘肃省兰州市 730050)
子痫前期是一种妊娠期常见的多系统功能紊乱疾病,占所有妊娠并发症的5%~7%,是孕产妇和围产儿死亡的主要原因之一[1]。目前普遍认为子痫前期的发病机制是胎盘滋养细胞侵袭迁移不足,子宫螺旋动脉重构受阻,胎盘缺血缺氧,导致炎性因子释放到母体血液中,从而引起一系列临床症状[2-3]。研究证实,肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素(interleukin,IL)-6是引起子痫前期患者全身血管内皮细胞功能障碍和加重母体炎症反应的关键介质[4]。研究表明,脂多糖可诱导血管内皮损伤及炎症反应,参与子痫前期的发生和发展[5-6],但其具体机制尚不完全清楚。近年来有研究显示,人体血清微量元素锌参与机体多种物质的合成和代谢,锌代谢紊乱可引起机体免疫系统功能障碍及血管内皮炎症损伤,从而诱发子痫前期[7]。本研究通过探讨子痫前期孕妇血清锌水平与临床指标、炎症指标(TNF-α和IL-6)之间的相关性,同时采用脂多糖诱导人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)模拟子痫前期内皮炎症反应,探讨锌对HUVEC炎症反应的改善作用,为子痫前期的诊断和防治提供理论依据。
1 资料与方法
1.1 临床资料 选取2019年1月至2020年10月在甘肃省妇幼保健院住院的105例子痫前期孕妇为子痫前期组,纳入标准:符合子痫前期的诊断标准。另选择同期住院的100例健康孕妇作为对照组,纳入标准:因胎位不正 、瘢痕子宫、高龄、社会因素等原因行剖宫产。两组排除标准:(1)合并原发性肾脏疾病、糖尿病、甲状腺疾病、高血压病的患者;(2)双胎或多胎妊娠;(3)复发性流产、胎儿宫内生长受限、胎盘早剥、血栓形成等患者。子痫前期组孕妇年龄18~40(30.59±5.01)岁,入组时孕周32~40(36.93±2.76)周,身高153.0~170.5(165.20±5.19)cm,入组时体重62.5~85.5(76.70±8.67)kg。对照组孕妇年龄22~38(29.50±2.56)岁,入组时孕周36~40(37.50±1.16)周,身高150.5~168.5(164.20±5.45)cm,入组时体重55.3~80.3(69.70±7.16)kg。两组孕妇的年龄、孕周、身高差异均无统计学意义(均P>0.05),具有可比性。所有孕妇均签署知情同意书,本研究经甘肃省妇幼保健院医学伦理委员会审查批准(2022GSFY伦审[21]号)。
1.2 主要试剂与材料 HUVEC(上海雅吉生物科技有限公司);ZnSO4(Sigma Aldrich Lab & Production Materials公司,批号:M2643-500G);CCK-8试剂盒(北京索莱宝科技有限公司,批号:CA1210);胎牛血清(Gibco公司,批号:26140079),RPMI-1640高糖培养基(Gibco公司,批号:C11965500BT);脂多糖(Sigma Aldrich Lab & Production Materials公司,批号:017M4112V);青霉素-链霉素溶液、胰蛋白酶消化液、总蛋白提取试剂盒(碧云天生物技术研究所,批号:C0222、C0204、P0010S);TNF-α兔抗人一抗[艾比玛特医药科技(上海)有限公司,批号:PY19810]; IL-6兔抗人一抗[艾比玛特医药科技(上海)有限公司,批号:PY6087];β-actin(Santa Cruz公司,批号:sc-47778HRP);GAPDH(沈阳万类生物科技有限公司,批号:WL01114);总RNA提取试剂盒[天根生化科技(北京)有限公司,批号:DP430];反转录试剂盒、实时荧光定量PCR试剂盒(TaKaRa公司,批号:RR037A、RR420A);TNF-α和IL-6的ELISA试剂盒(北京欣博盛生物科技有限公司,批号:300-01BH、AF-200-06);引物[生工生物工程(上海)股份有限公司]。
1.3 研究方法
1.3.1 检测两组孕妇血清锌和炎症因子水平:采集两组孕妇入院时空腹肘静脉血5 mL,静置30 min后,以3 500 r/min离心5 min(离心温度4 ℃),吸取上层血清冷冻保存。取适量血清样本用去离子水稀释2倍后,置于原子吸收分光光度计(北京中兴百汇科技有限公司,型号:BH2100T)上,采用原子吸收光谱法测定血清锌水平。另取适量血清采用ELISA检测TNF-α、IL-6水平,严格按照试剂盒说明书进行操作。
1.3.2 收集子痫前期组孕妇的临床指标及新生儿出生体重:收集子痫前期组孕妇入院时的血压,测量前嘱孕妇休息5 min并且排空膀胱,用水银血压计测量血压两次,取两次读数的平均值并记录。收集子痫前期组孕妇入院后留取的24 h尿液作为尿蛋白检测标本,采取免疫比浊法检测24 h尿蛋白。记录子痫前期组新生儿的出生体重。
1.3.3 细胞培养:将HUVEC接种于细胞培养瓶中,加入5 mL含10%胎牛血清、100 μg/mL青霉素-链霉素溶液的RPMI-1640高糖培养基,置于37 ℃、5% CO2培养箱内进行培养,每2~3 d用0.25%胰蛋白酶消化传代1次,待细胞密度达85%~90%时用0.25%胰蛋白酶消化后吹打细胞,将细胞接种至96孔板,待细胞融合至70%~80%进行后续实验。
1.3.4 ZnSO4最佳干预浓度的筛选:将生长对数期的HUVEC以100 μL/孔接种至96孔板中,继续置于37 ℃、5% CO2培养箱中培养,待细胞融合至80%时,分别加入不同浓度ZnSO4(20 μmol/L、40 μmol/L、80 μmol/L、100 μmol/L、150 μmol/L、200 μmol/L)处理24 h,然后每孔加入 10 μL CCK-8试剂,放至37 ℃、5% CO2培养箱中共同孵育4 h,取出培养板,置于酶标仪(北京德泉兴业商贸有限公司,型号:Epoch)上检测各孔在波长490 nm处的吸光度值,以空白组(不加任何试剂)作为参照,计算存活率(%)=各组干预后24 h吸光度值/空白组干预前的吸光度值×100%。随后在空白组及各个不同ZnSO4浓度组中加入100 ng/mL脂多糖,刺激12 h后再次检测细胞在波长490 nm处的吸光度值, 以空白组作为参照,计算存活率(%)=各组干预后24 h吸光度值/空白组干预前吸光度值×100%。上述实验均重复3次。
1.3.5 ZnSO4对脂多糖诱导的HUVEC炎症反应的干预:对照组(无任何处理)、ZnSO4组(100 μmol/L ZnSO4处理24 h)、脂多糖组(100 ng/ mL脂多糖刺激12 h)、脂多糖+ZnSO4组(100 μmol/L ZnSO4处理24 h后再用100 ng/mL脂多糖刺激12 h)。细胞接受不同的刺激处理后置于37 ℃、5% CO2培养箱中培养,以备后续实时荧光定量PCR检测和Western blot检测。各组均设置3个复孔。
1.3.6 实时荧光定量PCR检测各组HUVEC中TNF-α和IL-6 mRNA表达水平:按照总RNA提取试剂盒说明书提取细胞总RNA,用分光光度计(SimpliNano公司)分析RNA纯度及浓度,按反转录试剂盒说明书将RNA反转录成cDNA,进行实时荧光定量PCR。实时荧光定量PCR反应体系(共20 μL)包括TB Green Premix Ex TaqⅡ 10 μL、上下游引物各0.8 μL、RNase Free ddH2O 6.4 μL、cDNA 2 μL。IL-6上游引物为5′-ACTTCACAGAGGATACCAC-3′,下游引物为5′-GCATCATCGCTGTTCATAC-3′;TNF-α上游引物为5′-GGACTAGCCAGGAGGGAGAACAG-3′,下游引物为5′-GCCAGTGAGTGAAAGGGACAGAA-3′;GAPDH上游引物为5′-GGTGAAGGTCGGTGTGAACG-3′,下游引物为5′-CTCGCTCCTGGAAGATGGTG-3′。反应条件:95 ℃预变性 30 s,95 ℃变性 5 s、57 ℃退火34 s,扩增40个循环。以GAPDH为内参,采用2-ΔΔCt法计算TNF-α、IL-6 mRNA相对表达水平。上述实验重复3次。
1.3.7 Western blot测定各组HUVEC中TNF-α、IL-6蛋白表达水平:提取各组细胞的总蛋白,取30 μg蛋白样品于12%分离胶和4%浓缩胶中进行SDS-PAGE电泳;将蛋白质湿转至PVDF膜;用5%脱脂牛奶封闭2 h后,PBST洗涤3次,10 min/次;加入TNF-α、IL-6相应一抗各10 μL(稀释比均为1 ∶5 000),4 ℃孵育过夜;PBST洗涤3次,10 min/次;加入10 μL辣根过氧化物酶标记的山羊抗兔二抗(稀释比为1 ∶5 000),室温孵育2 h;PBST洗涤3次,10 min/次。使用ECL发光显色,以GAPDH为内参(稀释比为1 ∶5 000),应用Image Lab软件对蛋白条带的灰度值进行分析,实验重复3次。
1.4 统计学分析 采用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,进一步两两比较采用SNK-q检验,两组间比较采用两独立样本t检验;采用Pearson检验分析指标间的相关性。以P<0.05表示差异有统计学意义。
2 结 果
2.1 两组孕妇血清锌、TNF-α和IL-6水平的比较 子痫前期组孕妇血清锌水平低于对照组,血清TNF-α和IL-6水平均高于对照组(均P<0.05)。见表1。

表1 两组孕妇血清锌、TNF-α和IL-6水平的比较(x±s)
2.2 子痫前期孕妇血清锌水平与临床指标、炎症指标的相关性分析 子痫前期孕妇血清锌水平与收缩压、舒张压、24 h尿蛋白水平和血清TNF-α、IL-6水平均呈负相关(r=-0.374,P<0.001;r=-0.380,P<0.001;r=-0.396,P<0.001;r=-0.667,P<0.001;r=-0.723,P<0.001),与新生儿出生体重呈正相关(r=0.292,P<0.001)。
2.3 不同浓度ZnSO4对 HUVEC存活率的影响 HUVEC存活率有随ZnSO4浓度升高而降低的趋势,与空白组比较,100 μmol/L ZnSO4组、150 μmol/L ZnSO4组和200 μmol/L ZnSO4组的存活率均降低(均P<0.05),见表2。经脂多糖刺激后HUVEC存活率均降低(均P<0.05),其中在ZnSO4浓度为100 μmol/L时HUVEC的存活率最高(均P<0.05),为干预细胞的最佳浓度,故选用100 μmol/L ZnSO4浓度进行后续实验,见表3。
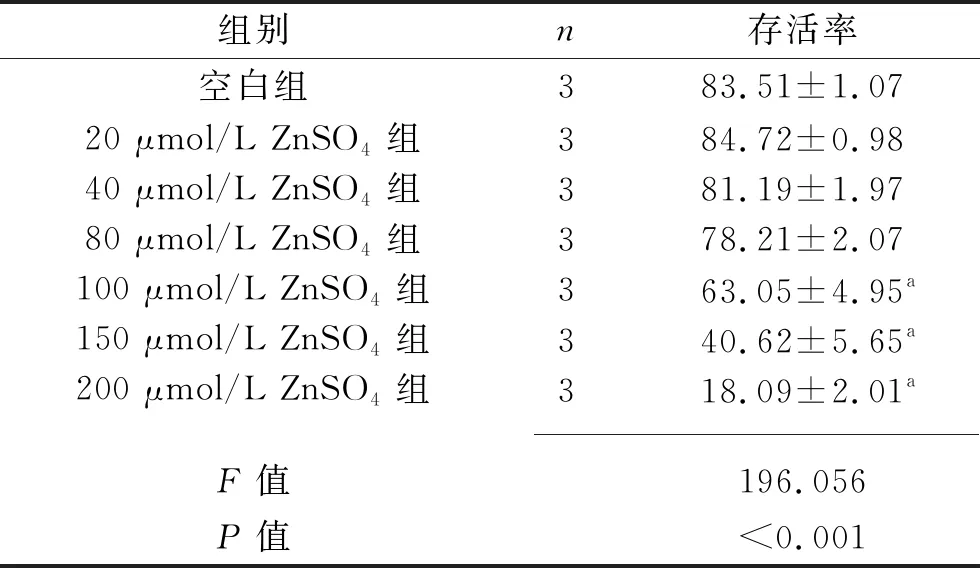
表2 不同浓度ZnSO4对HUVEC存活率的影响(x±s,%)
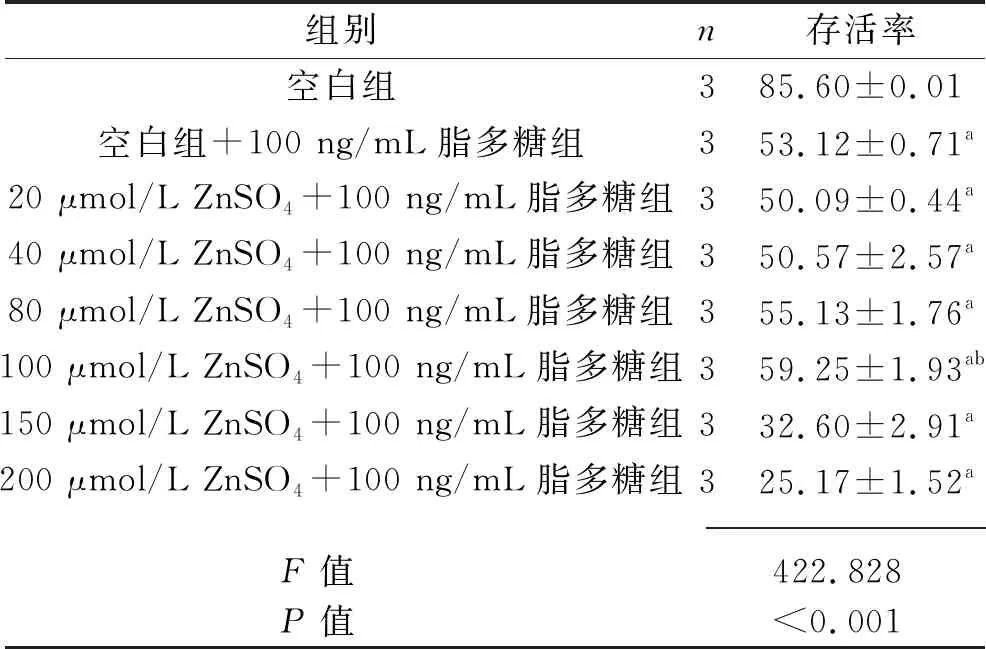
表3 不同浓度ZnSO4对脂多糖处理后的HUVEC存活率的影响(x±s,%)
2.4 ZnSO4对脂多糖诱导的HUVEC炎症反应的影响 ZnSO4组TNF-α和IL-6的mRNA和蛋白表达水平与对照组相比,差异均无统计学意义(均P>0.05);脂多糖组 TNF-α和IL-6的mRNA和蛋白表达水平均高于对照组(均P<0.05); 脂多糖+ZnSO4组TNF-α和IL-6的mRNA和蛋白表达水平均低于脂多糖组(均P<0.05)。见表4。
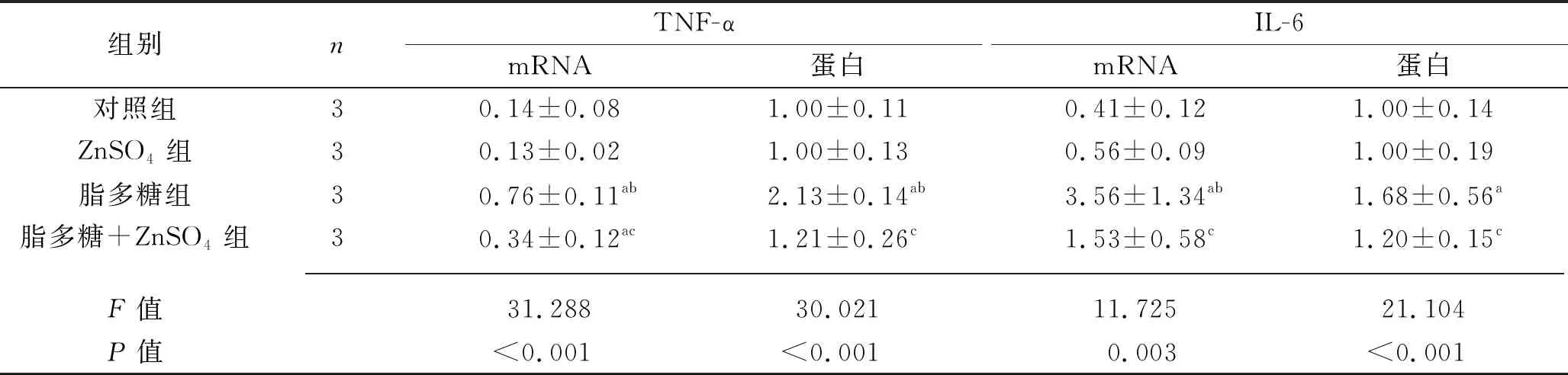
表4 4组HUVEC中TNF-α、IL-6的mRNA和蛋白相对表达水平的比较(x±s)
3 讨 论
近年来,子痫前期的发生率和病死率不断上升[9],严重影响孕妇的生命健康及胎儿的生长发育,其发病机制至今仍未完全明确,因此寻找子痫前期的有效防治策略仍是世界性难题。子痫前期发病机制涉及多方面因素,包括血管内皮功能障碍、过度炎性反应、胎盘滋养细胞侵袭迁移不足、母胎免疫耐受异常等[8]。其中血管内皮功能障碍及过度炎性反应是引起子痫前期相关临床表现的重要因素。在正常妊娠过程中,孕妇处于轻微持续炎症状态,而子痫前期孕妇体内促炎细胞因子水平明显升高,抗炎细胞因子水平明显下降,导致孕妇体内出现过度的全身炎症反应[9]。研究证实,TNF-α和IL-6在子痫前期患者血清及胎盘组织中均呈高表达[10]。在胎盘形成时期,异常增高的TNF-α破坏胎盘结构的发育,打破母体循环中血管舒张因子和血管收缩因子的平衡,而IL-6阻碍滋养细胞侵袭迁移,使子宫螺旋动脉重塑失败,减少母体血管舒张因子的释放[11];在妊娠中晚期,TNF-α和IL-6共同影响肾素-血管紧张素系统、交感神经系统等血压调节系统,使孕妇血压进一步增高,加重肾脏功能损害[12]。有学者在肾素-血管紧张素系统障碍所诱发的子痫前期小鼠模型中也发现了TNF-α和IL-6异常增高[13]。在子痫前期患者的血管内皮中,TNF-α和IL-6可以激活内皮细胞以产生黏附分子,并上调血管收缩因子内皮素-1水平,从而引起血管内皮损伤,导致全身血管内皮功能障碍[14]。同时,TNF-α可破坏其他促炎细胞因子和抗炎细胞因子之间的平衡[15],使子痫前期患者的病情进一步加重[16]。本研究结果显示,子痫前期孕妇血清TNF-α和IL-6水平均高于正常孕妇(均P<0.05),说明炎症反应在子痫前期的发病过程中可能发挥重要作用。炎性反应被过度激活的过程受到多种因素的影响,尤其是微量元素[17]。近年来有研究显示,微量元素是维持机体正常免疫应答、免疫监测和免疫自稳的重要因素之一[18-19]。脂多糖可引起血管内皮功能障碍[6],可模拟子痫前期出现的血管内皮炎症反应[5],因此,本研究采用脂多糖诱导HUVEC炎症反应,探究锌对内皮细胞炎症反应的影响。
锌是妊娠期必需的微量营养素,其参与胎盘及胎儿的发育[20],同时也是维持细胞稳态、细胞功能及免疫调节的必需元素[21]。锌在体内的代谢处于动态平衡,其代谢紊乱可引起机体免疫功能障碍,引发一系列与免疫损伤有关的症状[22]。子痫前期也是一种免疫炎性疾病, 锌代谢失衡可能增加子痫前期易患性,并对子痫前期的发生和发展产生一定影响[23]。Wibowo等[24]的研究显示,与正常孕妇相比,妊娠期高血压患者血清锌水平明显降低。本研究结果显示,子痫前期孕妇血清锌水平低于正常孕妇(P<0.05),与上述研究结果一致。本研究还发现,子痫前期孕妇血清锌水平与收缩压、舒张压、24 h尿蛋白水平呈负相关,与新生儿出生体重呈正相关(均P<0.05),因此推测锌可能参与子痫前期的发生和发展,同时也参与胎儿生长发育的调控。锌在体内参与多种酶和活性因子的组成,可以直接促进蛋白质之间的相互作用,并可调节基因表达和免疫炎性反应等[25]。锌是细胞内的第二信使,随着细胞内环境的改变,锌的浓度也随之发生改变,同时锌也能改变细胞内的信号传导[26]。因此,锌对于维持细胞正常生理活动及功能有着极其重要的作用。缺锌可引起免疫缺陷,增加炎性因子的释放,如IL-6、IL-1β及TNF-α等[27]。本研究结果显示,子痫前期患者血清锌水平与TNF-α、IL-6水平呈负相关(均P<0.05),提示锌可能是子痫前期患者机体免疫炎性反应被过度激活的重要信号因子。本研究采用ZnSO4处理 HUVEC 24 h 后再用脂多糖刺激12 h,结果显示,脂多糖+ZnSO4组TNF-α和IL-6的mRNA和蛋白表达水平均低于脂多糖组(均P<0.05),表明锌可以下调脂多糖诱导的HUVEC炎性因子表达水平,对HUVEC有一定保护作用,从而抑制子痫前期炎性反应。
综上所述,子痫前期患者血清锌水平与临床指标、炎症指标存在相关性,锌可减轻脂多糖诱导的HUVEC炎症反应,锌可能参与子痫前期的发生和发展。因此,对于子痫前期高危人群,动态监测妊娠期间血清锌水平,并指导孕妇合理摄入含锌食物,对于预防子痫前期的发生具有重要的临床意义。

