超重和肥胖的2型糖尿病患者二联口服药物治疗的临床疗效分析
陈建霞,代凌,邓川芬,王玲,刘敏,李正宇
泸州市泸县人民医院内分泌科,四川泸州 646100
随着社会的发展预计2045年T2DM全球患病人数将达到7亿[1]。由于饮食及生活方式的变化导致超重、肥胖率明显上升[2],糖尿病患病率也呈现急剧 上 升[3],从1994年2.5%上 升 到2017年 的11.2%[4]。超重及肥胖的比例占到了30%[5]。肥胖还是T2DM重要危险因素[6-7]。超重(BMI≥24 kg/m2)的T2DM与BMI正常人相比发病率增高3.5~4.6倍[8]。研究中显示BMI>25 kg /m2的T2DM的血糖控制较差[9],心血管事件、死亡风险也明显增高[10],所以要管控血糖和体质量。指南均建议强化方式降低体质量[11],但是T2DM患者减低体质量很困难,传统方法是二甲双胍(MET)为一线药物,特别是超重和肥胖患者[12];随着病程进展MET降糖效果下降,这时需要联合治疗,钠-葡萄糖协同转运蛋白2抑制剂和二肽基肽酶-4抑制剂是目前热门药物,除了降糖外,联合MET还有其他获益,恩格列净和维格列汀是代表性的药物,本研究从临床角度分析2020 年5月—2021年 4月泸州市泸县人民医院二甲双胍缓释片分别联合恩格列净74例和维格列汀75例治疗超重和肥胖T2DM患者的疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料
采用回顾性分析,研究本院收治的150例二甲双胍缓释片单药治疗血糖不达标,超重或肥胖T2DM患者的临床资料,根据联合用药方式的不同,分为恩格列净组和维格列汀组。在恩格列净组中,1例因不良反应反复发生停药,最终恩格列净组入组74例,男40例,女34例;平均年龄(54.03±8.1)岁,平均HbAIc(8.12±0.84)%,平均体质量(78.85±8.43)kg。维格列汀组入组75例,男38例,女37例;平均年龄(52.9±8.4)岁,平均HbAIc(7.98±0.91)%,平均体质量(79.12±8.31)kg。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
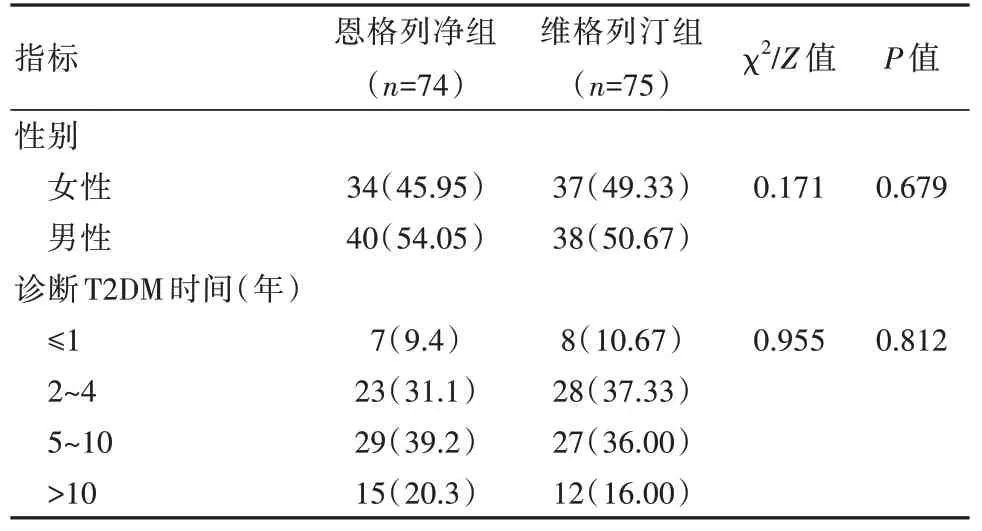
表1 两组患者一般资料比较[n(%)]
1.2 纳入与排除标准
纳入标准:①诊断明确的≥18岁超重或肥胖(BMI≥24 kg/m2)的T2DM患者;②已给予了饮食及运动疗法后,只使用了二甲双胍降血糖治疗血糖不达标(HbA1c:7%~10.5%);③既往未使用减肥药物。
排除标准:①估算肾小球滤过率(eGFR)≥50 mL/(min·1.73 m2)(使用MDRD方程);②近期内有心血管事件史、多发性内分泌肿瘤史、怀孕、哺乳、意外怀孕、胰腺炎、反复尿路感染、肝肾功能异常、免疫性疾病、精神类疾病或糖尿病急性并发症。
1.3 方法
两组患者已经给予饮食、运动疗法,并口服二甲双胍缓释片(国药准字H20050349;规格:0.5 g/次,2次/d,餐后服用)单药治疗,1 g/d起始,逐渐增至1 500~2 000 mg/d或者患者能耐受最大剂量,维持治疗时间≥1个月,血糖不达标。恩格列净组:二甲双胍缓释片联合恩格列净(国药准字 H20170351;规格:10 mg/次,1次/d,空腹口服),剂量10 mg/d;维格列汀组:二甲双胍缓释片联合维格列汀(国药准字 H20181103,;规格:50 mg/次,2次/d,早晚餐前口服),100 mg/d,分两次口服。观察治疗24周后情况。
1.4 观察指标
1.4.1血糖指标 评估第24周HbA1c较治疗前的变化水平,评估治疗效果:治疗24周后糖化血红蛋白(glycated hemoglobin, HbA1c)达到血糖标准的患者例数/总例数×100.00%,采集早上7点空腹血液。
1.4.2其他临床指标 评估第24周时FPG、2 hPG较治疗前的变化,并探索治疗24周后BMI、血压[坐位收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP)]、晨空腹血脂、尿微量白蛋白肌酐比(urinary albumin-creatinine ratio, UACR)、胰岛素的抵抗指数(insulin resistance index, HOMA-IR)变化。BMI计算公式:体质量/身高2,单位:kg/m2;HOMA-IR计 算 方 法:HOMA-IR=FPG×FINS/22 (FINS:空腹胰岛素水平);安全评估:药物的不良反应以及低血糖的发生情况。
1.5 统计方法
采用SPSS 25.0统计学软件处理数据,计量资料符合正态分布,以(±s)表示,比较采用t检验;计数资料以频数和百分率(%)表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血糖水平及HbAlc比较
恩格列净组和维格列汀组治疗24周后FPG、2 hPG、HbAIc 指标均较治疗前明显降低,差异有统计学意义(P<0.05);组间比较,差异无统计学意义(P>0.05),见表2;治疗后恩格列净组HbAlc达标率(HbAlc<7.0%)为55.40%(41/74),维格列汀组为50.66%(38/75)。
表2 两组患者糖代谢指标的变化对比(±s)
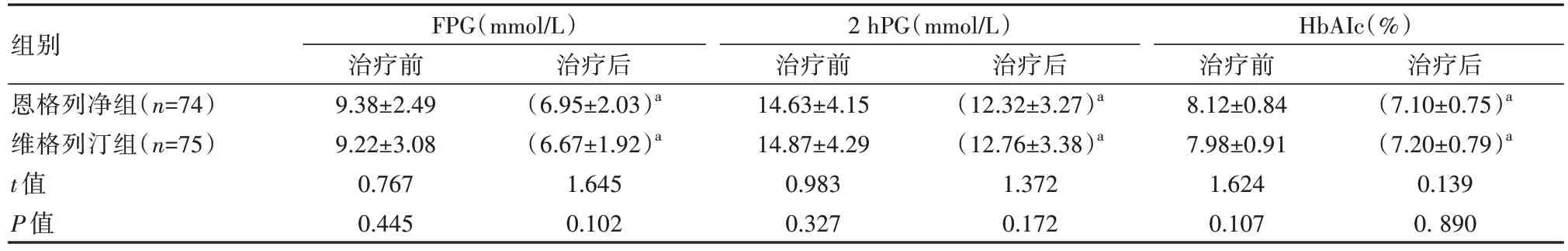
表2 两组患者糖代谢指标的变化对比(±s)
注:a表示与本组治疗前比较,P<0.05
组别恩格列净组(n=74)维格列汀组(n=75)t值P值FPG(mmol/L)治疗前9.38±2.49 9.22±3.08 0.767 0.445治疗后(6.95±2.03)a(6.67±1.92)a 1.645 0.102 2 hPG(mmol/L)治疗前14.63±4.15 14.87±4.29 0.983 0.327治疗后(12.32±3.27)a(12.76±3.38)a 1.372 0.172 HbAIc(%)治疗前8.12±0.84 7.98±0.91 1.624 0.107治疗后(7.10±0.75)a(7.20±0.79)a 0.139 0. 890
2.2 两组患者BMI、血压、血脂、UACR变化对比
治疗后两组BMI较用药前降低,恩格列净组体质量、腰围显著低于维格列汀组,差异有统计学意义(P<0.05)。两组治疗后血压(SBP/DBP)、TC、TG、HDL-C、LDL-C、UACR均较前降低,差异有统计学意义(P<0.05),组间比较差异无统计学意义(P>0.05)。见表3、表4。
表3 两组患者体质指标变化对比(±s)

表3 两组患者体质指标变化对比(±s)
注:a表示与本组治疗前比较,P<0.05
组别恩格列净组(n=74)维格列汀组(n=75)t值P值体质量(kg)治疗前78.85±8.43 79.12±8.31 0.707 0.481治疗后(75.39±7.85)a(77.86±9.23)a 2.485 0.014 BMI(kg/m2)治疗前27.11±1.81 27.53±2.02 1.897 0.060治疗后(25.94±2.27)a(26.87±1.96)a 0.975 0.030腰围(cm)治疗前98.56±7.62 99.48±8.17 1.676 0.960治疗后(96.32±7.98)a(98.54±7.96)a 5.263<0.001
表4 两组患者血压、血脂、UACR治疗前后指标变化对比(±s)
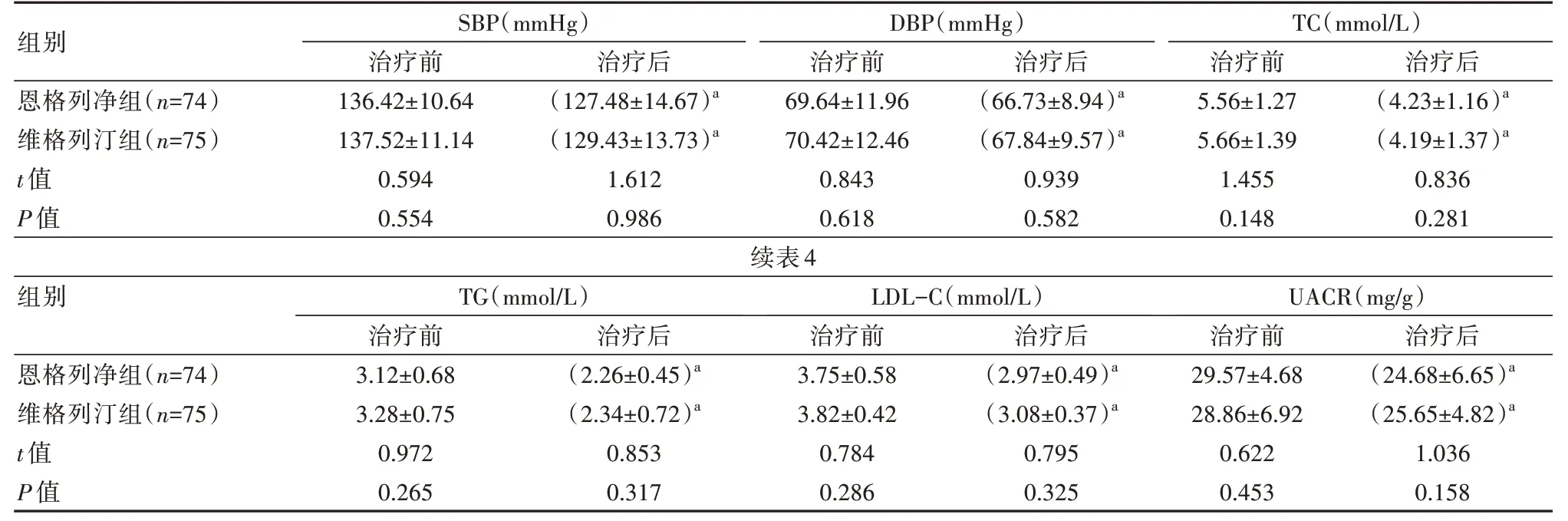
表4 两组患者血压、血脂、UACR治疗前后指标变化对比(±s)
注:a表示与本组治疗前比较,P<0.05
组别恩格列净组(n=74)维格列汀组(n=75)t值P值续表4组别恩格列净组(n=74)维格列汀组(n=75)t值P值SBP(mmHg)治疗前136.42±10.64 137.52±11.14 0.594 0.554 TG(mmol/L)治疗前3.12±0.68 3.28±0.75 0.972 0.265治疗后(127.48±14.67)a(129.43±13.73)a 1.612 0.986治疗后(2.26±0.45)a(2.34±0.72)a 0.853 0.317 DBP(mmHg)治疗前69.64±11.96 70.42±12.46 0.843 0.618 LDL-C(mmol/L)治疗前3.75±0.58 3.82±0.42 0.784 0.286治疗后(66.73±8.94)a(67.84±9.57)a 0.939 0.582治疗后(2.97±0.49)a(3.08±0.37)a 0.795 0.325 TC(mmol/L)治疗前5.56±1.27 5.66±1.39 1.455 0.148 UACR(mg/g)治疗前29.57±4.68 28.86±6.92 0.622 0.453治疗后(4.23±1.16)a(4.19±1.37)a 0.836 0.281治疗后(24.68±6.65)a(25.65±4.82)a 1.036 0.158
2.3 两组患者HOMA-IR变化对比
HOMA-IR水平两组均较治疗前降低,差异有统计学意义(P<0.05),组间比较,差异无统计学意义(P>0.05)。见表5。
表5 两组患者HOMA-IR治疗前后变化对比(±s)
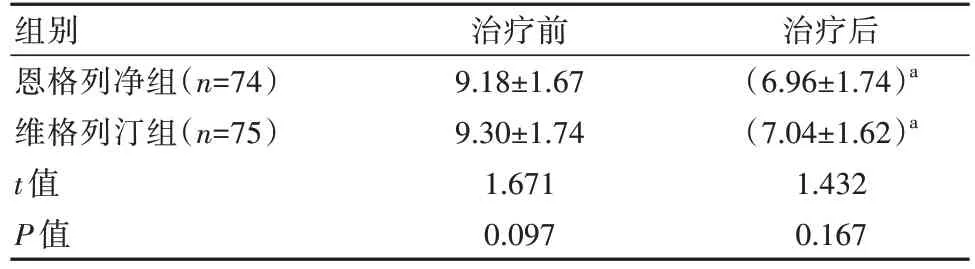
表5 两组患者HOMA-IR治疗前后变化对比(±s)
注:a表示与本组治疗前比较,P<0.05
组别恩格列净组(n=74)维格列汀组(n=75)t值P值治疗前9.18±1.67 9.30±1.74 1.671 0.097治疗后(6.96±1.74)a(7.04±1.62)a 1.432 0.167
2.4 两组患者不良反应对比
恩格列净组1例(1.35%)出现一过性恶心、呕吐,4例(5.40%)尿频、尿急、尿痛,给予抗感染治疗后症状消失,3例(4.05%)发现尿酮体阳性,给予饮食调控后转阴。维格列汀组2例(2.67%)发生恶心胃肠道不适,给予对症治疗改善,无停药患者;恩格列净组和维格列汀组均未发生严重低血糖,轻度低血糖恩格列净组1例(1.35%),维格列汀组1例(1.33%),低血糖反应恩格列净1例(1.35%)。恩格列净组总不良反应较维格列汀组多,差异有统计学意义(P<0.05)。见表6。
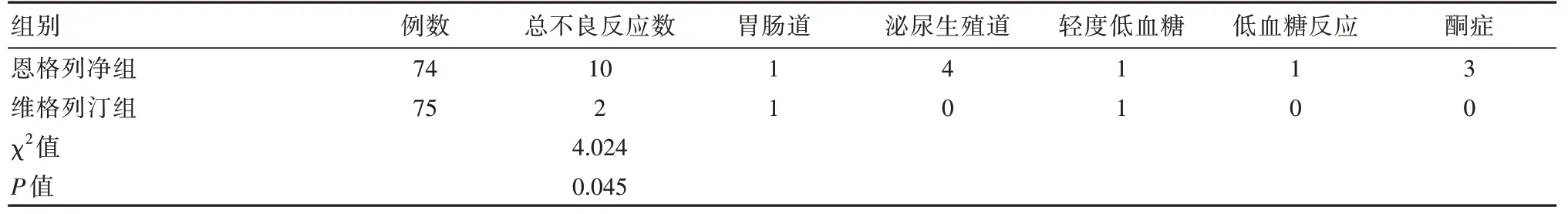
表6 两组患者不良反应比较
3 讨论
肥胖是一种慢性进行性疾病,T2DM的发病风险随着腰围和BMI的增加呈上升趋势,可见两者有着密切的关系[13]。T2DM合并超重或肥胖会加剧血糖控制的难度,导致胰岛素的抵抗性增加,加重糖尿病患者的病情[14-16],进而产生严重心血管等疾病。许多国家的指南均建议2DM患者一线用药为二甲双胍,该药可以抑制肝糖的输出,增加对胰岛素的敏感性,从而使血糖水平降低,可使早期糖尿病HbAIc水平下降1.2%[17],在短期内血糖可显著下降,但是并不能阻止胰岛β细胞功能逐渐衰退,不能长期维持有效平稳的血糖水平,如果增加剂量,胃肠道的不良反应的发生风险可能会增加。这时就需要超重和肥胖T2DM及时联合其他药物降血糖治疗。有大量研究证据表明,降低体质量可以降低血糖水平,而且,减重是糖尿病指南中一个非常重要的建议,但在T2DM患者身上,降低体质量的实施情况并不好。尽管如此,在临床中针对超重和肥胖的T2DM选择两联口服药物联合治疗时,需要兼顾血糖和体质量来选择药物。
在本研究中,选择了两种药物联合治疗超重和肥胖的T2DM,可以看出,在超重和肥胖的T2DM不管二甲双胍缓释片联合恩格列净还是维格列汀,治疗后血糖明显改善,还能够降低体质量、血压,改善脂代谢水平,减轻胰岛素抵抗,延缓糖尿病进展。恩格列净是一种口服有效、独立于胰岛素外、高效高选择性的钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,是耐受性良好的降血糖药物,减少肾脏对游离葡萄糖的再吸收,降低肾脏的葡萄糖阈值,最终达到葡萄糖从肾脏排泄增加,从而降低血糖,同时还可以降低胰腺β细胞的负荷,如果血糖水平下降,尿中的葡萄糖排泄将减少,可以防止发生严重低血糖,可作为单药治疗,也可以与其他具有互补作用机制的降血糖药物联合降糖治疗,可以改善T2DM患者的血糖水平[18]。除了降血糖外,恩格列净在降低体质量和血压方面也具有一定的优势[19]。维格列汀是二肽基肽酶-4(DPP-4)抑制剂,可防止胰高血糖素样肽1(GLP-1)和葡萄糖依赖的胰岛素多肽失活,延长肠促素对营养摄入的活性来改善血糖控制。可以刺激胰岛素释放,减少胰高血糖素分泌,并以葡萄糖依赖的方式改善β细胞功能[20]。它还可以增加细胞对葡萄糖的反应性,而且不会导致体质量增加或增加低血糖风险[21]。根据VERIFY试验的研究表明,在T2DM患者中,早期联合治疗(维格列汀+二甲双胍)比最初的二甲双胍单药治疗能更好地控制血糖[22]。
经过联合治疗第24周两组的血糖达标率明显提高。其中恩格列净组HbA1c<7%患者比例55.40%,维格列汀组为50.66%。两组均无严重低血糖发生,由此可见两组的降糖效果相当,低血糖风险很低,这与同许多类似实验结果相同[23-25],这也是这两类降血糖药物的优势。从本研究中得出,恩格列净作为一种联合治疗方法,不仅降低血糖,在体质量、BMI、腰围降低幅度优于维格列汀组,降低体质量在其他研究中也有体现[26-29],这种优势无疑是超重和肥胖T2DM的最佳选择[30-31],降低血糖同时减轻体质量,并且还能降低胰岛素抵抗,除此外,还能看到对降低血压的优势[24]。在不良反应方面,维格列汀具有优势,恩格列净组5.33%发生了泌尿生殖道感染[25,32],其大部分患者通过治疗都能得到改善。
综上所述,恩格列净、维格列汀分别联合二甲双胍缓释片能确切有效地降低超重和肥胖T2DM患者血糖,特别是恩格列净在除降血糖外,在降低体质量方面优于维格列汀,从而可减轻胰岛素抵抗,更有利血糖的控制,减少并发症发生,为超重和肥胖的T2DM患者提供了更好的口服药物联合治疗方案。本研究中高BMI的患者数量偏少,样本数量和观察时间有限,以后还期待长期的观察,以评估该两种药物在降血糖方面的持久性及其他获益。

