免疫联合治疗增强Vγ9Vδ2 T细胞的抗肿瘤活性①
苏凯 赵报 崔忆旋 马士崟(蚌埠医学院第一附属医院,蚌埠 233000)
T淋巴细胞是机体适应性免疫应答的重要组成,在对抗外界干扰和机体自我调节方面至关重要。根据T细胞抗原受体(T cell antigen receptor,TCR)不同,T细胞可分为αβT细胞和γδT细胞。αβT细胞主要参与获得性免疫过程,受主要组织相容性复合体(major histocompatibility complex,MHC)限制,但γδT细胞对抗原的识别则不具有MHC限制性。γδT细胞具有抗原提呈能力,在应对机体免疫疾病和抗肿瘤等过程中发挥重要作用[1]。γδT细胞被认为是抗肿瘤免疫的重要参与细胞,作为最有利于预后的单一免疫细胞,具有肿瘤免疫治疗的诸多特性,如细胞毒性、易扩增和良好的安全性等。
与B细胞相同,γδT细胞与αβT细胞利用V(D)J基因重排产生不同类型受体识别抗原。丰富的受体类型归因于TCR中CDR3的组合多样性和连接多样性。其中连接多样性是在V(D)J基因片段连接过程中产生的,其方法包括:①不对称地打开发夹编码端,允许结合回文序列;②通过末端脱氧核苷酸转移酶(TdT)在连接处引入额外的核苷酸;③核酸外切酶裂解导致核苷酸在两个编码端边界进行修剪[2-3]。γδT细胞表达变量Vγ和Vδ链,根据结构和功能不同,可进一步将γδT细胞分为“Vδ2”“Vδ1”和较少的“Vδ3”或“Vδ5”链表达细胞。尽管无限制且理论上具有较高的组合多样性,但Vδ2链优先与Vγ9配对,这些Vγ9Vδ2 T细胞占外周血T细胞的1%~5%,在人体免疫中发挥重要作用,是成人血液循环中的优势γδT细胞群[4-5]。Vγ9Vδ2 T细胞基因表达谱是典型的αβT和NK细胞杂合,其抗原活化具有特异性和接触依赖性,且不受免疫排斥反应限制,成为近年肿瘤免疫治疗的研究热点[6]。
1 Vγ9Vδ2 T细胞识别激活和肿瘤免疫杀伤
由于不受传统MHC限制,Vγ9Vδ2 T细胞可直接识别并杀死恶性肿瘤细胞。Vγ9Vδ2 T细胞主要识别磷酸抗原,无需加工、呈递,且无MHC限制性。哺乳细胞磷酸抗原主要通过甲羟戊酸途径合成,除感染或肿瘤转化阶段外,正常生理状态下,磷酸抗原浓度不足以激活Vγ9Vδ2 T细胞。因此,Vγ9Vδ2 TCR的工作模式类似于模式识别受体,可感知恶性转化细胞或感染细胞代谢改变。另一方面,Vγ9Vδ2 T细胞表达NKG2D受体,NKG2D在Vγ9Vδ2 T细胞介导的T细胞免疫应答(细胞因子产生、增殖和细胞毒活性)中提供重要刺激信号。Vγ9Vδ2 T细胞通过NKG2D识别肿瘤细胞表面表达的NKG2DL(包括MICA、MICB和ULBP家族成员)发挥肿瘤杀伤功能[7]。同时刺激Vγ9Vδ2 TCR和NKG2DL可更有效刺激Vγ9Vδ2 T细胞,从而具有更强的抗肿瘤活性。磷酸抗原是Vγ9Vδ2 T细胞的主要活化因子,可被氨基双膦酸盐(NBPs)上调。NBPs可通过抑制IPP处理酶法尼基焦磷酸合酶活性,导致细胞内IPP积聚和胞外释放,被Vγ9Vδ2 TCR识别并激活,故经NBPs预处理的肿瘤细胞对Vγ9Vδ2 T细胞的杀伤更为敏感[8]。
遗传学和功能性研究均揭示Vγ9Vδ2 T细胞是天然免疫和获得性免疫系统的中间体,发挥重要作用,典型的天然免疫表型是Vγ9Vδ2 T细胞介导的抗体依赖的细胞毒活性、吞噬作用和无需预先分化或扩增的、针对病原特异性抗原的快速反应。尤其是Vγ9Vδ2 T细胞的基因表达谱是典型的αβT和NK细胞杂合,而Vγ9Vδ2 T细胞获得性免疫的特点是具有受体基因的体细胞重排能力、记忆能力和抗原呈递能力[4]。与NK细胞类似,Vγ9Vδ2 T细胞表达的CD16受体可结合IgG的Fc段。磷酸抗原激活后的Vγ9Vδ2 T细胞可上调CD16表达,从而增强抗体依赖的细胞毒性作用。Vγ9Vδ2 T细胞快速活化,以MHC非限制方式识别多种肿瘤相关抗原,通过穿孔素-颗粒酶、凋亡诱导蛋白配体途径Fas-FasL及分泌大量细胞因子(如IFN-γ、TNF-α)等作用于肿瘤细胞及其微环境,杀伤多种肿瘤细胞,而不对正常细胞存活产生任何影响(图1)[9]。

图1 Vγ9Vδ2 T细胞激活Fig.1 Activation of Vγ9Vδ2 T cells
2 Vγ9Vδ2 T细胞在肿瘤免疫治疗方面的应用
近年肿瘤自身免疫细胞及嵌合抗原受体T细胞免疫、NK细胞疗法成为研究热点,对细胞肿瘤免疫和干预具有不可估量的前景[10]。Vγ9Vδ2 T细胞可沟通先天性免疫与适应性免疫,在肿瘤发生和感染监视和防御中起重要作用,有望成为肿瘤免疫治疗的新方法,尤其是传统手术治疗难以治愈的肿瘤。Vγ9Vδ2 T细胞免疫治疗肿瘤研究发现,在卵巢癌、胆管癌、肝癌、骨髓瘤、胶质母细胞瘤、白血病、乳腺癌、淋巴瘤等治疗方面,Vγ9Vδ2 T细胞可发挥重要作用。
2.1 卵巢癌NOÉMIE等[11]采用小鼠上皮性卵巢癌模型进行体内实验,设置未经治疗的肿瘤切除小鼠、单用化疗的小鼠和Vγ9Vδ2 T细胞免疫治疗联合化疗的小鼠三组方案,结果显示未经治疗的小鼠出现了巨大的腹膜癌,单用化疗的小鼠出现小的局限性肿瘤,但免疫治疗联合化疗的小鼠几乎未发现肿瘤;MAO等[12]将NSG实验小鼠分为三组,分别接受PAM联合Vγ9Vδ2 T细胞治疗、Vγ9Vδ2 T细胞治疗,与用1×PBS治疗的对照组相比,接受全身PAM联合Vγ9Vδ2 T细胞或单独使用Vγ9Vδ2 T免疫治疗的小鼠卵巢癌细胞完全消失。
2.2 胆 管 癌ALNAGGAR等[13]观 察1例 接 受Vγ9Vδ2 T细胞免疫治疗的30岁胆管癌伴纵隔淋巴结转移Ⅳ期男性患者发现,前6次治疗每2周接受1次Vγ9Vδ2 T细胞治疗,后2次每4周接受1次γδT细胞治疗,同种异体Vγ9Vδ2 T细胞用于免疫治疗是安全的,可消除肿瘤转移,MRI图像显示淋巴结明显缩小,提示随着Vγ9Vδ2 T细胞输注次数增加,淋巴结转移逐渐消失。
2.3 肝癌ZHOU等[14]研究表明,Vγ9Vδ2 T细胞与亲脂性双膦酸盐结合可有效杀伤活性肝星状细胞,活化的肝星状细胞可促发肝癌,因此Vγ9Vδ2 T
细胞有望成为纤维化-肝硬化相关肝癌的治疗策略,不仅可杀死肝癌的驱动力肝星状细胞,还可直接杀死肿瘤细胞。同时,CIMINI等[15]研究表明,Vγ9Vδ2 T细胞具有抑制HCV复制的能力,而丙肝又是肝癌和肝移植的主要原因之一。
2.4 胶质母细胞瘤Vγ9Vδ2 T细胞感知肿瘤细胞的能力已在体内针对多种肿瘤进行了广泛研究,CHAUVIN等[16]在体外和体内均证明了异基因人Vγ9Vδ2 T淋巴细胞可自发识别杀伤原代胶质母细胞瘤。JARRY等[17]证实在小鼠脑肿瘤实质内直接立体定向注射扩增的Vγ9Vδ2 T细胞,Vγ9Vδ2 T细胞可存活数天,随后深入脑组织,有效控制脑胶质母细胞瘤生长。
2.5 白血病Vγ9Vδ2 T细胞可与白血病细胞相互作用并根除,达到最佳激活时Vγ9Vδ2 T细胞具有强大的抗白血病活性。GERTNER-DARDENNE等[18]采用急性髓系白血病(acute myelogenous leukemia,AML)细胞与Vγ9Vδ2 T细胞异种移植建立小鼠模型,发现Vγ9Vδ2 T细胞靠近植入白血病细胞的骨髓中归位,与单独注射AML细胞的小鼠相比,Vγ9Vδ2 T细胞和AML细胞共同注射的小鼠存活率更高。DE WEERDT等[19]采用体外激活的Vγ9Vδ2 T细胞用于慢性淋巴细胞白血病治疗,同样显示治疗有效。
2.6 乳腺癌BENZAID等[20]建立皮下移植T47D乳腺肿瘤实验小鼠模型,结果显示,与安慰剂组相比,利塞膦酸盐预处理的Vγ9Vδ2 T细胞毒性增强,小鼠肿瘤体积减少了46%。MAN等[21]采用PET示踪Zr标记的Vγ9Vδ2 T细胞,可在双膦酸预处理的小鼠异种移植乳腺肿瘤中观察到大量Vγ9Vδ2 T细胞,证明Vγ9Vδ2 T细胞在肿瘤靶向治疗方面具有广泛应用前景。
2.7 其他癌症IKUO等[22]观察了7例胃癌患者,在注射Vγ9Vδ2 T细胞前1天接受ZOL预处理,经过一轮治疗即发现腹水中癌细胞减少。DUAULT等[23]证明扩增的Vγ9Vδ2 T细胞与PAg联用可阻止小鼠淋巴瘤模型肿瘤生长。
3 单一使用Vγ9Vδ2 T细胞治疗肿瘤的局限性
采用过继转移法转移体外激活的Vγ9Vδ2 T细胞联合氨基双膦酸盐和IL-2的临床耐受性良好,但在多种肿瘤中显示临床效果有限,原因可能为激活的Vγ9Vδ2 T细胞无法到达肿瘤部位,或被肿瘤细胞和肿瘤微环境(tumor microenvironment,TME)中邻近细胞控制的免疫抑制环境所削弱。TME帮助肿瘤细胞抵抗化疗和逃避免疫监视[24]。TME中,肿瘤细胞及其他细胞(如基质细胞、肿瘤相关巨噬细胞)产生免疫抑制细胞因子诱导Vγ9Vδ2 T细胞出现Th17及Treg相似的特征。此外,Vγ9Vδ2 T抗肿瘤活性可通过其表面表达抑制性受体(如PD-1)及与肿瘤细胞上表达的相应配体结合而被抑制[9]。
除TME对Vγ9Vδ2 T细胞的抑制作用外,多种实体瘤细胞系对Vγ9Vδ2 T细胞的细胞毒作用的抵抗力较强[25]。TODARO等[26]通过研究结肠癌细胞发现,结肠癌细胞对化疗药物和Vγ9Vδ2 T细胞介导的细胞毒性均具有耐药性,结肠癌细胞表达的磷酸化抗原浓度可能较低,低于反应性Vγ9Vδ2 TCR有效识别所需阈值,暴露于唑来膦酸盐后,结肠癌细胞对Vγ9Vδ2 T细胞毒性更为敏感。
4 联合治疗增强Vγ9Vδ2 T细胞抗肿瘤活性
Vγ9Vδ2 T细胞具有一定细胞毒性,有望成为肿瘤免疫治疗的新手段。但临床研究中,Vγ9Vδ2 T细胞也反复显示出低毒性,导致临床治疗效果有限[5]。越来越多的研究显示,Vγ9Vδ2 T细胞免疫治疗肿瘤可与其他治疗结合提高其细胞毒性(图2),以期在临床应用中取得更好效果[27]。
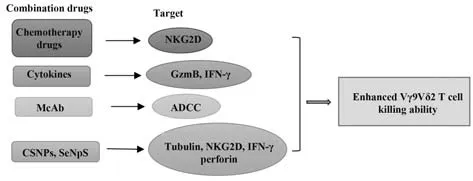
图2 联合治疗增强Vγ9Vδ2 T细胞抗肿瘤活性的途径Fig.2 Pathways of combination therapy to enhance antitumor activity of Vγ9Vδ2 T cells
4.1 化疗药物细胞免疫疗法与化疗药物联用对癌症治疗具有重要作用,Vγ9Vδ2 T细胞由于其抗肿瘤细胞作用且异体扩增移植相对简单而在联合治疗中备受关注。低浓度化疗药物或唑来膦酸盐预处理可使Vγ9Vδ2 T细胞快速杀伤肿瘤细胞,细胞毒性接近90%。此外,唑来膦酸盐增强了化疗诱导的肿瘤细胞对Vγ9Vδ2 T细胞毒性的敏感性,在某些情况下导致肿瘤靶点几乎100%溶解。无论采用哪种预处理方法,Vγ9Vδ2 T细胞识别靶点均由TCR介导,化疗致敏靶点由NKG2D介导,Vγ9Vδ2 T细胞识别和释放穿孔素后杀死肿瘤细胞。化疗/唑来膦酸/Vγ9Vδ2 T细胞联合治疗可广泛用于多种恶性肿瘤,且治疗相关毒性最小。唑来膦酸盐一般无毒,化疗药物可减少到毒性较小的肿瘤致敏剂量[26]。
作为一种标准化疗药物,大量研究已证实吉西他滨在临床上具有安全性和毒性可控,吉西他滨联合Vγ9Vδ2 T免疫细胞具有良好应用价值。γδTCR单独刺激不足以完全激活Vγ9Vδ2 T细胞毒性,需要NKG2D等受体共刺激信号[28]。TERUKI等[29]已证实Vγ9Vδ2 T细胞对膀胱癌的治疗效果显著,通过原位异种移植模型研究Vγ9Vδ2 T细胞和ZOL联合吉西他滨的体内抗肿瘤作用,与未经吉西他滨预处理的实验组相比,吉西他滨预处理增强了体内γδT细胞的细胞毒性,差异有统计学意义,Vγ9Vδ2 T免疫细胞联合吉西他滨是一种有效的体内抗肿瘤策略。NKG2D-MICA/B信号通路和MICA/B阻断实验结果表明,MICA/B表达显著上调,阻断NKG2D受体导致UBC细胞裂解减少,表明NKG2D-NKG2DLs途径发挥重要作用。地西他滨联合Vγ9Vδ2 T细胞同样可增强其细胞毒性以强化其在肿瘤免疫治疗中的作用,γδT细胞对骨肉瘤效果良好,ZHAN等[7]发现相对于单用Vγ9Vδ2 T细胞或地西他滨治疗,Vγ9Vδ2 T细胞联合地西他滨对骨肉瘤细胞的增殖抑制更为有效,表明地西他滨联合Vγ9Vδ2 T细胞治疗对骨肉瘤细胞杀伤作用更好。地西他滨作为一种DNA去甲基化药物,增加了骨肉瘤细胞表面NKG2D配体(NKG2DLs)表达,对细胞毒性Vγ9Vδ2 T细胞的识别和破坏更为敏感。此外,替莫唑胺(一种被批准用于神经胶质瘤的DNA甲基化化疗试剂)能显著增加神经胶质瘤细胞表面NKG2DL表达,使神经胶质瘤细胞更易被Vγ9Vδ2 T细胞杀死[30]。
4.2 细胞因子癌症患者中,Vγ9Vδ2 T细胞反复被发现减少或有缺陷,增殖能力降低。体外培养Vγ9Vδ2 T细胞可在短时间内由PBMCs有效生成,采用IL-2和膦酸盐进行细胞扩增可产生具有高分化TCRγδ阳性表型的人Vγ9Vδ2 T细胞[29]。IL-33是一种γ链受体独立的细胞因子,能够诱导PAg激活的Vγ9Vδ2 T细胞体外增殖,这些T细胞完全功能性地表达IFN-γ和TNF-α,并显示出体外抗肿瘤活性[23]。
IL-21是一种强调节性细胞因子,在包括Vγ9Vδ2 T细胞在内的免疫效应器中可提高胞内颗粒酶B水平,进而提高细胞毒性[31]。IL-21具有增强细胞毒性和促进细胞增殖的能力,是肿瘤免疫治疗的候选药物[32]。测 定 细 胞 内GzmB表 达 前 采 用IL-21对Vγ9Vδ2 T淋巴细胞进行短暂致敏,结果表明IL-21显著提高了人Vγ9Vδ2 T细胞内GzmB水平,且不影响其存活。JOALLAND等[6]表明,与未经处理的Vγ9Vδ2 T细胞相比,IL-21增加了Vγ9Vδ2 T细胞对胶质母细胞瘤细胞GBM-1的细胞毒性(67%),短期IL-21治疗可通过长期提高细胞内GzmB水平显著增强人同种异体Vγ9Vδ2 T细胞天然抗肿瘤活性。采用IL-21治疗GBM-1荷瘤小鼠,连续3个周期(第7、14和21天)立体定向给予致敏或不致敏的人Vγ9Vδ2 T细胞,小鼠在GBM-1细胞植入后存活150 d以上,表明该疗法可根除胶质母细胞瘤。IL-23是一种由新生树突状细胞产生的细胞因子,MOENS等[33]发现,与IL-23可与Vγ9Vδ2 T激活剂唑来膦酸盐结合促进新生儿Vγ9Vδ2 T细胞表达高水平的细胞毒性递质并产生IFN-γ及IL-17。HCV是肝癌的重要发病原因,慢性丙型肝炎病毒感染可导致Vγ9Vδ2 T细胞减少。Vγ9Vδ2 T细胞在病毒感染中起关键作用,能够介导广泛的抗病毒和免疫调节活性。激活的Vγ9Vδ2 T细胞抗病毒作用主要通过IFN-γ释放实现。CIMINI等[34]研究发现,HCV患者Vγ9Vδ2 T细胞产生IFN-γ的功能受损,IFN-α可改善HCV患者的Vγ9Vδ2 T细胞功能,从而促进IFN-γ产生。
4.3 单克隆抗体过去20年中,单克隆抗体已成为对人类恶性肿瘤疗效显著且类型新颖的药物之一,尤其是靶向免疫检查点的单克隆抗体药物在肿瘤免疫治疗中发挥重要作用。尽管抗体免疫治疗在肿瘤治疗中取得了显著进展,但对抗体单一疗法相对较弱的应答以及肿瘤耐药性仍是未解决的主要问题。单克隆抗体联合免疫治疗具有广泛应用前景[35]。直接靶向肿瘤细胞表面抗原可增强同种异体转移的Vγ9Vδ2 T细胞特异性[36]。单克隆抗体结合了高靶点特异性和良好的毒性特征,但单独使用时抗肿瘤活性有限,与Vγ9Vδ2 T细胞联用具有良好效果。表明单克隆抗体增强了Vγ9Vδ2 T细胞的细胞毒性,体外研究表明,临床采用单克隆抗体治疗肿瘤,如利妥昔单抗、赫赛汀、阿来组单抗可通过CD16介导ADCC激活γδT细胞。
Vγ9Vδ2 T细胞与曲妥珠单抗联用增强了对HER2阳性细胞的杀伤能力[37]。曲妥珠单抗在HER2表达较低的恶性肿瘤中几乎无抗肿瘤活性。LIU等[38]研究曲妥珠单抗联合Vγ9Vδ2 T细胞能否增强对ZOL预处理的骨肉瘤细胞的杀伤作用,在临床相关时间段(2 h),ZOL预处理的骨肉瘤细胞虽能刺激Vγ9Vδ2 T细胞最佳免疫应答,但曲妥珠单抗能进一步增强Vγ9Vδ2 T细胞的细胞毒性。表明曲妥珠单抗与ZOL联用可显著提高Vγ9Vδ2 T细胞的细胞毒性。GA101作为一种Ⅱ型糖化抗CD20单克隆抗体,联合Vγ9Vδ2 T细胞对原发性滤泡性淋巴瘤细胞的杀伤能力显著增强[39]。研究还发现抗PD-1治疗可使Vγ9Vδ2 T细胞对磷酸抗原刺激后的细胞毒性增加近5倍,是多发性骨髓瘤免疫治疗的有效手段[40]。
4.4 纳米药物纳米药物具有最佳生物相容性、体内可降解性以及优异的抗氧化和抗癌活性,具有广泛应用前景。研究发现,纳米药物可用于增强Vγ9Vδ2 T细胞抗肿瘤免疫能力,纳米颗粒较少被内化,主要在细胞表面聚集,有望成为抗癌药物载体。通过上调α-微管蛋白乙酰化稳定微管结构及NKG2D、IFN-γ、FasL、穿孔素、CD16等相关受体表达可延长γδT细胞体外生存时间,提高Vγ9Vδ2 T细胞对癌细胞的杀伤能力[41]。壳聚糖纳米粒(chito⁃san nanoparticles,CSNPs)是一种可用于增强Vγ9Vδ2 T细胞抗肿瘤免疫能力的可靠生物相容性材料,LIN等[42]设计了以CFSE标记的慢性粒细胞白血病细胞株K562为模型的细胞进行了体外杀伤实验,结果显示,CSNPs预处理的Vγ9Vδ2 T细胞在E∶T为5∶1时对K562细胞的细胞毒性比未处理的Vγ9Vδ2 T细胞(对照组)增强,表明CSNPs可增强Vγ9Vδ2 T细胞对癌细胞的杀伤作用。硒纳米颗粒(selenium nanopar⁃ticles,SeNPs)还可提高细胞增殖能力和促进γδT细胞向肿瘤部位聚集。HU等[43]研究显示,三种乳腺癌细胞与经SeNPs预处理的γδT细胞共孵育后,癌细胞死亡率明显大于未经处理的癌细胞,体外实验表明,SeNPs预处理能显著提高γδT细胞对不同癌细胞株的杀伤作用。为进一步验证SeNPs预处理的γδT细胞增强癌细胞毒性的体外研究结果,MDA-MB-231细胞小鼠模型结果表明,SeNPs能更有效地增强γδT细胞对肿瘤生长和转移的抑制作用,提示SeNPs在调节γδT细胞抗肿瘤活性方面具有应用价值。
5 总结
Vγ9Vδ2 T细胞是目前具有广阔应用前景的免疫细胞,由于具有T细胞和NK细胞特性,使得Vγ 9Vδ2 T细胞在肿瘤、炎症、结核、艾滋病等众多领域发挥重要免疫治疗作用,其中肿瘤免疫治疗是目前研究较为成熟且最为广泛的。Vγ9Vδ2 T细胞研究进展为其在肿瘤免疫治疗的应用铺平了道路。以Vγ9Vδ2 T细胞为基础的抗肿瘤免疫疗法已在体内外实验中显示了良好功效,双膦酸盐类药物可有效扩增和激活Vγ9Vδ2 T细胞。基于单一Vγ9Vδ2 T细胞抗肿瘤免疫活性不足的问题,Vγ9Vδ2 T细胞联合化疗药物、单克隆抗体、细胞因子、纳米药物等可有效增强抗肿瘤免疫活性。未来可将联合治疗作为新的突破方向,寻找可更有效增强抗肿瘤活性的药物,充分发掘Vγ9Vδ2 T细胞在肿瘤免疫治疗中的应用价值。

