靶向B7-H3的CAR-T细胞在实体瘤免疫治疗的研究进展①
张贵珍 余祖江 韩双印(郑州大学第一附属医院感染科,郑州 450052)
嵌合抗原受体T细胞(chimeric antigen receptor-T cells,CAR-T)治疗是目前被临床广泛关注的一种新型细胞免疫疗法,从患者或异体供者血液中获取T细胞后利用基因工程技术将靶向肿瘤抗原的CAR引入到T细胞,体外扩增后回输患者体内发挥特异性抗肿瘤作用。2017年CAR-T细胞治疗迎来了阶段性胜利,美国食品药品监督管理局先后批准两个CD19 CAR-T活细胞药物“Tisagenlecleucel”和“Axi⁃cabtagene ciloleucel”,用于急性B细胞白血病和B细胞淋巴瘤 的 治疗[1-2]。2020年7月,第三个CD19 CAR-T药物“brexucabtagene autoleucel”也获得加速审批,用于治疗复发难治性套细胞淋巴瘤患者[3]。
CAR-T细胞在血液系统肿瘤中取得了令人瞩目的进展极大提高了研究者的热情将CAR-T研究延伸至实体瘤治疗领域中。CAR-T抗肿瘤效果有赖于CAR对肿瘤抗原的特异性识别。因此,合适的抗原靶点对CAR-T治疗的成功实施至关重要。B7-H3(也称CD276)是一种在多种实体瘤中过表达的B7家族成员跨膜蛋白,由于其在免疫学和肿瘤发生发展过程中的生物学作用而备受关注,在肿瘤免疫治疗领域中作为分子靶点被广泛研究[4]。
1 B7-H3的分子特征
B7-H3基因由CHAPOVAL等[5]于2001年在人树突状细胞cDNA文库中首次克隆而出,因其结构与B7家族基因相似,故命名为B7Homolog 3(B7-H3)。B7-H3位于人类染色体15q24.1,含10个外显子,其mRNA长4.1 kb。B7-H3分子是Ⅰ型跨膜蛋白,为免疫球蛋白超家族成员,由1个氨基端信号肽、1个胞外结构域(含免疫球蛋白样可变区IgV和恒定区IgC)、1个跨膜域和1个仅有45个氨基酸的胞内域组成。B7-H3与其他B7家族成员20%~27%的氨基酸具有同一性,是最保守的家族成员,人B7-H3与小鼠B7-H3的序列相似性高达88%。由于外显子复制,人B7-H3有两种剪切异构体:即2Ig-B7-H3,胞外域含IgV-IgC,包含316个氨基酸,分子量为45~66 kD;4Ig-B7-H3是胞外域为IgV-IgC-IgV-IgC的另一种异构体,含534个氨基酸,分子量为90~110 kD,是人体组织中最主要的存在形式[6-7]。此外,由于内含子的可变剪切,可生成可溶性B7-H3(soluble B7-H3,sB7-H3);膜型B7-H3也可被基质金属蛋白酶(matrix metalloproteinase,MMP)裂解形成sB7-H3,并可在人类血浆中检测[8-9]。
2 B7-H3的表达与分布
B7-H3 mRNA广泛表达于人类多种细胞和组织中。在非免疫性的静止成纤维细胞、内皮细胞、成骨细胞和羊水干细胞上均可检测到B7-H3 mRNA,在心脏、肝脏、胰腺、小肠、结肠、前列腺、子宫、胎盘、胸腺、脾脏等淋巴器官中也有表达,外周血单核细胞中不表达;但B7-H3蛋白的表达却较为局限且呈低水平,主要表达于局灶性肝细胞以及胃、结肠的少数腔上皮细胞,广泛的mRNA表达谱与局限的蛋白表达与转录后严密的调控机制有关[10-11]。B7-H3蛋白还可表达于未成熟和成熟的树突状细胞中,经诱导也可表达于NK细胞、B细胞、T细胞。然而,与健康组织的局限性表达不同,B7-H3蛋白在多种实体瘤中过表达,包括胶质母细胞瘤(glioblastoma,GBM)、神经母细胞瘤(neuroblastoma,NB)、胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)、肺癌、黑色素瘤、前列腺癌、膀胱癌、卵巢癌、肾癌、乳腺癌和宫颈癌等。多项研究表明,B7-H3在非小细胞肺癌(non-small cell lung cancer,NSCLC)患者中表达率可高达100%[12];SUN等[13]发现93.8%肝癌患者中B7-H3过表达;前列腺癌患者的B7-H3表达率也高达95.9%;76%的NB和100%的髓母细胞瘤及超过70%的GBM均呈现B7-H3过表达[14];此外,95%的肾透明细胞癌患者的肿瘤间质和脉管系统中也发现了B7-H3阳性表达[15]。
3 B7-H3功能与肿瘤
目前对B7-H3特异性受体和下游信号知之甚少,但大量研究表明B7-H3对固有免疫和适应性免疫均有调节作用。早期研究发现,B7-H3阳性的NB细胞可免受NK细胞介导的裂解作用,推测NK细胞表面可能含有与B7-H3结合的抑制性受体[16]。在T细胞介导的适应性免疫中,最初研究表明B7-H3作为共刺激分子,可促进CD4+和CD8+T细胞的增殖,增强细胞毒性T淋巴细胞活性,选择性刺激IFN-γ的产生。然而随研究深入,越来越多的证据表明B7-H3可抑制T细胞的活化,并有效抑制活化T细胞的增殖、细胞因子产生和细胞毒性功能。临床前研究表明,阻断B7-H3可增强CTL和NK细胞活性,减少肿瘤相关巨噬细胞的数量,减轻肿瘤负荷[17-18]。
除上述免疫调节功能外,B7-H3也在肿瘤发生、增殖、凋亡等生物学进程中发挥作用。多项研究表明B7-H3可改变细胞糖代谢,增加肿瘤细胞的有氧糖酵解能力,即Warburg效应,促进肿瘤发生相关生物大分子的合成[19]。B7-H3可能通过抑制Nrf2的转录提高活性氧和低氧诱导因子1-α(hypoxia-induc⁃ible factorα,HIF1-α)的水平,从而上调乳酸脱氢酶A和丙酮酸脱氢酶激酶1,促进糖酵解[20-22]。B7-H3还可提高基质金属蛋白酶水平,募集并激活VEGF和Tie-2,促进血管内皮细胞在基质间隙的扩散和迁移,从而促进肿瘤新生血管的形成[23]。此外,B7-H3可能通过PI3K/AKT途径干扰细胞周期,加快G1期/S期进程,促进肿瘤细胞快速增殖[24]。研究显示B7-H3基因表达可明显促进宫颈癌、食管癌、口腔癌和结直肠癌细胞的增殖,基因敲除后细胞增殖明显减弱。在肝癌研究中发现B7-H3可通过JAK2/STAT3/SLUG通路靶向上皮-间质转化过程,促进肝癌的侵袭和转移[25]。尚有研究表明B7-H3还与肿瘤耐药有关。B7-H3可能通过JAK2/STAT3和PI3K/Akt/mTOR途径激活survivin,Mcl-1,Bcl-xL和Bcl-2等凋亡抑制因子抑制caspase级联反应,或与主穹隆蛋白结合,激活MAPK激酶途径,促进肿瘤干细胞的产生,从而发挥抗肿瘤细胞凋亡作用并使其对化疗药物产生耐药性[26-28]。B7-H3的过表达和其在肿瘤进展中的生物学作用也得到了临床数据的支持。大量研究表明,B7-H3过表达与肿瘤分级、高肿瘤负荷、淋巴结转移、高复发率和总体生存期缩短有关。TANG等[29]的研究发现,B7-H3在高级别神经胶质瘤中的表达较高,而在低级别胶质瘤中表达较低,在正常脑组织中不表达;低级别胶质瘤患者中,B7-H3低表达组中位生存期136.1个月,而高表达组仅55.5个月。
4 B7-H3 CAR-T用于实体瘤免疫治疗
B7-H3过表达和在肿瘤生物学进程中的功能使其在实体瘤免疫治疗中备受关注。靶向B7-H3的单克隆抗体MGA271在肾细胞癌和膀胱癌临床前模型中表现出有效的抗肿瘤活性。Ⅰ期临床试验已在前列腺癌、黑色素瘤、NSCLC等患者中开展。在转移性NB的补救治疗中,131I标志的8H9使83.3%的患者生存期延长,中位生存期达33个月[30]。目前,Ⅰ期临床试验已在腹膜肿瘤、GBM和软脑膜转移瘤患者中开展。mAb376.96是靶向B7-H3的另一种单克隆抗体。单药应用于卵巢癌、胰腺癌模型时,与未治疗组相比可延长小鼠中位生存期2~3倍[31-32]。此外,新型双特异性抗体(如MGD009)、抗体偶联药物(如mAb276-PBD、MGC018和8H9-PE38)在肺癌、结肠癌、乳腺癌等多种肿瘤中已有研究,在异种移植模型中产生了实质性肿瘤消退,部分已进入临床试验阶段。
与传统放化疗及抗体治疗相比,CAR-T细胞治疗具有独特的优势。CAR由胞外域、跨膜域和胞内域组成(图1)。胞外单链可变片段(single-chain variable fragment,scFv)用于识别抗原靶点,胞内域含CD3链和共刺激分子,用于传递活化、共刺激信号。第一代CAR-T胞内域仅含CD3ζ结构。第二代和第三代CAR-T胞内域分别含有一个和两个共刺激分子(如CD28、4-1BB)与CD3ζ串联。第四代CAR-T引 入了增 强T细 胞功能 的细胞因 子[33-34]。CAR-T细胞靶向性强,靶点范围广,可识别蛋白质、糖类和脂类等多种肿瘤抗原;CAR-T以MHC非限制性方式识别肿瘤抗原,因此不受肿瘤中MHC表达下调的影响;CAR-T内信号域的修饰可弥补共刺激分子的下调,在CAR胞内信号域加入CD28和4-1BB等共刺激分子可显著增强T细胞增殖、存活、细胞因子分泌和肿瘤溶解能力。此外,CAR-T在体外可快速大量增殖,可在短期内获得足够的肿瘤特异性细胞满足治疗所需[34-35]。
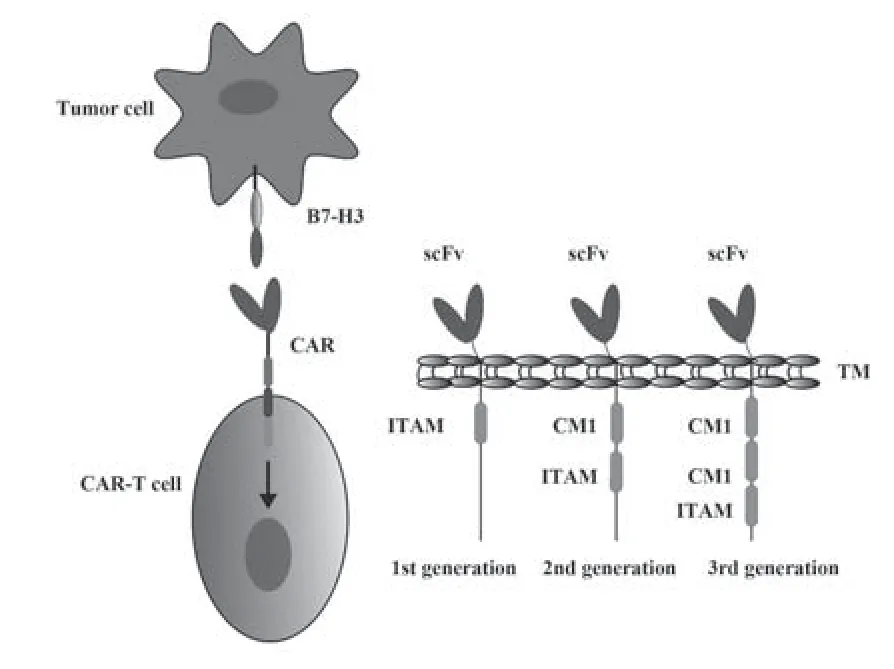
图1 CAR结构示意图Fig.1 Schematic structure of CAR
目前靶向B7-H3的CAR-T在神经系统肿瘤、骨肉瘤、胰腺癌、卵巢癌、黑色素瘤等多种实体瘤中研究。有研究测试了基于MGA271的第二代CAR-BBζ-T在B7-H3阳性骨肉瘤、髓母细胞瘤、尤文氏肉瘤细胞系中的作用,体外共培养发现B7-H3 CAR-T可有效靶向肿瘤细胞并分泌大量IFN-γ、TNF-α和IL-2[36]。随后有相关研究团队在非典型畸胎横纹肌样瘤(atypi⁃cal teratoid/rhabdoid tumors,ATRTs)中测试了B7-H3 CAR-T对8种不同ATRT细胞系的杀伤作用,结果表明B7-H3 CAR-T可有效杀伤肿瘤细胞,其中与BT12细胞系共培养时,即使以1∶5效靶比,仍可清除几乎所有肿瘤细胞[37]。DU等[11]发现B7-H3 CAR-T反应强度与肿瘤细胞表面B7-H3的表达量有关,即B7-H3 CAR-T优先靶向B7-H3高表达肿瘤细胞,对抗原低表达肿瘤细胞活性显著降低,显示出“治疗窗”,与上述团队在不同B7-H3表达水平的NALM-6细胞系中研究相似。B7-H3 CAR-T的抗原密度依赖性反应在GBM中也得到验证。在B7-H3高表达GBM组,B7-H3 CAR-T可产生强烈的特异性裂解作用,在中表达组可观察到中等强度细胞裂解,而在B7-H3阴性或低表达组未观察到明显反应,提示B7-H3 CAR-T可能更适用于治疗B7-H3高表达肿瘤[29]。此外,B7-H3 CAR-T在卵巢癌、神经母细胞瘤和黑色素瘤的体外试验中亦显示出有效的抗肿瘤活性[11,38]。
为探究不同CAR结构对T细胞功能的影响,研究者基于不同B7-H3 mAb设计了包含不同共刺激信号的CAR-T[36]。体外试验表明基于MGA271的第二代CAR-BBζ-T在特异性识别B7-H3阳性肿瘤细胞同时细胞因子分泌能力最佳。同样,DU等[11]基于mAb376.96构建了二代B7-H3 CAR-28ζ-T和B7-H3 CAR-BBζ-T,发现两种CAR-T均可特异性识别并杀伤B7-H3阳性PDAC细胞系,但在靶向组成性表达PD-L1的PDAC细胞系时,相比B7-H3 CAR-28ζ-T,B7-H3 CAR-BBζ-T表面PD-1表达更低,并具有较强的抗肿瘤活性,表明B7-H3 CAR-BBζ-Ts对PD-L1介导的抑制作用较小。除优化CAR结构外,研究者们也从CAR-T表面共表达分子上另辟蹊径。HUANG等[39]基 于mAb7E12设 计 了 共 表 达PD-1诱骗受体(PD28/PDmut7R)的B7-H3 CAR-T,该受体由CD28的共刺激信号域或组成性活化IL-7受体胞内域与PD-1的胞外域嵌合而成,以期将PD-1介导的抑制信号逆转为刺激信号,从而改善CAR-T的抗肿瘤活性。与B7-H3阳性肺巨细胞癌或卵巢癌细胞系共培养,PD28 CAR-T或PDmut7R CAR-T可产生更高水平的Th1细胞因子,提示PD-1诱骗受体在B7-H3 CAR-T的共表达可提高其抗肿瘤活性。
基于前期良好的体外试验结果,研究者们相继开展了B7-H3 CAR-T体内试验。在骨肉瘤(n=5)和尤文氏肉瘤(n=5)原位异种移植模型中,向NSG小鼠尾静脉注射1×107个B7-H3 CAR-T导致了肿瘤的完全退缩和消除,并显著延长小鼠生存期。在骨肉瘤转移模型中,B7-H3 CAR-T组(n=10),9例小鼠生存时间超过5个月,而对照组(n=5)均在50 d内死亡,生存获益明显[36]。B7-H3在多种神经系统肿瘤中过表达,为测试B7-H3 CAR-T能否有效穿越血脑屏障并根除肿瘤,研究者向髓母细胞瘤原位异种移植小鼠尾静脉注射B7-H3 CAR-T,注射7 d后,小鼠颅内即可检测到大量B7-H3 CAR-T,最终5只小鼠颅内肿瘤均被有效根除;即便在高侵袭性模型中,仍有效清除肿瘤(4只/6只),与CD19 CAR-T对照组相比,显著延长小鼠生存期(20 dvs80 d)[36]。受到前期结果的鼓舞,有相关研究团队继续探索了B7-H3 CAR-T在儿童ATRTs中的作用[37]。在两组侵袭性ATRT-PDX(patient-derived xenograft,PDX)模型中,B7-H3 CAR-BBζ-T静脉给药后(1×107个细胞)成功根除肿瘤(10只/10只,9只/10只)。与静脉注射相比,局部(肿瘤内或脑室内)给予B7-H3 CAR-BBζ-T归巢更快,抗肿瘤效果更好,与其他学者在卵巢癌研究中的结论相似[11]。剂量滴定实验显示,脑室内给予0.25×106个B7-H3 CAR-T可清除60%的小鼠肿瘤,清除全部小鼠肿瘤需0.5×106个B7-H3 CAR-T,而静脉注射组则需2.5×106个B7-H3 CAR-T。此外,局部给药全身炎症因子水平更低,表明局部应用CAR-T的毒性可能小于全身应用。在肿瘤再挑战模型评估中,无论是静脉注射还是脑室内给药均介导了抗原特异性的免疫记忆,为防止肿瘤复发提供了可能。GBM也是备受关注的中枢神经系统肿瘤。国内学者构建了靶向B7-H3的第三代CAR-T(CD28-4-1BB-CD3ζ)[29]。在 原 位GBM-PDX模 型(n=5)中向NOD-SCID小鼠静脉注射2×106个B7-H3 CAR-T后观察到明显的肿瘤生长抑制,2只小鼠复发。排除抗原丢失引起的复发后,TANG等[29]采用不同剂量给药,发现B7-H3 CAR-T呈现剂量依赖性抗肿瘤作用和生存期延长,在NB模型中得出了同样的结论。NEHAMA等[40]还测试了含不同共刺激分子的B7-H3 CAR-T在GBM模型中的抗肿瘤作用,B7-H3 CAR-28ζ-T组和B7-H3 CAR-BBζ-T组未观察到治疗相关不良反应,均出现持续的肿瘤退缩,并具有显著的生存获益(6只/11只>120 dvs6只/10只>120 d),两组差异无统计学意义。同样地,在PDAC细胞系原位异种移植模型、转移模型和PDAC-PDX模型中,两种B7-H3 CAR-T也表现出相似的抗肿瘤特性,其中,在PDAC-PDX模型中,B7-H3 CAR-T可有效根除肿瘤并持续控制肿瘤生长长达80 d。但在靶向组成性表达PD-L1的PDAC模型时,CAR-BBζ-T表面PD-1表达更低,抗肿瘤作用明显优于CAR-28ζ-T,与体外试验结果一致[11]。为提高CAR-T的抗肿瘤作用,HUANG等[39]在人肺巨细胞癌和卵巢癌皮下异种移植模型中测试了共表达PD-1诱骗受体(PD28/PDmut7R)的B7-H3 CAR-T,与对照组相比,共表达PD-1诱骗受体的B7-H3 CAR-T,特别是PD⁃mut7R CAR-T,表现出更优异的抗肿瘤活性,且在肿瘤再挑战模型中,单次注射5 d后即可成功清除肿瘤。另有学者发现在B7-H3 CAR-28ζ-T细胞表面共表达41BBL,可增强CAR-T细胞的体内扩增能力,改善其抗肿瘤活性,并将共表达41BBL的CAR-T细胞用于早期临床试验[41]。针对实体瘤的抗原异质性,国内华西医院学者设计了同时靶向CD70和B7-H3的CAR-T细胞,与单靶点CAR-T相比,低剂量的双靶点CAR-T细胞即可有效控制肺癌和黑色素瘤异种移植瘤并改善模型动物的总体存活率[42]。CAR-T的安全性是CAR-T应用中的焦点,为此,有研究探究了具有免疫能力的荷瘤C57BL/6J小鼠中的潜在毒性,结果表明B7-H3 CAR-T不仅可控制PDAC生长达4周,且血细胞计数和组成均无显著变化,未检测到组织损伤和器官毒性[11]。
临床前期令人鼓舞的结果也推动了B7-H3 CAR-T向临床阶段的发展。国内学者率先发表了B7-H3 CAR-T用于1例复发性间变性脑膜瘤患者的结果。研究者将B7-H3 CAR-T采用局部腔内注射方式连续治疗3个周期,患者耐受性良好,未出现3级及以上的毒性反应。B7-H3 CAR-T可浸润至输注装置附近的肿瘤组织并可有效控制浸润部位的肿瘤生长,但无法浸润至远处肿瘤组织。免疫组化分析显示,治疗3个周期后,浸润部位的肿瘤组织B7-H3表达量明显降低,而远处无浸润部位B7-H3仍呈高表达[43]。第一例临床治疗结果提示局部注射B7-H3 CAR-T是安全的,并可产生局部生物学活性,未来解决抗原损失和CAR-T细胞浸润可进一步增强B7-H3 CAR-T疗效。目前B7-H3 CAR-T已有多项临床试验进行(表1)。其中一项Ⅰ期临床试验计划将B7-H3 CAR-T肿瘤内或脑室内局部给药,评估其在弥漫性胶质瘤、ATRT等在内的多种儿童复发性或难治性中枢神经系统肿瘤中的安全性和可行性(NCT04185038)。一项Ⅰ/Ⅱ期试验由国内一家机构开展,预探究在难治性或复发性GBM中,与替莫唑胺单药相比,局部给予B7-H3 CAR-T联合替莫唑胺的安全性和有效性(NCT04077866)。

表1 最近正在开展的B7-H3 CAR-T细胞治疗实体瘤的临床试验Tab.1 Recently ongoing clinical trials with B7-H3 CAR-T cell therapy in solid tumors
5 总结与展望
CAR-T在血液系统肿瘤中的进展为实体瘤的免疫治疗奠定基础。以B7-H3为靶点的CAR-T临床前研究展示了良好的耐受性和抗肿瘤作用。但由于实体瘤的复杂性和临床前实验的局限性,B7-H3 CAR-T的临床实施未来还需在以下方面做出努力:①深入研究B7-H3受体和信号传导机制为CART应用提供理论基础;②引入趋化因子受体或寻求最佳给药方式促进CAR-T细胞浸润;③发掘CAR-T调控因子、优化共刺激结构、同时靶向肿瘤基质或联合免疫检查点治疗以克服实体瘤免疫抑制微环境;④基于实体瘤的高度异质性,设计多靶点CAR-T,防止因单靶点耐受而免疫逃逸;⑤完善治疗体系,确定最佳给药时机和剂量,在保证抗肿瘤作用同时尽量减少毒副作用。CAR-T治疗肿瘤存在研究意义,尽管存在诸多困难,但随着人们对肿瘤生物学、免疫学认识的不断加深和CAR-T技术的成熟与改进,CAR-T将为众多实体瘤患者治疗提供研究基础。

