基于Box-Behnken响应面法优化党参抗氧化活性组分提取工艺
任海云,韩瑞,张磊
(山西中医药大学,山西 榆次 030619)
在遭受有害刺激时,机体内会产生过多的活性氧自由基,导致机体组织氧化损伤,尽管机体具有抗氧化防御和修复机制,然而过度的氧化应激会导致机体组织损伤,引发各种疾病,如何有效抑制过度的氧化应激至关重要。研究发现,很多传统中药具有抗氧化作用。近年来,找寻天然抗氧化剂,并对其抗氧化活性成分及抗氧化机制进行完全的阐释已成为药品、食品研究领域的焦点。党参属桔梗科植物,含多种抗氧化活性成分,近几年有关党参的研究多集中在中药组分的提取及其抗氧化活性的研究[1−6],而将工艺与抗氧化活性相结合追踪筛选工艺研究的则比较少。本研究以党参为研究对象,采用抗氧化活性与工艺相结合的方式进行跟踪筛选,以期得到能高度富集抗氧化有效成分的工艺,为下一步血清药物化学研究奠定基础。
1 材料与仪器
1.1 材料
党参药材产于山西太行,冷冻干燥后粉碎过2 号筛;亚硝酸钠、硝酸铝、无水乙醇、Tris-HCl缓冲溶液、维生素C(Vc)、氢氧化钠、过硫酸钾购于山西吉泰生化试剂有限公司;芦丁对照品、邻苯三酚、1,1-二苯基-2-三硝基苯肼(ABTS)、2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(DPPH)购于上海阿拉丁生化科技股份有限公司。所用试剂皆为分析纯。
1.2 仪器
冷冻干燥机(宁波新芝冻干设备有限公司);瓦里安50 Cary紫外可见分光光度计(美国瓦里安公司);电子天平(上海象平仪器仪表有限公司);SG-4054型数控精密恒温水浴锅(上海硕光电子科技有限公司);R206型旋转蒸发仪(上海申生科技有限公司)。
2 试验方法
2.1 标准曲线的绘制
参考文献中的方法测定总黄酮得率[7−11],精密称取芦丁标准品(干燥至恒重)20.6 mg,加入60%的乙醇,超声溶解并定容,即得芦丁对照品溶液(C=0.206 mg/mL)。分别准确移取对照品0、1.0、2.0、3.0、4.0、5.0、6.0 mL于25 mL 容量瓶中,加蒸馏水至6.0 mL,再加入5%亚硝酸钠溶液1.0 mL,放置约5 min,加入10%硝酸铝溶液1.0 mL,放置约5 min,加入4% 氢氧化钠溶液10.0 mL,最后加入蒸馏水定容,静置20 min,在400~600 nm范围内进行光谱扫描,得λmax=505 nm。以吸光度为纵坐标,芦丁浓度为横坐标绘制A~C曲线。
对标准曲线进行线性拟合得回归分析方程:y=13.670 25x-0.007 5,相关系数R2=0.998 69,表明样品浓度在0.008 24~0.049 44 mg/mL 范围内呈现较好的线性相关性。
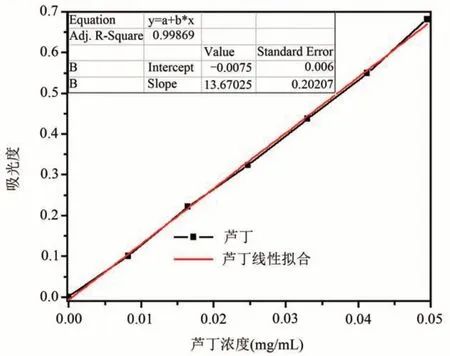
图1 A~C曲线
2.2 党参总黄酮样品溶液及抗氧化能力测试液的制备
首先将党参进行冷冻干燥预处理,粉碎过筛放于干燥器中待用。称取党参粉末2.0 g于圆底烧瓶中,加入不同体积与浓度的乙醇,设定温度和时间后进行水浴回流提取,滤过,取上清液进行旋蒸浓缩,然后迅速转移到100 mL 容量瓶中,加入提取时同样浓度的乙醇至刻度线即得党参总黄酮样品溶液及抗氧化能力测试液。

其中:x为黄酮含量(mg/mL),y为总黄酮得率。
2.3 单因素对党参体外抗氧化能力的影响
以提取温度85 ℃、乙醇浓度80%、提取时间60 min、提取1 次为条件考察不同料液比(1∶20、1∶25、1∶30、1∶35、1∶40)对党参体外抗氧化能力影响;以料液比1∶25、提取温度85 ℃、提取时间60 min、提取1次为条件考察不同乙醇浓度(75%、80%、85%、90%、95%)对党参体外抗氧化能力影响;以料液比1∶25、乙醇浓度80%、提取时间60 min、提取1次为条件考察不同提取温度(75、80、85、90、95 ℃)对党参体外抗氧化能力影响;以料液比1∶25、乙醇浓度80%、提取温度85 ℃、提取1次的条件考察不同提取时间(30、60、90、120、150 min)对党参体外抗氧化能力影响;料液比1∶25、乙醇浓度80%、提取温度85 ℃、提取时间60 min的条件考察不同提取次数(1、2、3、4、5次)对党参体外抗氧化能力影响;以党参对ABTS自由基清除率评价其体外抗氧化能力。
2.4 ABTS自由基清除能力测定
分别量取7 mmol/L ABTS 水溶液和2.45 mmol/L K2S2O8(过硫酸钾)水溶液各5 mL,两者等体积混合,室温避光反应12~16 h,得ABTS储备液。使用时将ABTS储备液用无水乙醇稀释30~40 倍,制备成在波长734 nm处吸光度为(0.70±0.02)的工作液。取两组不同质量浓度的Vc 溶液(0.08、0.16、0.24、0.32、0.40 mg/mL)1 mL,分别与稀释后的ABTS 溶液4 mL 及无水乙醇4 mL 混合均匀,在室温下避光静置30 min 后用紫外仪在517 nm 处测定吸光度A。以Vc作为阳性对照,每个质量浓度测3组平行数据,取平均值,计算清除率。
ABTS自由基清除率=[1-(A1-A2)/A0]×100%
其中:0.8 mL 无水乙醇与3.2 mL ABTS 稀释溶液混合均匀作为A0;0.8 mL 样品溶液与3.2 mL ABTS 稀释溶液混合均匀作为A1;0.8 mL 样品溶液与无水乙醇3.2 mL混合均匀作为A2。
2.5 DPPH自由基清除能力测定
取两组不同质量浓度的Vc 溶液(0.08、0.16、0.24、0.32、0.40 mg/mL)各2 mL,分别加入0.04 g/L DPPH 溶液和无水乙醇各2 mL,经振荡、混合均匀后,在室温下避光静置30 min,再用紫外仪在517 nm 处测定吸光度A。最后以Vc 作为阳性对照,每个质量浓度测3组平行数据,取平均值,计算清除率。
DPPH自由基清除率=[1-(A1-A2)/A0]×100%
其中:2 mL 无水乙醇与2 mL DPPH 溶液混合均匀作为空白对照A0;2 mL 样品溶液与2 mL DPPH 溶液混合均匀作为A1;2 mL无水乙醇与2 mL 样品溶液混合均匀作为A2。
2.6 ·O2-自由基清除能力测定
量取两组浓度50 mmol/LTris-HCl 缓冲液(pH=8.2)4.5 mL,在室温放置20 min,2组均与不同质量浓度Vc 溶液(0.08,0.16,0.24,0.32,0.40 mg/mL)1 mL 混合,一组加入2.5 mmol/L邻苯三酚溶液0.4 mL,另一组加入蒸馏水0.4 mL混合均匀,在室温下反应5 min,加入8 mmol/L HCl溶液1 mL终止反应,用紫外分光光度计在波长325 nm处测定吸光度。以Vc作为阳性对照,每个质量浓度测3组平行数据,取平均值,计算清除率。
·O2-自由基清除率=[1-(A1-A2)/A0]×100%
其中:4.5 mL Tris-HCl 缓冲液与1 mL 无水乙醇+0.4 mL邻苯三酚和1 mL HCl溶液作为A0;4.5 mL Tris-HCl 缓冲液与样品溶液1 mL+邻苯三酚0.4 mL 和HCl溶液1 mL混合作为A1;4.5 mL Tris-HCl缓冲液+1 mL样品溶液+0.4 mL水+1 mL HCl溶液混合作为A2。
2.7 响应面试验设计
结合单因素试验结果,根据Box-Behnken 设计原理,采用响应面法进一步优化党参抗氧化活性工艺。利用Design-Expert 10.0 软件以党参ABTS 自由基清除率为响应值设计4因素3水平的实验方案进行分析,响应面因素水平见表1。

表1 响应面因素水平表
3 结果与分析
3.1 单因素对党参体外抗氧化能力的影响
3.1.1 不同料液比对ABTS自由基清除率的影响
考察不同料液比对党参提取液ABTS 自由基清除率的影响发现,随着料液比从1∶20 到1∶40 变化时,党参提取液对ABTS 自由基清除率伴随乙醇体积的增加先增加至89.56%,后又下降至84.98%。同时追踪总黄酮得率变化,其变化趋势与党参对ABTS 自由基清除率变化趋势相似,随着溶剂乙醇量增多,总黄酮很快溶解析出,但继续增加溶剂其得率有所下降。这可能是由于在后续浓缩过程中损失增大所致,由此可见党参所含抗氧化成分其得率与党参提取液清除ABTS 自由基能力正相关。综合分析,最终选择1∶25与1∶35为最低和最高水平进行响应面分析实验。见表2。

表2 料液比对ABTS自由基清除率的影响
3.1.2 不同醇浓度对ABTS自由基清除率的影响
考察不同乙醇浓度对党参提取液ABTS 自由基清除率的影响发现,随着乙醇浓度的增加,党参提取液ABTS 自由基清除率在乙醇浓度为85%时达到最高,为90.33%,同时总黄酮得率也达到最高,为6.79%,这是由于随着乙醇浓度增大,总黄酮较易溶解析出。继续增加乙醇浓度则导致其ABTS 自由基清除率下降,同时总黄酮得率也显示明显下降趋势,降至5.31%。见表3。既往研究发现,乙醇浓度过大则导致体系极性太低,不利于总黄酮的溶解析出[12−13]。醇浓度为85%时ABTS 自由基清除率数据最佳,以此为依据选择醇浓度80%~90%进行下一步的实验优化。

表3 乙醇浓度对ABTS自由基清除率的影响
3.1.3 不同提取温度对ABTS自由基清除率的影响
考察不同温度对党参提取液ABTS清除效果的影响发现,在温度为75~95 ℃范围内随着温度上升,党参提取液ABTS清除率先在85 ℃时达到95.98%,总黄酮得率也增至6.48%,这说明温度升高有利于总黄酮的溶解析出。然而当温度继续升高时其清除率则呈现下降趋势,降至91.10%。同时追踪总黄酮发现其得率也呈降低趋势,这可能是由于温度过高则会使总黄酮结构中易被氧化的部分发生氧化而失去还原能力所导致。整体总黄酮得率与其抗氧化能力正相关。最终选择温度80 ℃与90 ℃作最低和最高水平进行实验优化。见表4。

表4 提取温度对ABTS自由基清除率的影响
3.1.4 不同提取时间对ABTS自由基清除率的影响
考察不同提取时间对党参提取液清除ABTS 自由基的影响发现,在30~150 min 范围内随提取时间增加,ABTS自由基清除率先上升至93.27%,后又下降至87.81%。同时追踪总黄酮得率变化发现,其与温度变化趋势相似,先增至6.48%后又下降至3.72%。由此可见时间过长,会导致总黄酮部分结构发生氧化,从而使其失去抗氧化能力,党参提取液抗氧化能力与总黄酮得率正相关。综合分析选择提取时间在60、90、120 min进行下一步优化。见表5。

表5 提取时间对ABTS自由基清除率的影响
3.1.5 不同提取次数对ABTS自由基清除率的影响
考察提取次数对党参提取液ABTS 自由基清除效果的影响发现,随着提取次数的增加清除率随之上升并趋于平缓,提取次数1次与2次之间的清除率差值较大,3~5 次的清除率变化减小,均在89%左右,见表6。可明显看出提取次数的增加对总黄酮得率影响不大。从试剂消耗、抗氧化能力与富集以总黄酮为代表的抗氧化成分多少综合分析,选择2 次为最佳条件进行优化。
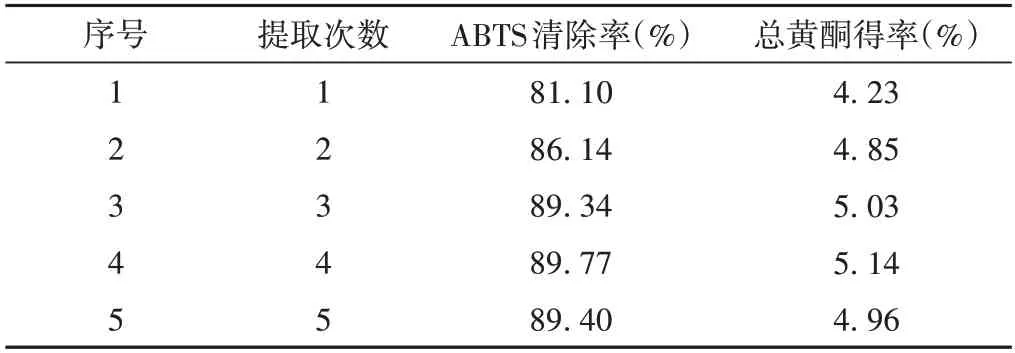
表6 提取次数对ABTS自由基清除率的影响
3.2 实验优化结果
党参抗氧化活性优化工艺回归模型的建立及其显著性检验见表7和表8。

表7 实验优化方案

表8 响应面设计与结果
根据实验结果,采用软件Design-Expert 10.0 对实验数据进行回归拟合,得到自变量料液比(A)、提取温度(B)、提取时间(C)、乙醇浓度(D)与ABTS 自由基清除率(Y)的多元二次回归方程为:

对响应面回归模型进行方差分析,结果见表8。该回归模型F值为3.15,P=0.026 8<0.05,表示该试验所得的回归方程达到极显著水平,该模型具有较高的可信度,回归方程可以很好地预测党参抗氧化活性。该模型中一次项D,二次项D2数据均<0.05,说明因素D对结果影响显著,而一次项A,B,C,和二次项A2,B2,C2的P值均>0.05,可见其交互作用相对较弱,对结果影响不显著。
3.3 响应面分析
由交互作用图可知,AC即料液比与提取温度交互作用曲面最陡,其交互作用最为显著,AC 交互作用P值0.073 9 与显著水平相当,这说明党参抗氧化能力对料液比与提取温度的改变较为敏感,与方差分析结果一致。见图2。

图2 影响因素交互作用响应面图
为了得到响应面最大值及实验最优方案,对所得结果进行分析,可得各变量因素的最大值料液比为1∶30.923,乙醇浓度为83.521%,提取温度为89.336 ℃,提取时间为68.727 min,最终得到的清除率为99.942%,考虑到实验的可实行性将因素水平进行改善,最终料液比、乙醇浓度、提取温度与提取时间分别为1∶30、85%、90 ℃、70 min,清除率为(99.93 ±0.03)%,与预测值接近,相对误差较小。
3.4 与Vc的抗氧化活性比较
在最佳工艺条件下对党参提取液与阳性对照组Vc抗氧化活性进行比较,结果在0.08~0.40 mg/mL的浓度范围内党参提取液对ABTS 自由基的清除率明显高于Vc,清除·O2-自由基与DPPH 自由基的能力则与Vc 相当,这说明通过工艺优化有效提高了党参抗氧化能力。见表9。

表9 党参与Vc对DPPH、ABTS以及·O2−自由基清除率的比较(%)
4 结论
本研究发现,能高度富集抗氧化活性的工艺条件为:料液比1∶30、乙醇浓度85%、提取温度90 ℃与提取时间70 min。在最优工艺条件下党参提取液对DPPH自由基、ABTS自由基以及·O2-自由基均展现出了优良的清除能力,且与维生素C 相当,甚至在清除ABTS 自由基时展现出了优于维生素C的抗氧化能力。追踪其抗氧化成分之一——总黄酮的含量也得到很大的提高,进一步表明该工艺能高度富集党参抗氧化活性成分,可以为下一步的血清药物化学提供技术支持。

