肾小球滤过率活体实时监测荧光示踪剂的研究进展
丁奕如,张超颖,谢贺新
(华东理工大学药学院,上海市新药设计重点实验室,上海 200237)
肾脏是人体新陈代谢过程的重要器官,通过过滤血液生成尿液排泄、清除代谢产物,调节血容量,维持电解质和酸碱平衡,从而保证机体内环境稳定[1,2].肾小球是血液和尿路之间的过滤屏障,对于成年人而言,每天约有180 L的血液流经肾脏,随后通过肾小球的滤过作用和肾小管的重吸收作用产生尿液[3,4].
急性肾损伤(Acute kidney injury,AKI)是一种临床常见的急性肾脏疾病.急性肾损伤临床表现主要为肾功能迅速下降或丧失,其主要特征有血液中废物溶质(如尿素和肌酐)水平升高、少尿及电解质紊乱[5].根据全球权威肾脏医学组织KDIGO(Kidney Disease:Improving Global Outcomes)共识定义,48 h内血清肌酐升高至26.5 mmol/L,或在7 d内升高至基线的1.5倍,或尿量少于0.5 mL·kg-1·h-1持续6 h,即可定义为急性肾损伤.
通常,急性肾损伤的病因是多因素的,其中脓毒症、休克和肾毒性占据了大多数[6].急性肾损伤的发病率在所有住院患者中为1%~7%,在重症监护病房(ICU)患者中高达30%~50%,并且伴有非常高的死亡率(约50%).全球每年约有170万人的死亡与急性肾损伤密切相关,并且在存活患者中容易发展成慢性肾脏病(约20%)或是终末期肾脏病(约5%)[7].同时,急性肾损伤也经常作为其它综合征(如心衰、肝功能衰竭和脓毒症等)的一部分出现,而这些综合征本身也会导致大量的发病率和死亡率.
在肾功能受损的情况下,对肾功能的准确评估对于早期发现肾功能衰竭、评估干预措施和监测肾功能变化至关重要[8].尽管在过去的近100年里,诊断技术已经取得了长足的进展,但肾脏疾病的早期诊断与发现仍然非常具有挑战性,特别是在重症监护病房中的易发患者中.血清肌酐和尿量是诊断急性肾损伤的非常有效的手段,但这两项指标都是肾脏损伤的较晚期标志,血清肌酐还会受到年龄、性别、饮食和药物等的影响.此外,肾脏的功能状态也可以通过肾小球滤过率、肾血流量和肾小管重吸收或各种化合物的分泌来评估.其中,肾小球滤过率(Glomerular filtration rate,GFR,即在单位时间内肾产生的滤液量)一直以来都被认为是评估肾功能的最佳指标[9].然而,GFR难以进行直接测定,因此通常应用特定标志物的肾脏清除率来进行推测.一种物质的肾脏清除率被定义为每单位浓度从血浆中清除该物质的速率[10],不同的标志物通常具有不同的GFR计算方法.
早期的GFR标志物主要是内源性标志物,包括血清肌酐(Scr)[11,12]、尿素(Urea)[13]、β2-微球蛋白(β2-M)[14,15]、β-痕迹蛋白(BTP)[16]以及血清胱抑素C(Cystatin C,CysC)[17,18],然而这些内源性标志物的检测通常操作方法繁琐、准确性偏低[19,20].另外,内源性标志物不可避免地受到个体差异的影响[21],并且这些标志物大部分是蛋白质.对这些标志物进行高灵敏度和准确度的检测通常依赖于复杂、精密的仪器设备,而且一般操作耗时和成本昂贵.迄今为止,尚未寻找到完美的内源性标志物,也仍未开发出精确和可靠的估计方法.

Fig.1 Structures of exogenous tracers for GFR
为了克服上述内源性标志物的问题,研究人员开始将目光转向GFR外源性标志物的开发.外源性标志物几乎不受个体因素的影响,具有更高的个体间重现性.目前常用的外源性标志物主要有菊粉(Inulin)[9]、碘酞酸盐(Iothalamate)[22]和碘海醇(Iohexol)[23~25]等(图1).这些标志物可以用于检测其在血浆中的清除率,但一般需要应用高效液相色谱(HPLC)或X射线荧光法(X-ray fluorescence)进行检测,并且需要费时费力多次采集血液和尿液样本,难以适合在临床环境中进行GFR的连续监测[20,26,27].为了解决这些问题,放射性的外源性GFR标志物[如51Cr-EDTA(EDTA=乙二胺四乙酸)[28],99mTc-DTPA(DTPA=二乙基三胺五乙酸)[29]等]也被开发出来.应用这些放射性的试剂在监测GFR中准确性更高,并可实现连续检测.然而这个过程中需要使用到价格昂贵的仪器设备,且监测对象需较长时间暴露在辐射中,很大程度上也限制了这些放射性标志物的临床应用[30].
分子荧光探针的成像技术作为一种操作简便、灵敏度高的非侵入性检测方法,其在活体成像研究、临床疾病诊断等领域都具有广泛的应用前景.近年来,一系列基于荧光技术的GFR示踪剂被设计、发展出来.同时,为了配合这些荧光示踪剂的应用,各种类型的检测仪器也陆续被开发出来,这些新型示踪分子和检测仪器在急性肾损伤的临床检测与诊断应用中取得了重要的进展[31].研究表明,外源性GFR荧光示踪剂的消除率可以在相关检测仪器的帮助下通过皮肤实现实时、无创的监测.与传统的方法相比,这一方法有效避免了频繁抽血和后续实验分析,显著提升了GFR监测的效率与操作的便捷性.基于GFR荧光示踪剂的分子结构,本文对其相关研究进行了归纳和总结,重点介绍了其设计策略以及临床应用的最新进展.同时,对相应的检测仪器开发进行了简单介绍,并展望了这些基于GFR荧光示踪剂的检测技术引入临床实践的发展前景.
1 外源性肾小球滤过率荧光示踪剂的设计策略
作为应用于肾功能实时监测的外源性GFR荧光示踪剂,一般情况下需要满足如下基本条件:(1)高生物兼容性,即在使用剂量范围内对检测对象没有危害性;(2)高稳定性,除肾清除外无其它代谢途径;(3)低血浆蛋白结合性和体内组织摄取性及高尿液回收率;(4)高度亲水性并在肾小球处自由滤过;(5)不被肾小管重吸收、分泌、合成或代谢[20];(6)具有较长的荧光的激发与发射波长及较高的荧光量子产率,使激发光与荧光信号能够有效穿透身体组织,确保其检测灵敏度.
为了满足这些要求,目前GFR荧光示踪剂在设计上主要采用以下两种策略:(1)直接利用高亲水性的小分子荧光化合物作为GFR示踪剂;(2)基于亲水性多糖大分子化合物与常见的非亲水性荧光染料共价键连接,构造可肾脏清除的大分子荧光GFR示踪剂.基于高亲水性小分子荧光化合物的GFR示踪剂具有明确的化学结构,在后续合成生产中的品质监控相对更容易.但是,这类示踪剂的吸收和发射波长相对较短,易于受到活体自发荧光信号以及穿透率的影响.相反,基于亲水性多糖大分子化合物的示踪剂,由于采用了与现有荧光染料共价键连接的方式来构建,因此可以采用吸收和发射波长以及荧光量子产率都较为理想的荧光染料,能够有效克服自发荧光及荧光穿透率的影响.然而,这类示踪剂一般采用具有一定分散性的多糖化合物,而非单一结构的化合物,因此其结构存在一定的不确定性.
目前,基于这两种策略发展的荧光示踪剂的吸收和发射波长一般都在可见光区域,一定程度上能够实现快速、动态和准确地测量肾脏清除率,均展现出了较好的临床应用前景.
2 小分子肾小球滤过率荧光示踪剂
基于小分子荧光化合物的GFR荧光示踪剂具有结构明确、易于获取的特点.目前作为外源性GFR小分子荧光示踪剂的主要是吡嗪类化合物.吡嗪及其衍生物通常具有较高的荧光量子产率、优异的光热稳定性和化学稳定性等特性.通过在吡嗪2位和5位引入吸电子基团,在3位和6位引入给电子基团(如3,6-二二甲氨基-2,5-氰基吡嗪,1)[图2(A)],可使其在最大吸收与发射波长均在可见光范围,斯托克斯位移接近100 nm,荧光量子产率约为0.4[32].2011年,Rajagopalan等[33]首次将吡嗪衍生物应用于荧光肾小球滤过率示踪剂的设计.他们以二羧酸吡嗪为母核结构,通过在其2位和5位引入一系列具有亲水性的取代基团,设计、合成了10种化合物,并从血浆蛋白结合率、血浆清除率、尿液中回收注射剂量百分比(%ID)及肾小管分泌等方面对这些化合物进行了筛选,最终筛选出3个较为理想的候选化合物2a(MB-102),2b和2c[图2(A)].在进一步的大鼠模型实验中,发现化合物2b具有与临床GFR测量的“金标准”碘酞酸盐基本相当的血浆清除率和更高的尿液中的回收率[图2(B)].
在此基础上,他们进一步在吡嗪母核中引入高亲水性的聚乙二醇(PEG)链作为取代基团.经过系列筛选,发现化合物2d(PP-2338)和2e具有非常低的血浆蛋白结合,并且在大鼠模型实验中呈现出了与碘酞酸盐基本相当的血浆清除率和尿液回收率以及更快的半衰期(2d:25 minvs.碘酞酸盐:32 min)[34].
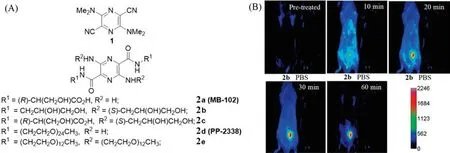
Fig.2 Structures of pyrazine-based GFR tracer agents(A)and in vivo time-dependent fluorescence detection of 2b(B)[33]
为了进一步评估化合物2d(PP-2338)在GFR实时监测中的作用[35],他们通过将大鼠5/6肾切除的方式构建了急性肾损伤模型(图3).研究发现,与对照组健康大鼠相比,化合物2d在急性肾损伤大鼠中的透皮荧光信号降低的速率要慢得多,其荧光信号清除的半衰期由对照组的25 min增加至85 min.这一结果表明了大鼠荧光信号变化的速率与其肾清除率具有高度相关性,并且首次确定这类化合物在透皮荧光检测中的潜力.
需要特别指出的是,为了更简化大鼠荧光信号的收集,他们构建了一套专门的检测装置[35](图3).该装置主要包括一个激光发生器(作为激发光源)与一个感光模组(作为荧光信号收集器).将该装置与相应的计算机相连即可实现在小型动物中荧光信号的采集与分析.在成像过程中,将相关检测探头置于血管分布较为密集的大鼠耳部即可实现荧光信号的实时非侵入性检测.这与一般的采血或采尿检测实验相比在操作便捷性上具有明显的优势.

Fig.3 Data acquisition system designed for 2d(PP-2338)(A)and representative elimination curves of 2d measured optically in anesthetized 5/6 nephrectomized and sham rats 7 d post injury(B)[35]
与此同时,Dorshow等[36,37]对先前筛选出的候选化合物2a(MB-102)也进行了更深入的研究.通过对MB-102在啮齿动物、比格犬等动物的体内安全性和毒性实验研究,证明了MB-102是一种具有高度生物安全性的GFR示踪剂候选化合物.通过对符合生产质量管理规范(GMP)条件下生产的MB-102进行分析,发现这一化合物具有高化学稳定性,在2~8℃下可以保持3年以上不发生变化[38].此外,研究发现,与经典GFR示踪剂碘海醇相比,MB-102具有更低的血浆蛋白结合率(MB-102:4.1%;碘海醇:6%),同时,MB-102固有的光物理特性为GFR的实时、定量测定提供了一种可靠的方法.
基于MB-102的首次人体临床研究于2017年被报道[39],研究人员搭建了一套经皮荧光测量仪,从而可以实现对血液中的MB-102荧光信号进行实时、非侵入性的测量.同时对测试人员身体的4个部位[前额、胸骨、内侧上部手臂和外侧下胸腔(代表躯干)]进行实时监测.观察到MB-102进入测量区域的平衡动力学会因身体的测量位置不同而发生变化[图4(A)和(B)].此外,由于运动和组织光学特性的变化,研究中也会观察到部分信号伪影.基于这些现象,研究人员进一步构建了一个电子模型[图4(C)],以解释观察到的临床测试结果,并完善了仪器设计[40].总体而言,8名肾功能正常且肤色不同的测试人员的测试结果显示,相关数据与模拟数据具有较好的一致性.

Fig.4 An example of clinical measurements of MB-102 for a single subject(A),measurements simulated by the model(B)[39]and a schematic of instrument developed to perform the transcutaneous fluorescence measurements(C)[40]
目前,MB-102已经在20多项正式的毒理学、安全性和药理学研究中[37]进行了性能评估.并且在人体测试中显示,静脉注射MB-102后可以利用直接放置在皮肤上的光电探测模块经皮检测MB-102的实时荧光信号.这些结果均表明,MB-102有望为GFR的定量分析提供一种可靠的方法.目前,MB-102正由MediBeacon公司进行开发,进行Ⅲ期临床实验研究.此化合物有望成为第一个真正在临床应用的实时GFR监测示踪剂.
3 基于大分子多聚糖的肾小球滤过率荧光示踪剂
作为应用于活体内荧光实时成像的试剂,GFR示踪剂对其激发/发射波长、荧光量子产率等都提出了较高的要求.然而,常用的具有较为理想光物理性质的有机荧光染料,由于一般都具有较高的亲脂性而难以有效通过肾小球滤过.为了能够将这类高效荧光染料应用在GFR示踪剂中,研究人员通常采用将其与高亲水性的大分子多聚糖化合物共价键结合的方式构建GFR示踪剂.由于荧光染料分子相对大分子多聚糖要小得多,因此这些染料分子的引入对多聚糖本身的肾小球滤过率影响甚微.基于这种策略构建的示踪剂同时具有高荧光量子产率和GFR示踪剂所必须的高肾小球透过率,在近年来受到了广泛关注.应用在这一类型GFR示踪剂中的大分子多糖化合物主要包括菊粉、葡聚糖(Dextran)、海葱糖(Sinistrin)以及环糊精(Cyclodextrin,CD)等(图5).这些多糖分子在GFR示踪剂应用研究中各有特点,并且其结构也可用于其它官能团的进一步修饰.
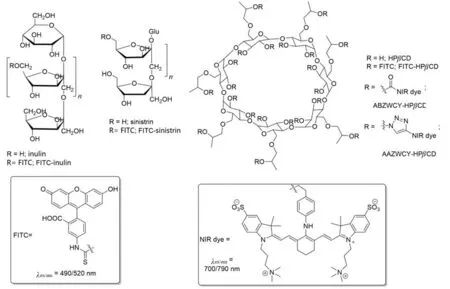
Fig.5 Structures of glycan-based GFR tracer agents
3.1 基于菊粉的肾小球滤过率荧光示踪剂
菊粉是一种分子量为3000~5000左右的惰性果糖聚合物,它可以被肾小球自由过滤,同时既不被肾小管上皮细胞分泌也不被再吸收,满足外源性标志物的所有标准,是一种较为理想的GFR外源性标志物[41].因此,菊粉清除率长时间以来被公认为是GFR定量的标准.菊粉的清除率被定义为每分钟为尿液中菊粉的排出所需的血浆体积[42].早期,菊粉单独作为外源性标志物被用来检测肾功能,一般通过分光光度法和荧光法进行定量[43].但这一方法一般需要较高的血浆菊粉浓度,以至于最终尿液中的菊粉浓度会产生一定的渗透效应,同时也进一步加重了肾的负担.
为了便于菊粉的检测,早在1983年,Ulfendahl等[44]即首次利用常用的荧光染料异硫氰酸荧光素(FITC)对菊粉进行共价键标记,构建了FITC-菊粉.FITC在菊粉中的分子取代度约为0.001,即每1000个单糖中约连接1个FITC分子.在低取代度的情况下,FITC的引入对菊粉本身的生物活性影响被降至最低.FITC本身具有明亮的绿色荧光,这一荧光基团在菊粉中的引入极大地简化了在复杂环境中对菊粉的测定.利用FITC-菊粉作为标志物,研究人员测定了肾小管液血浆浓度比(TF/P),这个比值与肾小管功能长度密切相关.为了研究FITC-菊粉作为衡量肾小球滤过标志物的有效性,在研究中以51Cr-EDTA和氚代菊粉作为对照进行了清除率和TF/P测试实验.结果显示,基于FITC-菊粉的检测方法与这两种方法具有良好的一致性,证明了FITC-菊粉作为GFR检测工具的有效性.然而这种基于FITC-菊粉的方法在消耗大量样本的同时,也同样要求维持较高水平的血浆菊粉浓度,因此这一示踪剂在应用中依然受到了较大的限制.考虑到这些问题,1999年,Lorenz等[45]利用FITC-菊粉通过微穿刺的方式研究评估单肾单元肾小球滤过率(SNGFR)和小管液再吸收情况.这种方法只需要较低水平的血浆菊粉-FITC浓度,而且分析过程中不会消耗液体样本,因此检测效率得到了较大的提高.
2004年,为了探寻简单、便捷的方式对清醒小鼠的肾脏功能进行检测,Breyer等[46]利用FITC-菊粉,分别用两种方式对清醒小鼠体内GFR进行了测定.一种方法是通过血浆FITC-菊粉的清除动力学来测量GFR,这种方式的主要优点是不需要定时收集尿液或进行手术,能够提供高重复性结果,但是反复采血本身也会给动物造成生存压力.另一种是通过腹腔内的微渗透泵持续给药FITC-菊粉,再利用代谢笼收集尿液来测量FITC-菊粉的清除量,以此来测定其尿清除率.这种方法可避免多次血液采样,但需要小鼠尿液的定时采集.这两种方法各有优缺点,但这一研究本身首次证明了利用FITC-菊粉检测清醒小鼠GFR的可行性.
2013年,Rieg等[47]基于FITC-菊粉报道了一种高通量测试有意识小鼠GFR的方法.这种方法通过应用双室模型,根据特定流程,只需通过剪尾采血得到的1~2μL的稀释血浆来测定其荧光,每天可以测量多达24只小鼠的GFR.该方法中所有的血液样本都可以在清醒小鼠体内采集,且只需要短暂的异氟烷麻醉.剪尾采血使得操作更方便快捷,同时,这种方式的另一个优势是,它可以在长达几个月的时间内持续跟踪治疗,通过饮食变化或药物应用进行配对协同实验.
然而,基于单一波长的荧光强度测量容易受到各种实验条件的影响从而造成偏差,如激发光源的波动、成像设备的不均匀性和不同成像深度的强度衰减等.为了克服这一问题,Yu等[48]发展了一种比率荧光测量法,利用活体荧光显微镜快速评估啮齿模型动物的肾功能.他们将FITC-菊粉和德克萨斯红-葡聚糖混合试剂经皮注入血液.在这两种试剂中,发出绿色荧光信号的FITC-菊粉由于分子量较小(3000~5000),可以自由透过肾小管,而发出红色荧光信号的德克萨斯红-葡聚糖由于分子量较大(500000)而不能被肾脏过滤,因此被限制在血管内.通过测量肾脏中绿色与红色荧光强度比率即可实现对GFR效率的快速评估,在量化肾功能方面具有更高的准确度.
在此基础上,他们进一步利用FITC-菊粉和德克萨斯红-葡聚糖混合试剂对急性肾损伤模型大鼠进行了研究[49].他们将混合试剂对小鼠进行快速输注,并对其肾脏进行荧光成像.从图6(A)可以看出,毛细血管的红色荧光通道的整体信号强度相对稳定,而毛细血管的绿色荧光通道的信号强度急剧下降,表明绿色荧光标记的菊糖从血管间隙中代谢消失.经过研究获得了0.17~1.12 mL·min-1·100 g-1范围的全谱GFR值,与标准菊粉清除分析得到的GFR值有很好的相关性.该课题组[50]还通过测定45 min缺血模型后24 h内多个时间点的GFR值,首次分析了肾脏缺血对肾功能的早期影响.研究发现,利用这种混合示踪剂再结合活体荧光比率双荧光通道肾脏成像和两室药代动力学模型,可以对正常和急性肾损伤模型大鼠实现GFR的快速量化.
为了将这一双荧光通道技术应用于临床,Wang等[50]进一步开发了能够产生及传递两个激发源,并对相应的发射进行检测量化的比率型光纤系统[图6(B)],可分别为FITC和德克萨斯红荧光标记物提供激发光源.经过特定的激发滤光片后,两束近准直的光束在反射蓝色并发射琥珀色的激发二向色镜处合并,混合荧光信号通过反射激发波长的同一双频分束器.他们将可传递激发光并收集荧光发射的亚毫米光纤通过商业静脉导管插入动物模型的外周静脉或中心静脉通路.混合注入分子量较小的肾自由过滤分子FITC-菊粉和肾不可过滤的德克萨斯红-葡聚糖,在被发光二极管激发后,光电倍增管检测和量化体内信号.该比率测定技术既可以检测血浆血管体积,又能高精度地实时测定GFR.这种独特的定量荧光方法的原理可以扩展应用到其它器官或其它过程的实时监测中,从而提高准确性.然而,考虑到混合试剂中含有的排泄半衰期接近无穷大的分子带来的潜在毒性,这种检测策略在临床应用上受到了极大的限制.
另一种经皮测量技术是Luyt等[51]研发的经皮脉搏染料密度计(TPDD).他们将开发的一种近红外染料(Cy7.5)标记的菊粉作为光学探针,在血氧仪中实时计算染料在动脉中的浓度,以非侵入性的方式测量活体的GFR.近红外荧光染料的应用有助于提升荧光穿透率,更利于检测深层组织的荧光信号.利用这一方法,目前已成功实现模型猪的无创GFR测量.
目前,在外源性标志物中,菊粉本身既不被肾小管重吸收也不分泌的特点使其依旧作为金标准而被广泛认可.而FITC-菊粉作为GFR荧光示踪剂在研究中也取得了一定的进展.然而,FITC-菊粉的一些不利因素长久以来一直困扰着研究人员.如其水溶性较差,使用前通常需要高温加热促进其溶解,并且其荧光染料FITC发射波长较短,穿透性有限,在部分活体成像中依然需要使用侵入性的方式进行.基于这些原因,目前各种替代策略也在开发研究之中.
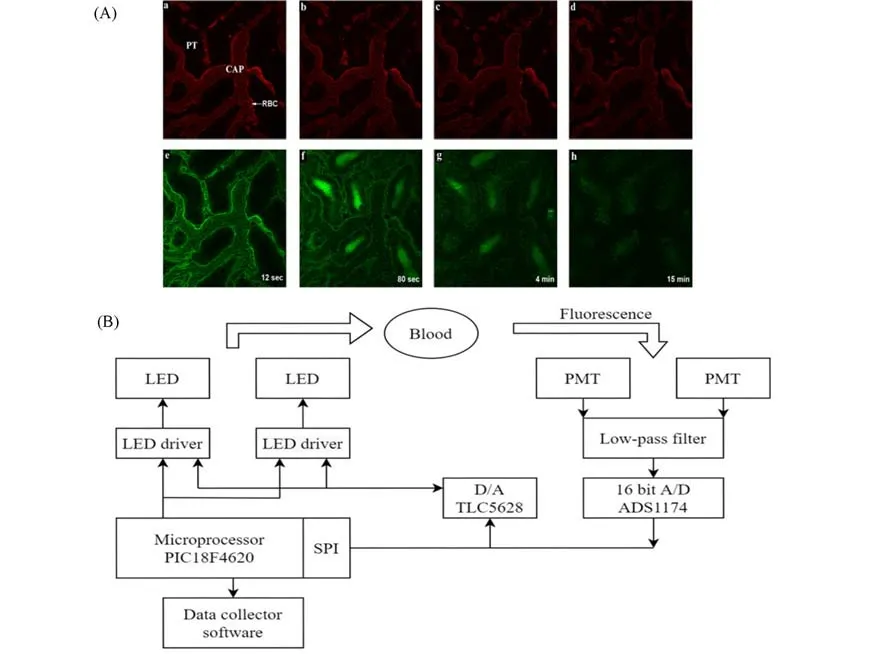
Fig.6 Two-photon images from a living rat infused a mixture of Texas red-dextran(red)and FITC-inulin(green)(A)[49]and design of the ratiometric optical fiber system(B)
3.2 基于海葱糖的肾小球滤过率荧光示踪剂
海葱糖(Sinistrin)是一种由果糖单位(97%)和葡萄糖单位(约3%)组成的支链多聚果糖,分子量范围在2000~6000之间,平均分子量为3500.由于其化学结构中存在侧链而增加了水溶性,使其在应用中更容易处理,并且海葱糖的聚合度、相对分子质量和流体动力学研究结果表明,其通过肾小球基底膜的渗透性比较好.因此,作为一种极具潜力的菊粉替代品,海葱糖在1963年首次被引入作为肾脏标志物[52].
2005年,为了克服FITC-菊粉水溶性较差、使用前需提前加热促溶解的问题,Pill等[53]首次将FITC与海葱糖共价键连接合成得到了FITC-海葱糖,其分子取代度约为0.08,即每100个单糖中约连接8个FITC分子.初步研究发现,利用FITC-海葱糖可使用常规荧光计检测其随时间变化的血浆清除率,并且基于这一试剂测定GFR的方法耐受性好、准确度高及相对易于操作,这些特点使得FITC-海葱糖成为一种极具潜力的GFR示踪剂.
为了简化活体中GFR的测定,Schock-Kusch等[26]注意到了利用GFR荧光示踪剂通过透皮实现实时测量GFR的潜力.为此,他们首次利用FITC-海葱糖作为荧光示踪剂,结合小型活体动物成像仪通过测量大鼠耳上的荧光信号开发了实时评估GFR的方法[图7(A)].由于活体成像仪的应用极大地简化了数据的收集,从而可以大大增加消除曲线上的测量点数量,有效提高了GFR的检测精度.他们通过与常用的酶法和荧光法同时测定的血浆清除率比较,证明了利用FITC-海葱糖经皮测量荧光强度得到的GFR结果的有效性.但这一方法与传统方法相比,避免了血液或尿液采样以及耗时的实验室工作,极大地简化并加快了小型实验室动物的GFR测定.然而,此研究中所选用的单室模型没有考虑到药物血浆浓度最初的快速下降,也存在一定的问题.对此可以通过获得大量的经皮测量数据,分析复杂的运动特征,根据获得的结果数据来建模,从而更精确地估计GFR.
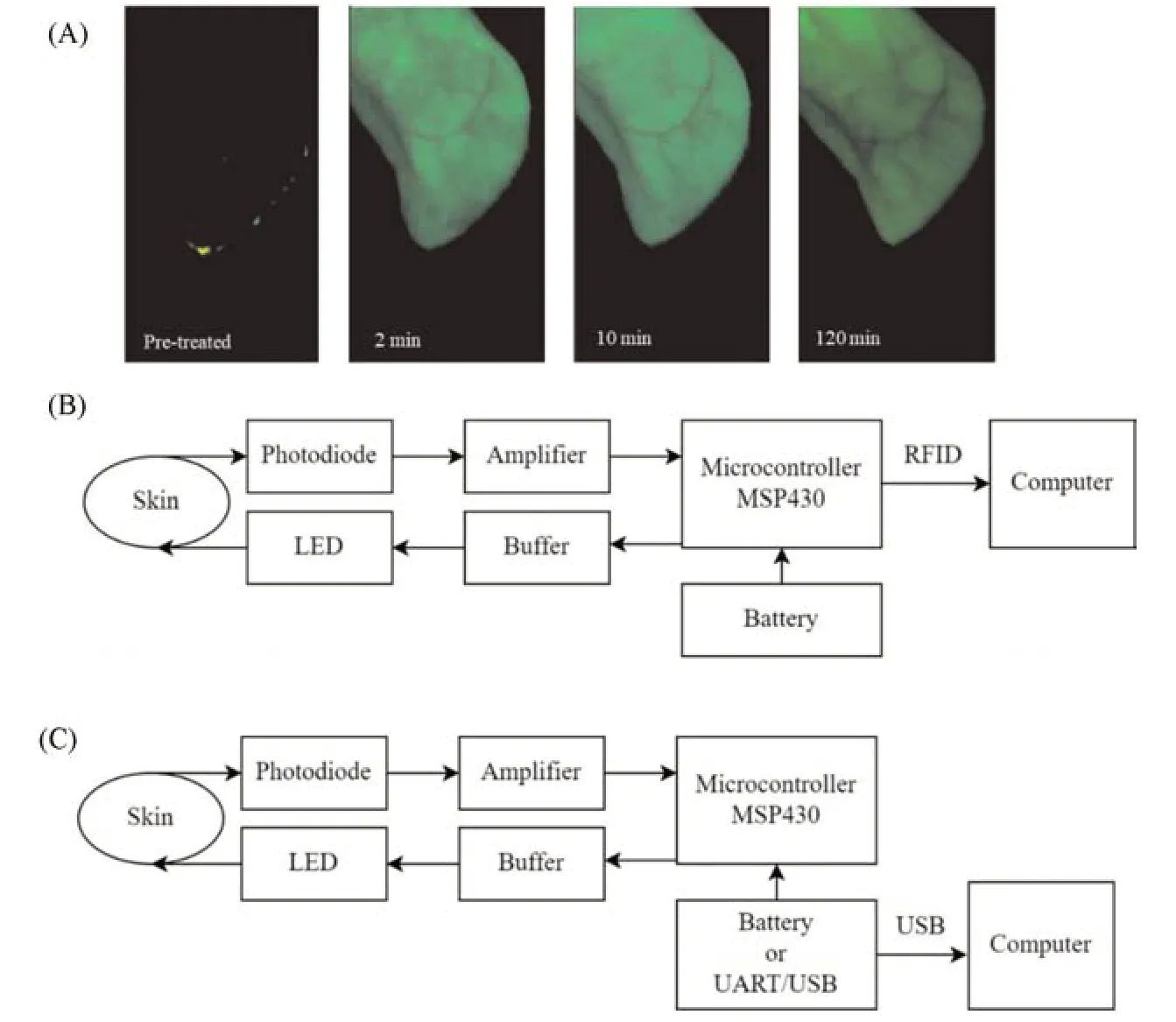
Fig.7 Fluorescence images of a depilated rat ear taken before and after injection of FITC-sinistrin using a CRI Maestro small animal imager(A)[26],a schematic drawing of a transcutaneous device and optical part of the device(RFID:radio-frequency identification)(B)and a schematic drawing of a modified miniaturized device(C)
一般小型活体动物成像仪对小型动物GFR的检测过程中通常需要提前对动物进行麻醉处理,而对动物进行麻醉本身也有很大可能对其GFR测定造成影响,从而降低检测的准确性.为了实现对非麻醉状态下的小型动物GFR的测量,Schock-Kusch等[54]设计、发展了一种小型便携荧光监测装置[图7(B)],该装置主要包括用于激发荧光标记物的发光二极管和用于检测所发射的荧光的光电二极管.将该装置固定在大鼠的皮肤上后,通过在适当的波长闪烁反复激发血管间隙内的荧光标志物,其发出的荧光信号被检测并转换成数字信号,存储在内部存储器中.利用这个监测装置,首次实现了对非麻醉状态下的小型动物进行荧光成像.这种用于测量非麻醉动物肾功能的非侵入性方法不会对动脉压、心率或运动活动产生不良影响[54].因此,可以避免麻醉本身导致的GFR变化,有利于获得更准确的结果.
2012年,该课题组[55]对先前报道的可用于大鼠的小型便携性监测装置进行进了优化,通过进一步缩减监测装置的尺寸,并配备内部存储器,使其可适用于体型更小的小鼠.基于这一装置,首次实现了对自由活动的清醒小鼠GFR的实时监测[图7(C)].使用这一小型化成像设备,结合已建立的二室模型,经皮测量荧光肾标记物FITC-海葱糖的消除动力学,并且在单侧肾切除小鼠和肾结核模型小鼠中证明了透皮检测法与传统血浆清除率法的结果具有良好的一致性.
在此基础上,该课题组[56]基于FITC-海葱糖透皮检测技术进一步建立了一种实时反馈调节的恒定输液清除方法.恒定输液清除(CIC)技术一直以来被认为是GFR评估方法的金标准.该系统主要由透皮监测装置和主机上用于调节输液泵的控制器组成.荧光检测器将测量的数据发送到主机,主机能够控制一个装有FITC-海葱糖的注射器泵,将药物注射进动物的股静脉.设置参考剂量后,闭环调节能够自动确定最佳的维持注射剂量,从而做到对每一实验对象的平衡时间单独优化.这种方法可以精确地确定稳态标记浓度的起始点,实时监测体内标记物浓度的相对变化,从而实现独立于GFR水平的维持剂量的单独优化调节.此外,达到稳定状态后可以连续监测数小时,且可以只使用单一血液样本确定GFR.他们还对不同品系小鼠(Balb/c,SV129,NMRI和C57BL/6)进行两次经皮GFR测定,评估了GFR的日常可重复性、品系内和品系间变异性以及年龄等参数对研究的影响[57].这项研究发现,同一动物在3 d内记录的GFR测量数据可靠性强,根据小鼠品系的不同,变异系数稳定在3.0%~6.2%之间.
目前,这种非侵入性肾脏清除检测装置(NIC)已经实现商业化制造,并在多种动物模型中验证了其可行性.如,Cowley等[58]应用该装置,通过注射FITC-海葱糖连续测定有意识且行动自由的达尔盐敏感性(SS)大鼠中随着高血压发展的前21 d GFR的变化.研究结果表明,该方法与传统的基于肌酐清除的标准测量方法相比,检测灵敏度更高,且更为简便省时.并且,实验显示SS大鼠的肾小球滤过率下降出现于高血压发生的约14 d后,因此推断肾小球滤过率的降低是高血压所导致的结果而并非其原因.此外,该装置还被用于血管紧张素转换酶(ACE)基因敲除小鼠中,证明了肾脏ACE对于一氧化氮合成诱发的高血压抑制起着非常重要的作用[59].
利用FITC-海葱糖和非侵入性肾脏清除检测装置,Street等[60]测定了野生型和A1aR基因敲除小鼠盲肠结扎和穿刺性脓毒症早期的GFR和系统血流动力学,为已知的脓毒性急性肾损伤中GFR降低建立早期时间表.研究表明,透皮荧光检测可以准确快速监测GFR在脓毒症期间的变化,而传统的GFR生物标志物检测方式无法检测到如此快速的变化.此外,Scarfe等[61]利用类似的技术对阿霉素诱导的肾病模型小鼠的GFR进行了评估,发现海葱糖清除率与患有阿霉素诱导肾病的重度联合免疫缺陷(SCID)小鼠中受损肾小球的比例显著相关.这项技术允许对个体动物进行反复测试,最大限度地利用肾病和/或再生效应的进展获得信息,可以显著减少临床前肾病模型中的动物数量.
Mullins等[62]基于FITC-海葱糖对瘦和肥胖C57BL/6J雄性小鼠进行了经皮GFR测试研究.研究发现,这种非侵入性技术可以实时连续测量清醒瘦小鼠的GFR,而无需收集血液和尿液或进行化验.但是在高脂饮食诱导的肥胖、高血糖和近端肾小管病变的小鼠中,基于经皮荧光测试得到的GFR与公认的血浆清除方法得到的结果差异性较大.他们推测,GFR经皮荧光和/或血浆检测可能受到循环脂类与FITC-海葱糖之间相互作用的影响.此外,Chang等[63]首次将透皮监测装置和FITC-海葱糖用于实时测量模型大鼠GFR和肾损伤生物标志物的研究中.
由于活体动物背景荧光信号干扰、荧光信号透过率低等原因,用于监测GFR的荧光示踪剂通常需要使用较高的浓度.但是,荧光示踪剂的血浆和/或尿液浓度过高可能会干扰常规的血液或尿液检测.因此,在应用于人体之前,应最大限度地减少荧光标记物使用的浓度,以此减少其潜在副作用.为此,Shmarlouski等[64]提出了基于时间相关单光子计数(TCSPC)的一种新的GFR透皮测量方法,称为荧光寿命分解测量(LTDM),即将时间相关单光子计数采集与新的分解方法相结合[图8(A)].该硬件的光路由发射波长为485 nm的新型紧凑型皮秒脉冲二极管激光器、柔性光纤束和可安装于清醒大鼠背上的测量头,以及以单光子计数模式工作的光电倍增管和经优化的时间相关单光子计数单元组成.这种方法可以将FITC荧光信号与背景荧光信号分离,有效排除体内自发荧光,从而提高检测灵敏度.与NIC透皮检测装置相比,在保留相同检测精度的情况下,该系统在清醒大鼠体内的所需FITC-海葱糖检测剂量减少了200倍.但是,LTDM依赖于光导,因此必须使用Raturn微透析笼来防止测量头因强烈运动而分离,因此检测成本较高.研究指出,LTDM设备的高昂成本与Raturn笼的应用缺陷能够被节省GFR荧光示踪剂的优势所弥补.当监测时间延长或者在需要更大剂量荧光示踪剂的狗或猪等高等动物中进行临床前研究时,这一优势更为明显.

Fig.8 Components of optical measurement systems for lifetime-decomposition measurement(LTDM)(A)and MR-compatible optical sensor devices for FITC-sinistrin clearance measurement(B)[67]
同样,为了解决透皮检测GFR过程中皮肤漂白、自发荧光以及由皮肤灌流变化的影响,Friedemann等[65]通过测得的经皮荧光数据,推导并验证了一个新的区别于标准1~3室模型的FITC-海葱糖分布和排泄动力学的数学算法.结果表明,记录从注射示踪剂开始的完整动力学过程,结合基线信号偏移的自动校正,基于透皮荧光测定得到的GFR可以达到与金标准恒定输液清除率近乎相当的精度.
除了荧光示踪剂透皮检测外,动态对比增强磁共振成像(DCE-MRI)也是一种非侵入性的GFR检测方法.动态对比增强磁共振成像还支持单肾GFR,甚至可以通过计算参数图对GFR进行空间分辨分析.但是,基于这一方法在人体研究和动物研究中的结果表明,其与金标准检测方法结果偏差较大[66].Zöllner等[67]在Schreiber等[55]设计的透皮装置的基础上进行了改进,首次报道了一种可以同时进行磁共振成像(MRI)和荧光成像的小型传感器[图8(B)].这种传感器包括用于信号激发和接收的LED及光电二极管的原始设备和电子器件,采用铜箔屏蔽,仅保留LED、光电二极管和电池插头.该装置允许通过两种非侵入性技术(动态对比增强磁共振成像和经皮荧光检测)同时测量GFR,免除了血液/尿液采样或实验室检测的繁琐程序,具有高时空的三维(3D)分辨成像.通过透皮荧光检测所获得的平均GFR值大约是DCE-MRI值的两倍.与之前的报道相比,这种差异的缩减改善了大鼠GFR的测量结果.研究认为,GFR测量差异可能是由于未能找到最佳的动脉输入函数以及未能考虑到信号强度与浓度曲线转化中的偏差.
此外,Ahmad等[68]于2021年首次报道了X射线计算机断层成像(CT)和FITC-海葱糖透皮荧光检测在放射性肾脏疾病成像中的联合应用,利用FITC-海葱糖荧光成像弥补了X射线成像不利于在7 d内多次评估的问题.该课题组评估了C57BL/6小鼠接受双侧局灶X射线照射治疗后的肾损伤,结合FITC-海葱糖肾排泄的透皮测量以及使用造影剂(ISOVUE-300 Iopamidol)的动态对比增强CT成像来检测GFR.基于FITC-海葱糖的技术允许在有意识、自由移动的小鼠中重复测量GFR,而使用非离子造影剂的动态增强CT成像可以提供肾脏的功能信息和形态特征,两种方法具有较好的互补性.
FITC-海葱糖的优异表现使研究人员在肾病模型的研究和临床应用中对海葱糖尤为关注.然而这种示踪剂具有一定的局限性,如海葱糖成本相对较高、提取和纯化过程复杂.此外,大部分多糖都是多分散的聚合物,结构的确定性相对较低.这些物质是否均匀可靠也是它们能否用作GFR标志物的一个重要限制因素.
3.3 基于环糊精衍生物的肾小球滤过率荧光示踪剂
环糊精(Cyclodextrin,CD)是一类环状低聚糖,一般含有6~12个D-吡喃葡萄糖单元.这些环状寡糖具有高水溶性,在动物和人体内毒性都非常低,生物相容性良好,并且不会引发免疫反应,因此在制药与相关工业中具有非常广泛的应用[69].2-羟丙基环糊精(HPCD)由于破坏了次级羟基之间的氢键网络,具有比一般天然环糊精更好的水溶性[70],如,2-羟丙基β环糊精(HPβCD)水溶性可以达到60%(质量分数),甚至更高.并且,这一类化合物对猪源或人源的α-淀粉酶的水解性也更稳定.此外,它们的分子量相对海葱糖分布更窄,获取成本更低.HPCD经静脉给药后体内吸收非常低,主要经由肾脏排泄.HPCD已被证明在人体内短期和长期研究中耐受性良好,静脉给药对肾脏或其它器官基本没有不良影响[71].诸多优良性能使它们成为GFR荧光试剂的理想骨架[72,73].
2016年,Gretz课题组[74]首次基于2-羟丙基环糊精发展了一系列GFR荧光示踪剂,其中,基于2-羟丙基β环糊精(HPβCD)构造的化合物FITC-HPβCD是最具潜力的GFR检测试剂(图5).这一荧光示踪剂可以经由2-羟丙基β环糊精与荧光染料FITC共价键标记快速合成得到,并且化合物具有良好的荧光特性.研究表明,FITC-HPβCD具有低血浆蛋白结合力,高血浆与酯酶稳定性,并且没有展现出任何可检测到的细胞毒性.在模型大鼠实验中发现,FITC-HPβCD在体内基本不被代谢,具有非常高的尿液回收率.他们进一步通过一个微型经皮荧光信号监测装置对注射FITC-HPβCD的实验大鼠进行了非侵入性实时荧光信号分析[图9(A)],结果显示,在有与没有丙磺舒处理的情况下,FITC-HPβCD的清除没有显著差异[图9(C)和(D)],证明肾脏近端小管对这一示踪剂既没有重吸收也没有分泌,即FITC-HPβCD仅被肾小球滤过.这些结果为基于2-羟丙基环糊精发展GFR示踪剂奠定了重要基础.此外,相关检测设备体积小,可以直接穿戴在清醒大鼠身上[图9(B)],通过对其荧光信号强度变化的测量,实现了以非侵入性的方式对未麻醉实验动物GFR的实时动态监测.
基于荧光探针分子的成像技术在活体动物成像中易于受到光穿透率、光散射和自发荧光信号的干扰.如,血液中的血红蛋白对可见光具有较强的吸收作用,极大地限制了短波长荧光信号的穿透,而源自弹性蛋白、胶原蛋白以及其它一些生物荧光团的自发荧光也会对活体荧光信号的检测造成较大的干扰[75,76].由于GFR荧光示踪剂发射波长大部分都在波长较短的蓝、绿光范围,在进行体内无创透皮肾功能评估时,不可避免地受到信号穿透性差和组织的自发荧光信号背景的干扰,限制了其应用.而在700~1700 nm近红外区域,包括近红外第一窗口(NIR-I,波长:700~900 nm)和近红外第二窗口(NIR-II,波长:1000~1700 nm),由于其组织穿透深、自发荧光干扰少及成像速度快等优点,近年来引起了极大关注[77].但是,有机近红外荧光染料大多具有强疏水性的大π-共轭体系,这通常会导致染料与血清中的蛋白质之间有很强的结合,会影响由此产生的药代动力学、药效学和体内的生物分布[78].
Gretz课题组[79]将近红外荧光染料七甲川菁与2-羟丙基β环糊精共价键连接,首次发展了发射波长在近红外区域的GFR荧光示踪剂ABZWCY-HPβCD与AAZWCY-HPβCD(图5).同时,为了降低亲脂性的荧光染料与蛋白的非特异性结合,他们在染料中引入磺酸基阴离子和季铵盐阳离子,使其具有两性离子.研究结果表明,这些近红外荧光示踪剂具有非常强的亲水性、极低的血浆蛋白结合与生物毒性以及更深的荧光信号穿透性.同时,与多数GFR荧光示踪剂一样,可以有效透过肾小管而不被肾小管重新吸收与分泌.他们进一步将这些近红外荧光示踪剂分别注射到健康大鼠与过表达人Ang II 1型受体(hAT1R)的肾功能障碍大鼠中.同时,为了实现对清醒大鼠的荧光信号监测,他们也开发出一个穿戴式的小型荧光监测装置.该装置由两个激发波长为700 nm的发光二极管和一个用于检测790 nm发射波长的光电二极管组成.通过无创透皮实时荧光强度变化检测发现,肾功能障碍大鼠的血浆半清除时长比肾功能正常大鼠显著增加[图9(E)和(F)],从均值32.98 min增加到了42.88 min,表明基于这些近红外的荧光示踪剂来实时监测肾脏的功能具有较高的可行性.
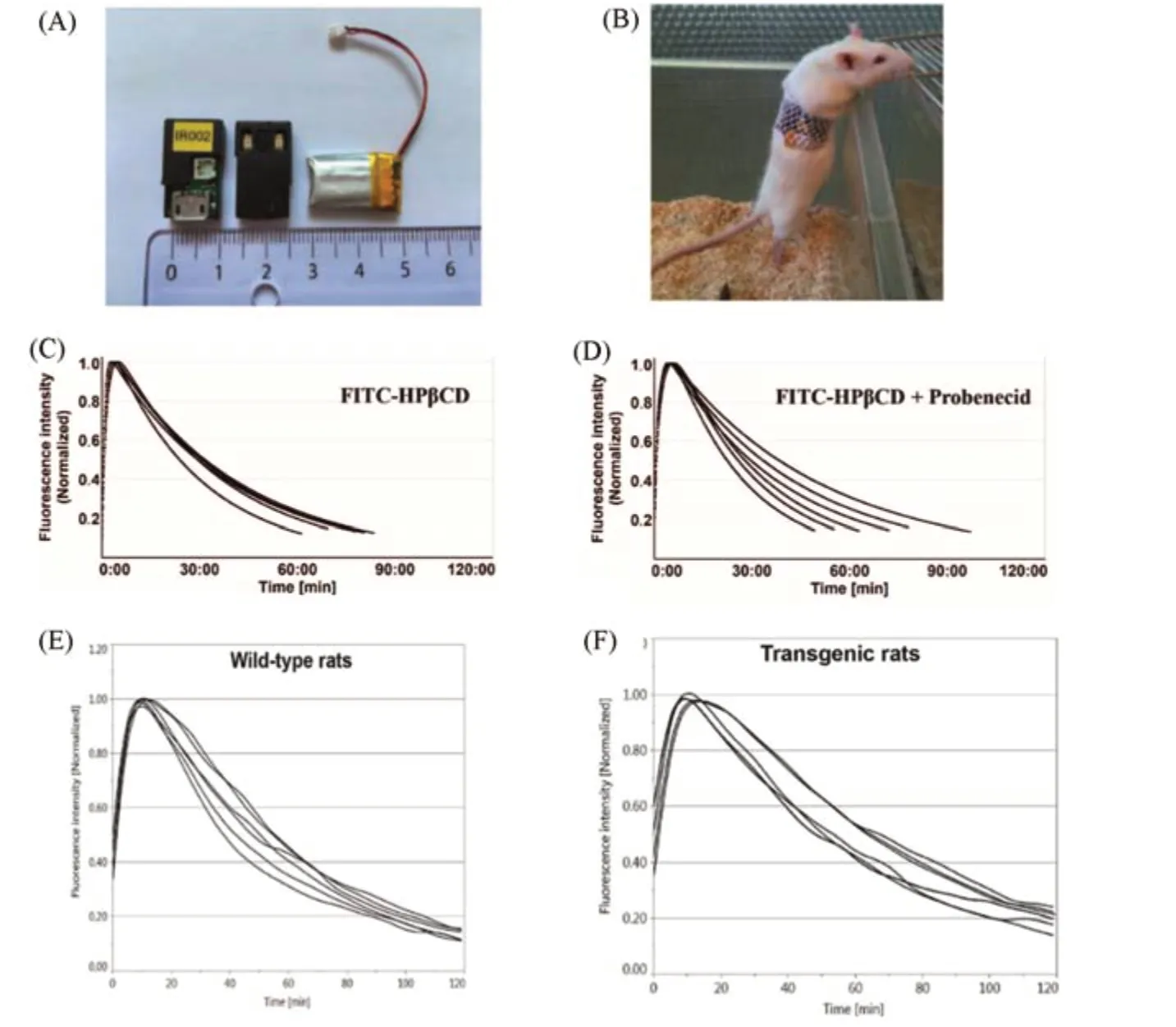
Fig.9 Miniaturized transcutaneous devices and a battery for transcutaneous measurement(A),a conscious Sprague-Dawley(SD)rat under transcutaneous measurement with an attached device(B),elimination curves of FITC-HPβCD by transcutaneous measurements in SD rats in the absence(C)and presence(D)of probenecid treatment[74],elimination curves of ABZWCY-HPβCD by transcutaneous measurements in wild-type rats(E)and AT1R transgenic rats(F)[79]
综上,肾小球滤过率(GFR)荧光示踪剂在过去的20多年间取得了长足的发展(表1),一系列新颖的荧光示踪剂被陆续发展出来,同时,与之相匹配的系列检测装置也被开发出来.这些示踪剂与新型成像装置的结合,已在模型动物的GFR实时监测中展示出极大的应用潜力.特别是通过小型穿戴式荧光成像装置,更可实现对清醒无麻醉状态下模型动物的透皮非侵入性荧光检测,实时了解其肾脏功能.

Table 1 Summary of GFR fluorescent tracers and their key parameters
4 总结与展望
基于荧光示踪剂的分子结构和设计策略,对近20年来发展的GFR荧光示踪剂进行了归纳与总结,同时对相关的检测仪器或装置也进行了介绍.在这些探针分子中,基于吡嗪的荧光示踪剂MB-102目前由MediBeacon公司进行开发,正在进行临床Ⅲ期研究当中.同时,基于大分子多糖化合物与常用荧光染料共价键连接构建的GFR荧光示踪剂,由于其具有的荧光量子产率高、结构可调性强等优势,受到了越来越多的关注,相关的临床研究也在稳步推进中.这些GFR荧光示踪剂的成功开发,再结合可穿戴式的小型化检测仪器,一方面将极大地简化肾脏功能相关模型动物的研究,实现对各种类型动物在清醒非麻醉状态下的实时肾功能监测.更为重要的是,在另一方面将为潜在肾功能障碍病人,特别是处于重症监护室中的急性肾损伤高危人群提供一个无创实时的监测与诊断工具,使医护人员能够早了解、早干预、早治疗,具有非常重要的临床应用价值.
尽管当前GFR荧光示踪剂已经取得了令人瞩目的进展,但是这些试剂的进一步应用,尤其在临床应用中仍然面临着一些问题.首先,活体组织固有的背景荧光信号以及荧光在活体组织中的低穿透率依然是目前GFR荧光示踪剂需要克服的一个挑战,这直接影响到了相关示踪剂的检测灵敏度.尽管目前通过增加示踪剂的用量一定程度上能够提高检测信号的强度,但与此同时也增加了肾的负担,一定程度上带来了试剂安全性方面的问题.此外,目前近红外荧光染料的应用也有助于解决荧光信号穿透率低和背景信号干扰等问题,但依然存在较大的提升空间.可以预期,进一步应用具有更长激发/发射波长、更高量子荧光产率的荧光染料,特别是处于近红外二区(1000~1700 nm)激发/发射的荧光染料将有助于提升信号穿透率和降低背景荧光信号干扰,提升检测灵敏度,从而进一步降低荧光示踪剂的用量.同时,能够有效去除背景荧光信号与具有更高检测灵敏度的新型仪器的开发也将有效地降低荧光示踪剂的实验量.其次,目前GFR荧光示踪剂主要是依赖于单一荧光信号强度的变化来评估个体GFR.这种方法尽管在应用上相对简单,但是易于受到成像光源、信号接收装置、检测位点变化,甚至个体差异性等各个方面的影响,对检测结果的可靠性产生影响.为了解决这个问题,基于混合示踪剂的比例性荧光检测方法已经被开发出来,但是这种混合试剂中基本不排泄示踪剂的应用极大地限制了其临床应用的可能性.此外,基于肾小管滤过率来对肾脏功能进行实时监测和评估的方法也难以反映出肾脏本身更为早期的病理变化,从而失去对病人更早干预治疗的宝贵机会.近年来,一系列基于环糊精的激活型分子荧光探针被报道出来,通过体内注射探针结合尿液分析的方式对肾脏早期病变生物标志物进行检测,实现了对急性肾损伤更早期的诊断[80~82].但是,这种依赖于尿液分析的方法对应用于处于重症监护期的急性肾损伤易发病人群存在一定的困难.在未来的研究中,如果能够将这种类型的荧光探针分子与GFR荧光示踪剂有机结合,构造出具有检测靶标成像功能的GFR荧光示踪剂,通过体表无创的方式实现同时对包括肾小管滤过率和前期的急性病变信号在内的肾脏功能的实时监测,将更有助于这一检测策略在重症监护状态下急性肾损伤易发人群中的应用.

