金属-有机框架材料在癌症诊疗中的应用
董明杰,王 璇,董海峰,张学记
(深圳大学医学部生物医学工程学院,人工智能与数字经济广东省实验室(深圳),深圳 518000)
癌症诊疗,即集诊断和治疗功能于一体,涉及成像与治疗试剂的有机整合,可以为临床医生根据患者的病情制定个性化的治疗策略,并进一步监测治疗的效果,从而准确判断预后[1].目前,用于癌症诊断的成像技术主要包括光学成像[2]、光声成像[3]、磁共振成像[4]、计算机断层扫描成像[5]和正电子发射断层扫描成像[6]等.然而,这些成像技术都存在一些内在缺陷,比如低灵敏度、低穿透深度和低组织对比度等,降低了其成像质量和诊断效果[7].另一方面,在癌症治疗方法上,除了传统的手术疗法、放疗和化疗外,免疫疗法、光热疗法、光动力疗法、化学动力疗法和声动力疗法等备受关注.但各类疗法也都存在各自的缺点,如化疗的低选择性与大毒副作用[8],光热疗法的光组织穿透能力受限[9],放射疗法和光/化学/声动力疗法的肿瘤乏氧限制[10],免疫疗法的肿瘤和个体异质性[11]等,并且这类治疗都需要在成像指导下进行才能获得更好的治疗效果.因此,将众多成像技术与治疗策略的特点整合到一个智能化的一体化诊疗平台中,进行成像引导的精确癌症治疗已经成为一个热门的研究方向[12,13].
随着纳米技术和合成策略的发展,大量功能化纳米材料被制备出来,用以满足癌症诊疗中同时成像诊断和高效治疗的特殊需求[14,15].一般来说,理想的癌症诊疗纳米材料需要满足成像和治疗试剂的高负载能力、良好的生物相容性和可降解性、可控稳定的纳米尺寸及易于设计修饰的表面性质等特点[16].
金属-有机框架材料(MOFs)又称多孔配位聚合物,是一类由金属离子或金属簇(也称为次级构筑单元,SBUs)和多齿有机配体构建而成的有机-无机杂化多孔材料[17].相对规律和可预测的配位模式使制备的MOFs具有多孔和结晶性质,而配位键的相对不稳定性又使MOFs能在温和条件下合成,从而兼容很多有机官能团.因此,MOFs的这种结构、组成和功能可调的类分子性质使其不同于传统的无机材料,表现出更大的应用潜力.经过约30年的发展,MOFs已经在气体存储与分离[18]、传感[19]、催化[20]、光学材料[21]与生物医药[22~24]等方面表现出强大的应用前景.自2006年Lin课题组[25]首次报道将纳米MOFs用于成像试剂后,MOFs在生物医药领域的应用更是得到了空前的发展.与传统的应用于生物医药领域的纳米材料相比,MOFs主要有以下3方面的结构优势:(1)高孔隙率和大比表面积,利于高效负载成像和治疗试剂;(2)易设计修饰的SBUs和有机配体,利于多功能特性的引入并实现时空可控的功能激活;(3)生理环境中可调的框架稳定性,利于设计可控释放的纳米载体.因此,基于这些特性,MOFs已经被用作多种成像引导的多模式癌症治疗平台(图1).
Fig.1 Schematic illustration of MOFs as cancer theranostic nanoplatforms
本文由MOFs的组成结构出发,从(后修饰)金属节点、(后修饰)有机配体、MOFs复合物和MOFs衍生物4个方面(图2)分别总结了各种组成结构用于癌症诊断(光学成像、光声成像、磁共振成像、计算机断层扫描成像和正电子发射断层扫描成像)和治疗(放疗、化疗、光热疗法、光动力疗法、化学动力疗法、声动力疗法和免疫疗法)的研究进展.此外,还阐述了MOFs在癌症诊疗中的发展前景和面临的关键挑战,希望能够帮助研究者全面了解MOFs在癌症诊疗领域的现状,并激发MOFs和生物医学交叉领域的跨学科研究活动,从而推动这一领域的发展.
Fig.2 Four common strategies for loading theranostic agents into MOFs
1 基于(后修饰)金属节点的癌症诊疗平台
成像技术作为一种智能化的可视化工具,为探索疾病特别是癌症的发病机制和特征提供了重要保障.其中,成像试剂是成像技术的关键组成部分,在成像过程中起着至关重要的作用[26].然而,传统的小分子成像试剂存在易降解、代谢速度快及非特异性分布等缺点.因此,在过去的几十年里,研究者制备了各类有机和无机纳米载体用于负载小分子成像试剂以克服上述问题,从而提高疾病的诊断效果[27].遗憾的是,虽然已经取得了重大进展,但无机载体的生物降解性、体内分布和代谢机制仍需进一步全面研究[28];而有机载体的低负载率、弱靶向性和易降解性也限制了其更好的发展[29].作为一种有机-无机杂化材料,MOFs具有结构可设计、功能可调、易后修饰、可生物降解、超高比表面积和孔隙率等优点,已成为最有希望用于癌症诊断的候选材料之一.此外,MOFs还可以同时负载小分子药物、酶、光敏剂和核酸等生物活性制剂以实现成像引导的癌症诊疗[30~33].作为构筑MOFs的基本元素之一,金属离子在生物体内扮演了非常重要的角色,其含量与很多疾病的发生发展密切相关,同时还是非常重要的成像试剂.
1.1 磁共振成像诊疗平台
磁共振成像是利用外部磁场/无线电波与探测到的软组织中的质子(通常是水中的氢原子)之间的复杂相互作用产生射频信号,获得活体解剖和生理过程的医学成像技术[34].由于其无创、空间分辨率高和组织穿透深等特点而被广泛应用于临床[35].磁共振造影剂可以改变检测部位质子的纵向弛豫时间(T1,s)和横向弛豫时间(T2,s),从而构建疾病诊断图像[36].造影剂的效率由横向弛豫值(r2,mmol·L-1·s-1)与纵向弛豫值(r1,mmol·L-1·s-1)的比值确定,当r2/r1在1~3之间时表现为T1类型,当r2/r1>10时,表现为T2类型,而在两者之间时,表现为2种类型共存[37].目前,小分子的Gd螯合物和超顺磁性的氧化铁常被分别用于T1加权(正信号增强)和T2加权(负信号增强)成像,但是使用剂量通常较大,且水溶性差,有效半衰期短.基于此,将Gd,Fe和Mn等金属离子用于构筑MOFs可以在癌症诊疗中增加造影剂的肿瘤积聚,提高成像质量[38].
1.1.1T1型磁共振成像诊疗平台 2006年,Lin课题组[25]首次报道了以Gd为金属节点的纳米MOF用于磁共振成像的造影剂.该研究中使用的2种MOFs通过反相微乳液法合成,一种是GdCl3与对苯二甲酸构筑的[Gd(BDC)1.5(H2O)2]n,另一种是GdCl3与1,2,4-苯三酸构筑的[Gd(1,2,4-BTC)(H2O)3]n.2种MOFs在相同摩尔浓度下都表现出了极高的r1和r2弛豫值.随后,Hatakeyama等[39]通过在反相微乳液法合成时引入助水溶物来调控[Gd(BDC)1.5(H2O)2]n和[Gd(1,2,4-BTC)(H2O)3]n的尺寸大小.研究发现,水杨酸钠的引入可以显著减小Gd-MOF的尺寸至约82 nm,从而增加其总比表面积,使r1值提高到了83.9 mmol·L-1·s-1,是临床上使用的马根维显(钆喷酸葡胺注射液)造影剂的约20倍.
除了Gd,顺磁性的二价Mn也是一种与Gd类似的T1造影剂,且毒性相对较低[40].Mn是参与线粒体过程的天然细胞成分,其摄取高度依赖于细胞内的线粒体代谢和线粒体密度,因此可以成为肝脏和其它富含线粒体的器官(如胰腺和肾脏)的有效造影剂[41].这些特点可以指导研究者开发基于Mn的MOFs用于磁共振成像.Lin等[42]使用反相微乳液法合成了具有可控形态的Mn MOF{[Mn3(BTC)2(H2O)6]n},随后将二氧化硅层包裹在Mn MOF上,并用环精氨酸-甘氨酸-天冬氨酸(RGD)肽功能化用于肿瘤靶向.制得的纳米MOF表现出了高灵敏的肿瘤特异性磁共振成像性质.Qin等[43]合成并比较了2种水溶性的Mn和Gd MOFs,{[Mn2(Cmdcp)2(H2O)2]·H2O}n(1)和{[Gd(Cmdcp)(H2O)3](NO3)·3H2O}n(2),用作体内的磁共振造影剂.如图3(A)和(B)所示,体外测试表明,Mn MOF的r1值为17.50 mmol·L-1·s-1,略高于Gd MOF(13.46 mmol·L-1·s-1),但都远高于临床使用的造影剂Gd-DTPA(DTPA=二亚乙基三胺五乙酸,r1=4.87 mmol·L-1·s-1).体内成像实验表明,Mn MOF具有长时间的高对比成像能力,使肾脏的阳性信号显著增强[图3(C)].
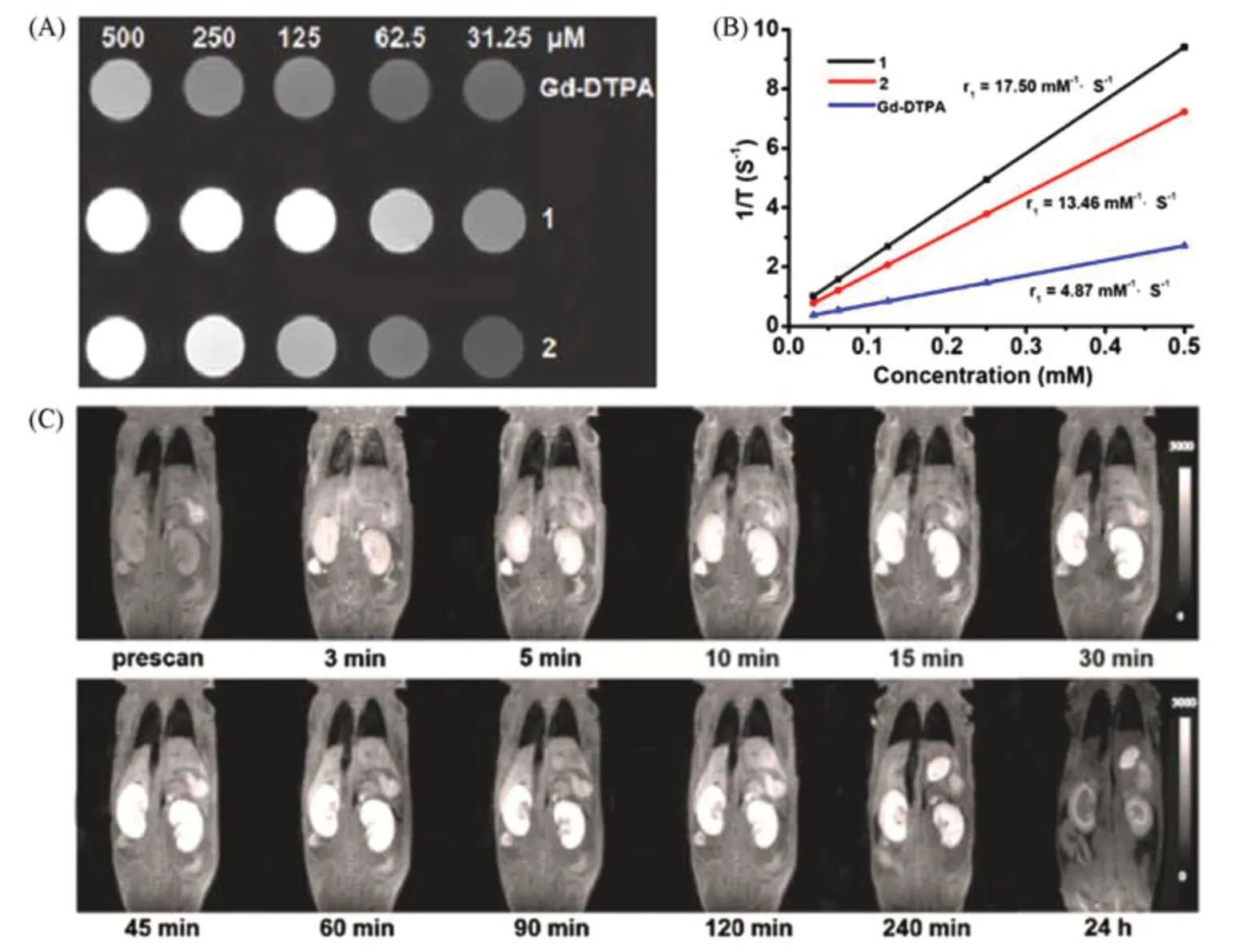
Fig.3 MRI imaging properties of([Mn2(Cmdcp)2(H2O)2]·H2O)n(1)and[Gd(Cmdcp)(H2O)3](NO3)·3H2O)n[43]
Mn离子除了磁共振成像能力外,在体内特别是双氧水高表达的肿瘤微环境中,还具有出色的化学动力学治疗功能[44].Yu等[45]以3,5-二(4-羧基苯基)吡啶(H2PBC)和MnCl2在水/DMF混合溶剂中合成了纳米MOF,Mn-PBC,在肿瘤中表现出T1增强的磁共振成像功能,同时Mn(II)与过表达的双氧水产生类芬顿反应产生羟基自由基,表现出化学动力学治疗功能.
1.1.2T2型磁共振成像诊疗平台 与Gd不同,Fe是生物体内大量存在的基本元素之一,在许多生物过程中具有非常基本和重要的作用[46].由于体内Fe含量较高,因此从MOF框架中泄漏出的Fe元素一般也不会产生毒副作用[38].与Gd和Mn相比,铁基磁共振成像造影剂可增加T2弛豫速率,并表现出负向图像增强,导致磁共振图像出现暗对比度效应.2010年,Horcajada等[47]首先开发了铁基MOFs用作磁共振成像造影剂.研究中使用MIL-88A(Fe)和MIL-100(Fe)2种MOFs,分别由延胡索酸和均苯三甲酸与氯化铁反应制备,都表现出很高的r2值.通过H3C-PEG-NH2进一步修饰包裹2种纳米颗粒后可以降低MOFs在水中的聚集,从而使MIL-88A(Fe)和MIL-100(Fe)的r2值分别由56和73 mmol·L-1·s-1增加到95和92 mmol·L-1·s-1,使其具有更好的成像能力.Zhang等[48]利用MIL-101(Fe)来递送未甲基化的磷酸胞嘧啶鸟嘌呤寡核苷酸(CpG ODNs),用于磁共振成像引导的免疫治疗.MIL-101(Fe)纳米粒子通过π-π相互作用后修饰CpG ODNs,与游离的CpG ODNs相比,该纳米材料显示出更强的免疫反应,以及体内外更高的T2磁共振成像能力.
1.2 计算机断层扫描成像诊疗平台
计算机断层扫描成像作为临床辅助检查的重要方法之一,具有良好的空间分辨率和较深的组织穿透性,是利用扫描组织间X射线衰减差异重建的三维灰度成像,为癌症的可视化诊断提供了良好的依据[49].目前,高原子序数元素如I,Au,Bi和Ba等,由于具有高X射线衰减能力,常被用作小分子计算机断层扫描成像造影剂,以增加靶组织与周围组织的区分度.但由于这类小分子造影剂在体内清除快,从血管和淋巴管外渗,组织靶向性低及剂量要求高(数十克)等,严重限制了其应用[50].因此,将Zr,Hf和Bi等高原子序数金属元素用于构筑MOFs,并进行一定的功能化修饰,即可解决上述问题,从而提高计算机断层扫描成像指引下的癌症治疗效果.
Lin课题组[51]报道了UiO-66构型的含高原子序数金属元素(Zr,Hf)的纳米MOFs的构建,并展示了其作为计算机断层扫描造影剂的应用.Zr和Hf的原子序数分别为40和72,是潜在的计算机断层扫描造影剂.该研究中,将合成的UiO-66(Hf)纳米颗粒用二氧化硅和聚乙二醇包裹以提高其生物相容性,并用于小鼠体内成像,在肝脏和脾脏都得到了更高的信号衰减.该课题组[52]还合成了节点为Zr12和Hf12簇、配体为卟啉单元的纳米MOFs,不仅具有良好的计算机断层扫描成像能力,而且还能在X射线照射下分解水产生羟基自由基实现放射治疗;同时Hf12簇为节点的纳米MOF还能作为X射线闪烁体,将吸收的X射线能量转移到卟啉配体上,从而激发卟啉配体产生单线态氧,达到放射动力学治疗的目的.本课题组[53]也合成了以Zr为节点、铁卟啉为配体的纳米MOF材料,实现了计算机断层扫描成像指引下的光动力和光热治疗功能.
Bi是天然存在的没有放射性的最高原子序数的元素,因此是一种构建计算机断层扫描成像MOFs的理想金属元素.Farha课题组[54]报道了一种节点为[Bi6O4(OH)4(NO3)6(H2O)](H2O),配体为1,3,6,8-四(4-羧基苯基)芘的一维纳米MOF,Bi-NU-901.体外实验结果表明,Bi-NU-901造影剂的效率分别比具有相同拓扑结构的Zr-MOF和商业化的造影剂碘克沙醇高约7倍和14倍.此外,Bi-NU-901在磷酸盐缓冲液中的稳定性使其进一步在体内应用成为可能.
除了以金属节点中的金属为成像中心外,还可以通过在金属节点上后修饰含高原子序数元素的有机分子作为成像中心.Zhang等[55]合成了一种含有单分散二碘取代的硼-二吡咯亚甲基(BODIPY)染料的MOF,即UiO-PDT,用于大鼠原位肝癌模型的计算机断层扫描成像[图4(A)].将BODIPY通过羧基与节点Zr的配位作用修饰到UiO-66中,制备了尺寸约为70 nm的八面体UiO-PDT.实验结果表明,UiO-PDT具有良好的生物安全性以及与浓度相关的X射线衰减效应,在浓度为40 mg/mL,R2=0.997时,衰减值为236 HU[图4(B)].从大鼠原位肝癌模型的成像结果看,UiO-PDT优先在肿瘤部位积聚,而非周围结缔组织和器官,静脉注射24 h后肿瘤与周围组织轮廓非常清晰,可获得最佳成像效果.该研究为构建具有计算机断层扫描成像能力、可用于疾病诊断和治疗的MOFs提供了可能.
1.3 正电子发射断层扫描成像诊疗平台
正电子发射断层扫描成像是一种核医学成像技术,应用正电子发射核素的解体来可视化体内的代谢过程,具有穿透深度大、剂量要求小、灵敏度高及定量能力强等优点[56].通常,临床使用的正电子发射断层扫描成像造影剂包含18F(t1/2=109.8 min),11C(t1/2=20.39 min),13N(t1/2=9.965 min),15O(t1/2=2.037 min),68Ga(t1/2=68 min),64Cu(t1/2=12.7 h),89Zr(t1/2=3.27 d)和124I(t1/2=4.176 d)等元素[57],但是这类临床造影剂同样面临组织特异性差等问题,因此通过将这类元素引入MOFs后可以增加其成像效果.
Hong等[58]通过在合成过程中加入锆的正电子发射同位素89Zr,开发了具有放射性的UiO-66纳米MOF(89Zr-UiO-66),并将其作为放射性示踪剂.通过负载DOX,并进一步用芘衍生的聚乙二醇(Py-PGA-PEG)和F3肽配体进行表面修饰,以靶向肿瘤细胞上的核蛋白,并增强肿瘤区域纳米MOF的细胞摄取和药物递送[图5(A)].在F3靶向肽修饰后,通过在不同时间点将此材料注射到MDA-MB-231肿瘤小鼠后进行正电子发射断层扫描成像研究,发现MDA-MB-231人乳腺肿瘤细胞对89Zr-UiO-66具有选择性地增强摄取作用[图5(B)].毒性评估结果证实,适当PEG化的89Zr-UiO-66不会对实验对象造成急性或慢性毒性.由于核仁素对肿瘤血管和肿瘤细胞具有选择性靶向作用,这种具有放射性的纳米MOF可在癌症治疗中得到广泛应用.

Fig.4 CT imaging properties of UiO-PDT[55]
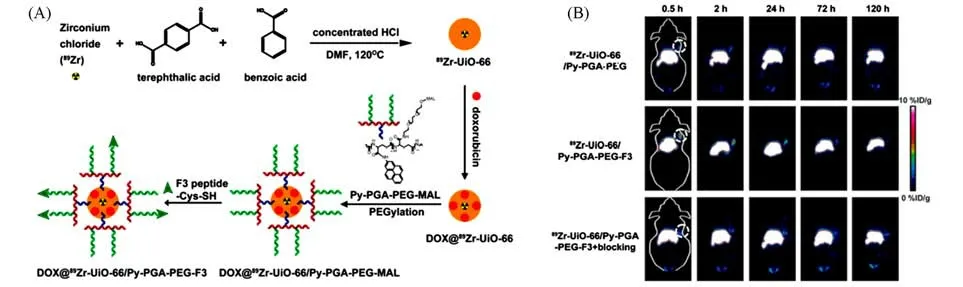
Fig.5 Synthesis and PET imaging properties of 89Zr-UiO-66/Py-PGA-PEG-F3[58]
1.4 光学成像诊疗平台
光学成像是一种常用的疾病诊断成像技术,其通过显像剂将光转化为荧光或磷光信号,反映生物体中器官、组织或细胞的信息,具有操作方便、灵敏度好以及分辨率高等优点.由于镧系元素具有稳定的强荧光发射、大而有效的斯托克斯位移和较长的荧光寿命,因此基于金属节点的MOFs光学成像诊疗平台主要通过构筑镧系MOFs实现.
Abazari等[59]报道了一种以9配位Eu(III)为节点的MOF,Eu:TMU-62-NH2,经过叶酸表面修饰和5-氟尿嘧啶(5-Fu)负载后进行人乳腺癌MCF-7细胞的靶向递送与荧光成像.与无叶酸修饰的材料相比,叶酸修饰的材料具有更好的癌细胞靶向能力,表现出更强的红色荧光发射.此外,该材料具有在酸性环境中响应释放5-Fu的能力,可以实现肿瘤微环境中的可控释放.与单分子的5-Fu相比,该材料具有更大的活性氧产生能力和细胞凋亡能力.
除了单纯的金属节点作为光学成像中心外,还可以通过后修饰金属节点实现光学成像中心的引入.Xie等[60]将BODIPY染料通过羧基与MOFs中的金属节点的配位作用引入到MOFs中.通过溶剂热法制备了平均直径为70 nm的八面体UiO-66纳米晶体,并通过溶剂辅助配体交换将羧酸盐功能化的二碘-BODIYP(I2-BDP)连接到Zr6节点上,负载量可以达到约30%(质量分数),具有良好的荧光成像能力和光动力治疗效果.
2 基于(后修饰)有机配体的癌症诊疗平台
有机配体在MOFs中扮演了非常重要的角色,也是MOFs区别于一般无机材料的重要部分,有机配体构型和功能的可设计性造就了MOFs结构和功能的多样性.因此,通过有机配体的设计及后修饰,可以赋予MOFs各种成像性质及治疗功能.
2.1 磁共振成像诊疗平台
除了在MOFs节点中引入金属外,有机配体也可以负载和修饰金属离子,因此有机配体也可以作为磁共振成像的中心.Yin等[61]将顺磁性金属离子螯合到有机配体卟啉环中制备金属卟啉MOFs,用于T1加权磁共振成像引导的癌症治疗.通过将顺磁性Mn离子螯合到卟啉环中,金属卟啉MOFs具有卓越的T1加权磁共振对比能力、高光热转换和热响应NO释放性质.体内实验结果表明,磁共振成像显示金属卟啉MOFs通过静脉注射到小鼠体内后可在肿瘤部位有效积累.经过808 nm激光照射下的光热治疗和NO气体治疗后,肿瘤被完全抑制,说明该金属卟啉MOFs在磁共振指引治疗中的应用潜力.
2.2 正电子发射断层扫描成像诊疗平台
Wang等[62]通过原位聚合策略制备了聚合物包裹的纳米MOFs,具有很强的生理稳定性,用于正电子发射断层扫描成像引导的可控药物递送.锆基卟啉MOF(Zr-MOF)、MIL-101(Fe)、ZIF-8和UiO-66等MOFs可用于锚定双[2-(甲基丙烯酰氧基)乙基]磷酸盐(BMAP)配体,在表面形成由不同单体[如N,N′-双(丙烯酰)半胱氨酸、丙烯酸、聚(乙二醇)二丙烯酸酯、荧光素二甲基丙烯酸酯和聚(乙二醇)甲基丙烯酸酯]制成的聚合物涂层,最终得到聚合物包裹的MOFs.与原始MOFs相比,聚合物包裹的MOFs在磷酸缓冲液和细胞培养基RPMI-1640中的稳定性显著增强.同时,聚合物包覆MOFs的稳定性也与包裹在表面的单体类型有关.以卟啉Zr-MOF为例,利用卟啉中心与64Cu配位得到的Zr-MOF在A431荷瘤小鼠中表现出良好的正电子发射断层扫描成像能力.重要的是,与64Cu标记的Zr-MOF相比,64Cu标记的聚合物包裹的Zr-MOF由于延长了血液循环时间而在肿瘤区域实现了显著的积累,具有更好的监测和治疗效果.
2.3 光学成像诊疗平台
有机荧光小分子具有生物相容性好、荧光量子产率高及易设计合成等特点,是一种理想的光学成像试剂.但往往由于水溶性低及组织靶向能力差等问题而受到限制.因此,通过将此类分子设计成多齿有机配体,用以构筑纳米MOFs,有望解决上述问题.
Zhang等[63]报道了一种用仿生癌细胞膜包裹的MOF纳米材料(mCGP),用于荧光成像引导的癌症饥饿和光动力协同治疗.由Zr6团簇和四羧基苯基卟啉(TCPP)制备球形PCN-224 MOF,通过静电作用负载葡萄糖氧化酶(GOx)和过氧化氢酶(CAT),然后包裹癌细胞膜,制备了具有10 nm均匀外脂质双分子层的仿生核壳材料mCGP.由于仿生表面的修饰,mCGP的免疫逃逸和同源靶向能力将显著提高其对肿瘤的靶向和滞留效应.一旦进入到肿瘤细胞中,mCGP装载的CAT可以将H2O2分解为O2,从而改善缺氧微环境中的O2含量,而GOx可以促进葡萄糖的消耗,对肿瘤进行有效的饥饿治疗.此外,在光照射下,TCPP具有光动力治疗的功能.同时,通过体内荧光成像测试可以跟踪静脉给药后mCGP在肿瘤部位的积累情况,确定给药后光照的时间以及药物的代谢情况.
聚集诱导发光(AIE)分子是一类在单分散状态不发光,聚集状态下发强荧光的分子,具有良好的光稳定性、大的斯托克斯位移以及高效的活性氧产生能力等特点,是一类理想的生物成像和治疗分子[64,65].本课题组[66]设计了含AIE分子的纳米MOF复合材料,用于荧光成像指引的光动力和化学动力联合治疗乳腺癌.如图6所示,将AIE分子单元设计修饰到对苯二甲酸中,用于构筑含AIE分子的UiO-66构型A-NUiO MOF,为了克服水对AIE分子荧光发射的干扰,在其表面修饰一层疏水的小分子层十二烷二酸(DCDA),然后再在其表面修饰铜掺杂的ZIF-8层,得到荧光猝灭和光动力功能抑制的核壳型纳米材料A-NUiO@DCDA@ZIF-Cu.当该材料进入肿瘤微环境之后,由于外层ZIF-Cu在弱酸性和高GSH含量条件下不稳定而降解,从而导致疏水核A-NUiO@DCDA聚集,增加其在肿瘤的滞留时间,同时恢复荧光发射和增强光动力效果,实现肿瘤微环境刺激响应的荧光成像与光动力治疗.此外,ZIF-Cu降解释放的Cu2+能消耗谷胱甘肽,生成的Cu+能进行化学动力学治疗,进一步增加了肿瘤的治疗效果.
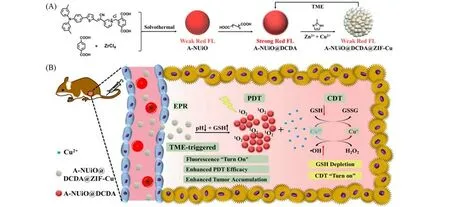
Fig.6 Schematic illustration of the synthesis process and theranostic features of A-NUiO@DCDA@ZIF-Cu[66]
除了直接利用构筑MOFs的有机配体作为光学成像诊疗分子外,还可以通过后修饰有机配体引入光学成像诊疗试剂.Lin课题组[67]合成了有机配体氨基功能化的MIL-101(Fe)纳米颗粒,通过氨基与羧基或烯丙基溴的反应后修饰光学成像试剂BODIPY,负载量可达11.6%(质量分数),进一步修饰一层二氧化硅层后,可以实现较好的荧光成像能力,而负载铂类前药可以进行化学疗法杀死肿瘤细胞.
2.4 光声成像诊疗平台
光声成像是生物组织吸收脉冲激光产生光声信号而形成的一种独特的无创、非电离医学影像检测技术,是研究靶向组织的形态结构、病理特征和代谢功能的重要工具,特别适用于癌症的早期诊断和治疗监测[68].与其它成像技术一样,MOFs也被用作光声成像试剂,以获得高质量成像引导下的增强癌症治疗效果.
Zhou等[69]利用钯与四吡啶基卟啉(TPyP)外围吡啶基团的配位,合成了一种卟啉Pd-MOF.在Pd-MOF中对单原子Pd进行还原加氢后,得到的PdH-MOF具有分布均匀的纳米级尺寸、良好的水分散性、优良的光热效率(光热转换效率为44.2%)与光声成像性能、持续的还原释氢行为以及高的肿瘤靶向性.因此,得到的PdH-MOF纳米颗粒具有光声成像引导下的光热和氢气协同治疗癌症的作用.
本课题组[70]以光声成像分子5,15-二(对苯甲酸)细菌卟吩(H2DBBC)为配体,Hf(6μ3-0)(4μ3-OH)4为节点,合成了一种多功能的细菌叶绿素基MOF纳米片,DBBC-UiO,用于缺氧肿瘤的光声成像引导的光动力治疗[图7(A)].DBBC-UiO纳米片长约220 nm,厚约4.6 nm,表现出良好的稳定性,在754 nm处有强烈的近红外吸收峰,可进行较深组织的光动力治疗.实验结果表明,DBBC-UiO在近红外激光照射下,既可以通过II型光动力机制产生1O2,也可以通过I型光动力机制在严重缺氧微环境中产生大量的超氧阴离子自由基(·O2-),从而促进肿瘤细胞凋亡.进一步实验表明,该材料在MCF-7荷瘤小鼠中表现出良好的生物相容性、优秀的光声成像能力和显著的肿瘤生长抑制作用[图7(B)和(C)],为利用基于MOF的纳米平台对缺氧实体肿瘤进行成像引导的光动力治疗提供了新的机会.
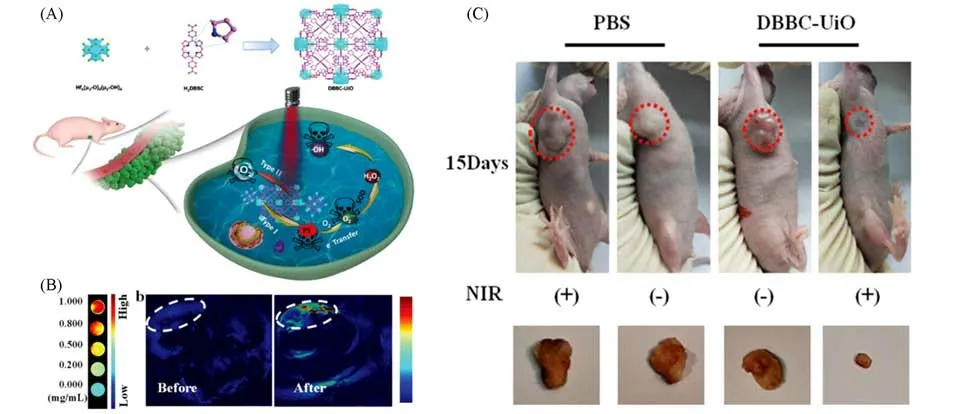
Fig.7 Synthesis,PA imaging and tumor therapy properties of DBBC-UiO[70]
3 基于MOFs复合物的癌症诊疗平台
MOFs具有可调的孔道尺寸、超高的比表面积和孔隙率以及可设计的降解性质,是一种理想的成像试剂和活性药物载体,特别对于一些疏水性的、在血液循环中易被清除的物质,可以显著增加其肿瘤积聚.
3.1 磁共振成像诊疗平台
Yang课题组[71]将具有T2加权磁共振成像能力的Fe3O4纳米颗粒原位负载到UiO-66中,得到核壳结构的Fe3O4@UiO-66,然后与水溶性羧酸盐柱[6]芳烃(WP6)纳米阀反应形成智能诊疗纳米复合物,Fe3O4@UiO-66@WP6,用于磁共振成像引导的宫颈癌治疗[图8(A)].Fe3O4@UiO-66核壳纳米复合物通过将具有高负载抗肿瘤药物5-Fu能力的UiO-66-NH2壳层生长在具有优异的磁共振成像能力和磁分离效应的Fe3O4核表面制备.随后,WP6纳米阀通过与UiO-66-NH2壳层上含有的1-(6-溴己基)溴化吡啶的动态主-客体相互作用修饰到Fe3O4@UiO-66纳米复合物表面,制得在病理环境下具有多刺激响应性药物释放能力的Fe3O4@UiO-66@WP6.值得注意的是,该智能诊疗纳米平台具有良好的生物相容性,优异的T2加权磁共振能力[图8(B)]以及对HeLa细胞的卓越杀伤作用.有趣的是,WP6纳米阀的存在可使药物持续释放超过7 d,这证明了超分子纳米阀在药物可控释放方面的有效性和可调性.该研究为配有超分子纳米阀的MOF基纳米复合物用于癌症诊断和治疗提供了可能.

Fig.8 Synthesis,MRI imaging and chemotherapy properties of Fe3O4@UiO-66@WP6[71]
3.2 计算机断层扫描成像诊疗平台
Han等[72]利用Au纳米棒(NRs)的计算机断层扫描成像性质,将其与ZIF-8构建了一种Janus纳米复合材料,即LA-AuNR/ZIF-8,用于H22荷瘤小鼠的计算机断层扫描成像引导的化学-光热协同治疗.该体系中,在聚丙烯酸的作用下ZIF-8被组装到Au NRs上,然后在侧表面上修饰靶向基团乳酸,制得Janus构型的LA-AuNR/ZIF-8.为了评估该系统的药物传递能力,将DOX作为模型药物负载到LA-AuNR/ZIF-8中,载药量为30%,可以在弱酸性pH条件/近红外刺激下响应释放.值得注意的是,由于Au NRs的存在,LA-AuNR/ZIF-8表现出33%的光热转换效率,显示出良好的光热治疗能力和计算机断层扫描成像能力.因此,具有良好生物相容性和双刺激响应药物释放的LA-AuNR/ZIF-8在近红外激光照射下表现出有效的计算机断层扫描成像引导的协同化疗和光热治疗效果.
3.3 光学成像诊疗平台
持久性发光纳米颗粒(PLNPs)具有一种独特的光学现象,即使在移除激发光源后,也会连续发射数秒或数小时[73].基于这些优势,Xie等[74]报道了ZIF-8纳米颗粒与铬掺杂的ZGGO近红外PLNPs的复合物,使得该核壳多功能纳米复合物在近红外光谱区域发射,可在体内条件下消除自体荧光干扰并获得深部组织穿透和低辐照损伤.在该研究中,PLNPs提供了长期的近红外持续发光信号,用于具有红光可充电特性的自荧光生物成像,而具有较好生物相容性的ZIF-8提供了一个外壳结构,用以负载抗癌药物DOX.所制备的ZGGO@ZIF-8-DOX多功能复合物通过DOX荧光和近红外持续发光实现了4T1小鼠乳腺腺癌细胞的双重成像,并可作为pH响应型药物递送系统,在体内肿瘤荧光成像和治疗方面表现出非常好的效果.
量子点(QDs)是一种半导体纳米晶,通常在2~10 nm的大小范围内,具有尺寸依赖的荧光发射[75].与传统荧光分子相比,QDs的光致发光带窄、吸收窗宽、摩尔消光系数大、光漂白率低、量子产率高且化学稳定性好,因此在各种领域都具有广阔的应用前景,而其与MOFs的结合近年来引起了人们的关注[76].特别是荧光碳点(C-dots),作为一类新型的量子点和纳米碳,与有毒的金属基量子点相比,具有较强的荧光强度、较高的物理化学稳定性和较低的毒性,具有很高的生物医学应用价值[77].本课题组[78]设计合成了一种“火龙果”型的MOF碳点复合物,用于荧光成像指引的光动力治疗(图9).通过在卟啉MOF,PCN-224中负载具有上转换性质的C-dots,可以在近红外激光(808 nm)照射下激发碳点,再将能量转移到卟啉上,进行荧光成像和光动力治疗.同时在MOF表面修饰TPP后,可以实现线粒体靶向功能,达到更好的光动力治疗效果.
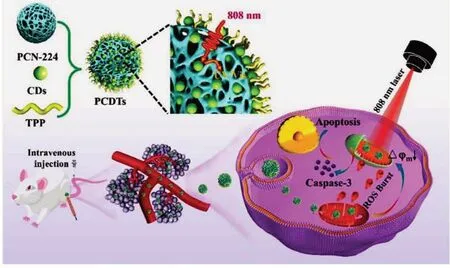
Fig.9 Schematic illustration of the structure of PCDTs and their application to 808 nm NIR light-activated and mitochondria-targeted PDT[78]

Fig.10 Synthesis,PA imaging and chemo/photothermal tumor therapy properties of MCH NPs[79]
3.4 光声成像诊疗平台
Chen等[79]利用MIL-100(Fe)制备了多功能MOF纳米复合物,用于光声成像引导的化疗/光热联合治疗.MIL-100(Fe)可以高效负载姜黄素作为化疗药物,并在表面包覆聚多巴胺(PDA),赋予其光声成像性质和光热转换性能,同时增强纳米复合物在体循环中的稳定性和生物相容性.最后在表面进一步与PDA反应修饰透明质酸(HA),以特异性靶向CD44过表达的肿瘤细胞.研究结果(图10)显示,该纳米复合物在肿瘤部位明显聚集,并实现了光声成像引导下的化疗/光热联合治疗,得到了良好的治疗效果.
本课题组[80]报道了一种乏氧响应的Cu-MOF/Ce6纳米复合物,用于精准递送药物至深层肿瘤进行光声成像引导的化学动力学/声动力学联合治疗.研究表明,尺寸可变的Cu-MOF/Ce6通过EPR效应在肿瘤中有效积累,在乏氧条件下降解后释放Cu2+和Ce6,然后渗透到肿瘤深层组织.内化的Cu2+和细胞内过表达的GSH之间发生氧化还原反应诱导GSH耗尽,并通过类芬顿反应触发Cu+介导的化学动力学治疗,而释放的Ce6在超声作用下进行声动力治疗,同时表现出光声成像的性质.
4 基于MOFs衍生物的癌症诊疗平台
MOFs作为一种规则有序的有机-无机多孔材料,通过高温热解可以部分保持孔道和长程结构,从而得到多孔的碳材料或者金属/金属氧化物与碳的复合材料,这种材料可以保持原有MOFs的多孔性,得到含单原子的仿生酶性质,并改变其光学声学等性质,从而拓展其在生物成像与治疗中的应用.此外,也可以利用MOFs作为模板,合成具有特定结构和功能的纳米材料,实现特定的生物成像与治疗功能.
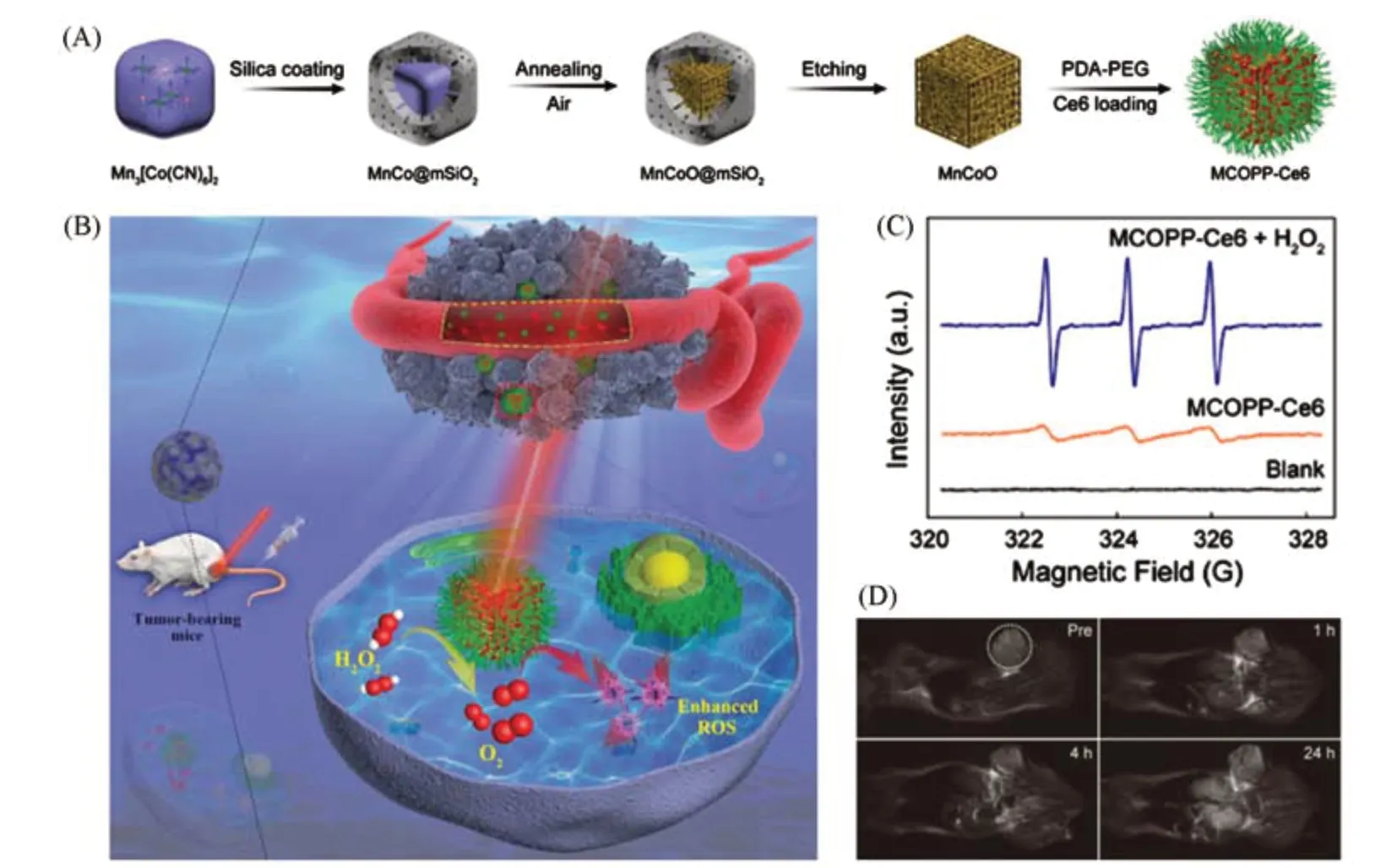
Fig.11 Synthesis,MRI imaging and PDT properties of MCOPP-Ce6[81]
4.1 磁共振成像诊疗平台
Zhao等[81]报道了一种MOF衍生的介孔纳米酶,具有模拟过氧化氢酶的活性,用于分解双氧水产生氧气,缓解肿瘤乏氧,增强光动力治疗活性.如图11(A)和(B)所示,通过在空气中一步煅烧硅包覆的Mn3[Co(CN)6]2MOF可以得到单分散的MnCoO纳米颗粒,进一步负载Ce6和表面PEG化修饰后得到最终的MOFs衍生纳米酶MCOPP-Ce6.由于MOFs固有的介孔特性,在煅烧过程中保持了良好的三维介孔纳米结构,表现出增强的光动力学治疗效果.该纳米酶在H2O2的存在下表现出良好的过氧化氢酶模拟活性,产生大量O2,在激光照射下O2的持续供给有利于MCOPP-Ce6产生更多的1O2[图11(C)],增强光动力治疗效果.由于Mn元素的存在,该纳米酶表现出较强的磁共振成像信号,r2值为56.4 mmol·L-1·s-1,可以示踪肿瘤内随时间变化的药物积累程度,从而更好地确定给药后光动力治疗的时间点以及药物的代谢情况[图11(D)].
Pan等[82]以ZIF-8为模板,合成了MOF衍生的双层中空硅酸锰纳米颗粒(DHMS),DHMS具有磁共振成像引导的声动力治疗功能.该研究以ZIF-8为模板,选择性部分刻蚀ZIF-8,在其表面包覆一层介孔二氧化硅形成蛋黄蛋白结构的ZIF-8@mSiO2,最后引入Mn2+刻蚀ZIF-8原位形成中空结构的硅酸锰纳米颗粒(DHMS).Mn2+赋予了该纳米材料磁共振成像的能力,中空结构增强了超声引起的ROS产生能力,最终实现了磁共振成像引导的增强声动力诊疗性质.
4.2 光声成像诊疗平台
Yang等[83]通过一步法合成了ZIF-8衍生碳纳米颗粒(ZCNs),以实现光声成像引导的癌症光疗,并研究了纳米颗粒尺寸对光疗和光声成像性质的影响(图12).由体内光声成像监测可知,ZCNs作为光热剂和光敏剂,在近红外激光照射下可以同时产生热量和活性氧,导致有效的肿瘤消融.此外,纳米颗粒尺寸的增加可以增强光疗效果和光声信号强度.

Fig.12 Synthesis,PA imaging and PDT/PTT tumor therapy properties of ZCNs[83]
5 总结与展望
本文从MOFs结构出发,介绍了将癌症诊疗药物负载到MOFs中的4种策略,包括(后修饰)金属节点、(后修饰)有机配体、MOFs复合物和MOFs衍生物,并总结了MOFs在磁共振成像、计算机断层扫描成像、正电子发射断层扫描成像、光学成像和光声成像等多种成像技术指导下作为多功能癌症诊断和治疗平台的最新进展和成果.将成像技术和治疗策略整合在一个系统中,开发基于MOFs成像引导的精确诊疗平台,实现对肿瘤的同时诊断和治疗.迄今,已经开发了许多优秀的MOFs平台以满足癌症治疗中日益增长的特殊需求.如前文所述,MOFs作为智能诊疗平台,主要依靠其易后修饰、孔隙和功能可调、结构可设计等独特性质,证明了MOFs在癌症治疗中的巨大应用潜力.
尽管在实验室研究中取得了显著的进展,但MOFs在癌症的诊断和治疗中仍然面临着严峻的挑战,这限制了其在临床的进一步应用.首先,MOFs的毒性和生物安全性是临床应用前需要研究的关键问题.由于MOFs种类的多样性,其毒性与其组成、尺寸、稳定性和物理化学性质密切相关.同时,还应考虑人体不同活体组织的耐受性.因此,有必要对各种MOFs的毒性进行综合评价.目前报道的许多关于MOFs毒性的优秀研究工作主要集中在急性毒性和短期毒性,而对长期毒性的研究较少,这需要大量长期的体内和组织积累研究.此外,通过Fe,Ca及Zr等具有高度生物相容性的金属离子为金属节点,内源性分子为有机配体构筑的MOFs可以有效降低其内在毒性.
其次,由于癌症的复杂性和多样性,有必要开发智能和多功能的MOFs诊疗系统,以实现癌症的精准治疗.重要的是,动物肿瘤模型与实际的人类肿瘤之间存在显著差异.许多MOFs诊疗平台在动物模型中表现出了出色的抗肿瘤能力,但对实际人类肿瘤的治疗效果仍需综合评价.此外,虽然目前报道的主动靶向配体可以部分提高肿瘤细胞对载体的内化能力,但开发只针对肿瘤细胞杀伤而对正常细胞无副作用的纳米药物仍是亟待解决的问题.幸运的是,MOFs表面的各种官能团,如—NH2,—COOH,—N3等可以保证靶点配体的成功修饰.
最后,由于MOFs是一种通过配位作用自组装形成的材料,因此不同批次间保证相同成分、形貌与尺寸的高质量制备是一大挑战.特别是一些整合多种成像和治疗功能于一体的复合材料,往往制备步骤多,过程繁琐,质控难度大.但是随着纳米合成技术的发展,纳米工艺技术的成熟,纳米MOFs的可控合成也会不断成熟和稳定.总之,虽然MOFs作为临床诊疗仍然面临着长期的挑战,但已经取得了显著的进展.由于MOFs具有可精确定制的独特性能,未来将会广泛应用于临床.

