基于Cy7类菁染料分子探针的设计策略
秦文婕,黄一倬,罗 潇,钱旭红,杨有军
(1.华东理工大学药学院,上海 200237;2.华东师范大学化学与分子工程学院,上海 200241)
菁染料家族有许多成员,包括菁染料(Cyanine dyes)、半菁染料(Hemicyanine dyes)、噁桑醇染料(Oxonol dyes)、部花菁染料(Merocyanine dyes)和方酸染料(Squaraine dyes)等.其中,吲哚七甲川菁染料(Cy7)是一类典型的菁染料,由于其优异的光物理性质而得到了广泛关注,并被用于生物医学影像与生物传感领域.随着成像技术的逐渐完善以及合成方法的成熟,大量基于Cy7的分子探针被开发出来.2016年,Peng等[1]总结了2010~2015年间报道的近红外荧光分子探针.2021年,Dai等[2]总结了具有应用于肿瘤诊断潜力的菁染料,2022年,Ren等[3]综述了关于发射波长在1000 nm以上用于成像的探针的研究,总结了最近几年菁染料在生物成像方面的进展.
本课题组[4]曾总结了荧光分子探针的通用型传感分子机制(图1).包括光诱导电子转移(PET)、荧光共振能量转移(FRET)、共轭骨架调节、推拉电子修饰以及外围电荷调节几类.
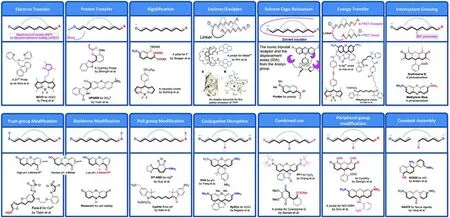
Fig.1 Classic molecular probe design strategies[4]
本文根据染料荧光调控分子机制,对基于吲哚七甲川花菁染料的分子探针进行了综合评述.
1 光诱导电子转移
光诱导电子转移(Photoinduced electron Transfer,PET)包含a-PET与d-PET两种类型(图2).在a-PET体系中,一个荧光染料与一个电子供体相连.该电子供体的HOMO轨道能级介于染料的HOMOLUMO能级间.染料受激发进入激发态,电子供体HOMO轨道的一个电子转移至染料单电子占据的原HOMO轨道,形成一个染料自由基阴离子和供体的自由基阳离子.这一过程导致染料荧光猝灭.在d-PET体系中,一个荧光染料与一个电子受体相连.该电子受体的LUMO轨道能级介于染料的HOMOLUMO能级间.染料进入激发态后,染料单电子占据的原LUMO轨道的电子转移至受体的LUMO空轨道,同样导致荧光猝灭.分析物可以通过与识别位点的相互作用阻断PET过程来诱导荧光恢复,即PET的“On-off”模式.相反,PET的“Off-on”模式通过荧光猝灭实现目标的检测[1].
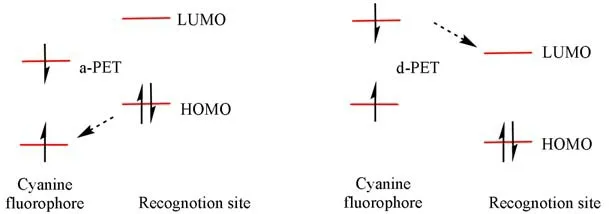
Fig.2 Schematic illustration of the a-PET and d-PET mechanism
1.1 PET类金属离子探针
金属螯合配体上常含多个氮、氧、硫等原子,可通过PET机制猝灭染料荧光.配体和金属离子配位后,PET效应受到抑制,染料荧光得到恢复.利用这一机制,可开发PET类金属离子探针.
1992年,Strekowski等[5]在Cy7共轭链骨架中心引入六元环(图3),不仅大大提高了Cy7的稳定性,也增加了可修饰位点.基于该结构骨架,1996年,他们合成出结构1和2[6],并在1998年报道了结构1在金属检测方面的应用[7].邻羟基羧基是Al3+和Be2+离子的选择性受体,在菁染料苯环上引入邻羟基羧基,以检测Al3+和Be2+.由于电荷从配体转移到金属离子上,干扰了荧光团的共振结构,导致1与高浓度Al3+和Be2+离子结合时发生荧光猝灭.之后通过在中间位置上修饰响应基团开发出各种金属离子的检测器,如Ozmen等[8]在2000年报道的第一个Cy7类钙离子选择性探针,通过引入特异性配体1,2-双(2-氨基苯氧基)-乙烷-N,N,N′,N′-四乙酸四钠盐(BAPTA)螯合钙离子,782 nm处的荧光强度可增加4倍;Tang等开发出了结构3~6分别用于检测锌离子[9]、汞离子[10]、亚铁离子[11]和铜离子[12],这些探针都可对细胞进行成像.随着成像技术的发展成熟,不少探针已应用于活体成像,如亚铜离子检测器9[13]和Qian等[14]开发的两个发射波长超650 nm的镉荧光探针10和11.
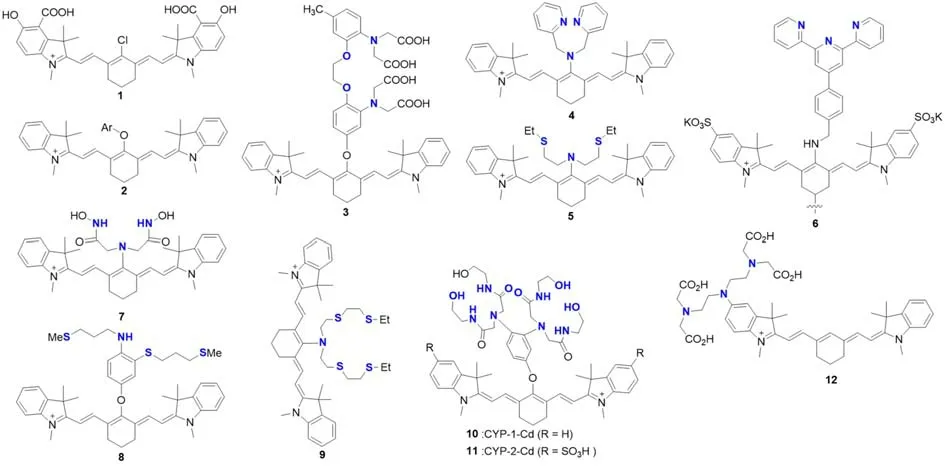
Fig.3 Molecular structures of metal ion fluorescent probes 1—12 based on PET mechanism
2009年,Achilefu等[15]报道了结构12,这是第一个放射性核素衰变与荧光团结合的分子系统,证明了放射性核素衰变可以改变有机染料的荧光性质.这种通过放射性核素的衰变来监测荧光增强的新方法有多种潜在的应用前景,如观测核素衰变速度.此外,将放射性核素衰变与荧光增强相结合,可以为放射性核光学多模态生物成像提供一种独特的互补信号机制.
1.2 PET类pH荧光探针
氮、氧原子的质子化可大幅降低其供电子能力,进而降低其作为PET电子供体的能力.因此利用含氮、氧原子基团的质子化和去质子化可实现PET效应的调控,从而开发pH探针(图4).2007年,Tang等[16]合成了探针结构13.该探针对pH=4.0~6.5范围内的H+变化有响应,同时也可在10.5~11.8的pH范围内对H+作出响应.首次实现了在不同的激发和发射波长下对不同pH范围内的H+进行双重测量.此外,它作为第一个用于细胞内酸性pH成像的近红外荧光探针,适用于研究内环境为酸性的细胞器,该探针也被成功用于活体成像.之后,该课题组[17]又开发了一种对pH敏感的探针14,可对6.70~7.90范围内的微小pH波动呈线性和快速响应.
2017年,Cai等[18]报道了一种具有光热效应的pH探针15,随着pH值的增加(4.4~8.0)(图4),探针吸收峰从637 nm转移到792 nm,并且吸收强度增加,但荧光强度减弱.该探针不仅在小鼠体内表现出高分辨率的光声成像效果,也表现出有效的肿瘤光热消融效果.2019年,Wu等[19]在花菁的中间碳上引入一个苯甲酰肼基团,得到pH敏感的近红外探针16,其在pH=7.0~9.0范围内荧光可增强10倍,该探针首次成功应用在监测转基因糖尿病小鼠模型中急性伤口向慢性伤口发展过程中pH的变化.
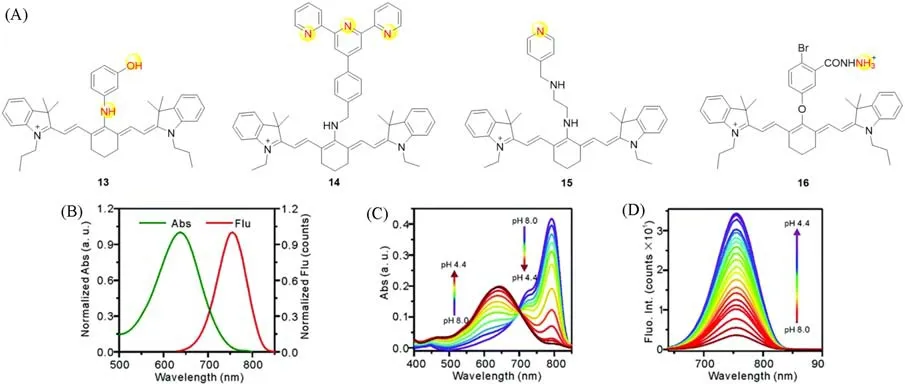
Fig.4 Moleculars structure of pH fluorescent probes 13—16 based on PET mechanism(A),UV-Vis spectra and fluorescence spectra(Flu)of probe 15 in PBS,pH=4.4(B),UV-Vis spectra of probe 15 at various pH values in 20 mmol/L PBS buffer(C),emission spectra of probe 15 under increasing pH levels upon excitation at 637 nm(pH=4.4—8.0)(D)[18]
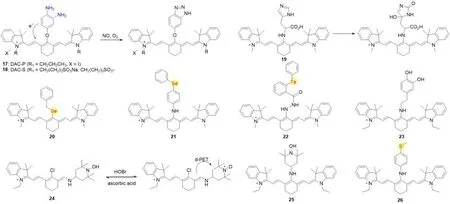
Fig.5 Molecular structures of ROS/N fluorescent probes 17—26 based on PET mechanism
1.3 PET类活性氧/氮荧光探针
多种对活性氧响应的原子或基团具有较高的电子云密度,可作为PET机制中的电子供体,如对一氧化氮响应的邻苯二胺,对活性氧响应的邻苯二酚、硫原子、硒原子等.与活性氧/氮(ROS/N)反应之后,这些基团变成吸电子基团,PET效应受阻,探针荧光恢复.
2005年,Nagano等[20]通过引入邻苯二胺作为一氧化氮(NO)响应基团得到了Turn-on型探针17和18(图5),实现了对小鼠肾脏的体外NO成像.2011年,Tang等[21]利用组氨酸(His)咪唑环的1,4-环加成反应,特异性清除1O2的性质,合成了探针19以检测1O2.探针可被1O2氧化,导致荧光恢复.该探针能对1O2快速响应且选择性高,成功应用于活细胞和组织中1O2的检测和成像.该课题组[22]还利用硒(Se)在体内参与氧化还原循环的性质设计了ONOO-响应的探针20,这是最早通过在Cy7骨架上引入硒原子以检测ONOO-的探针.该探针可以被ONOO-氧化,被抗坏血酸(ASCH2)还原,氧化还原循环至少可以重复8次,氧化后的探针在770 nm处的荧光强度降低了5倍.他们还在RAW264.7细胞中成功实现了细胞氧化还原周期的实时成像.类似的,Han等[23]也开发了一种含硒的检测ONOO-的探针21,该探针可被谷胱甘肽(GSH)还原,循环次数达5倍,荧光开启可增强23.3倍(图5),量子产率从0.05增加到0.12.之后该课题组[24]又将碲(Te)引入到荧光团22中,并将该探针成功应用于细胞和小鼠ONOO-/GSH氧化还原稳态变化的实时成像.该课题组在2012年还开发了检测过氧化氢(23)[25]和次溴酸(24,25)的探针[26].探针23与过氧化氢反应导致荧光强度降低,当加入GSH到含有氧化型探针的PBS缓冲液中时,在10 min内得到GSH偶联物,荧光恢复.该探针能够在这些不同类型的细胞系中检测细胞内过氧化氢和谷胱甘肽.探针24和25对次溴酸和抗坏血酸引起的氧化还原循环有响应,他们利用这一性质将探针成功应用于连续监测细胞内次溴酸水平的变化.2016年,Chen等[27]设计并开发了一种高选择性和高灵敏度检测次氯酸和髓过氧化物酶(MPO)的荧光探针26,其(甲基硫代)-苯胺基部分可被次氯酸氧化,使荧光开启.该探针可靶向线粒体,用于检测生物样品中次氯酸和MPO的活性.
1.4 PET类硫化物荧光探针
体内的硫醇化合物[如半胱氨酸(Cys)、同型半胱氨酸(Hcy)和GSH]在生理和病理过程中发挥着重要作用.利用其亲核性或还原性,可选择性切断探针分子的PET电子供体结构片段,用以开发特异性检测探针.如2012年,受Se—N键很容易被硫醇裂解的启发,Wang等[28]引入强吸电子的2-硝基苯基硒烷和3-(三氟甲基)苯基硒烷作为电子受体(图6),猝灭探针27和28的荧光,随着GSH的加入,荧光强度(λem=750 nm)显著增加.该探针在pH=4.0~8.6范围内对非蛋白硫醇和蛋白硫醇具有较高的反应性,可用于检测活细胞和组织中不同水平的硫醇.2013年,Tang等[29]开发了另外一种含Se—N的检测GSH的探针29,该探针的荧光可被过氧化氢恢复,这种循环至少可进行4次.该探针还成功地应用于监测斑马鱼幼苗伤口边缘过氧化氢的变化.之后Kim等[30]和Zhang等[31]分别报道了两种生物硫醇检测探针30和31,皆成功应用于细胞成像.
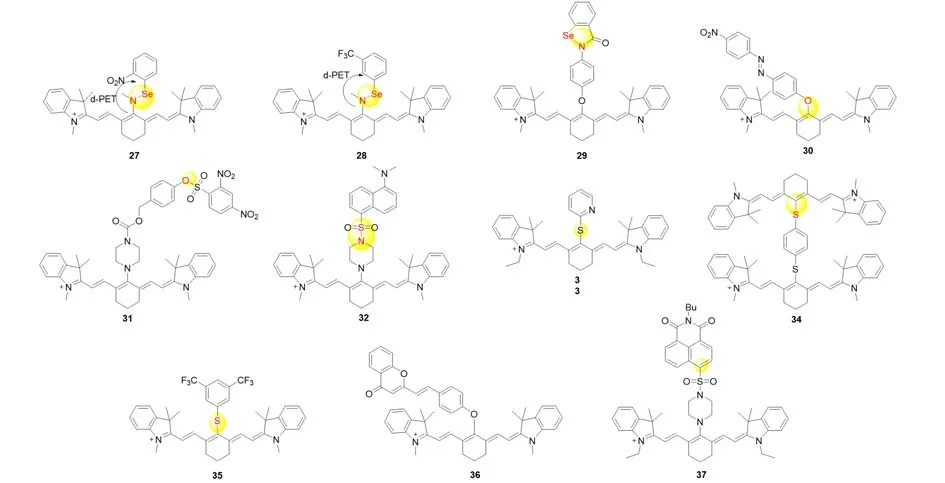
Fig.6 Molecular structures of fluorescent probes 27—37 for thiols based on PET mechanism
2015年,Yoon等[32]报道了一种选择性检测GSH的荧光探针32.该探针与Zhang等[31]采用了完全相同的设计策略.但由于哌嗪环的椅形构象和S—N键的距离与其它对硫醇缺乏选择性的探针不同,且GSH和其它硫醇之间也存在结构差异,该探针具有GSH选择性.又如2018年,Lee等[33]开发的探针33与GSH作用后在818 nm处发出强荧光,而Cys/Hcy只在807 nm处有弱荧光.同年,Yoon等[34]开发了两种新的基于花菁的荧光探针34和35.探针34含有两个菁基团,由对苯硫醚键连接.探针34相邻的两个花菁基团自猝灭,GSH诱导的硫醚键断裂可恢复探针34的荧光.探针35具有3,5-三氟甲基苯硫醇部分,该部分由于光诱导电子转移效应导致荧光猝灭,同样,GSH导致3,5-三氟甲基苯硫醇的硫醇断裂,并恢复荧光,对其它GSH无响应.
利用不同生物硫醇与荧光团反应活性的不同,不少研究选择合适的荧光团修饰在花菁骨架上,构建了双通道检测器,较单通道荧光探针更有利于消除自吸收的影响.2019年,Yuan等[35]设计并合成了一种双通道荧光探针36,该探针由两个荧光团组成,可以很好地检测细胞内源性GSH.同年,Yin等[36]引入萘酰亚胺到荧光团中,得到可用于谷胱甘肽体内成像的双通道探针37.与GSH反应后,形成亲核取代产物和硫解产物,并分别进行双光子成像和近红外成像.
2012年,Zhang等[37]受硫化钠可以还原硝基的启发,设计并合成了一种含有硝基的新型荧光探针38(图7),用于细胞内硫化氢检测.该探针在pH为4.2~8.2的范围内稳定.在755和809 nm处分别表现出最大的吸收和发射.探针38与硫化氢反应后荧光强度增加了12.7倍,量子产率从0.05增加到0.11.2017年,Li等[38]通过哌嗪单元将NBD组装到花菁骨架上开发了一种新型探针39.由于硝基取代的苯并呋咱(NBD)部分和花菁骨架之间有效的PET过程,该探针在796 nm处显示非常微弱的荧光,与H2S反应后,PET过程受阻,荧光强度增加87倍,探针对硫化氢的检测限为39.6 nmol/L.利用该探针还实现了在小鼠肝脏中的H2S成像.
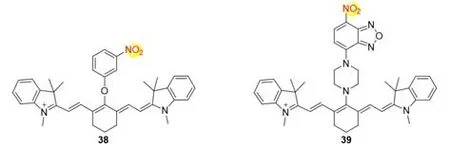
Fig.7 Molecular structures of H2S fluorescent probes 38 and 39
1.5 PET类硝基还原酶荧光探针
硝基咪唑具有很强的亲电性,可作为d-PET分子探针中的电子受体.肿瘤缺氧微环境导致硝基还原酶的活性提高,可实现硝基的选择性还原,从而抑制d-PET效应,恢复探针荧光.此类探针在检测肿瘤缺氧环境中受到广泛关注.2012年,Nagasawa等[39]报道了一种检测肿瘤缺氧环境的探针40,这是首个用于观察肿瘤缺氧状态的荧光探针(图8).为了提高探针40的选择性,在后续的报道中他们设计并合成了一种新的近红外(NIR)荧光探针41,并用于生物体内肿瘤缺氧环境成像[40].同样,Tang等[41]利用硝基咪唑的亲电性得到了探针42,并将其成功应用于研究肿瘤发展进程与细胞内缺氧水平之间的关系.另外,Li等[42]设计开发了一种含硝基苯的探针43,其硝基被还原后,电子重排可脱去酰胺部分,开启荧光.
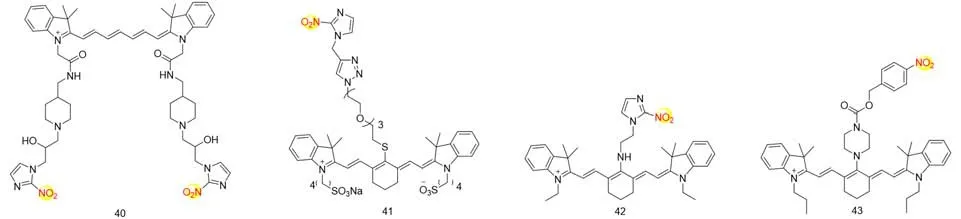
Fig.8 Molecular structures of nitroreductase fluorescent probes 40—43 based on PET mechanism
光诱导电子转移机制是一类经典的荧光探针分子设计机制,可被用于设计基于Cy7染料骨架的荧光增强或减弱型分子探针,常用的检测底物和识别基团的构效关系研究也已比较成熟.但由于基于PET机制的探针无法实现荧光的完全猝灭,使得探针本身总是带有一定的背景荧光,因此,探针的检测灵敏度还需进一步提高.同时,由于Cy7吸收波长在近红外区间,HOMO-LOMO能级差小,不易通过分子内电子转移猝灭荧光,设计开发新型的响应基团实现荧光猝灭也具有挑战性.
2 共轭骨架的破坏与恢复
根据关于PET过程的Weller方程,Cy7染料母核的HOMO-LUMO间隙很小,激发光引入近红外体系的能量太小,不易通过分子内电子转移猝灭荧光.因此,很难实现高效的PET猝灭荧光.为了进一步提高分子探针的检测灵敏度,开发了基于Cy7共轭骨架破坏和恢复的分子探针,可实现荧光的完全开启或关闭,极大提高了检测灵敏度.同时,共轭骨架的破坏与恢复必然伴随紫外-可见吸收的显著改变,可以同时实现肉眼检测.
2.1 中位内酯或内酰胺化
在Cy7染料的中位引入内酯或内酰胺基团,可实现染料共轭链的破坏,使得探针完全不发荧光(图9).受特定底物(如质子和金属离子等)激活,内酯或内酰胺开环,染料共轭骨架恢复,发出荧光.相较于传统的调节七甲川花菁荧光的PET机制[43],这一利用螺环可逆开关的策略可提高底物检测的灵敏度.

Fig.9 Schematic diagram of Cy7-based fluorescent probe via spiro-cyclization
2015年,He等[44]提出螺旋化来开启荧光,设计合成了两个Turn-on型荧光探针44和45,并用于活细胞的pH(图10)和活体动物的Hg2+成像.在该策略的启发下,2017年,Citterio等[45]合成了46和47两个探针分子,分别对Hg2+和Zn2+/Cd2+进行检测.

Fig.10 Molecular structures of several pH and metal ion probes 44—47 based on spiro-cyclization(A),pH-dependence of the fluorescence emission spectra of probe 44[10μmol/L,V(PBS)/V(DMF)=95∶5]upon excitation at 745 nm(B),representative fluorescence images of the mouse injected with probe 44 during LPS-mediated inflammatory response in vivo(C)[44]
2.2 给体-双受体菁染料
2011年,Shabat等[46]报告了一种基于给体-双受体(A-D-A)菁染料(QCy7)的新型探针设计平台(图11),将Cy7的染料共轭骨架中的一个单键和双键嵌入苯环,QCy7含有一个受保护的作为潜在供体的官能团和两个带正电荷的氮受体.在特定检测底物的激活下,保护基团离去,随后发生分子内电子转移,生成醌,同时,恢复Cy7的推拉电子共轭体系,从而发射荧光.巧妙实现了菁染料的增强型紫外-可见和荧光检测.唯一遗憾的是,产物的吸收波长相比Cy7类花菁染料有较明显的蓝移.

Fig.11 Schematic diagram of QCy7-type fluorescent probe
2.2.1 ROS 该类探针通过引入活性氧响应基团作为离去基团,在与底物作用后,分子内可以发生电荷重排,恢复D-π-A结构,使荧光开启.基于该策略,Shabat等[46]率先设计了H2O2活化的QCy7荧光探针48(图12),将H2O2触发基团苯基硼酸通过醚键连接到QCy7的磺化衍生物上.当触发裂解反应保护基团离去时,探针会形成一个去保护的酚类活性给体,通过一对π电子的分子内电荷转移,重建QCy7,形成了电子离域之间的推拉共轭体系,发射荧光.在H2O2存在下,探针48溶液逐渐恢复近红外荧光,该探针还具有对外源性和内源性H2O2的可视化能力.2016年,Tang等[47]通过构造五元环保护双羟基实现了pH和H2O2双响应的QCy7荧光探针49,实现了成像引导下的蛋白在肿瘤区域的传递.
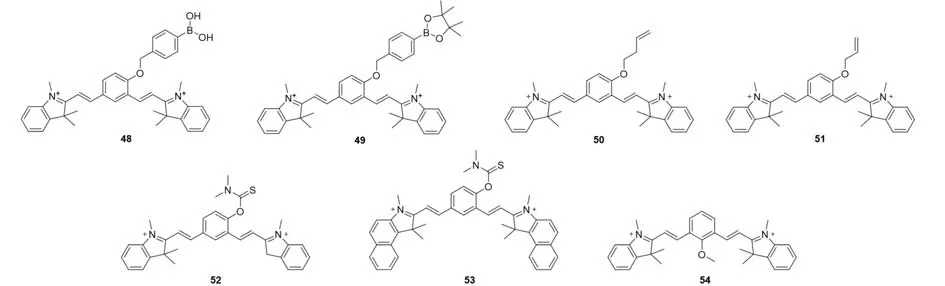
Fig.12 Molecular structures of ROS/N probes 48—54 based on QCy7
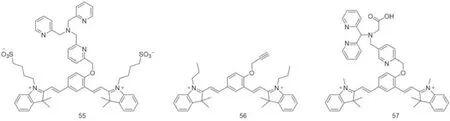
Fig.13 Molecular structures of metal ion probes 55—57 based on QCy7
之后,基于类似的思路,通过改变荧光团上对活性物质响应的触发位点,领域内开发了一系列探针用于检测不同种类的活性氧.如Tang等[48]在骨架上引入可以选择性识别臭氧(O3)的基团(3-丁烯基),开发了探针50,首次实现了抑郁小鼠大脑中臭氧的成像.Zhang等[49]引入烯丙基醚作为触发位点,开发了检测一氧化碳(CO)的比例型荧光探针51.Wang等[50]开发的亲水性荧光探针52和53,其荧光可被次氯酸(HClO)开启,是快速、敏感地检测内源性和外源性HClO的潜在工具.他们选择保护基团N,N-二甲基硫代氨基甲酸酯(DMTC)作为响应基团,通过降低π-电子共轭来猝灭荧光.在次氯酸的存在下,DMTC裂解离去,释放染料并恢复荧光信号.2018年,Ma等[51]报道了首个敏感型的羟基自由基探针54,当探针与羟基自由基反应时,在653 nm处的荧光增强倍数约为122倍,被成功应用于监测铁自氧化过程中微量羟基自由基的产生.
2.2.2 金属离子 2015年,Govindaraju等[52]报道了一种亚铜离子探针55,选择三(4-吡啶基)胺作为亚铜离子响应基团(图13),在探针与亚铜离子络合后,探针55荧光开启.该探针被成功用于生物液体中的Cu+池的近红外荧光检测和体内成像应用.2019年,Hu等[53]合成了一种近红外的Pd2+探针56,该探针在Pd2+的存在下表现出明显的荧光增强,检测限低至0.52μmol/L.该探针荧光强度的变化可能是因为Pd2+诱导的丙炔醚键裂解,使探针56在光照射下,转化为相应的酮结构,发射出荧光.该探针可用于含钯催化剂Pd2+的成像.2019年,Tang等[54]报道了一种新的近红外荧光探针57,Fe2+将与探针57中的N4O配体结合,并在O2存在下导致C—O键断裂,从而恢复QCy7共轭结构发出荧光.它可以对在药物诱导的肝损伤中的Fe2+进行成像.
2.2.3 硫化物 2013年,Govindaraju等[55]开发了一种水溶性的检测氧化型谷胱甘肽(GSSG)和GSH氧化还原过程的探针58(图14),其发射波长为700 nm.该分子探针很容易与硫醇,特别是GSH发生反应,对pH稳定.可用于监测谷胱甘肽还原酶的活性,并作为评估氧化应激水平的工具.2019年,Chen等[56]设计并合成了两种近红外荧光探针59和60,用于实时成像和评估线粒体GSH在活细胞和体内的保护作用.探针59与GSH反应后在728 nm处表现出荧光“开启”,被成功应用于小鼠GSH成像.

Fig.14 Molecular structures of thiols probes 58—63 based on QCy7
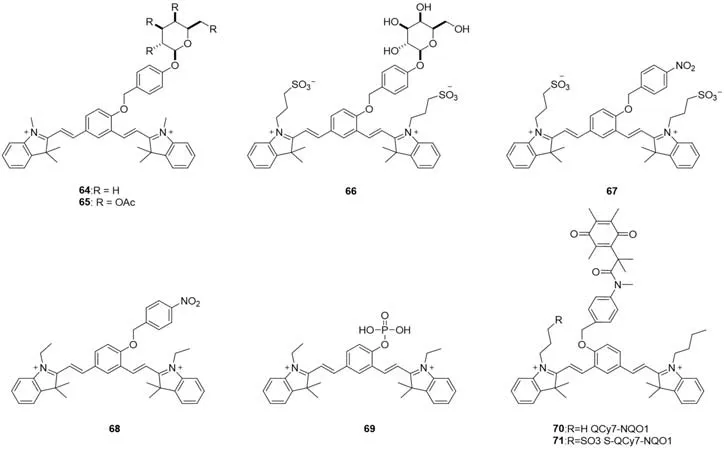
Fig.15 Molecular structures of thiols probes 64—71 based on QCy7
2019年,Zhao等[57]开发了用于检测硫化氢的荧光探针61和62.水溶性荧光探针61在没有有机溶剂或表面活性剂的帮助下与硫化氢反应,荧光增强了115倍,检测限为11 nmol/L.细胞成像实验表明,探针61具有细胞渗透性,能够敏感地检测溶酶体中的硫化氢.2020年,Yuan等[58]设计合成了探针63并用于检测H2S.随着H2S含量的增加,以394 nm为中心的最大吸收峰逐渐减小,在480和610 nm处的吸收峰逐渐增加.结果表明,该探针的荧光强度在715 nm处显著提高了25倍,其量子产率为0.107.这两个探针均成功应用于小鼠体内硫化氢的检测.
2.2.4 酶 2013年,Tung等[59]报道了一种荧光探针64(图15),用于检测溶液中的β-Gal酶活性,在680 nm处有110倍的荧光开启;将其乙酰化后得到探针65,可对细胞进行成像.与溶液中检测酶活性不同,由于生物硫醇的作用,酶水解得到的产物不同,QCy7的核心结构被破坏,在560 nm(λex=530 nm)左右发射荧光.同年,Lepenies等[60]报道了类似结构的探针66并用于检测细菌.
2013年,Zhang等[61]设计并合成了一种检测硝基还原酶(NTR)活性的探针67.在与NTR反应后,硝基苄基部分的硝基被还原为氨基,在708 nm处荧光开启.该氧化还原诱导的NIR荧光探针已成功应用于生理条件下高选择性的NTR活性检测.2016年,Hecht等[62]开发了类似的线粒体靶向的NTR探针68,并成功用于细胞成像.
2018年,Chen等[63]合成了一种由荧光团QCy7和碱性磷酸酶(ALP)识别基团磷酸单酯组成的荧光探针69.探针69主要分布在线粒体,可用于量化ALP在8种不同细胞系中的表达水平.由于其较高的成像分辨率和深层组织穿透能力,可以区分肿瘤小鼠和正常裸鼠体内ALP的表达水平,具有应用于研究ALP在疾病诊断中的功能的潜力.
2022年,Su等[64]报道了两个选择性检测和可视化NAD(P)H醌脱氢酶(NQO)的探针70和71.通过引入两个亲水磺酸基,荧光强度得到显著提高.探针71已被应用于活细胞内源性NQO的高对比度成像,并进一步用于体内无创成像.
2.2.5 其它 2016年,Devaraj等[65]还开发了一种苯基乙烯基醚的QCy7探针72,用于RNA分析(图16).经四嗪驱动的生物正交反应脱保护后,观察到的荧光比探针72增加了70倍.受益于两个反应基团之间的空间邻近性,生物分子(如mRNA)可以有效地加速微摩尔水平的反应.通过制备探针72和四嗪-磺酸基-活性酯(NHS)偶联物,可用于在体外和CHO细胞中检测目标RNA.2021年,Feng等[66]报道了一种近红外荧光探针73,它可以有效地检测活细胞和小鼠体内的CORM-3(CO供体).与CORM-3反应后,在600 nm处荧光信号降低,743 nm处产生的荧光信号增加,可对CORM-3进行比率检测.
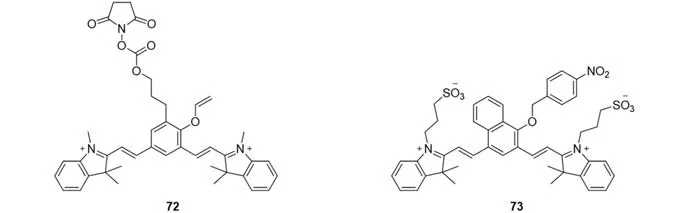
Fig.16 Molecular structures of RNA or CO probes 72 and 73 based on QCy7
2.3 氧化破坏/恢复共轭链
2.3.1 氧化恢复共轭链 利用Cy7染料骨架的氧化恢复,可以实现无背景Turn-on型荧光探针的开发,目前,基于此类巧妙设计机制的探针还很有限.2008年,Tang等[67]开发了一种用于观察活细胞中的脂质氢过氧化物(ROOH)的选择性探针74(图17),氧化磷原子引起碳磷键断裂,同时恢复Cy7染料骨架.该探针的最大吸收和最大荧光发射波长分别为747和770 nm,在pH=7.4~7.8范围内稳定.探针与过氧亚油酸甲酯(MeLOOH)反应后,荧光量子产率由0.058增加到0.64,荧光强度与MeLOOH的浓度成正比,可用于ROOH的定量检测.
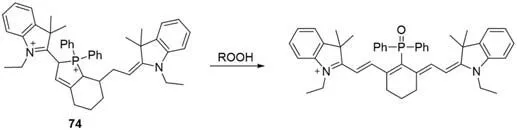
Fig.17 Molecular structure of ROOH probe 74
2.3.2 氧化破坏共轭链 强氧化性物质(如HClO和过氧亚硝酸根等)可以氧化花菁共轭链的双键生成环氧化物,或进一步发生碳碳键断裂生成烯醛结构,破坏Cy7的推拉电子体系从而猝灭荧光(图18).基于这一氧化破坏共轭链机制,研究者开发了不少活性氧荧光探针.
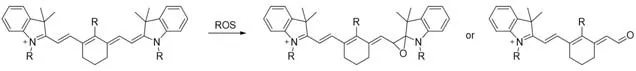
Fig.18 Detection mechanism of Cy7 conjugation disruption by ROS
2013年,Han等[68]开发的HOCl比率型(I566/I780)探针75~79,分别在600~800 nm之间有最大吸收峰,与HOCl作用后,在560 nm处出现新的吸收峰.探针75具有大的Stokes位移,它被成功地应用于活细胞的次氯酸成像.之后Wang等[69,70]陆续报道了两种检测HOCl的探针80和81并成功用于细胞成像(图19).

Fig.19 Molecular structures of hypochlorous acid fluorescent probes 75—81
2018年,Dong等[71]设计并合成了一系列基于Cy7的荧光比率探针来检测肺中的次氯酸(图20).他们发现脂质链和氨基都是探针实现肺靶向作用的重要部分,具有长疏水性脂链和亲水性氨基的探针82在小鼠肺中有较高的积累,探针85在脾脏中的摄取量高于其它器官,具有短脂链的探针87在肝脏中分布较高,与吲哚菁绿(ICG)相似.因此,选择了探针82进行活体实验,并证明了探针82能够在小鼠肺中捕获脂多糖(LPS)诱导的次氯酸.这些发现可用于设计新的无创检测HClO探针.
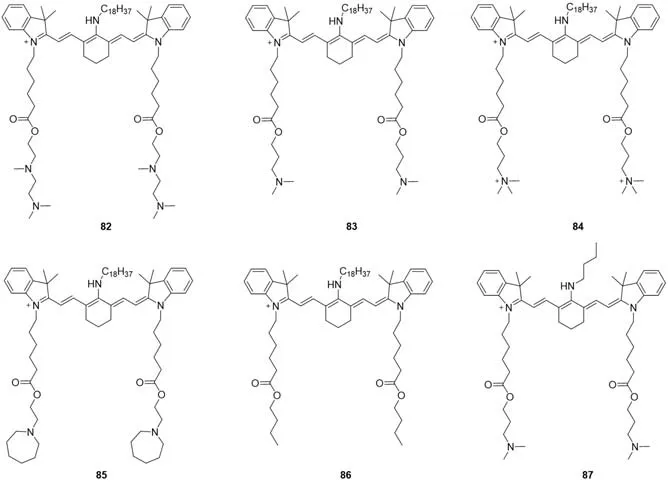
Fig.20 Molecular structures of hypochlorous acid fluorescent probes 82—87
2019年,Li等[72]开发了可用于水介质次氯酸盐(测试体系pH=4)的选择性检测器探针88(图21).其可与次氯酸根通过氧化裂解反应破坏共轭链.2020年,Yi等[73]开发了一种检测HClO的双光子吸收,三通道(560/650/780 nm)比率型探针89.尼罗红部分对HClO不敏感,可作为内标.当HClO/ClO-浓度小于20μmol/L时,3个荧光峰(560/650/780 nm)均呈下降趋势,特别是在780 nm处的荧光几乎完全猝灭.进一步增加HClO/ClO-浓度,在560 nm处的发射迅速下降,但在650 nm处同时观察到约10倍的荧光增强.因此,利用探针89的两个不同荧光峰(I560/I650和I650/I780)之间荧光强度的比值变化来实现HClO/ClO-浓度的准确定量(图21).探针89首次实现了在活体动物中对HClO/ClO-浓度进行比率检测.
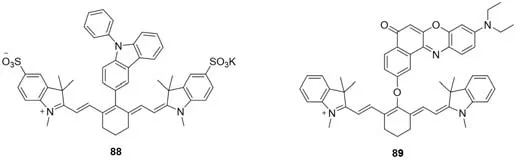
Fig.21 Molecular structures of hypochlorous acid fluorescent probes 88 and 89
2021年,Xing等[74]设计了一种独特的双波长近红外探针90(图22),用于同时监测活性氧和活性氮的体内外变化,并成功应用于监测活细胞和活小鼠细菌感染过程中氧化和亚硝化应激过程.其检测机制为探针的Cy5部分被超氧阴离子自由基或羟基自由基氧化恢复菁染料推拉电子体系,在660 nm处开启荧光.而过氧亚硝酸盐或次氯酸盐(ONOO-,ClO-)诱导的Cy7结构被氧化降解导致800 nm处的荧光降低.可通过不同波长处荧光变化来分析细菌感染过程中自由基种类的变化.
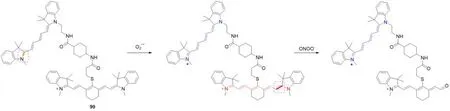
Fig.22 Molecular structure and sensing mechanism of ROS probe 90
基于Cy7共轭骨架破坏和恢复的分子探针设计策略,可以实现荧光的完全开启或关闭.通过消除探针本身的背景干扰,可以明显提高探针的检测灵敏度,在生物应用中表现出较大的优势.在这一策略中被广泛使用的方法主要是基于QCy7的骨架恢复和基于ROS的骨架破坏,而其它方法的检测底物还较少,有望通过分子机制的创新进行进一步拓展.
3 连接在染料共轭链上外围基团吸电子和供电子能力的调控
1992年,Patonay等[75]开发了在共轭链引入一个刚性氯环己烯环的七甲基菁染料,可增加光稳定性,提高荧光量子产率,这种结构也为染料在中心环上的化学取代提供了一个反应位点.近年来,通过中心位置的亲核取代反应获得了许多作为生物传感器和荧光探针的七甲基菁染料.2005年,Peng等[76]发现一种新的花菁类染料91(图23),在七甲基花菁骨架中间位置引入氨基烷基,由于分子内电荷转移效应,染料具有更大的斯托克斯位移和更强的荧光,更适合用作荧光探针.2006年,该团队[77]报道的3H-吲哚的N取代对染料的光稳定性有很大的影响,在3H-吲哚环N原子上引入苄基可获得更高的光稳定性;引入给电子基团比吸电子基团有利于获得更大的光漂白抗性探针92~95.
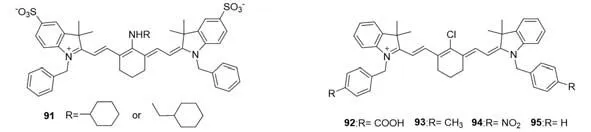
Fig.23 Molecular structures of modified Cy7 skeletons 91—95
在此结构基础上,设计出一系列花菁类染料,通过改变花菁染料骨架中间位置的取代基团,来改变发射波长,用于传感.在近红外染料中,胺取代的Cy7通过修饰具有明确受体的氨基,导致分子内部电荷转移,被证明是设计近红外探针的理想选择,这种类型花菁的光物理性质高度依赖于骨架中位共轭外围基团的电子密度.
3.1 金属离子
2002年,Patonay等[78]选择冠醚为锂离子(Li+)响应基团得到传感器96(JCM-15C5)(图24).探针在乙腈中的发射波长为799 nm.在乙腈溶液中溶剂化的Li+与冠醚腔体相适配,供电子能力降低,发生荧光猝灭.JCM-15C5可用于痕量金属的测定.2006年,Nagano等[79]报道了首例锌离子(Zn2+)比例型探针97(DIPCY),胺取代的Cy7作为近红外荧光团,二-(2-吡啶甲基)胺(DPEN)部分作为金属螯合剂.与金属离子配位后,DPEN基团的电子密度降低,降低了胺在荧光团中的给电子能力.随着Zn2+浓度的升高,DIPCY在非离子两性(HEPES)缓冲液中的吸收峰红移44 nm(627~671 nm),并在760 nm处荧光增强,但过量的Co2+和Cu2+对Zn2+的检测有一定的干扰.利用相似的机理,2008年,Liu等[80]在花菁骨架上引入Hg2+螯合剂二硫二氧单杂大环得到Hg2+比率型探针98,其在777 nm处的荧光可被Hg2+猝灭.
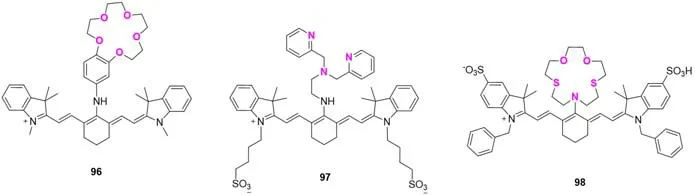
Fig.24 Molecular structures of probes 97 and 98 for metal ions detection
除Hg2+外,甲基汞离子(MeHg+)也因其高毒性而成为备受关注的检测对象.Guo等[81]合成了3个Hg2+和MeHg+的比值传感器,分别为探针99~101(图25).这些传感器对Hg2+和MeHg+均显示出双激发(A810nm/A670nm)和双发射(F830nm/F780nm)的比例响应.这种变化是由Hg2+和MeHg+促进环化过程引起的.取代基(仲胺、咪唑啉、叔胺)的给电子能力下降,大大降低了分子内电荷转移过程的效率,吸收光谱和发射光谱出现了较大的红移.2013年,Li等[82]将硫脲亚基与Cy7结合得到探针102,在MeHg+的作用下,探针分子发生环化反应,吸收光谱发生红移.
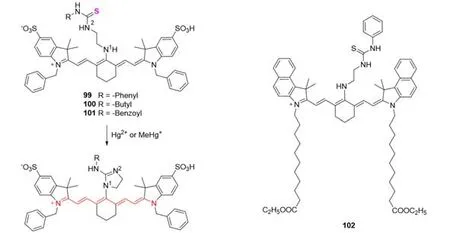
Fig.25 Molecular structure of probes 99—102 for detecting metal ions
3.2 硫化物
在Cy7骨架中间位置共价连接硫化物响应基团,硫化物与响应基团反应后,花菁染料中位的N/O共价连接的荧光调节剂通过分子内或分子间亲核反应离去,从而改变外围基团的供电子能力,来改变发射波长,实现活细胞或体内成像.
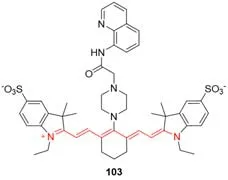
Fig.26 Molecular structure of sulfide cation fluorescent probe 103
2011年,Cao等[83]基于过渡金属置换策略构建了首个硫化物阴离子近红外荧光传感器103(图26).传感系统由菁染料、哌嗪连接剂、8-氨基喹啉配体和Cu2+组成.铜离子可以使游离的探针在pH=7.0的HEPES缓冲液/乙醇溶液(25 mmol/L,体积比=6∶4)中吸收光谱发生明显红移(78 nm),同时近红外染料探针103的荧光几乎可以被Cu2+完全猝灭,在Cu2+与硫化物阴离子形成稳定的配合物后,染料探针103被释放,794 nm处荧光开启,观察到高达27倍的荧光增强.该传感器在乙醇水溶液中具有大的近红外荧光开启信号、高灵敏度和高选择性.过渡金属基置换策略为目标阴离子检测探针的开发开辟了一条新的途径.
2016年,Chen等[84]开发了Cy7骨架和氨基甲酸酯连接链的Cy-Dise探针104(图27).由于半胱氨酸氢过硫化物Cys-SSH具有低pKa特性,在中性pH条件下能够形成亲核阴离子,进攻Cy-Dise的Se—Se键,导致氮的脱保护和发射波长的蓝移(797~749 nm).Cy-Dise中半乳糖基团的存在使其能够靶向肝脏,用于BALB/c小鼠的深部组织比率成像.对Spraque-Dawley(SD)大鼠(Walker-256肿瘤的正常和异种移植物模型)的检查进一步表明了探针在肝脏中检测Cys-SSH的潜在应用.
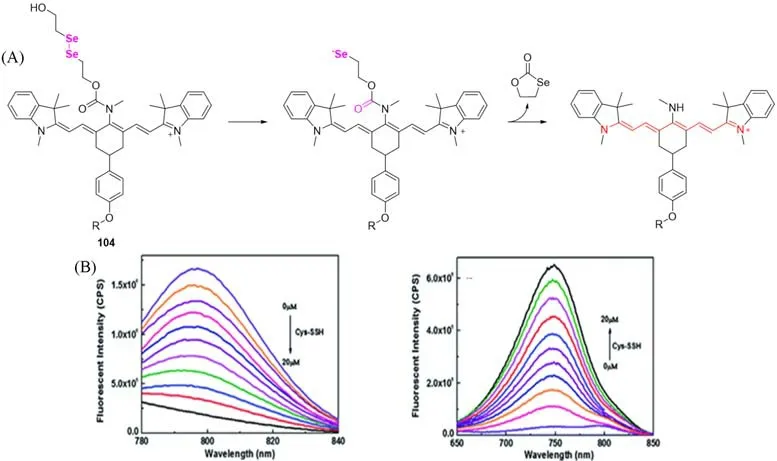
Fig.27 Sensing mechanism of probe 104 for Cys-SSH(A),dose dependent fluorescent emission spectra of probe 104 response to Gys-SSH(left:λex=730 nm;right:λex=614 nm)(B)[84]
他们基于这个思路,开发了一系列检测硫化物的分子探针,实现了在体硫化物成像(图28).之后基于类似的思路,通过改变荧光调节剂,开发了探针105~107,利用2,4-二硝基苯磺酰(DNBS)[85]、叠氮基[86]、三氟甲磺酰胺[87]修饰花菁骨架中间位置,实现了超氧阴离子和多硫化氢的成像.

Fig.28 Molecular structure of sulfide fluorescent probes 105—107
除硫化物外,其它小分子(如神经毒剂)的检测也可以利用该机制.Hu等[88]报告了一种用于检测神经毒剂的探针108(图29).加入神经毒剂模拟模型二乙氧基氯磷酸盐(DCP)后,吸收峰红移(615~784 nm),溶液颜色由蓝色变为绿色.Chen等[89]利用类似的传感机制开发了一种单胺氧化酶成像探针109.该探针具有氨丙基氨基甲酸酯连接物,可以选择性地检测单胺氧化酶,导致750/803 nm荧光比值变化.该探针可用于评估MAO-B在小鼠衰老模型中对氧化应激的贡献.2018年,该团队[89]开发了一种花青素探针Mito-Cy-Sec(110),利用丙烯酰胺部分对硒半胱氨酸进行成像.Zhou等[90]报道了一种基于控制荧光开关机制的磷酸盐离子近红外化学传感器111.
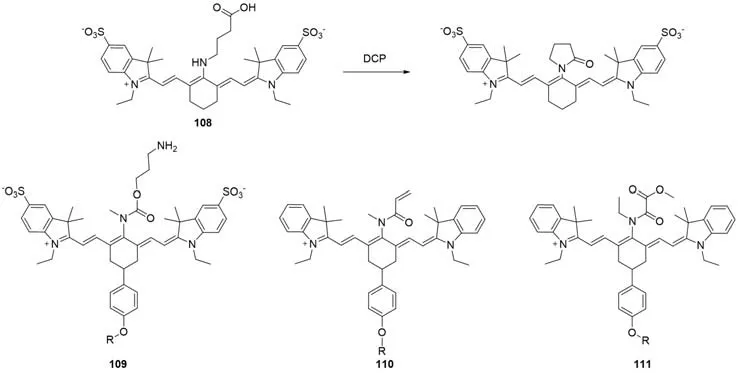
Fig.29 Molecular structures of small biomolecule detection probes 108—111
3.3 ROS
根据上述机制也可以开发用于活性氧检测的探针.2013年,Jiang等[91]基于氨基甲酸酯化学特异性裂解构建近红外比例荧光探针CyNB(112)用于H2O2的检测(图30).一个吸电子的氨基甲酸酯基团修饰Cy7的胺取代基,可以有效地降低胺的电子密度,用特定的分析物触发氨基甲酸酯基团裂解过程,释放CyNB的近红外染料,从而获得显著的比率荧光信号.
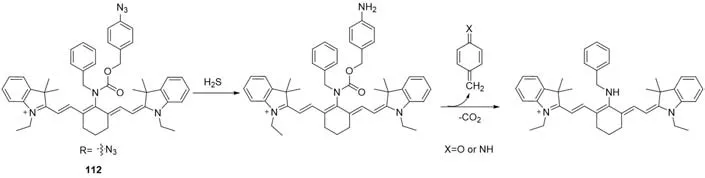
Fig.30 Detection mechanism of probe 112 for H2O2
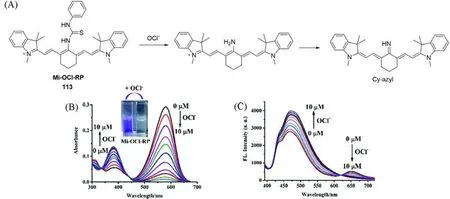
Fig.31 Sensing mechanism of probe 113 for hypochlorous acid(A),UV-Vis absorption spectra(B)and fluorescence emission spectra(C)of probe 113 response to HOCl[92]
线粒体是次氯酸盐(OCl-)产生的主要部位.OCl-水平异常会引起氧化还原失衡和线粒体功能的丧失.Lin等[92]以菁染料作为荧光发射器,异硫氰酸苯酯基团的硫原子作为OCl-的特定识别基团,设计了Mi-OCl-RP探针(113)(图31).异硫氰酸苯酯基团会被OCl-氧化释放一个仲胺的花菁碱单元,经过仲胺互变异构形成Cy-azyl.在pH=7.4的PBS缓冲溶液中Mi-OCl-RP与OCl-反应后,在580 nm处的吸收峰减少,一个以380 nm为中心的新吸收峰显著增加,在440 nm处有一个等吸光点.Mi-OCl-RP在471 nm处的荧光强度增加,在651 nm处的发射光谱减少,溶液的颜色由紫蓝色变为浅黄色.这些结果表明可以利用比值法(I471/I651)检测OCl-,发光强度比(I471/I651)与OCl-浓度在0~10μmol/L范围内呈线性相关,检出限为0.35μmol/L.
3.4 pH值
通过调节吲哚基上氮原子的电荷来改变花菁骨架分子间的电荷转移是控制花菁类探针荧光的一种有效策略.利用探针对质子变化的特殊光物理化学响应可设计对pH敏感的花菁类探针.发射特性在很大程度上是由芳香环上两个氮原子之间的共振效应决定的,因此,吲哚氮原子的质子化会产生强荧光.另一方面,如此得到的酸化花菁的去质子化会导致荧光猝灭.
2019年,Chen等[93]设计了一种pH敏感型探针114(图32).在酸性环境下,吲哚氮原子的质子化会增强电荷转移过程,吸收光谱发生红移,并产生强烈的荧光发射.在此基础上,将探针114与另一种染料(以萘酰亚胺为例)结合,得到的探针114用于细胞成像.以乙醇作为溶剂,在碱性介质中,只有535 nm处有一个吸收峰.随着pH的降低,535 nm处的吸收峰逐渐下降,出现一个新的吸收峰,并在795 nm处逐渐增强.在640 nm处存在一个明显的等吸光点.同时,随着酸度的增加,溶液的颜色由粉红色变为紫色,并进一步变为绿色,这验证了其作为“肉眼”pH值指示剂的潜在应用价值.
Nagano等[94]构建pH传感器的策略是通过二胺取代基的质子化/去质子化来控制胺基团的给电子能力.探针115的pKa值为6.8,细胞成像结果证明了通过荧光比率方法传感器监测细胞内pH值变化的可能性.Zhang等[95]开发了一系列酸性pH敏感的荧光探针(116~119)并用于溶酶体追踪(图33).通过在NIR-II染料骨架(Flav32和BTC33)的C7/C6位置引入溶酶体靶向哌嗪,创建了一系列染料,适合于溶酶体的酸性环境(pH=5.0~6.0)的传感.由于哌嗪基团的质子化,在较低的pH值下,这些染料的荧光增强.

Fig.32 Molecular structure of pH probe 114

Fig.33 Molecular structures of pH probes 115—119

Fig.34 Sensing mechanism of pH probes 120a—120f
2017年,Ohe等[96]开发了具有亲核基团(氨基、羟基和巯基)的ICG衍生物120a~120e(图34),作为pH响应探针.这些染料分别在pH=7~9,pH=5~7和pH=3~6范围内,在荧光开环结构和非荧光闭合结构之间表现出pH依赖的平衡.染料120d和120e适用于活性细胞的高灵敏度分析,还可用于肿瘤组织酸性部位的高对比度光学成像.
3.5 中位供电子基团(氧/氮原子)电子密度的调节
通过调节花菁染料中位氧原子或者氮原子的电子密度可实现Cy7荧光发射波长的调控,利用这种方法可设计比率型探针.这类探针具有斯托克斯位移大、检测灵敏度高的特点(图35).
Fig.35 General probe design principle via electron density modification of the central O or N atom
3.5.1 金属离子 2012年,Yoon等[97]设计制备了高灵敏度和高选择性的比例型Zn2+荧光传感器121(CTMPA)(图36),探针121与Zn2+可以形成摩尔比1∶1的配合物,选择560 nm作为激发波长,测量荧光强度比(I590nm/I730nm)对Zn2+进行定量检测.他们将其成功用于监测活细胞和生物体中的内源性锌离子,该探针是首个成功应用于检测斑马鱼神经瘤的荧光探针.2014年,Zhu等[98]开发了一种基于Tsuji-Trost allylic反应的钯高选择性传感器122.利用荧光比值(I655nm/I825nm)变化对水样品和活细胞中的钯进行定量检测,检测限低至0.3μg/L.

Fig.36 Molecular structures of metal ion probes 121 and 122
3.5.2 pH值 1993年,Strekowski等[99]报道了首个通过调节中位氧来改变荧光发射波长的pH探针123(图37),该探针在水溶液中不稳定.在甲醇溶液中,pH<3时,染料的最大吸收波长红移(531~709 nm),在甲醇-水溶液(体积比=1∶1)中测得pKa=6.91,该染料适合作为有机溶剂介质中的pH探针.为了解决这些染料在水溶液中不稳定的问题,通过在探针中引入磺酸根以及羧基得到了3个水溶性pH探针124~126[100].在甲醇中,648 nm处有最大吸收,pH=3时,出现以932 nm为中心、新的更强的吸收.
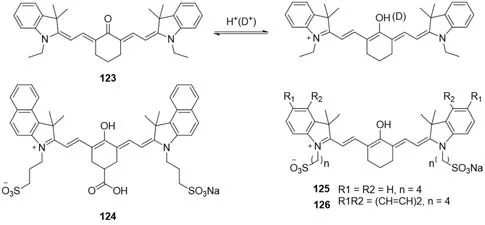
Fig.37 Molecular structures of pH probes 123—126
2016年,Tan等[101]开发了一种能监测线粒体自噬、区分自噬溶酶体和其它溶酶体的对pH有响应的HQO探针(127)(图38),它可以通过表现出不同的荧光特性来同时探测活细胞中的线粒体和自噬溶酶体.HQO选择性地在线粒体中积累,但当功能失调的线粒体进化为自噬溶酶体时,HQO随pH的降低而转化为质子化的HQOH+形式.由于HQO和HQOH+在低极性环境中分别在530/650 nm和710/750 nm处表现出不同的吸收和发射,发现探针在胶束中特别适合用于监测线粒体自噬.该探针在pH=0~2.0范围内可再次被质子化,受此启发,2018年,Zhang等[102]开发了一系列探针128和129,这类探针可在极碱和极酸条件下工作.其中也利用表面活性剂进行了pH调剂.
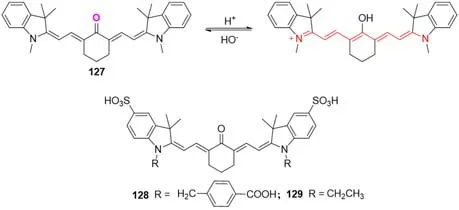
Fig.38 Molecular structures of pH probes 127—129
2022年,Yin等[103]构建了一种肿瘤酸性微环境激活的纳米探针Cy-TPA NPs(130)(图39),该纳米探针可以通过增强通透性和保留(EPR)效应在肿瘤部位积累,并被肿瘤酸性环境激活.在弱酸性环境下,Cy-TPA恢复到长共轭形式,在725 nm处表现出一个较强的吸收峰,其荧光和光热治疗能力被“开启”可用于特异性近红外荧光(NIRF)成像引导的光热治疗(PTT).

Fig.39 Molecular structure of pH probe 130(A)and fluorescence imaging of 4T1 tumour-bearing mice after i.v.injection of Cy-TPA NPs at different time intervals(B)[103]
3.5.3 硫化物 2012年,Yoon等[104]报道了一种选择性检测半胱氨酸(Cys)的比率型探针CyAC(131)(图40).这是首个通过调节π共轭链长短的比率型Cys探针.在CyAC溶液中加入Cys后,CyAC的光谱可以发生显著的变化(吸收光谱从770 nm变化到515 nm,发射光谱从780 nm变化到570 nm).类似的,Chen等[105]将对硝基苯甲酸酯引入到花菁骨架上得到探针132,利用F640/F785对Cys进行检测并将该探针成功用于小鼠体内Cys成像.
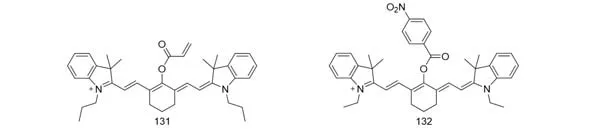
Fig.40 Molecular structures of Cys fluorescent probes 131 and 132

Fig.41 Continuous detection of superoxide radical anion and H2S n by probe 133
2015年,Chen等[106]开发了一种多响应近红外荧光探针133(图41),用于超氧阴离子(O·2-)和多硫化物(H2Sn)检测,探针133对O·2-和H2Sn依次响应.具体过程为Cy7的氮被O·2-氧化恢复染料共轭结构,在794 nm处产生弱荧光;而2-氟-5-硝基苯甲酸部分作为荧光调节剂,该基团中存在的双亲电中心可用于捕获H2Sn,在H2Sn的作用下,探针133发生亲核取代反应,随后发生分子内的亲核反应脱去荧光调节剂,释放出Hcy-Mito,并在625 nm处产生强烈荧光.该多响应探针可以作为一种直接的化学工具用于检测细胞和小鼠的O和H2Sn.
2016年,Chen等[107]报道了两个连续检测超氧阴离子自由基和H2Sn的探针Hcy-Mito和Hcy-Biot(134和135)(图42),分别用于检测细胞和体内的超氧阴离子自由基和H2Sn.Hcy-Mito对内源性超氧阴离子自由基和H2Sn的检测表现出显著的灵敏度和选择性.细胞实验提示,H2Sn可以通过直接清除超氧阴离子自由基来保护细胞免受线粒体氧化应激的损害.而Hcy-Biot被成功用于活体成像,其可以靶向癌细胞以检测癌细胞组织中的超氧阴离子自由基和H2Sn.

Fig.42 Continuous detection of superoxide radical anion and H2S n by probe 134 or 135
以上两种连续检测超氧阴离子自由基和聚硫化物的探针由于光谱重叠,不利于实际应用.因此经过合理设计,该课题组又进一步设计开发了探针136(图43),它在极低的背景信号干扰下,可实现对不同荧光采集窗口中超氧阴离子自由基和H2Sn的连续检测[108].
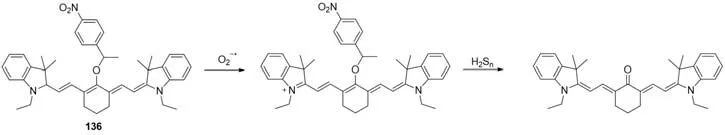
Fig.43 Continuous detection of superoxide radical anion and H2S n by probe 136
2013年,Tang等[109]开发了一种选择性检测硫化氢的比率型探针137(图44).探针137在700和780 nm处分别有最大吸收峰和发射峰.探针137与硫化氢反应后在3 min内荧光被猝灭.随后,在35 min内,在625 nm左右(510 nm激发)处逐渐出现了一个新的蓝移发射峰.他们利用荧光强度比(I625/I780)成功应用于细胞成像以及量化硫化氢.类似的,Yin等[110]报道了另外一种硫化氢检测器138,探针与硫化氢反应后荧光开启.
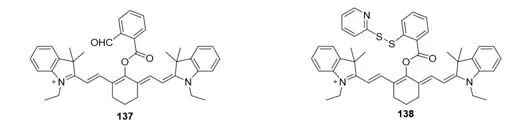
Fig.44 Molecular structure of hydrogen sulfide fluorescent probes 137 and 138

Fig.45 Molecular structure of a N2H4 probe 139
3.5.4 其它 2013年,Peng等[111]开发了一种检测联氨的比率型探针139(I810/I582)(图45),首次在活小鼠中实现联氨可视化.探针139与联氨反应后,分别在530和624 nm处出现新的最大吸收和发射峰,荧光量子产率由0.044增加到0.340.
2018年,Chen等[112]报道了首个能联合检测O和Hg2+的三通道比例型荧光探针HCy-SeH(140)(图46),以验证Hg2+引起的细胞内氧化应激.HCy-SeH有红色荧光发射,吸收峰以755 nm为中心,发射峰以800 nm为中心.Cy=Se表现出绿色荧光发射,吸收峰以405 nm为中心,发射峰以567 nm为中心.与Hg2+反应后,最终产物Keto-Cy在510 nm处形成最大吸收,在607 nm处有发射峰,通过比值更好地定量检测.HCySeH已成功应用于慢性汞中毒小鼠模型中O和Hg2+的检测.之后他们将Se替换成S,得到了类似响应机制的检测探针141[113].探针HCy-SH可用于HEK 293细胞和小鼠模型的汞中毒检测,对O的检测限为65 nmol/L,对Hg2+的检测限为72 nmol/L.
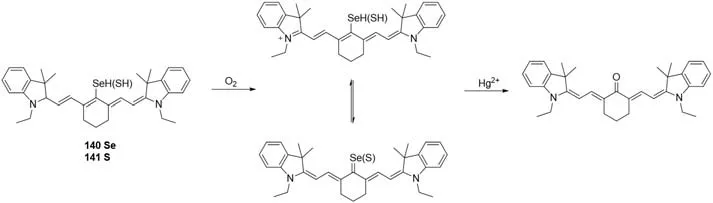
Fig.46 Continuous detection of superoxide radical anion and Hg2+by probe 140 or 141
2019年,Miao等[114]报道了一种用于硝基还原酶(NTR)上转换发光探针Cy7-NO2(142)(图47),用以在体内检测NTR.探针142响应基团为硝基苯环.该探针在硝基还原酶作用后,850 nm波长激发下,在790 nm处发射荧光.2020年,Yin等[115]开发了一种对去甲肾上腺素(NE)响应的探针143.在NE存在下,探针143在640 nm处荧光开启.在这项工作中,将该探针应用于高K+刺激下去甲肾上腺素胞吐信号通路的荧光成像.首次实现抗抑郁药物对去甲肾上腺素干预效果的可视化.
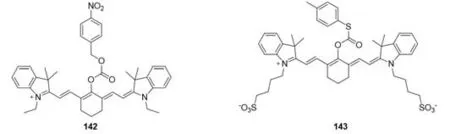
Fig.47 Molecular structures of nitroreductase and norepinephrine fluorescent probes 142 and 143
2018年,Li等[116]报道了一种由改进的Suzuki偶联得到的检测CN-的探针144(图48),实现了对氰根离子的定量检测.该探针在乙腈中对氰根离子的检测限为14 nmol/L,在CH3CN/H2O(V/V=9∶1)中的检测限为0.23μmol/L.
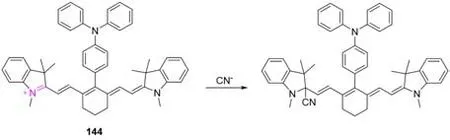
Fig.48 Molecular structure of cyanogen fluorescent probe 144
2019年,Yin等[117]报道了一种用于弱酸性环境下脂肪酸(FA)的特异性检测探针145(图49).当暴露于FA时,探针145在弱酸性环境(pH=3~6)中颜色变化明显,从蓝色变成绿色,而在中性或碱性环境中保持蓝色.探针145的颜色在FA暴露下发生变化,这是由于FA缩合诱导的pKa增加和随后在弱酸条件下的质子化过程.探针145可在30 s内对FA快速反应,灵敏度较高(检测限为3.25μmol/L),选择性好.该探针被成功用于弱酸性溶液和气体环境中FA的快速检测,这个工作为特定条件下FA的检测提供了一种简便而有效的策略.
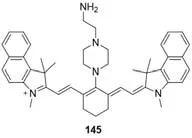
Fig.49 Molecular structure of a fatty acid probe 145
2019年,Chen等[118]报道了一种可用于活细胞和体内缺氧条件下检测次氯酸的探针CyHOCl(146)(图50).该探针对次氯酸的反应灵敏,生物相容性好,被成功用于测量急性缺血小鼠模型体外解剖器官中的次氯酸,并用于实时监测缺氧斑马鱼模型中次氯酸的变化.

Fig.50 Molecular structure of a hypochlorous acid fluorescent probe 146
大多数情况下,利用PET机制或者共轭骨架的破坏与恢复策略设计开发的探针只在一个荧光通道下发生强度的增强或者减弱,而基于Cy7共轭外围基团吸电子和供电子能力调控策略开发的分子探针,在检测前后通常具有不同的荧光发射波长,因此有潜力对待测底物实现比例型定量检测.
4 荧光共振能量转移
当一个荧光分子(供体分子)的荧光发射光谱与另一个荧光分子(受体分子)的激发光谱重叠时,供体荧光分子的激发能诱发受体分子发出荧光,同时供体荧光分子自身的荧光强度衰减,这一过程被称为“荧光共振能量转移”(FRET)[119].Cy7与其它光谱匹配的染料可以形成FRET对,利用二者对底物的反应性差异,可以实现基于FRET机理的荧光探针构建,从而实现待测底物的比例型检测[120].
2010年,Nagano等[121]研究了Cy5和Cy7与ROS反应性的差异(图51),发现Cy7比Cy5对ROS更敏感,共轭结构更容易被破坏.通过将Cy5和Cy7连接成功地开发了近红外荧光探针FOSCY-1(147),用以检测氧化应激水平.在没有ROS的情况下,由于两种菁染料分子的FRET效应,在Cy5的激发波长下,探针只发射微弱的Cy5对应的荧光,而Cy7通道荧光较强.然而加入ROS后,Cy7的多甲基链发生断裂,FRET效应消失,Cy5荧光得到恢复.探针147可检测HL60细胞、猪中性粒细胞和小鼠腹膜炎模型中的ROS.基于类似的研究思路,2016年,Qian等[122]开发了一种基于FRET的小分子荧光探针PNCy3Cy5(148),利用Cy3和Cy5对ONOO-的反应性差异监测ONOO-.当ONOO-存在时,荧光强度在560 nm处增强,在660 nm处减弱(图52).两个荧光发射通道强度比(F560/F660)在检测前后显示出高达324倍的动态增长,该探针对ONOO-的最低检测限为0.65 nmol/L.
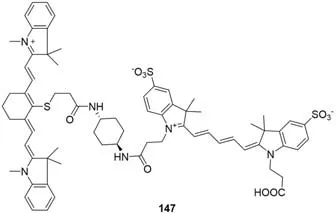
Fig.51 Molecular structure of a FRET probe 147 for ROS
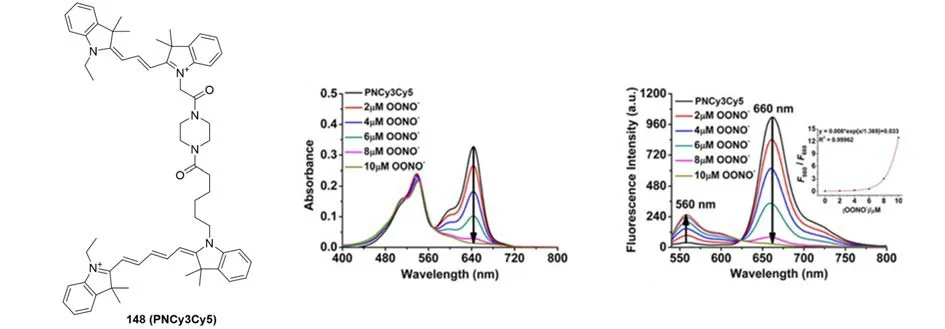
Fig.52 Molecular structure of a FRET probe 148 with its spectral response to ONOO-[122]
罗丹明供体和Cy7也可以组成FRET染料对.如2012年Hanaoka等[123]报道的可逆FRET系统149(图53),用于监测活细胞中的重复缺氧-常氧循环.2018年,Liu等[124]合成了一种基于FRET的近红外pH荧光探针150,将罗丹明供体与Cy7受体连接,利用罗丹明的酸碱响应开关调控其荧光发射,同时通过FRET将信号通过Cy7反馈出来.

Fig.53 Molecular structures of FRET probes 149—152
此外,基于Cy7平台的FRET机制在设计特定的酶敏感化学传感器中也非常流行.如2017年Yoon等[125]开发的可被组织蛋白酶B激发的探针151,可用于肿瘤特异性近红外成像和光疗;2019年设计的探针152[126]可用于检测组蛋白脱乙酰基酶SIRT1的活性.
5 总结与展望
综合评述了用作各种分析物比色和荧光传感器的吲哚七甲川菁染料,特别关注了它们的结构设计、检测机制以及生物成像剂的应用.对于花菁染料骨架的修饰通常有6个位点,分别为对称结构的吲哚氮原子上的取代基、吲哚苯环上的取代基、聚甲川链中位N/O上的修饰以及中心环上的取代.其中,聚甲川链中位N/O上通常与目标分子响应位点相连接.目前已经探索了检测pH、活性氧、活性氮、硫化物和金属离子等活性小分子的化学传感器,并根据检测机制进行细致的分类,其中,基于PET以及改变共轭外围基团吸电子和供电子能力的探针最为常见.这些花菁化学传感器由于其合适的激发和发射波长以及在生物样品中的良好生物相容性,是必不可少的生物成像剂.
吲哚七甲川花菁染料具有较高的摩尔消光系数,结构可修饰性位点多,调控策略丰富,荧光发射处于近红外区间.在过去的几十年里,许多基于经典的花菁染料的荧光探针已经被开发出来,用于体内检测.然而,由于生物组织具有背景荧光,亟需开发具有高对比度和灵敏度的深组织生物成像荧光团.为了扩大其在生物成像或生物传感方面的应用,必须克服菁染料荧光团的几个局限性:(1)菁染料仍然面临量子产率低和稳定性差的问题.如其光稳定较差,在成像的过程中可能因为光解导致探针信号减弱,对待测底物的检测造成一定的干扰;(2)水溶性差,易堆积,需要引入额外的亲水性基团或者通过材料包裹改善溶解性.活体内代谢过快等不足也限制了其在生物体内中的应用.此外,作为医学诊断和疾病治疗的荧光指标的花菁探针需要进一步关注.基于菁平台的理想特性,相关化学传感器的开发有重要的意义.

