半月板运动损伤力学机制及差异基因分析
蒲磊 漆正堂
(华东师范大学体育与健康学院 上海 200241)
随着经济和社会的发展,人民生活水平的提高,运动及意外事故造成的半月板损伤成为膝关节的常见外伤性疾病之一。半月板是纤维软骨板,位于胫骨内、外侧髁关节面上,具有缓冲震动和保护膝盖的功能。半月板损伤会导致膝关节及其以下关节活动受限。运动造成半月板损伤的常见因素是膝关节的突然制动和剧烈摆动等。因此,研究运动引起的半月板损伤的力学机制可以避免运动寿命降低和运动损伤的发生。由于学科的相互交叉渗透及不断发展,体育领域逐渐将基因组学相关研究方法与思路应用于运动损伤及各种疾病之中。目前而言,基于基因组学的运动损伤及干预措施的研究正逐步推进,针对运动造成半月板损伤的DEGs分析仍较少。回顾性研究发现,半月板发生损伤后,不及时康复治疗,损伤会积累,继而影响相关生理功能,即使治疗后,伴随着年龄的增长,半月板损伤也会引起并发症,如关节积液、骨关节炎、滑膜炎等。因此,利用生物信息学方法探索不同年龄段的DEGs,提供半月板损伤的基因靶点,可能对延缓、预防疾病具有一定的价值。
1 制动导致半月板损伤的机制
半月板是膝关节的重要软骨组织,由于特殊的生理位置及功能,运动造成的半月板损伤成为常见的运动性疾病。制动在运动过程中发挥着重要作用,动量矩在身体内传递和转移就是利用某些身体环节的突然制动,从而使环节原已获得的动量矩向相邻环节转移和传递,然而制动又是导致半月板损伤的主要原因之一。运动时,身体处于变化状态,重心也随之变化,当身体急剧制动,重心未及时调整时,半月板在股骨髁与胫骨之间发生研磨,半月板受到压缩-扭转复合载荷,导致损伤。例如,足球运动中,运动员为减少惯量,大、小腿折叠后急剧伸小腿作强力扭转,此刻半月板处在股骨内外侧髁、股骨的突起部位中间,未及时滑移,受到上、下关节面强烈冲击和挤压,导致损伤的发生。制动造成的半月板损伤主要表现为磨损与变性(改变性质)[1]。
其中,磨损分为两类,即界面磨损和疲劳性磨损。界面磨损由承载表面之间的相互作用引起,疲劳性磨损由关节变形引起。承载面磨损的可能机制为半月板微结构受到破坏,正常加载机制(如分泌润滑液)发生改变,表面研磨与粘黏,承载表面过于干涸而引发磨损。变形机制可能是,运动时,由于剧烈制动,半月板受到外力作用,内部产生对抗力,局部相对变形,继续增加压强,半月板受到过高载荷,未及时使组织间液重新分布与滑移,继而因强烈碰撞导致半月板承载表面变形,最终引发疲劳性磨损。
软骨变性的可能机制为软骨受到异常应力与应变,随着应力的增加,力的作用点集中,软骨内产生断裂,继而引发软骨变性与退化[2-3]。研究发现,制动后数日内,关节滑液分泌障碍,润滑囊干涸、粘连、消失,关节软骨接触面的表层发生退行性变化,逐渐侵入各层,继而引发软骨细胞死亡、软骨吸取营养功能障碍、纤维化等,最终导致关节粘连、关节挛缩、关节炎,引起关节活动障碍[4]。制动不仅能引起半月板单方面损伤,还会引起周围韧带的机械损伤,形成膝关节损伤。制动导致韧带萎缩,韧带应力、应变下降、机械性能降低,韧带发生机械性损伤,最终关节稳固性下降。总之,剧烈运动增加了损伤发生的可能性,制动首先引起关节内压强增大,应力、应变发生变化,所受载荷超出范围,发生损伤,进而引发稳定性下降、软骨细胞凋亡、功能异常等[5-7]。
2 半月板损伤的差异基因分析与讨论
随着细胞生物学和生物信息学的发展,基因组学的调控疗法逐渐被应用于运动损伤及各种疾病之中。目前而言,基于基因组学的运动损伤研究及干预措施正逐步推进。回顾性研究发现,针对运动造成半月板损伤的DEGs分析仍较少。游茗柯等人[8]的研究报道,血管内皮生长因子(VEGF)、软骨素酶-ABC、硫酸软骨素(CS)、白细胞介素-1(IL-1)、胰岛素样生因子-1(IGF-1)等,对于半月板损伤的治疗具有重要意义。国内研究者贾琼通过建立大鼠半月板损伤模型,分析肿瘤坏死因子(TNF-α)和超级生长因子TGF-β1 基因在半月板受损后的差异表达,发现TNF-α 的正负调控和TGF-β1 在软骨组织的维持和修复作用,可用于治疗、保护关节软骨。虽然大量研究证明基因表达与半月板损伤的发展相关,但半月板患者在不同年龄段病理变化的差异基因表达尚不清楚。
该研究通过GEO数据库下载了GSE45233基因集,数据源采集年龄已划分为>40 岁和≤40 岁,据此,该研究将划分为两组:老年组/对照组(>40 岁,6 人平均50岁,最大年龄55 岁,最小年龄43 岁)和年轻组/实验组(≤40 岁,6 人平均30 岁,最大年龄40 岁,最小年龄16岁)。利用GEO2R在线数据库分析GSE45233,并以P<0.05和logFC绝对值≥1作为筛选标准,共筛选出290个上调差异基因(DEGs)和235 个下调DEGs,并运用UE和R软件绘制火山图(见图1)。
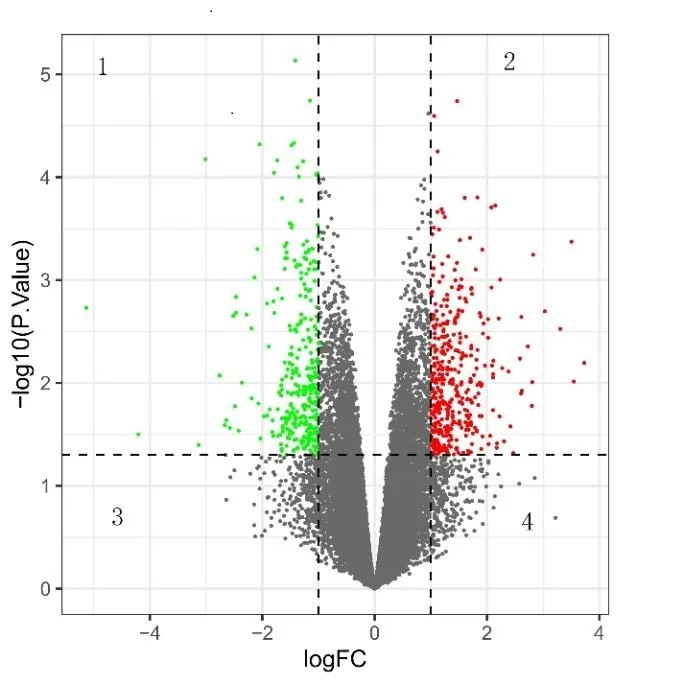
图1 DEGs火山图
然后,利用DAVID 数据库进行上调、下调DEGs 的基因本体功能(GO)的生物过程(BP)和京东与基因组百科全书(KEGG)富集分析。图2 结果显示,上调DEGs 在BP 中显著富集于骨骼系统开发、胶原纤维组织、软骨发育、软骨凝结、软骨细胞分化的负调控、软骨内骨化、软骨细胞分化等进程中。KEGG 通路中,上调基因显著富集的通路共5条:蛋白质消化吸收通路、磷脂酰肌醇3 激酶/丝氨酸-苏氨酸蛋白激酶(PI3K/Akt)信号通路、海马信号通路、低氧诱导因子(HIF-1)信号通路和细胞外基质受体相互作用通路等。P13K-Akt是一类AGC 家族的苏氨酸激酶,P13K/Akt 通路与人类疾病密切相关,如癌症、骨关节炎、心血管疾病、神经疾病等,主要参与着调控细胞周期的多种环节,在细胞过程中发挥着关键作用。有研究探讨了P13K/Akt信号通路的激活可减少细胞的凋亡、减轻心肌内皮细胞凋亡等,并认为上调P13K/Akt能够减少肌细胞凋零,达到改善骨骼肌功能的效果[9]。李田洋等人[10]研究报道,P13K/Akt通路在骨关节炎软骨细胞凋亡中发挥着重要作用,抑制P13K/Akt的磷酸化可促进软骨细胞增殖,对延缓骨关节炎的发展和治疗有良好的疗效。大量研究表明,P13K/Akt通路参与细胞凋亡、调控细胞周期及软骨组织疾病的发生和发展,据此,推断半月板损伤加剧可能机制为PI3K/AKT通路表达量减少,软骨细胞逐渐凋亡,伴随白介素(IL-1β)诱导细胞凋亡和炎症,软骨细胞的一氧化碳和活性氧增加,半胱氨酸蛋白酶(Caspas-9/caspas-3)的产生和PI3K/Akt的磷酸化,最终引发半月板损伤恶化[11]。细胞外基质(ECM)指在多细胞有机体中,由细胞分泌至细胞外间质的大分子组成的复杂网络。ECM 与多种疾病密切联系,相关研究已证实ECM 基因突变可引发骨关节炎,黄斑变性病,动脉粥样硬化等疾病。杨等人[11-12]建立兔子模型,发现ECM诱导血管化组织工程对于修复兔子的半月板损伤具有一定潜力。该数据集采集者研究报道,细胞外基质与年龄具有相关性,随着年龄的增加,细胞外基质也发生变化,该研究筛选了与软骨稳态和骨关节炎相关的基因,发现了随年龄增长而发生上调和下调变化的基因,暗示了软骨病或将随着年龄而发生变化。这与该研究的富集分析结果不谋而合,上调DEGs基因集显示7 个基因富集于ECM 通路,分别是:COL2A1、LAMB3、LAMC3、ITGA10、CHAD、COL9A3、COL9A2,这些基因与软骨疾病密切相关,可为今后相关研究者提出大量实证。
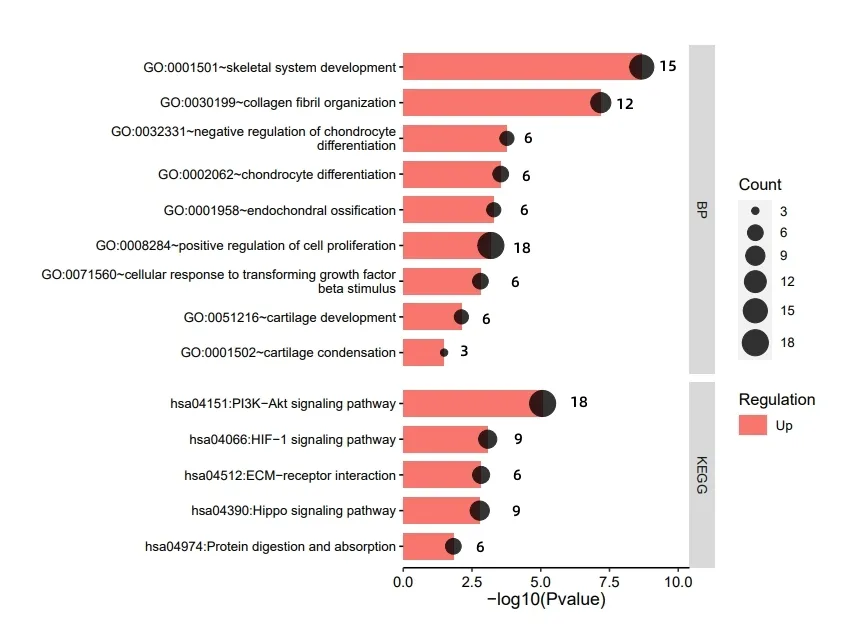
图2 上调DEGs的BP和KEGG 富集分析结果图
图3 显示,下调DEGs 在BP 中显著富集于细胞增殖,超氧化代谢过程,免疫应答,蛋白质磷酸化,白细胞介素-1β正调节,细胞凋亡过程,线粒体ATP合成耦合电子传递的正调控,细胞分裂,先天免疫反应等过程。下调DEGs 显著富集于3 条通路,即破骨细胞分化、中性粒细胞胞外陷阱形成、B细胞受体信号通路。骨细胞分化通路是骨生成的重要通路,相关研究报道,骨的生成是破骨细胞(OC)与成骨细胞(OB)保持平衡相互作用的结果,二者失去平衡将引起骨疾病,OC 前体细胞向破骨细胞分化需要细胞因子的参与,如巨噬细胞集落刺激因子、核转录因子-κB受体活化因子等,其中调控NF-κB已被证实可促进关节炎软骨再生[13-16]。中性粒细胞胞外陷阱(NET)指中性粒细胞(NEU)与感染性病原体作用后排出的细胞外DNA 链,NET 是血液中丰富的免疫细胞,参与着非感染炎症的调控,NET也是消灭病原体,宿主抵御病原感染的关键点,其表达水平增多或减少都影响着急性、慢性疾病的病理过程[17-20]。B细胞受体(BCR)信号通路是B 细胞存活的重要信号通路,B 细胞在体液免疫中发挥着不可替代的作用,B 细胞膜表面表达着BCR,BCR 是能够识别并结合抗原的免疫膜蛋白受体,进行BCR 调控对于多种免疫疾病具有重要治疗意义[21-23]。
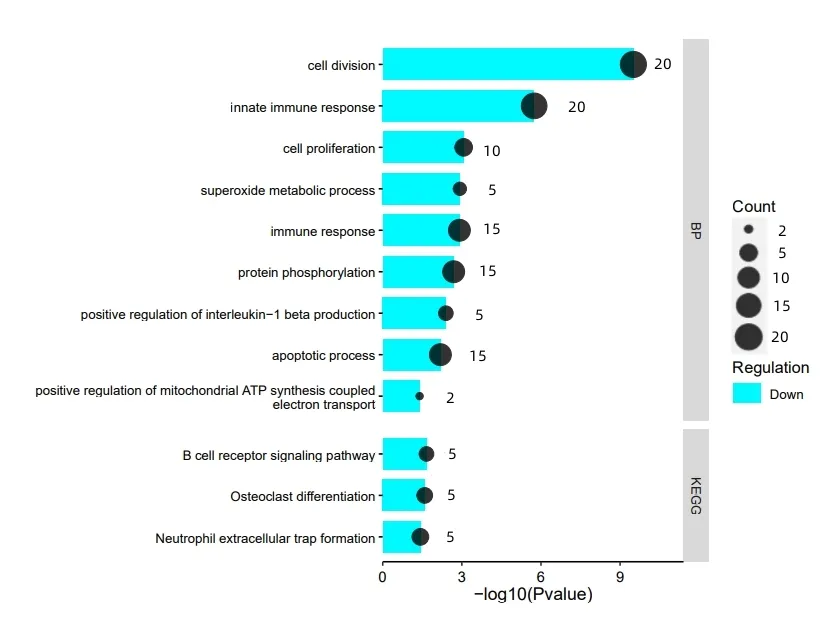
图3 下调DEGs的BP和KEGG富集分析结果图
最后,基于STRING数据库利用Cytoscape(3.82)软件分别构建了上调DEGs(见图4)和下调DEGs(见图5)的PPI 网络图,根据相关度(Degree)筛选出3 个上调关键基因和3 个下调关键基因。上调关键基因为VEGFA、FGF2、SOX9。下调关键基因为BIRC5、BUB1、CDK1。血管内皮生长因子A(VEGFA)是血小板衍生因子(PDGF)和血小板衍生生长因子(VEGF)家族的成员,该基因是血管生成的必要因子,在血管生成中诱导血管内皮细胞迁移和增殖,保护细胞避免凋亡和衰老[24]。成纤维细胞生长因子-2(FGF2)可促进细胞有丝分裂,刺激骨髓间充质干细胞(SMSCs)增殖并保持其多能性,间充质干细胞又是半月板细胞的有用来源,间充质干细胞可迁移至损伤部位,结合营养因子发挥修复功能,间接或直接改善半月板损伤。另外,袁媛等人通过建立牙髓模型,也发现FGF2预处理后可促进牙周膜干细胞的增殖及分化能力,对牙髓的再生发挥着重要作用[25-27]。SOX9是软骨性转录因子,主要在间充质软骨的形成过程中表达,对Aggrecan 和Co12a1 的转录发挥重要作用[28]。BIRC5该基因是凋亡抑制因子家族的成员,编码抑制凋亡细胞死亡的负调节蛋白,李玉龙等人[29]研究发现结合相关因子,沉默BIRC5 可抑制细胞增殖,促进其凋亡,该基因主要应用于癌症的靶点研究,但通过对其调控,应用于半月板损伤治疗也具有一定潜力。BUBI是有丝分裂检查点的重要成员之一,参与着有丝分裂过程微管与丝点结合的检测,并在衰老、肿瘤、不孕等方面发挥着调控作用[30-31]。周期蛋白依赖性激酶1(CDK1)是一套Ser/Thr 激酶系统,它对细胞周期调控、DNA损伤修复、检查点的激活发挥着关键作用,CDK1 对细胞生存具有重要意义,目前已受到肿瘤研究的高度关注。
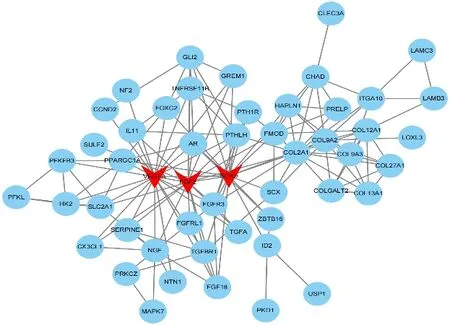
图4 PPI上调DEGs网络图
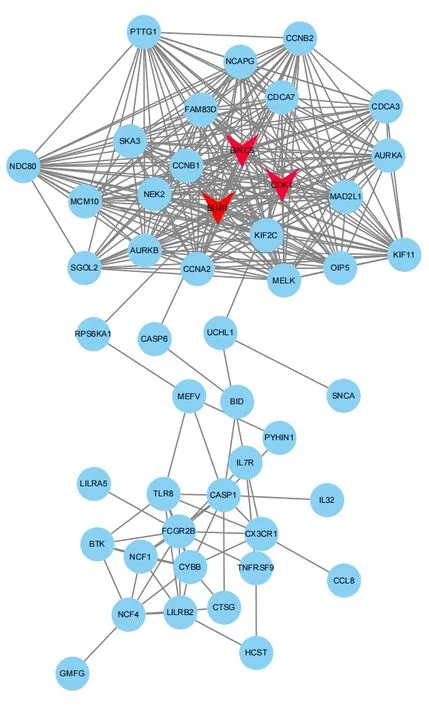
图5 PPI下调DEGs网络图
通过上述差异基因分析,该研究认为不同年龄段的半月板损伤发展具有差异性,对关键基因VFGFA、FGF2、SOX9、BIRC5、BUB1、CDK1的调控可能成为治疗半月板损伤的靶点。例如,Grunewald等人[32]通过建立小鼠模型的研究发现,衰老过程中,尽管VEGF产生量未具有显著性差异,但VEGF 在多个关键器官中的表达量显著性减少;Joe.V等人以构建的小鼠模型为研究对象,发现了FGF2的表达水平会随着年龄的增长而增加,FGF2 由于无法识别性地选择激活休眠干细胞池,因此导致了干细胞被不必要地激活,而通过抑制FGF2表达量,可以有效地抑制小鼠体内干细胞数量的下降,这表明了随着年龄的增长,干细胞池会被逐渐耗尽,进而导致干细胞数量下降[33];Gruber 等人[34]研究发现,SOX9 的表达量与年龄成反比,即随着年龄的增长,SOX9的表达量将会下降。相较于老年组而言,年轻组在半月板损伤的康复中可能更具有优势,但由于基因表达水平较高,损伤及引发相关疾病的加剧速度也较快,因此针对不同年龄段应采用不同手段。老年组由于多种益于软骨发育及修复的细胞逐渐凋亡的同时,促进病情加剧的相关细胞也随之凋亡,可在病情极端恶化时进行靶点基因调控,促进软骨再生及延缓。并制订微量的体育锻炼方案,提高肌肉性能,关节稳定性、灵活性,增加自身免疫力和消炎药物辅以控制病情。而年轻组由于细胞凋亡与增殖因子及自身免疫系统因子正处于壮年期,不建议利用基因调控对其进行治疗[35]。可采用适宜的运动进行康复锻炼,适宜的体育锻炼对软骨具有积极的影响,如抗阻运动,通过增大肌肉体积来提高关节负载能力,同时减少与软骨之间的摩擦阻力,进而发挥间接性治疗作用。
3 结语
该研究认为,制动会造成半月板磨损、变性,避免剧烈制动可防止损伤发生,一旦损伤发生,可根据病情发展及患者年龄等情况采取针对性治疗方法。
该研究为综述性研究,其确切结论及机制仍需更进一步临床研究证实,研究过程中发现了诸如KIF11及多种雌激素基因的反复出现,暗示了可能还受到性别影响,遗憾的是,基因集数据并未对此分类,相关影响因素有待进一步探讨。

