运动调节自噬改善心血管疾病预后的研究进展
吴长勇,保苏丽,徐菲,彭云珠
心血管疾病是全球人类死亡的主要原因之一[1],位于我国城乡居民疾病死亡构成比首位,其中每5例死亡中就有2例死于心血管疾病[2],因此需要有效的策略进行心血管疾病管理,改善患者预后。自噬是一种细胞内降解系统,普遍存在于细胞内,发挥着维持内环境动态平衡和防御的作用。正常水平的自噬保护细胞不受外界环境刺激,维持内环境稳态,而过度的自噬激活会导致另一种重要的细胞程序性死亡(被称为Ⅱ型程序性死亡)[3]。近年来研究表明,自噬具有比预期更多的病理、生理学功能,如发育、细胞内蛋白质及细胞器清除、抗衰老、细胞凋亡、心脏重构、肿瘤抑制和抗原呈递[4]。自噬是心血管疾病的重要调节机制,过度的自噬或自噬不足将导致心血管事件发生,最终诱导心力衰竭。因此,通过探究自噬的病理、生理功能及其相关信号通路的分子机制,并发现新型有效治疗靶点,有益于预防心血管事件,改善心功能,提高患者生活质量。
目前,国内外指南均指出心脏康复是二级预防的重要指标[5-7],且运动康复作为中心元素,有益于降低心血管疾病患者再入院率、死亡率及心血管事件发生率,改善患者心功能,提高心血管事件发生后的生存率[8-10]。另外,心肌梗死、缺血再灌注损伤、心力衰竭等心血管疾病研究证实,运动能减少心肌梗死面积、活性氧(reactive oxygen species,ROS)产生及炎性反应,增加梗死灶周围血管生成、减少心肌细胞凋亡,改善细胞基质合成、减轻心脏纤维化,最终改善心功能[11-12]。且运动可通过调节自噬水平维持内环境稳态,发挥适应性保护心脏作用。但目前运动改善心血管疾病预后的机制仍未充分阐述清楚。本文将从自噬及其主要信号通路角度总结运动调节自噬改善心血管疾病预后,现综述如下。
以“exercise,sport,autophagy,cardiovascular disease,myocardial infarction,ncRNA”为英文关键词检索PubMed、Medline、Web of Science;以“运动,自噬,心血管疾病,心肌梗死,非编码RNA”为中文检索词检索中国知网、万方数据知识服务平台、维普网及中国生物医学文献服务系统。检索时间为建库至2022-04-07。文献纳入标准:涉及心血管疾病的病理机制、自噬及其相关信号通路、心脏运动康复的基础研究及文献研究。文献排除标准:重复发表、数据记录不详细、文献年代久远、文献质量差。
1 自噬概述以及其在心血管疾病中的作用
自1957年CLARK和ASHFORD首次发现自噬形成现象以来[13],自噬在有机体的演变中发挥关键作用。自噬包括4个步骤:自噬的诱导、自噬小体的形成、降解和再利用[14],每一步骤在不同细胞环境中发挥不同功能(图1)。自噬调控过程涉及多种信号通路,其中较经典的是磷脂酰肌醇3激酶-丝氨酸/苏氨酸激酶-哺乳动物雷帕霉素靶蛋白(PI3K-AKT-MTOR)通路、腺苷酸激活蛋白激酶(AMPK)通路,且AMPK通路对细胞生长及氧化应激损伤起重要作用。心肌缺血缺氧时,增加一磷酸腺苷/三磷酸腺苷(AMP/ATP)比值,激活AMPK途径,抑制MTOR复合物1活性,诱导自噬,促进线粒体合成ATP,改善心肌能量代谢[15]。但MTOR通路调节自噬是双向的,早期被抑制促进自噬产生,晚期被激活避免过度自噬。自噬小体成熟的一个重要步骤是招募ULK1激酶复合物和PI3K复合物稳定于自噬体膜上。ULK1复合物、微管相关蛋白3(LC3)和自噬相关基因ATG5-12-16L1在自噬体膜上相互作用促进自噬小体的成熟。TIAN等[16]发现pATG16L1s278与自噬小体形成的生物学作用及自噬诱导速率密切相关,且遵循LC3-Ⅱ的速率,这可能为自噬的诱导和调控开辟新途径。除此外,ATG7募集LC3-Ⅰ到自噬体膜上,ATG5-12-16L1依赖的磷脂酰乙醇胺(PE)脂化为LC3-Ⅱ,对自噬体的成熟至关重要。成熟的自噬体与溶酶体融合成自噬溶酶体,在ATG、Lamp1、Lamp2、UVRAG等蛋白质协助一系列水解酶降解内容物,并回收用于蛋白质合成,维持细胞的能量代谢和质量守恒。
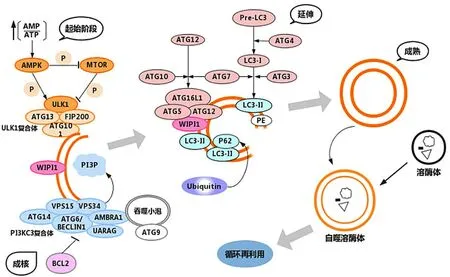
图1 自噬过程概述及主要的信号通路机制Figure 1 Overview of the autophagic process and main signaling pathway mechanisms
心肌细胞是终末期分化细胞,再生能力有限。心血管疾病进展到后期将产生共同的病理变化即心肌纤维化,导致心功能障碍,最后发展为心力衰竭。而自噬通过降解折叠错误或功能失调的蛋白质及损坏衰老的细胞器可促进ATP产生,为心肌细胞提供能量,改善心肌细胞缺血缺氧,发挥保护性作用。因此,自噬维持对心肌细胞的稳态具有重要作用。自噬可保护机体免受肾上腺素或压力负荷所致的心肌肥厚[17]。研究表明,全球每年约有65%心肌梗死患者表现为心肌纤维化性心脏重构[18],缺血缺氧诱导自噬能防止细胞肥大,清除心肌细胞功能障碍的线粒体,增加内质网应激,维持线粒体数量,恢复心肌细胞能量代谢。随着心血管疾病进展至心力衰竭阶段,机体通过MTOR和内质网(ER)应激通路激活自噬,减少细胞凋亡与坏死,抑制心室重塑,改善心功能。但过度的自噬或自噬不足将导致心血管疾病恶化,有关终末期心力衰竭的研究发现,自噬过度增加是心肌细胞进行性损失的主要驱动力,广泛发生细胞质破坏和核溶解,导致细胞坏死[19],这可能是疾病恶化的原因之一。
进一步研究发现,非编码RNAs(noncoding RNAs,ncRNAs)参与心肌细胞自噬的调节,是心血管疾病重要的调控因子之一[20-23]。ncRNAs是一类不编码蛋白的RNAs,主要包括微小RNAs(microRNAs,miRNAs)、长链非编码 RNAs(long noncoding RNAs,lncRNAs)和环状RNAs(circular RNAs,circRNAs)等,其中miRNAs是一种长度约22个核苷酸的小分子单链RNA,具有高度保守性,主要机制是miRNAs通过碱基互补配对原则与靶mRNA的3'非翻译区(3'UTR)结合,诱导靶mRNA降解或抑制其翻译。在糖尿病心肌病中,miR-30c的耗竭与Becn1的诱导增强了糖尿病心肌细胞的自噬通量,且miR-30c直接结合到Becn1的3'UTR而抑制Becn1表达,进而改善心脏结构及功能[24];通过miR-551b17/PCDH 17途径促进心肌细胞自噬,减少心肌纤维化形成,改善心功能[25]。然而,在肥厚型心肌病中发现,miR-29族、miR-302-367族通过磷酸酶和张力蛋白同源物(PTEN)/AKT/MTOR信号通路抑制自噬,进而加重心肌肥厚,导致心功能障碍[26-27]。lncRNAs是长度大于200个核苷酸的ncRNAs,且根据其与邻近编码区基因组的相对位置关系,可分为6种类型:正义lncRNAs、反义lncRNAs、基因间lncRNAs、内含子lncRNAs、增强子lncRNAs和双向lncRNAs。lncRNAs主要直接与蛋白质、DNA和miRNAs结合等相互作用而调节心血管疾病,但其生物学功能及分子机制尚未充分阐述清楚。LIANG等[28]报道lncRNA 2810403D2Rik/AK007586/Mirf(心肌梗死调节因子)海绵化miR-26a,靶向USP15激活自噬,减轻心脏损伤。此外,其余的lncRNAs,如lncRNA CAIF、lncRNA Chast和 lncRNA H19,也是调控自噬参与心血管疾病的重要因子[29-30]。然而,circRNA是一种新型的非线性内源性ncRNA,具有保守性好、稳定性高等特征,主要通过PI3K-AKT-AMPK等信号通路参与自噬调节。然而,因技术的局限性,ncRNAs特别是lncRNAs和circRNAs的研究主要通过体内实验进行证实,仍存在动物与人类基因差异表达及是否对心血管本身存在严重不良反应等挑战。
2 运动调节自噬改善心血管疾病
运动调节自噬是双向的[31-32](图2)。自噬损伤和自噬水平的改变与多种疾病的发病机制相关。研究显示在自噬缺陷的大鼠或患者中,自噬小体形成受损会使受损的线粒体、蛋白质清除不足,导致多器官功能障碍和其他严重的不良结局[33-35]。自噬性空泡肌病主要包括Pompe病、Danon病和X连锁肌病伴过度 自 噬(X-linked myopathy with excessive autophagy,XMEA),其中XMEA是由VMA21基因中的一个插入缺失引起,其特征是缓慢进行性肌无力和肌肉活检中过度自噬空泡的病理学表现,在XMEA患者肌肉检测到溶酶体pH值增加和LC3阳性空泡,这与基因突变的预测功能缺陷相符[36-37]。而对于自噬不足引起的心血管疾病,运动能上调自噬水平。而对于自噬过度所致的心血管疾病,运动则抑制自噬,使其恢复正常的自噬水平及功能,延缓心血管疾病的进展。此外,运动还可减少心肌梗死面积、梗死区域血管生成、增加梗死边缘区心脏特络细胞和抑制炎性反应,改善心室病理性重构[38]。有氧运动通过上调AMPK活动来抑制MTOR的磷酸化,改善心肌细胞自噬水平,防止心肌细胞凋亡和心脏功能障碍,且单项运动也可通过激活叉头转录因子(FOXO)3和缺氧诱导因子1激活心脏自噬,间接上调Beclin1表达[31]。除此外,有氧运动介导自噬通过热休克蛋白70相互作用蛋白的羧基端发挥心脏保护性作用[39]。

图2 运动诱导自噬的分子递质有益于心血管疾病Figure 2 Molecular mediators used in the inducing of autophagy by exercise are beneficial to cardiovascular disease improvement
有研究显示,运动可调节自噬水平或自噬通量,改善心功能,对心血管疾病有一定治疗、指导作用[40]。在过度自噬的病理情况下,运动训练降低自噬活性,阻碍心血管疾病的恶化[41]。心肌梗死后心肌细胞间质及细胞外基质增加导致心肌纤维化形成,而ROS的过度产生是主要病理机制之一。研究表明,氧化应激诱导Smyd1上调激活自噬,抑制心肌细胞间质增生和纤维化浸润,发挥保护心脏作用[42]。而运动调节自噬清除心肌梗死后受损及衰老的线粒体,调整心肌能量代谢,改善心室重构,降低心血管事件的发生率[43-45]。不同的运动模式及强度对不同心血管疾病的保护机制仍未充分阐述清楚。通过建立心肌梗死小鼠模型进行跑台、抗阻等不同运动训练的研究表明,运动通过激活FNDC5/Irisin-PINK1/Parkin-LC3Ⅱ/L-P62信号通路上调线粒体自噬,增强抗氧化能力,抑制氧化应激,改善心功能[11]。关于心力衰竭动物及患者的研究表明,运动能改善心肌和线粒体自噬,提高射血分数及缩短分数,减轻心脏纤维化,改善心功能[46-48]。除此外,研究发现运动干预可刺激骨骼肌等远端器官的FSTL1的表达,通过DIP2A-Samd2/3信号通路,抑制心肌梗死大鼠心肌纤维化形成,改善心功能,为心脏康复提供新的思路[49]。
除调节病理条件下的异常自噬外,有氧运动可以在不上调自噬通量的情况下维持心肌细胞自噬的稳态,发挥生理条件下的心脏保护作用,改善心功能。有研究表明,2月龄大鼠进行习惯性运动5个月后,与对照组相比,运动组的自噬通量未改变但LC3-Ⅱ蛋白增加,有助于提高细胞自噬能力和心肌细胞做功的效率[50]。健康老年人有氧运动8周后(运动组),其外周血单个核细胞检测提示LC3-Ⅱ/LC3-Ⅰ比值、ATG12、ATG16和Beclin1蛋白表达水平显著高于对照组,而P62、ULK-1蛋白表达水平下降,且运动组峰值摄氧量也增加[51]。老年人进行10周的运动干预训练发现,没有改变自噬相关基因表达及蛋白标志物水平,但在训练2.5 h后发现LC3-Ⅰ增加,这可能与MTORC1活性增强抑制LC3-Ⅰ到LC3-Ⅱ脂化,从而抑制自噬有关[52]。此外,在一项进行了21周的抗阻运动训练研究中发现,年轻男性的LC3-Ⅱ蛋白水平增加,而不是中老年男性[53]。总体来说,运动训练可能是减缓衰老引起的细胞自噬下降的一个因素。
3 总结与展望
科学而有规律的有氧运动能提高机体的新陈代谢。近年来,运动对心血管疾病的保护作用越来越受到关注[54-55]。运动能提高心肌自噬水平,抑制心室重构,改善心脏功能。运动调节心肌自噬是双向的、动态的,一方面运动可上调自噬水平和增强细胞能力,延缓细胞衰老和预防心血管疾病;另一方面,运动可抑制自噬,减少细胞凋亡和坏死,改善心室重塑,从而改善心血管疾病的预后。但研究也发现过度的自噬能损伤心肌细胞,甚至导致坏死程度增加[19]。
运动调节自噬在心血管疾病中发挥保护性作用,在进行心脏运动康复训练中,考虑到个体差异,也存在相应问题:(1)目前在基础与临床研究中可采用呼吸代谢系统或心肺运动试验检测氧消耗(VO2)和二氧化碳产生(VCO2)来定量运动处方,但不同的运动强度对不同年龄组确保运动诱导自噬对心血管疾病是否有益?(2)给出运动处方时,应考虑急性期与慢性期,以及短期与长期运动训练之间的区别,并且结合心脏康复模式,如居家心脏康复、社区心脏康复模式、医院主导的心脏康复及混合型心脏康复模式,对这些问题的研究与探讨,有助于更好地证实运动调控自噬在心血管疾病的获益,并为创新型的临床心脏运动康复提供更好的指导。然而,运动改善心血管疾病预后的机制仍未充分阐述清楚。目前研究表明,运动除介导自噬调控其相关信号分子外,ncRNAs特别是lncRNAs和circRNAs已成为心血管疾病中运动的重要调控因子,并有望成为生物标志物和新型靶向治疗策略,但其生物学功能及分子仍在探索中。因此,发现新的有效治疗靶点来预防心血管事件,改善患者的心功能及提高生活质量,为心血管疾病的生物学研究及临床心脏运动康复提供循证医学证据是至关重要的。
作者贡献:吴长勇负责论文的构思和设计、文献整理和撰写论文、图片制作;保苏丽、徐菲负责文献收集与整理;彭云珠负责文章的质控及审校,对文章整体负责,监督管理。
本文无利益冲突。

