新型嗪类荧光染料用于术中神经成像
包瑞楚,李昌盛,顾月清
(中国药科大学,南京 211198)
外科手术是大多数疾病和损伤最有效的治疗选择,全世界每年有超过3 亿次手术[1]。外科手术的最终目标是通过保留神经组织、血管等重要结构来移除或修复组织,同时最大限度地减少并发症。医源性神经损伤是最令人头疼的术后并发症之一,其引起的慢性神经疾病不仅降低了患者的生活质量,而且增加了医疗费用[2]。尽管外科技术和医疗设备不断发展,核磁共振成像[3]、肌电图[4]、超声波[5]、光学相干断层扫描[6]和共聚焦显微内镜检查已被应用于辅助术中神经识别。但是,这些技术缺乏特异性、分辨率和宽视场成像功能,使得神经实时监测变得困难。荧光引导手术通过增强术中特定组织的可视化[7],有效地将术前成像和手术指导结合起来,具有革新手术的潜力,非常适合神经组织等重要结构保护。然而,已经发现的几类神经特异性荧光团,包括二苯乙烯衍生物[8]、二苯乙烯基苯(DSB)[9]、香豆素衍生物[10]、苯乙烯基吡啶(FM)、三碳菁、神经特异性多肽[11]和钠通道选择性多肽[12]都受到发射波长较短、组织非特异性摄取高的困扰,而嗪类荧光团[13]是发射波长在可见光波段的神经特异性荧光染料,具有较强的荧光信号、结构可修饰空间。
临床中,喉返神经的医源性损伤是一种常见的甲状腺术后并发症,通过肉眼识别进而保护喉返神经是甲状腺手术中保证喉返神经安全的金标准[14]。然而,对于需进行二次甲状腺手术的患者,由于正常的解剖结构的破坏,再次手术过程中单纯通过肉眼识别喉返神经的难度大大增加。因此,在甲状腺再次手术过程中如何精准定位、识别喉返神经,是避免术中神经损伤的关键。
MBP 是神经髓鞘的主要成分,在形成和维持髓磷脂的稳定中起着至关重要的作用,对于神经系统的正常功能非常重要[15]。MBP 是1,4-双(对氨基苯乙烯基)-2-甲氧基苯(BMB)的潜在分子靶标[16],可能与髓鞘碱性蛋白中的β-折叠片状构象有关[17]。在目前已经开发或发现的神经荧光染料中,同一类别的物质具有相似的性质,嗪类衍生物基于与BMB 的化学相似性,MBP 也可能是其潜在分子靶标。有文献报道,除大鼠外,对猪神经进行嗪4的免疫组织化学研究,可以应用兔抗髓鞘碱性蛋白来显示髓鞘,同时用MBP 抗体染色,结果显示嗪4与纤维束中的髓鞘共定位[15]。
本研究中在嗪类化合物母核结构基础上进行结构修饰,得到了YQN-3~YQN-6 4 个化合物,其结构经质谱和核磁共振氢谱确证,并且其最大吸收和最大发射波长分别在625 nm 和640 nm 左右,具有较好的光谱性质。进一步在大鼠中筛选出具有神经组织高特异性靶向的YQN-3,最后在甲状腺手术切除过程中验证了,探针YQN-3 具有喉返神经特异性靶向能力,能很好地靶向、定位喉返神经,有效地避免术中损伤。YQN-3 具有良好的安全性,具有潜在的临床神经显影应用前景。
1 材 料
1.1 试 剂
高氯酸(70%)、二甲基亚砜、高氯酸嗪4(阿拉丁生化科技股份有限公司);叔丁醇钾、间羟基-N,N-二乙基苯胺、间溴苯甲醚(毕得医药科技股份有限公司);四(三苯基膦)钯(阿达玛斯试剂有限公司);环丁胺、环己胺(分析纯,迈瑞尔化学技术有限公司);水合氯醛(分析纯,贤鼎生物科技有限公司);胎牛血清(生物级,美国赛默飞世尔科技公司);Cell Counting Kit-8(碧云天生物技术有限公司);聚氧乙烯氢化蓖麻油(源叶生物科技有限公司);DMEM 培养基、胰蛋白酶(生物级,凯基生物技术有限公司)。
1.2 仪 器
Hei-VAP Core型旋转蒸发仪(德国海道夫有限公司);Avance-400型核磁共振波谱仪(德国布鲁克公司);6540-ESI-MS 型高分辨质谱仪(美国安捷伦科技公司);UV-2550型紫外可见分光光度计(日本岛津仪器有限公司);F-4700 型荧光光谱仪(日本日立有限公司);IVIS Lumia Ⅲ小动物活体成像仪(美国珀金埃尔默公司);Leica CM1950 型冷冻切片机(德国徕卡有限公司);ELx800型酶标仪(美国伯腾有限公司)。
1.3 动 物
SPF 级SD 大鼠,雄性,体重(210 ± 10)g,由南京青龙山动物繁殖中心提供,许可证号:SCXK(浙)2019-0002。手术前,用腹腔注射水合氯醛麻醉动物(120 mg/kg)。在所有研究完成后,用吸入二氧化碳的方法对小鼠实施安乐死,然后再进行颈椎脱位。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 合成方法和表征数据
化合物YQN-3 ~ YQN-6 的合成路线示意图如路线1所示。
土坝劈裂灌浆防渗加固机理是多方面的,首先是坝体内部应力的分布规律为劈裂灌浆提供了可能性,再就是灌浆过程中的泥浆的劈裂充填作用、浆坝互压作用、坝体湿陷固结作用、坝体内部应力调整作用等。
2.1.1 化合物YQN-3的合成
步骤一:25 mL 三颈瓶中,加入间溴苯甲醚1.50 g(8.02 mmol),环丙胺0.73 g(12.79 mmol),叔丁醇钾1.36 g(12.12 mmol),四(三苯基膦)钯0.05 g(0.043 mmol)和甲苯(8 mL),氮气保护下80 ℃加热反应8 h。降至室温后将反应液旋干、硅胶柱色谱纯化,可得到棕色油状液体N-环丙基-3-甲氧基苯胺。MS,m/z:164.14。
步骤二:取将步骤一得到的N-环丙基-3-甲氧基苯胺200 mg(1.23 mmol)溶解在冷的稀盐酸(2 mol/L)溶液5 mL 中,随后加入亚硝酸钠103 mg(1.49 mmol),冰水浴中搅拌反应2 h(控制反应液温度 < 5 ℃),反应结束后将反应液滴入饱和碳酸钾溶液中,再用乙酸乙酯萃取、无水硫酸钠干燥后,旋干得黄绿色固体N-环丙基-3-甲氧基-4-亚硝基苯胺。MS,m/z:192.09。
步骤三:间羟基-N,N-二乙基苯胺86 mg(0.52 mmol)溶 解 在i-PrOH-H2O(9∶1,4 mL)中80 ℃搅拌30 min 后,将N-环丙基-3-甲氧基-4-亚硝基苯胺100 mg(0.52 mmol)和高氯酸(70%,47 µL)的i-PrOH/H2O(9∶1,4 mL)溶液缓慢加到反应中,氮气保护下80 ℃反应8 h(反应体系由棕色渐变为绿色,最后变成深蓝色),反应完全后旋干、经硅胶柱色谱纯化,得YQN-3(40 mg,收率24.9%),深蓝色固体,经质谱、核磁氢谱确证结构。MS,m/z:308.22,1H NMR(400 MHz,DMSO-d6)δ:9.53(s,1H),7.87 ~ 7.77(m,1H),7.77 ~ 7.67(m,1H),7.49 ~ 7.40(m,1H),7.16 ~ 7.08(m,1H),7.05(s,1H),7.00 ~ 6.89(m,1H),3.76(q,J= 7.0 Hz,4H),2.94 ~ 2.84(m,1H),1.26(t,J= 7.1 Hz,6H),1.01 ~ 0.94(m,2H),0.72 ~ 0.65(m,2H)。如图1和图2所示。

Scheme 1 Synthetic route of YQN-3-YQN-6

Figure 1 Mass spectra of YQN-3
2.1.2 YQN-4的合成
化合物YQN-4 的合成参考YQN-3 合成,其中在步骤一中以环丁胺代替环丙胺进行反应,得到N-环丁基-3-甲氧基苯胺,后续合成方法参考YQN-3 合成中的步骤二、三,最终得目标化合物YQN-4(40 mg,收率23.8%),深蓝色固体,经质谱、核磁氢谱确证结构。MS,m/z:322.21,1H NMR(400 MHz,
DMSO-d6)δ:9.67(d,J= 6.5 Hz,1H),7.79(d,J= 9.4 Hz,1H),7.73(d,J= 9.3 Hz,1H),7.47 ~ 7.33(m,1H),7.15(d,J= 9.3 Hz,1H),6.97(s,1H),6.67(s,1H),4.44 ~ 4.24(m,1H),3.74(q,J= 7.1 Hz,4H),2.49 ~ 2.39(m,2H),2.09(p,J= 9.6 Hz,2H),1.84(q,J= 9.1,8.6 Hz,2H),1.25(t,J= 7.0 Hz,6H)。如图3和图4所示。
2.1.3 YQN-5的合成
2.1.4 YQN-6的合成2H),3.74(q,J= 7.1 Hz,5H),2.04 ~ 1.89(m,2H),1.83 ~ 1.71(m,2H),1.69 ~ 1.55(m,1H),1.53 ~ 1.26(m,6H),1.26 ~ 1.16(m,6H)。如图7和图8所示。
化合物YQN-6 的合成参考YQN-3 合成,其中在步骤一中以环己胺代替环丙胺进行反应,得到N-环己基-3-甲氧基苯胺,后续合成方法参考YQN-3 合成中的步骤二、三,最终得目标化合物YQN-6,深蓝色固体,经质谱、核磁氢谱确证结构(47 mg,收 率25.8%)。 MS,m/z:350.24,1H NMR(400 MHz,DMSO-d6)δ:9.39(s,1H),7.80(d,J= 9.5 Hz,1H),7.73(d,J= 9.5 Hz,1H),7.38(d,J= 8.9 Hz,1H),7.19(d,J= 9.4 Hz,1H),7.07 ~ 6.75(m,

Figure 2 1H NMR spectra of YQN-3

Figure 3 Mass spectra of YQN-4
2.1.5 荧光染料YQN-3等的光谱特性用乙腈将荧光染料YQN-3 ~ YQN-6 配成浓度125 µmol/L 溶液备用。分别用紫外可见分光光度计和荧光光谱仪测定这4 种荧光染料的紫外和荧光光谱(比色皿:1.0 cm,石英,四通),确定各染料的最大吸收波长和最大发射波长。
2.2 荧光染料YQN-3等活体神经显像和毒性研究
2.2.2 YQN-3 在术中喉返神经荧光成像 上述研究结果表明,YQN-3 具有最好的神经组织靶向能力,组织背景信号最低,可进一步开发应用于手术过程中神经组织荧光成像,有效避免神经损伤而导致功能性损伤。
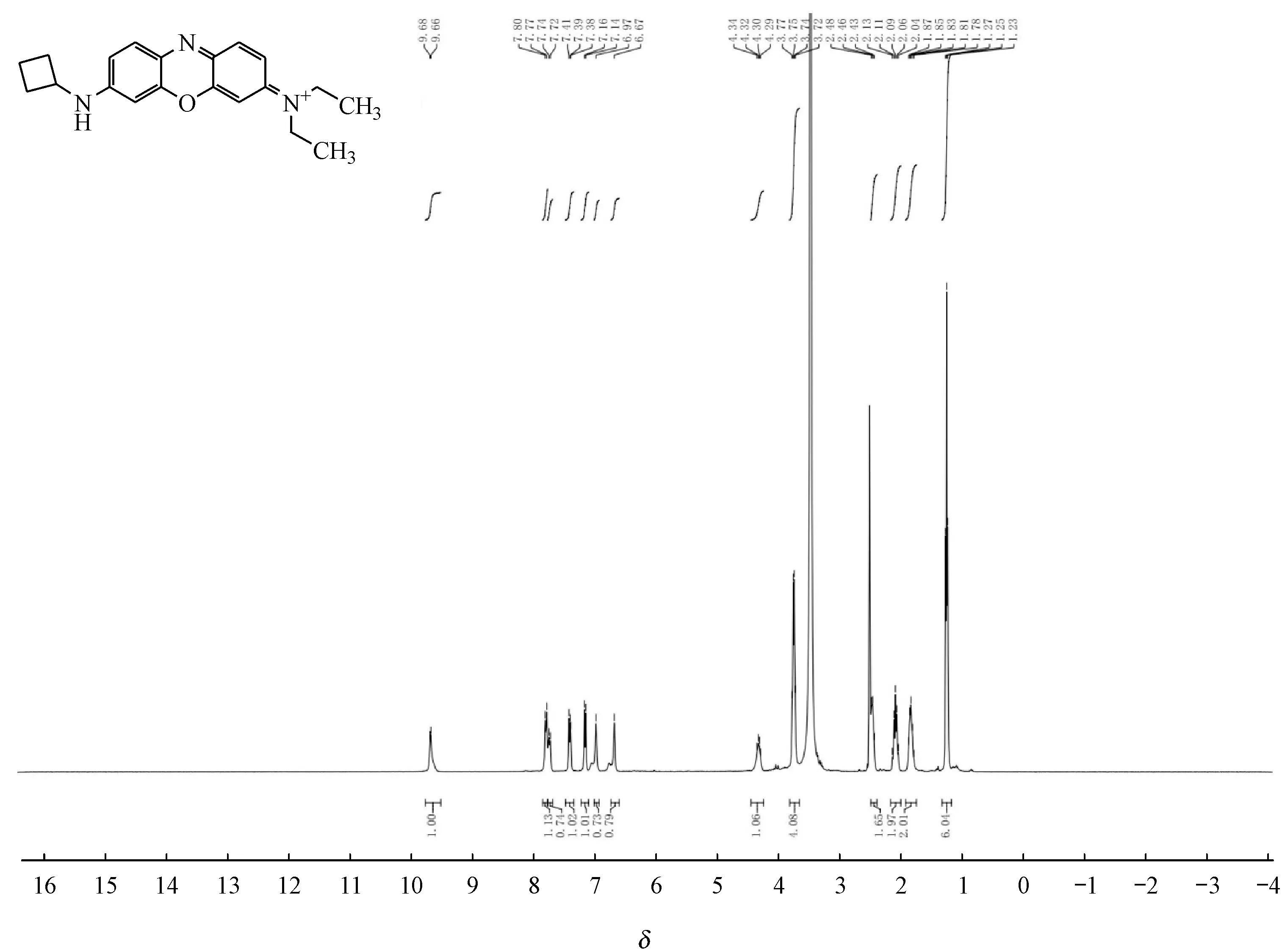
Figure 4 1H NMR spectra of YQN-4

Figure 5 Mass spectra of YQN-5
在大鼠甲状腺手术切除过程中,YQN-3 按1.54 mg/kg 剂量给药4 h 后,对大鼠甲状腺附近的脂肪、肌肉组织进行剥离,暴露出甲状腺和喉返神经,在大鼠甲状腺手术切除过程中,YQN-3 能有效地显示喉返神经,对其神经组织完整性进行检视,后续对荧光部位进行切除经组织病理HE染色。

Figure 6 1H NMR spectra of YQN-5

Figure 7 Mass spectra of YQN-6
3 结果与讨论
3.1 YQN-3等设计思路与结构确证
利用生物电子等排体在荧光染料嗪4 的结构基础上进行修饰得到的,即以环丙烷、环丁烷、环戊烷和环己烷对乙基进行替换得到化合物YQN-3、YQN-4、YQN-5、YQN-6。在不改变嗪母环的结构基础上进行官能团替换,旨在提高染料对神经组织的靶向能力,制备得到的YQN-3等化合物都经质谱、核磁氢谱确证结构(如图1 ~ 图8所示)。
3.2 YQN-3等的光谱性质
在乙腈中测定YQN-3 等的紫外吸收光谱和荧光发射光谱。YQN-3 等的最大吸收波长在630 nm左右,如图9 所示;最大荧光发射波长在645 nm 左右,如图10所示。因此,YQN-3等具有较长的发射波长,适合用于活体显像。
3.3 YQN-3等在体神经显像
如图11所示,在嗪4、YQN-3、YQN-4、YQN-5和YQN-6 的大鼠臂丛神经和坐骨神经显像中,YQN-3 表现出最强的神经特异性,具有最强的神经荧光信号和最低的背景吸收(脂肪和肌肉组织),随着取代环烷基环的增大,神经靶向能力减弱,肌肉和脂肪分布增加。因此,选YQN-3 作为候选化合物做进一步研究。

Figure 8 1H NMR spectra of YQN-6

Figure 9 Absorption spectra of fluorescent dyes YQN-3-YQN-6

Figure 10 Emission spectra of fluorescent dyes YQN-3-YQN-6
3.4 YQN-3在甲状腺再次手术中的成像
YQN-3 具有良好的神经靶向能力,能很好地显示神经组织,可用于术中神经造影和检视。在甲状腺切除手术过程中,甲状腺切除前后,可以利用YQN-3 对喉返神经进行检视,能有效避免手术过程对神经造成损伤,同时还能在术后对神经进行检视,进行有效预后。最后,将术后荧光信号部位进行切除,经病理组织HE 染色分析,结果显示为神经组织。结果如图12所示。
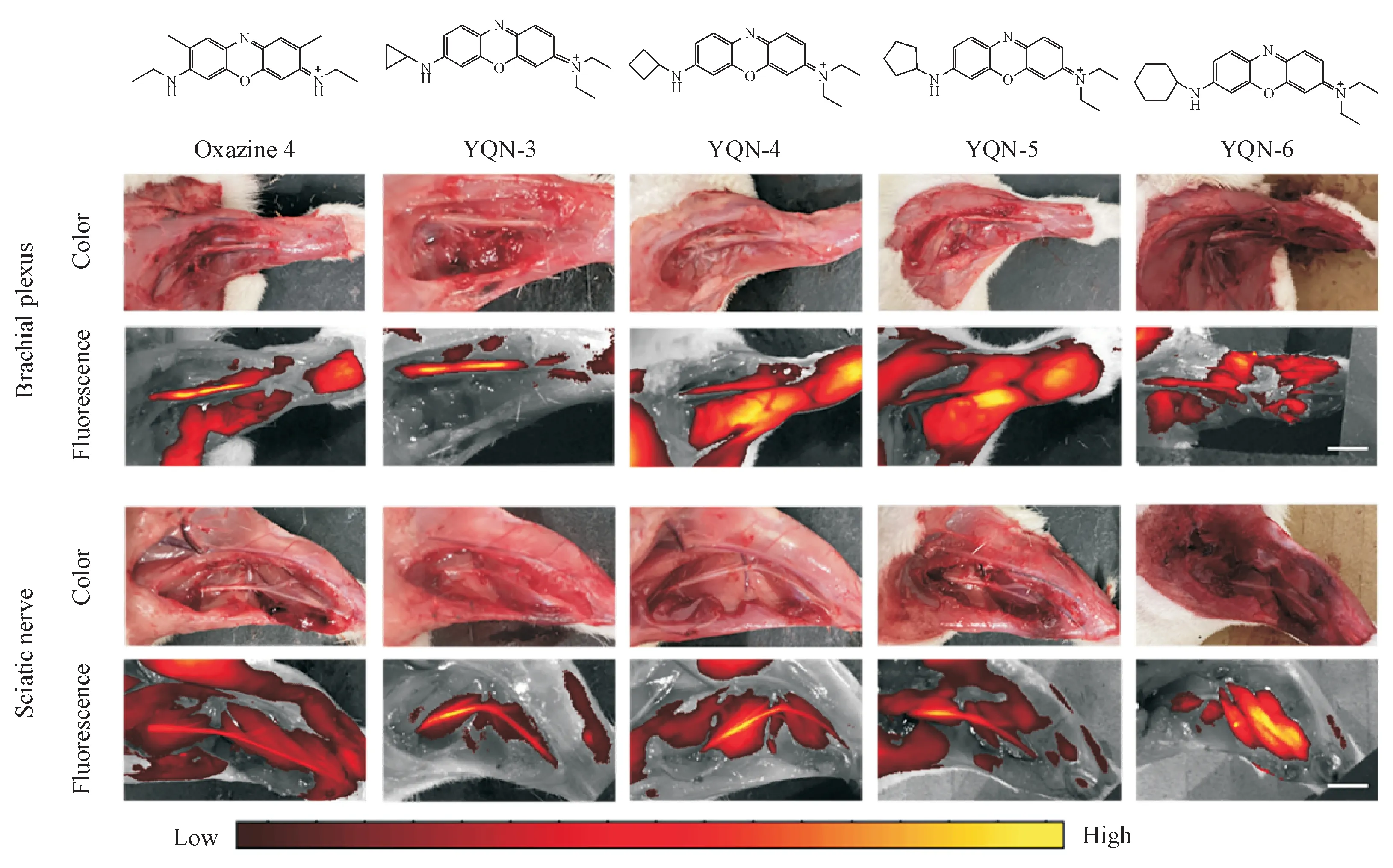
Figure 11 In vivo nerve imaging of oxazine 4, YQN-3, YQN-4, YQN-5 and YQN-6 (scale: 5 mm)

Figure 12 Imaging of YQN-3 in thyroid operation
3.5 YQN-3体外毒性研究
以嗪4为阳性对照,在0.01、0.05、0.1、0.2、0.3 mg/mL 质量浓度范围内,在低于0.2 mg/mL 质量浓度的YQN-3和嗪4几乎没有细胞毒性(细胞存活率均高于75%),结果如图13 所示,因此,YQN-3 具有良好的安全性,可进一步开发应用于临床神经显像。
4 结论与展望
本文设计并合成了4个嗪类荧光染料YQN-3 ~ YQN-6,其结构经质谱、核磁氢谱确证;YQN-3等在630 nm 左右有着最大吸收,在645 nm 左右有最大发射波长。进一步在臂丛神经和坐骨神经显像中,YQN-3 表现出最强的神经靶向能力和最低的背景吸收,还能用于甲状腺手术切除过程中,对神经组织进行有效检视和保护,同时具有良好的安全性,具有潜在的临床神经显像应用前景。
本研究工作仍有需要进一步研究加以改善的地方:(1)YQN-3 神经染料的发射波长较短,穿透深度有限。手术过程中先将神经解剖后才能有效成像,具有较大的局限性,无法契合临床需求,需提高神经染料的发射波长;(2)荧光探针的给药途径应根据探针的光学特性、成像系统的性能以及手术期间的实际情况仔细考虑。例如,在头颈部肿瘤切除过程中,需要突出显示所有神经,以避免任何神经损伤。但是,在某些情况下,如根治性前列腺切除术,不可能保留所有周围的神经组织;由于前列腺内广泛的神经荧光,全身系统性使用探针可能会降低最重要海绵体神经的信噪比。因此,在手术前需要合理评估选择最适合的给药途径来实现想要的识别和保留神经的效果。

Figure 13 Cytotoxicity test of YQN-3 and oxazine 4 on U87 cells

