新型三氟甲基查耳酮类衍生物的设计、合成及体外抗宫颈癌活性
玉苏普瓦吉木·阿力木江,艾孜提艾力·艾海提,木合布力·阿布力孜,杨 争,赛力克阿拉·阿里汗,刘正叶
(新疆医科大学药学院,乌鲁木齐 830011)
宫颈癌是一种全球性妇科肿瘤,其发病率和死亡率在女性恶性肿瘤中均居于第4 位[1-2]。据最新统计资料显示,我国每年新增宫颈癌患者达13万,严重威胁女性健康和生命安全[3-4]。目前对于宫颈癌的治疗主要以放疗、化疗和手术为主[5]。宫颈癌的化疗中,由于化疗药物的选择性差,全身性不良反应较严重,并容易产生耐药,成为导致疗效不理想、影响患者5年生存率的主要原因[6]。以肿瘤细胞信号通路中的潜在治疗靶点为干预目标,用天然先导化合物的结构优化途径,研究发现新型有效低毒的抗肿瘤药物是当前新药研究的一个热点[7]。
转录因子p53是重要的促凋亡蛋白,参与包括细胞生长、周期阻滞、衰老或凋亡、调节肿瘤基质以及抑制肿瘤侵袭和转移等多个过程[8-9]。鼠双微粒体2(MDM2)作为p53 的负反馈调节因子,可以直接与p53 结合,从而降低p53 的稳定性,并使其降解[10-12],因此MDM2 被视为通过绑架p53 来抑制肿瘤细胞凋亡的致癌因子,受到关注。若能通过抑制剂来阻断MDM2-p53蛋白之间的相互作用,下调MDM2 的表达,取消MDM2 对促凋亡蛋白p53 的绑架作用,则可以使p53 从MDM2 上游离出来,恢复和激活p53 的抑癌功能,这是通过干预Akt-MDM2-p53 通路,促进肿瘤细胞凋亡来增强抗肿瘤作用的重要途径[13-14]。
查耳酮类化合物是存在于甘草、明日叶等植物中的多酚类黄酮物质,具有1,3-二苯基丙烯酮结构骨架[15],分子具有较好的可塑性,并有一定的抗肿瘤活性[16-18]。近期研究显示,有些查耳酮类衍生物对p53 和MDM2 介导的信号通路或靶点能产生影响[19-20]。本课题组由此得到启发,在天然查耳酮类的抗肿瘤活性筛选中发现,甘草特殊品种胀果甘草中的查耳酮成分甘草查耳酮B 对MDM2 蛋白表达产生较明显的下调作用,具有可深入研究的潜力[21]。查耳酮结构骨架和甘草查耳酮B 的结构式如图1所示。
Figure 1 Chemical structures of chalcone and licochalcone B
含氟官能团在药物结构修饰中的优势越来越得到关注。三氟甲基作为一种含氟官能团,因其电负性较高,能增加分子的亲脂性,提高与靶点的亲和力,提高代谢稳定性,增强药物的生物利用度,从而得到重视[22-23]。
本课题组在前期研究中,对查耳酮骨架通过氯代、甲氧基化、α-甲基化修饰等途径得到抗宫颈癌活性较高的抗肿瘤化合物[24]。本研究在前期研究基础上,以甘草查耳酮B 为先导化合物骨架结构,经在其B 环上引入三氟甲基、α-位甲基,A 环上引入甲氧基等途径,设计并合成了15 个全新三氟甲基查耳酮类衍生物,经对多种宫颈癌细胞的抗肿瘤活性实验,筛选出对宫颈癌细胞具有显著的增殖抑制、促进凋亡、抗癌迁移侵袭特点的候选药物,并通过对正常细胞的毒性初步评估安其全性;与此同时,通过计算机辅助的分子对接技术,研究候选药物对肿瘤细胞Akt-MDM2-p53 通路中的MDM2蛋白靶点的亲和力特征,探讨初步可能的作用机制,为新型查耳酮类抗宫颈癌候选药物筛选奠定一定的基础。
1 材 料
1.1 药品与试剂
顺铂对照品(美国AbMole 公司);MDM2 拮抗剂Nutlin-3a(上海MCE 公司);其余试剂和溶剂均购自商业来源,无需进一步纯化即可使用;胎牛血清(美国Sigma 公司);青霉素/链霉素溶液、胰酶、DMEM培养基(美国HyClone公司)。
1.2 仪 器
WRX-4 显微熔点仪(宁波科诚仪器有限公司);LTQ-Orbitrap XL 赛默飞组合式高分辨质谱仪(美国Thermo Fisher 公司);ZF-7 型暗箱三用紫外分析仪(上海嘉鹏科技有限公司);SOPTOP 型倒置显微镜(宁波舜宇仪器公司);Victor nivo 多功能酶标仪(美国珀金埃尔默有限公司);BD 流式细胞仪(美国BD 公司);人宫颈癌细胞HeLa、SiHa、C-33A、人宫颈上皮永生化细胞H8,人类永生化表皮细胞HaCaT 均由新疆医科大学中心实验室惠赠。
2 目标化合物的合成
将化合物1(5 mmol)和化合物2(5 mmol)在无水乙醇(12.5 mL)中溶解,缓慢滴加氢氧化钾溶液(质量分数40%)2.5 mL,反应液于室温条件下搅拌反应,TLC 监测反应进程,反应完成后用稀盐酸调节pH 至1.0 ~ 2.0,过滤,用冷无水乙醇多次冲洗纯化,粗产物干燥后,加入少量无水乙醇加热溶解,进行重结晶,或者用硅胶柱色谱进行分离(流动相为乙酸乙酯-石油醚)得到目标化合物3a ~ 3o。目标化合物的合成路线如图2所示。
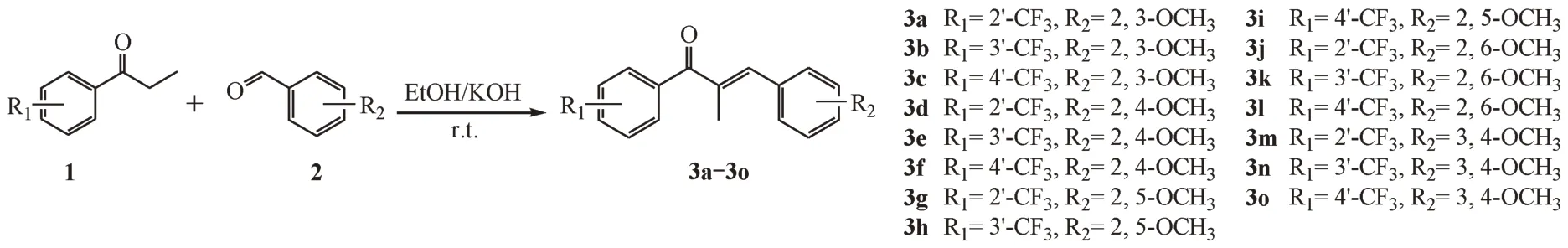
Figure 2 Synthetic route of compounds 3a-3o
2.1 目标化合物的抗肿瘤活性
2.1.1 抗细胞增殖活性实验 以查耳酮、顺铂和Nutlin-3a 作为阳性对照,采用MTT 法测定目标化合物3a ~ 3o 对HeLa、SiHa、C-33A、H8 以及HaCaT细胞的增殖抑制活性。分别将处于对数生长期的细胞以每孔5 000 ~ 8 000 个细胞的密度接种在96孔板上。在37 ℃、体积分数为5% CO2的细胞培养箱中培养12 h 后,弃去培养基,将不同浓度(0、6.25、12.5、25、50、100 µmol/L)的化合物加入96孔板中,每个浓度设6 个复孔。药物作用48 h 后,每孔加5 mg/mL MTT 溶液20 µL,在37 ℃、体积分数5%的CO2培养箱中孵育4 h,移除培养基和MTT,每孔加入DMSO 150 µL 以溶解甲臜,振荡均匀。使用多功能酶标仪在490 nm 波长下测量吸收度。通过吸收度计算出细胞增殖抑制率。化合物活性以半数抑制浓度IC50来表达。
2.1.2 细胞迁移侵袭实验 细胞迁移实验采用Transwell 小室实验法进行检测。取对数生长期的HeLa细胞,制成每毫升2 × 105个细胞的悬液,分别给予0(空白对照组)、6.25、12.5 µmol/L 的化合物3n 刺激,每个浓度设置3 个平行组。分别取上述给药后的细胞悬液200 µL加入到Transwell小室上层,下层中加入含20%胎牛血清的培养基600 µL。将细胞侵袭小室置于培养箱中培养24 h,上室用PBS 洗3次,4%多聚甲醛固定30 min,1%结晶紫染色30 min,晾干,于倒置显微镜下观察穿过基底膜的侵袭细胞。每个样本计数5个视野,取平均值作为检测结果。实验重复3次。
细胞侵袭实验:Transwell 上室先用基质胶(基质胶与PBS 体积比为1∶8)50 µL 铺胶,将细胞侵袭小室置于培养箱中,将Matrigel 烘干。后续实验步骤同“细胞迁移实验”。
2.1.3 细胞凋亡实验 采用AnnexinⅤ-FITC/PI双染色法进行检测。取对数生长期的HeLa 细胞,常规制备细胞悬液后,将细胞以每孔2 × 105个的密度接种于6 孔板中,并用不同浓度的化合物3n处理24 h 后,收集、洗涤细胞,先后加入Annexin Ⅴ-FITC、PI 试剂各5 µL,混匀,于室温下避光孵育15 min 后,采用流式细胞仪检测细胞凋亡情况,并通过Flow Jo 10 软件分析各组细胞的凋亡率。实验重复3次。
2.1.4 细胞周期阻滞实验 采用流式细胞术进行检测。取对数生长期的HeLa 细胞,常规制备细胞悬液后,将细胞以每孔1 × 106个的密度接种于6 孔板中,并用不同浓度的化合物3n 处理24 h 后,收集、洗涤细胞,在4 ℃下用70%乙醇固定24 h。用预冷的PBS 洗细胞3 遍,除去残留的乙醇,加入PI/RNase A 染色液500 µL,室温下避光孵育30 min进行染色,用流式细胞仪检测样本的DNA 含量,并通过Flow Jo 10 软件分析细胞周期分布。实验重复3次。
2.2 分子对接实验
为了预测化合物与MDM2 蛋白可能的结合模式,本研究将一种表现良好且有选择性的化合物3n 用于分子对接研究。采用Chem Bio3D Ultra 14.0 绘制目标化合物结构并进行能量最小化,保存为mol2 格式。将优化的目标化合物导入 AutodockTools 1.5.6 进行加氢、计算并分配电荷、设置可旋转键后保存为“pdbqt”格式。从PDB数据库下载MDM2 蛋白(PDB ID:5TRF),使用PyMoL(2.3.0)去除水分子,将蛋白导入AutoDocktools 1.5.6 进行加氢、计算并分配电荷、指定原子类型并保存为“pdbqt”格式。采用AutodockVina 1.1.2进 行 对 接,利 用PyMOL 2.3.0、Discovery Studio2016对结果进行相互作用分析。
3 结果与讨论
3.1 目标化合物的合成
本研究以甘草查耳酮B 为先导化合物,设计15 种氟代查耳酮衍生物的结构,并通过类似的合成路线制备各衍生物,即在课题组前期研究的基础上,以无水乙醇为溶剂,氢氧化钾为催化剂的条件下,对三氟甲基苯丙酮和甲氧基取代苯甲醛类化合物通过Claisen-Schmidt 缩合反应得到目标化合物3a ~ 3o,其结构经1H NMR、13C NMR 和HRMS(ESI)表征。
3.2 谱图解析
α-甲基-2'-三氟甲基-2,3-二甲氧基查耳酮(3a)白色结晶,收 率72.1%。 mp:126.3 ~ 126.7 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 0(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.90(d,J= 7.8 Hz,1H,C3‘-H),7.86 ~ 7.71(m,2H,C4‘-H,C5‘-H),7.59(d,J= 7.5 Hz,1H,C6‘-H),7.22 ~ 7.08(m,4H,C4-H,C5-H,C6-H,β-H),3.81(s,3H,C2-OCH3),3.52(s,3H,C3-OCH3),2.14(d,J= 1.4 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ: 197.83,152.93,147.60,141.27,138.80,137.95,132.60,130.44,129.22,128.76(2C),126.98,126.93,124.56,121.71,114.68,60.82,56.17,13.04。
α-甲基-3'-三氟甲基-2,3-二甲氧基查耳酮(3b)白色结晶,收 率56.2%。mp:123.7 ~ 125.1 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:8.07 ~ 7.98(m,3H,C2‘-H,C4‘H,C5‘-H),7.81(t,J= 7.9 Hz,1H,C6‘-H),7.28(s,1H,β-H),7.22 ~ 7.07(m,3H,C4-H,C5-H,C6-H),3.84(s,3H,C2-OCH3),3.66(s,3H,C3-OCH3),2.13(t,J= 1.1 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.40,152.90,147.48,139.43,138.58,136.84,133.22,130.18,129.48,128.68,128.65,125.99,125.95,124.42,121.75,114.33,60.71,56.18,14.32。
α-甲基-4'-三氟甲基-2,3-二甲氧基查耳酮(3c)白色固体,收 率42.7%。mp:124.9 ~ 125.7 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.92(s,4H,C2‘-H,C3‘-H,C5‘-H,C6‘-H),7.31(d,J= 1.7 Hz,1H,β-H),7.23 ~ 7.06(m,3H,C4-H,C5-H,C6-H),3.84(s,3H,C2-OCH3),3.66(s,3H,C3-OCH3),2.14(d,J= 1.4 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ: 197.79,152.92,147.50,142.39,139.13,136.90,130.17(2C),129.49,125.75(2C),125.71(2C),124.41,121.78,114.34,60.84,56.16,14.17。
α-甲基-2'-三氟甲基-2,4-二甲氧基查耳酮(3d)黄色结晶,收率78.1%。mp:115.4~115.9 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.89 ~ 7.82(m,1H,C3‘-H),7.82 ~ 7.68(m,2H,C4‘-H,C5‘-H),7.48(dd,J= 17.3,8.0 Hz,2H,C6‘-H,C6-H),7.17(d,J= 1.6 Hz,1H,β-H),6.63(dd,J= 8.6,2.4 Hz,1H,C5-H),6.58(d,J= 2.4 Hz,1H,C3-H),3.81(s,3H,C2-OCH3),3.67(s,3H,C4-OCH3),2.11(d,J= 1.4 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ: 197.68,162.59,159.36,141.22,139.29,134.74,132.59,131.49,130.28,128.83(2C),126.94,126.90,116.45,105.78,98.77,56.25,55.88,13.31。
α-甲基-3'-三氟甲基-2,4-二甲氧基查耳酮(3e)黄色结晶,收 率69.8%。mp:114.3 ~ 125.7 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 2(Found)。1H NMR(400 MHz,DMSO-d6)δ:8.01(s,1H,C2‘-H),7.97(dd,J= 7.0,2.2 Hz,2H,C4‘-H,C5‘-H),7.89 ~ 7.73(m,1H,C6‘-H),7.47(dd,J= 8.5,2.2 Hz,1H,C6-H),7.32(d,J= 2.1 Hz,1H,β-H),6.75 ~ 6.60(m,2H,C3-H,C5-H),3.84(s,3H,C2-OCH3),3.74(s,3H,C4-OCH3),2.14(q,J= 1.4 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.28,162.28,159.27,139.92,139.16,133.75,133.41,131.27,130.05,128.31,128.27,126.03,125.99,116.66,105.57,98.67,56.03,55.80,14.24。
α-甲基-4'-三氟甲基-2,4-二甲氧基查耳酮(3f)黄色结晶,收 率75.9%。 mp:112.7 ~ 112.9 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 0(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.92 ~ 7.80(m,4H,C2‘-H,C3‘-H-,C5‘-H,C6‘-H),7.48(d,J= 8.5 Hz,1H,C6-H),7.30(d,J= 1.7 Hz,1H,β-H),6.69 ~ 6.59(m,2H,C3-H,C5-H),3.83(s,3H,C2-OCH3),3.74(s,3H,C4-OCH3),2.13(d,J= 1.4 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.71,162.34,159.25,143.04,139.64,133.96,131.46,130.11(2C),125.72(2C),125.68(2C),116.65,105.63,98.71,56.18,55.86,14.25。
α-甲基-2'-三氟甲基-2,5-二甲氧基查耳酮(3g) 淡黄色结晶,收率47.5%。mp:111.2 ~ 112.6 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.88(d,J= 7.7 Hz,1H,C3‘-H),7.83 ~ 7.69(m,2H,C4‘-H,C5‘-H),7.54(d,J= 7.4 Hz,1H,C6‘-H),7.14(d,J= 1.7 Hz,1H,β-H),6.98(dd,J= 5.1,2.3 Hz,3H,C3-H,C4-H,C6-H),3.75(s,3H,C2-OCH3),3.63(s,3H,C5-OCH3),2.12(d,J= 1.5 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.79,153.12,151.91,141.24,138.84,137.26,132.65,130.50,128.88(2C),127.02,126.98,124.38,116.47,115.66,112.86,56.54,55.98,13.25。
α-甲基-3'-三氟甲基-2,5-二甲氧基查耳酮(3h) 淡黄色结晶,收率54.1%。mp:111.3 ~ 112.3 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:8.05 ~ 7.97(m,3H,C2‘-H,C4‘-H,C5‘-H),7.79(t,J= 7.9 Hz,1H,C6‘-H),7.24(d,J= 1.7 Hz,1H,β-H),7.06 ~ 6.94(m,3H,C3-H,C4-H,C6-H),3.76(s,3H,C2-OCH3),3.71(s,3H,C5-OCH3),2.13(d,J= 1.4 Hz,2H,α-OCH3)。13C NMR(101 MHz,DMSO-d6)δ:197.33,153.11,151.85,139.41,138.75,136.13,133.60,130.21,128.73,128.69,126.21,126.17,124.67,115.85,115.83,112.54,56.33,55.97,14.32。
α-甲基-4'-三氟甲基-2,5-二甲氧基查耳酮(3i) 淡黄 色结 晶,收率72.1%。mp:113.8 ~ 113.7 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.90(s,4H,C2‘-H,C3‘-H,C5‘-H,C6‘-H),7.25(d,J= 1.7 Hz,1H,β-H),7.05(d,J= 2.3 Hz,1H,C6-H),6.99(d,J= 2.5 Hz,2H,C3-H,C4-H),3.77(s,3H,C2-OCH3),3.71(s,3H,C5-OCH3),2.13(d,J= 1.4 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.70,153.11,151.80,142.44,139.31,136.32,130.28(2C),125.80(2C),125.76(2C),124.65,115.94,115.90,112.58,56.39,55.97,14.26。
α-甲基-2'-三氟甲基-2,6-二甲氧基查耳酮(3j) 白 色 粉 末,收 率82.4%。 mp:117.3 ~ 117.8 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 0(Found)。1H NMR(400 MHz,DMSO-d6)δ: 7.87(d,J= 7.8 Hz,1H,C3‘-H),7.83 ~ 7.68(m,2H,C4‘-H,C5‘-H),7.51(d,J= 7.5 Hz,1H,C6‘-H),7.34(t,J= 8.3 Hz,1H,C4-H),6.84(s,1H,β-H),6.69(dd,J= 8.5,1.1 Hz,2H,C3-H,C5-H),3.75(d,J= 1.1 Hz,6H,C2-OCH3,C6-OCH3),1.78(t,J= 1.3 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.53,157.56(2C),139.94,139.38,138.95,132.56,131.46,130.40,128.78(2C),127.03,126.98,112.27,104.40(2C),56.13(2C),14.34。
α-甲基-3'-三氟甲基-2,6-二甲氧基查耳酮(3k) 白 色 结 晶,收 率78.1%。mp:115.7 ~ 116.8 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 0(Found)。1H NMR(400 MHz,DMSO-d6)δ:8.08 ~ 7.97(m,3H,C2‘-H,C4‘-H,C5‘-H),7.81(t,J= 7.7 Hz,1H,C6‘-H),7.36(t,J= 8.4 Hz,1H,C4-H),6.98 ~ 6.93(m,1H,β-H),6.74(d,J= 8.4 Hz,2H,C3-H,C5-H),3.81(s,6H,C2-OCH3,C6-OCH3),1.82 ~ 1.78(m,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ: 197.09,157.56(2C),139.30,137.93,136.86,133.56,131.11,130.29,128.85,128.81,126.26,126.22,112.42,104.41(2C),56.10(2C),15.37。
α-甲基-4'-三氟甲基-2,6-二甲氧基查耳酮
(3l) 白 色 结 晶,收 率85.4%。 mp:117.5 ~ 118.2 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.91(d,J= 2.3 Hz,4H,C2‘-H,C3‘-H,C5‘-H,C6‘-H),7.37(t,J= 8.4 Hz,1H,C4-H),6.98(s,1H,β-H),6.73(d,J= 8.4 Hz,2H,C3-H,C5-H),3.81(s,6H,C2-OCH3,C6-OCH3),1.81(s,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ: 197.39,157.56(2C),142.34,138.05,137.65,131.18,130.29(2C),125.83(2C),125.79(2C),112.43,104.38(2C),56.14(2C),15.16。
α-甲基-2'-三氟甲基-3,4-二甲氧基查耳酮(3m) 白色块状固体,收率54.8%。mp:116.3 ~ 116.9 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 2(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.88(d,J= 7.8 Hz,1H,C3‘-H),7.77(dt,J= 25.2,7.5 Hz,2H,C4‘-H,C5‘-H),7.56(d,J= 7.5 Hz,1H,C6‘-H),7.14 ~ 7.06(m,2H,C2-H,C6-H),7.06 ~ 6.99(m,2H,C5-H,β-H),3.81(d,J= 13.2 Hz,6H,C3-OCH3,C4-OCH3),2.27(d,J= 1.3 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.66,150.54,149.03,146.15,139.11,135.10,132.64,130.26,128.86(2C),127.88,126.98,126.93,124.28,113.94,111.89,55.90,55.88,13.21。
α-甲基-3'-三氟甲基-3,4-二甲氧基查耳酮(3n) 白色块状固体,收率48.9%。mp:115.0 ~ 115.9 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:8.01 ~ 7.92(m,3H,C2‘-H,C4‘-H,C5‘-H),7.77(t,J= 7.7 Hz,1H,C6‘-H),7.21 ~ 7.10(m,3H,C2-H,C6-H,β-H),7.05(d,J= 8.3 Hz,1H,C5-H),3.79(d,J= 14.8 Hz,6H,C3-OCH3,C4-OCH3),2.24(d,J= 1.3 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ: 197.58,150.21,148.96,143.94,140.08,134.26,133.46,130.06,128.37,128.34,128.19,125.80,125.76,124.00,114.09,112.01,56.02,55.97,14.54。
α-甲基-4'-三氟甲基-3,4-二甲氧基查耳酮(3o) 白色块状固体,收率58.2%。mp:115.5 ~ 116.2 ℃;HRMS(ESI)m/z:C19H17F3O3Na+[M+Na]+373.102 2(Calcd.),373.102 1(Found)。1H NMR(400 MHz,DMSO-d6)δ:7.87(q,J= 8.3 Hz,4H,C2‘-H,C3‘-H,C5‘-H,C6‘-H),7.20 ~ 7.10(m,3H,C2-H,C6-H,β-H),7.04(d,J= 8.4 Hz,1H,C5-H),3.79(d,J= 15.0 Hz,6H,C3-OCH3,C4-OCH3),2.23(d,J= 1.3 Hz,3H,α-CH3)。13C NMR(101 MHz,DMSO-d6)δ:197.91,150.24,148.95,144.45,142.99,134.24,130.10(2C),128.17,125.82(2C),125.78(2C),124.03,114.20,111.97,56.01,55.99,14.38。
3.3 目标化合物的抗肿瘤活性
3.3.1 细胞增殖抑制活性实验 以3种宫颈癌细胞(HeLa,SiHa,C-33A)和两 种正 常 细 胞(H8,HaCaT)为受试细胞,查耳酮、顺铂、Nutlin-3a 作为阳性对照,通过MTT 法进行了体外抗肿瘤活性评价,结果如表1。结果显示,目标化合物对3种肿瘤细胞呈现出不同程度的抑制活性。其中化合物3n对HeLa细胞的抗肿瘤活性最强,其对HeLa细胞的IC50为(11.69 ± 2.05)µmol/L,优于对照药物,与查耳酮母核相比活性提高了5倍左右。随后,测试了目标化合物对H8 细胞和HaCaT 细胞的毒性,以此来评价目标化合物的安全性。化合物3n对正常细胞的毒性均低于阳性对照药顺铂,表明这些化合物对正常细胞具有较好的安全性,显示出较强的体外抗宫颈癌细胞增殖的能力以及较强的选择性。化合物3n作为一个有潜力的抗宫颈癌候选化合物值得进一步的深入研究。
Table 1 Anti-tumor activity of compounds 3a-3o (± s, n = 3)
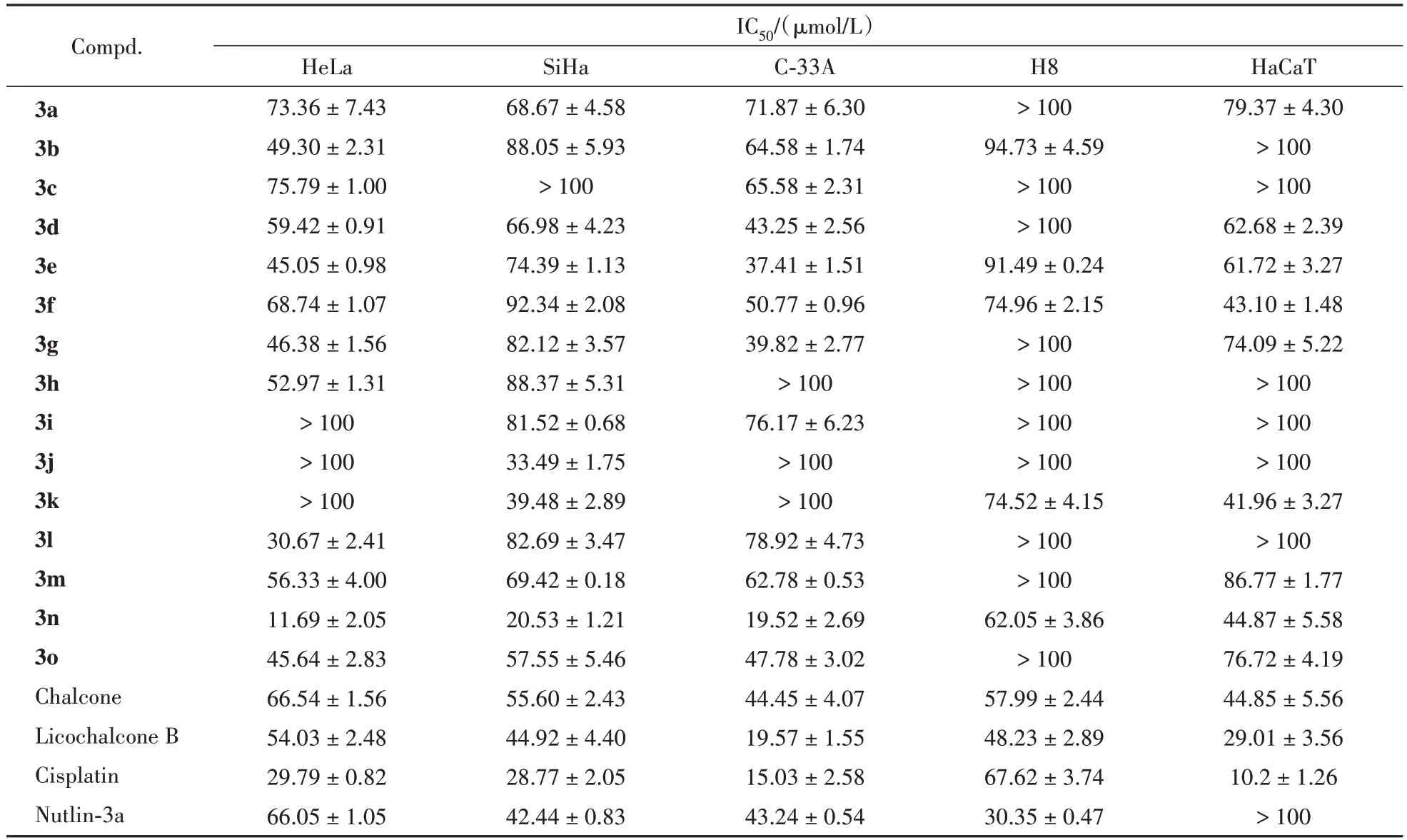
Table 1 Anti-tumor activity of compounds 3a-3o (± s, n = 3)
Compd.3a 3b 3c 3d 3e 3f 3g 3h 3i 3j 3k 3l 3m 3n 3o Chalcone Licochalcone B Cisplatin Nutlin-3a IC50/(µmol/L)HeLa 73.36 ± 7.43 49.30 ± 2.31 75.79 ± 1.00 59.42 ± 0.91 45.05 ± 0.98 68.74 ± 1.07 46.38 ± 1.56 52.97 ± 1.31> 100> 100> 100 30.67 ± 2.41 56.33 ± 4.00 11.69 ± 2.05 45.64 ± 2.83 66.54 ± 1.56 54.03 ± 2.48 29.79 ± 0.82 66.05 ± 1.05 SiHa 68.67 ± 4.58 88.05 ± 5.93> 100 66.98 ± 4.23 74.39 ± 1.13 92.34 ± 2.08 82.12 ± 3.57 88.37 ± 5.31 81.52 ± 0.68 33.49 ± 1.75 39.48 ± 2.89 82.69 ± 3.47 69.42 ± 0.18 20.53 ± 1.21 57.55 ± 5.46 55.60 ± 2.43 44.92 ± 4.40 28.77 ± 2.05 42.44 ± 0.83 C-33A 71.87 ± 6.30 64.58 ± 1.74 65.58 ± 2.31 43.25 ± 2.56 37.41 ± 1.51 50.77 ± 0.96 39.82 ± 2.77> 100 76.17 ± 6.23> 100> 100 78.92 ± 4.73 62.78 ± 0.53 19.52 ± 2.69 47.78 ± 3.02 44.45 ± 4.07 19.57 ± 1.55 15.03 ± 2.58 43.24 ± 0.54 H8> 100 94.73 ± 4.59> 100> 100 91.49 ± 0.24 74.96 ± 2.15> 100> 100> 100> 100 74.52 ± 4.15> 100> 100 62.05 ± 3.86> 100 57.99 ± 2.44 48.23 ± 2.89 67.62 ± 3.74 30.35 ± 0.47 HaCaT 79.37 ± 4.30> 100> 100 62.68 ± 2.39 61.72 ± 3.27 43.10 ± 1.48 74.09 ± 5.22> 100> 100> 100 41.96 ± 3.27> 100 86.77 ± 1.77 44.87 ± 5.58 76.72 ± 4.19 44.85 ± 5.56 29.01 ± 3.56 10.2 ± 1.26> 100
3.3.2 构效关系研究 通过对甘草查耳酮骨架的结构修饰研究中发现,分子中A、B 环上取代基的种类特征对化合物的抗肿瘤活性影响较大。
(1)B 环不同部位有三氟甲基取代,对宫颈癌细胞增殖的抑制活性从强到弱依次为3‘-CF3、2‘-CF3、4‘-CF3,即B 环C3‘-位引入CF3的衍生物的抗肿瘤活性均较显著。3‘-CF3查耳酮类衍生物有化合物3b、3e、3h、3k和3n等5个化合物。
(2)化合物均为A 环上有双甲氧基的衍生物,通过双甲氧基的位置对HeLa 细胞增殖的抑制活性比较中发现如下特点:3,4-二OCH3> 2,4-二OCH3> 2,3-二OCH3> 2,5-二OCH3> 2,6-二OCH3),即两个甲氧基在A 环的3,4 位上时,活性较高。
另外,所有合成衍生物均为α,β-不饱和羰基共轭系统中的α-碳上引入甲基的化合物(根据前期构效关系研究经验而修饰得到,先导化合物LicoB 无此特征)。因此,总结以上特点,可将构效关系规律归纳如下:甘草查耳酮分子中,A 环的3,4位引入两个甲氧基、α,β-不饱和羰基的α-位上引入甲基,并在B 环3‘-位上引入强吸电子基团三氟甲基时,化合物的抗肿瘤活性显著增强(例如,化合物3n,IC50为11.69 µmol/L,为15 个衍生物中活性最强的化合物)。
3.3.3 细胞侵袭迁移实验 本研究通过Transwell 实验分别测定化合物3n 对HeLa 细胞迁移和侵袭的影响。结果表明,化合物3n对HeLa细胞迁移和侵袭有显著的抑制作用,与空白组相比,化合物3n 处理后的HeLa 细胞穿过小室膜的数量明显减少,细胞迁移和侵袭能力显著降低,具有统计学意义(P<0.05,P<0.01,图3 和图4),并且随着药物浓度的增加,穿过基质胶的细胞数量越少。说明化合物3n通过抑制HeLa细胞迁移和侵袭,从而发挥抗肿瘤作用。
3.3.4 细胞凋亡实验 使用细胞凋亡检测试剂盒进行了双参数细胞荧光分析。结果显示,与空白组相比,随着化合物3n 浓度的增加,细胞发生凋亡反应的比例显著性增加,具有统计学意义(P< 0.01,图5)。0、6.25、12.5、25 µmol/L 各给药组细胞发生凋亡的比率分别为(6.15 ± 0.92)%、(8.00 ± 0.42)%、(11.17 ± 0.06)%和(20.65 ± 0.64)%,结果说明化合物3n 通过促进HeLa 细胞凋亡反应进而发挥抗肿瘤作用。
3.3.5 细胞周期阻滞实验 细胞周期的有序发展是细胞增殖的决定性因素。选择目标化合物3h进一步评价其对HeLa 细胞的周期阻滞的影响。化合物3n 对HeLa 细胞作用24 h 检测对细胞周期的影响。结果显示(图6),化合物3n 对HeLa 细胞周期变化有明显影响,随着药物浓度变化,G2/M 期细胞逐渐增多,分别为(15.36 ± 2.54)%、(15.55 ± 2.06)%、(15.89 ± 3.00)%和(25.20 ± 3.70)%。这些结果提示,化合物3n能够将HeLa细胞阻滞于G2/M期,延长细胞周期,从而发挥抗肿瘤作用。
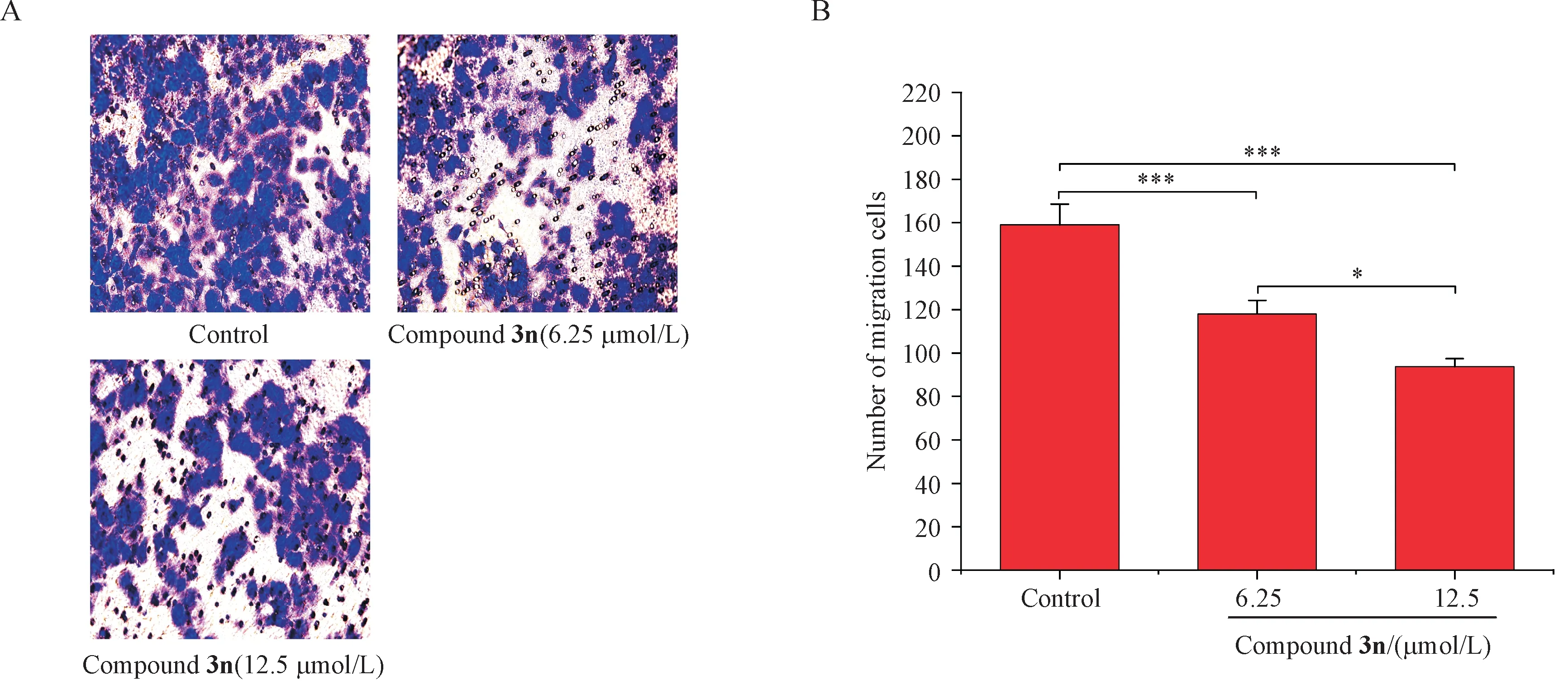
Figure 3 Effect of compound 3n on migration(×400) ability of HeLa cells (± s, n = 3)
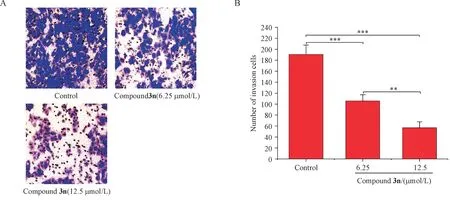
Figure 4 Effect of compound 3n on invasion ( × 400) ability of HeLa cells (± s, n = 3)
3.4 分子对接研究
通过Nutlin-3a、查耳酮母核、化合物3n 与MDM2 蛋白晶体结构进行分子对接(图7)。打分最高的构象显示Nutlin-3a、查耳酮母核、甘草查耳酮B、化合物3n 和MDM2 蛋白结合的最低能量分别为-36.4、-33.9、-37.6 和-38.1 kJ/mol(表2)。从二维示意图中可以直观地看出化合物3n能较好地结合于MDM2 蛋白的活性口袋内,与活性位点的结合以疏水相互作用为主。化合物3n的三氟甲基、甲氧基,苯环及α-甲基位于由MDM2 蛋白氨基酸残基ARG-105(B)、THR-101(A)、TYR-104(A)、ARG-105(A)、LEU-107(A)、VAI-109(A)、LYS-98(B)、GLU-95(B)所形成的疏水性口袋内,形成强烈的疏水性相互作用。此外化合物3n中的氟原子与MDM2 蛋白B 链上的第105 位精氨酸(ARG)形成一个氢键,此氢键作用有助于化合物3n 与MDM2蛋白的稳定结合。
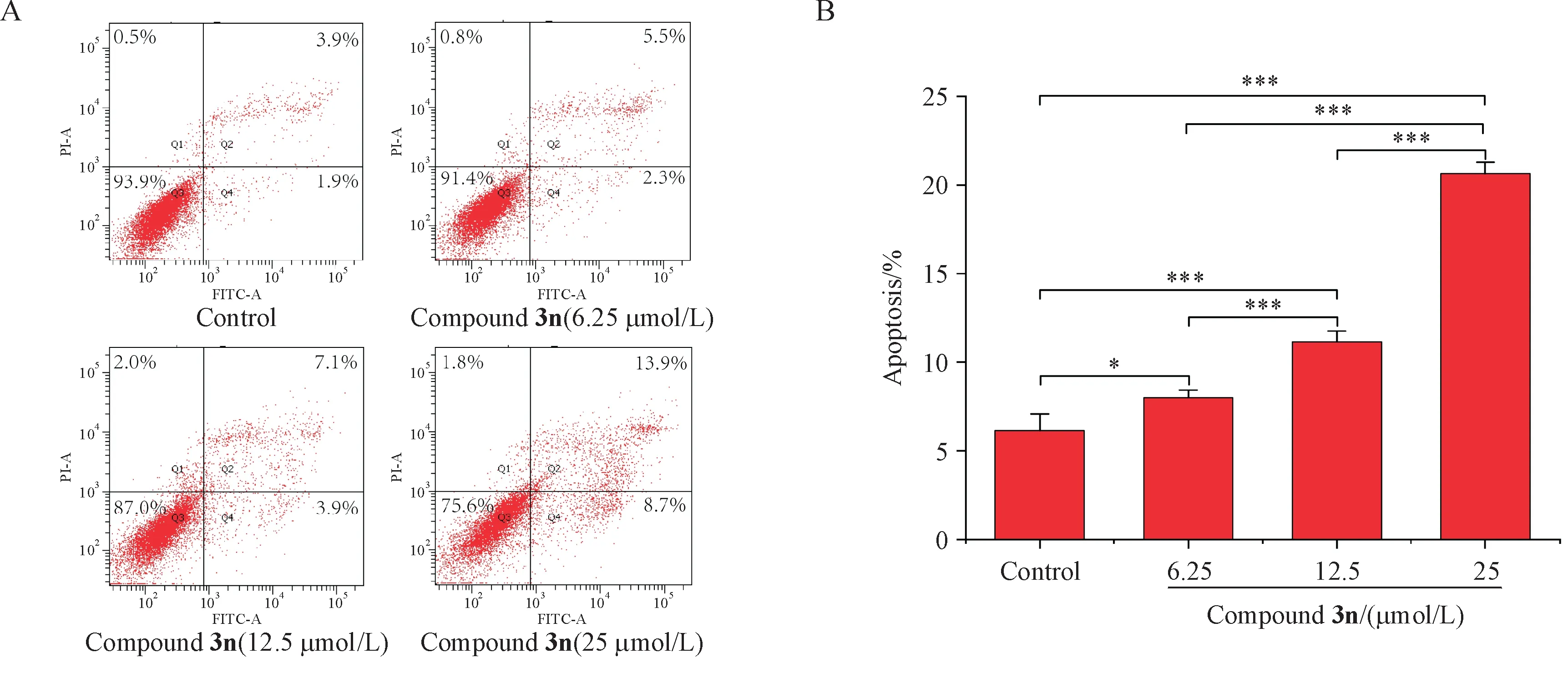
Figure 5 Effect of compound 3n on HeLa cell apotosis rate (± s, n = 3)
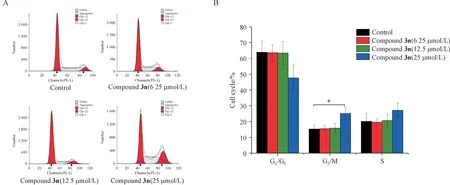
Figure 6 Effect of compound 3n on HeLa cell cycle arresting rate (± s, n = 3)
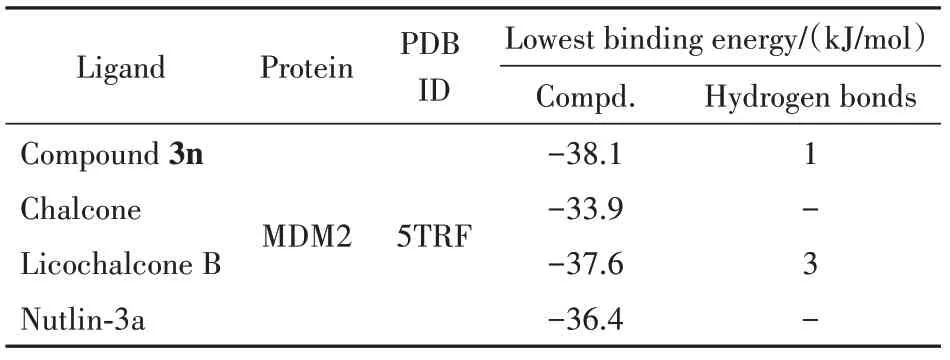
Table 2 Basic protein information and minimum binding energy for docking prediction
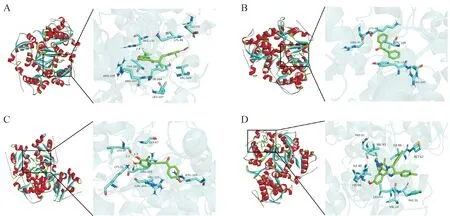
Figure 7 Docking results of Compound 3n and MDM2(A); Chalcone and MDM2(B); Licochalcone B and MDM2(C); Nutlin-3a and MDM2 (D)
4 结 论
宫颈癌的化疗中,化疗毒性一直是临床治疗的重要问题[25]。以肿瘤细胞信号通路中的潜在治疗靶点为干预目标,用天然先导化合物的结构优化途径,研究发现结构新颖的并有效低毒的抗肿瘤候选药物,是当前新药筛选中的一个重要途径[26]。
鼠双微粒体2(MDM2)作为一种泛素酶,通过跟促凋亡蛋白p53 形成MDM2-p53 复合物,绑架p53 并使其降解,从而降低癌细胞凋亡进程[27]。MDM2 的过度表达被认为是通过Akt-MDM2-p53信号通路中促癌的一种途径,因此MDM2 蛋白被认为潜在的新型抗肿瘤药物靶点。
本研究中,以甘草查耳酮B 位先导化合物,利用前期研究经验,将分子进行三氟甲基化、α-甲基化、甲氧基化等修饰,得到15种全新的氟代查耳酮衍生物。通过1H NMR、13C NMR 以及HRMS 方法鉴定化学结构。采用MTT 法检测了各化合物对HeLa、SiHa、C-33A 等3 种HPV 阳性和阴性宫颈癌细胞增殖的抑制活性;同时利用H8 和HaCaT 正常细胞评估化合物对正常细胞的初步毒性特征。通过简易的构效关系研究,筛选出化合物3n,并发现其对3 种宫颈癌细胞的抗增殖活性显著优于先导化合物查耳酮B、其他查耳酮类衍生物、阳性组顺铂及Nutlin-3a。化合物3n 对HeLa 细胞的活性最强(IC50=11.69 µmol/L),并对两种正常细胞的毒性较低,表现出较好的研究潜力。进一步的研究显
示,化合物3n 能够以浓度依赖的方式有效抑制HeLa 细胞的迁移侵袭,显著诱导HeLa 细胞凋亡,并将HeLa 细胞阻滞在G2/M 期,显示一定的浓度依赖性。实验结果显示,化合物3n 产生抗肿瘤作用的初步机制是通过抑制细胞活力、抑制增殖能力、抑制癌的迁移和侵袭、促进癌细胞凋亡等途径,并显示周期特异性抗肿瘤作用。分子对接结果显示,化合物3n能与MDM2蛋白有效结合(结合能为-38.1 kJ/mol),具有抑制MDM2 蛋白作用,值得深入研究。本研究为新型有效低毒的查耳酮类抗肿瘤候选药物筛选提供了实验依据。

