COVID-19鼻腔黏膜免疫疫苗的研究进展
吴雅琦,李 蒙,邢昊楠,陈大全,郑爱萍**
(1烟台大学药学院,烟台 264005;2军事科学院军事医学研究院毒物药物研究所,北京 100850)
2019年,由高传播性和致病致死性的新型冠状病毒严重急性呼吸综合征冠状病毒2 型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的COVID-19 疫情迅速蔓延全球,给人类的生命健康安全带来巨大威胁。截至目前,控制疫情和预防死亡的最佳策略仍然是接种疫苗,设计具有预防和治疗作用的新型疫苗迫在眉睫。
疫苗主要给药途径为肌肉注射、皮下注射或皮内注射,但注射人员须经专门培训,且注射有产生疼痛和急性感染的风险,患者依从性差,同时在应对SARS-CoV-2 等呼吸道病毒时不足以防止病毒传播。因此,探索疫苗递送的非侵入性给药途径具有必要性。黏膜免疫由于其独特的优势成为疫苗研究的热点,其中鼻腔免疫接种作为全身疫苗接种的替代方法,与注射给药相比,更为安全有效,可有效诱导免疫球蛋白A(immunoglobulin A,IgA),激发鼻腔和上呼吸道中的常驻记忆B 和T 细胞,进而产生细胞免疫、体液免疫及黏膜免疫三重免疫应答,阻止病毒的复制与传播[1-2]。本文概述SARS-CoV-2 的结构特征及鼻腔黏膜的免疫机制,并进一步阐述COVID-19 鼻腔黏膜免疫疫苗的种类及研究进展,为新型抗新冠疫苗研发奠定基础或提供依据。
1 SARS-CoV-2的结构特征
SARS-CoV-2 是一种单链正链RNA(+ssRNA)病毒,具有单一线性RNA 片段,属于冠状病毒家族。如图1所示,SARS-CoV-2主要由4种结构蛋白组成:刺突蛋白(spike protein,S)、包膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)和核衣壳蛋白(nucleocapsid protein,N)。N 蛋白包围病毒RNA,参与病毒的复制及释放;S、E 和M 蛋白形成病毒包膜,其中M 蛋白是最大的结构蛋白,E 蛋白对于病毒复制和成熟必不可少,而S蛋白则与病毒的传染能力密切相关,在病毒进入宿主细胞的过程中发挥关键作用[3-4]。
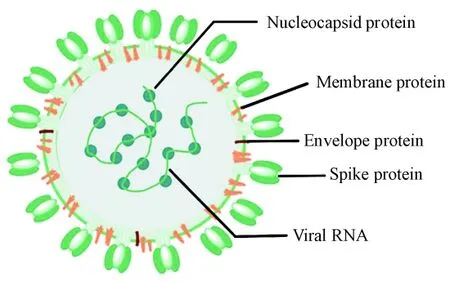
Figure 1 Structure of SARS-CoV-2 virus
SARS-CoV-2 冠状病毒进入宿主细胞由S 蛋白介导。S 蛋白在病毒表面形成同型三聚体,负责病毒与宿主细胞膜的附着和融合。S 蛋白包含S1 和S2 两个结构域,其中S1 结构域含有的受体结合域(receptor binding domain,RBD)负责与细胞表面受体血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)结合,S2 结构域负责病毒膜和细胞膜融合,从而允许病毒进入细胞(图2)。因此,SARS-CoV-2的S蛋白及其受体结合域RBD 是病毒中和抗体的关键靶点[5-7]。
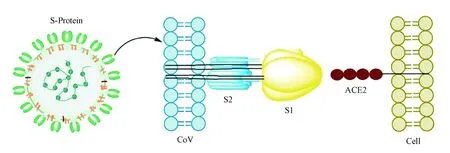
Figure 2 Mechanism of SARS-CoV-2 entering human cells ACE2: Angiotensin-converting enzyme 2
2 鼻腔黏膜免疫机制
新冠病毒的主要传播途径是呼吸道传播和接触传播。接触传播主要来源于感染者释放的病毒颗粒/飞沫沉降到物体表面,健康者手接触后沾染病毒,在不经意间触碰到鼻腔、口腔或者眼睛结膜等黏膜时,病毒就容易入侵人体,导致感染;呼吸道传播是病毒携带者通过打喷嚏、咳嗽或交谈,以飞沫或气溶胶的形式在空气中释放病毒微粒,以空气为介质进行传播,将病毒传染给健康者。研究证明,鼻上皮中ACE2 的浓度最高,可以推断病毒颗粒的复制主要发生在鼻腔黏膜[8-10],因此,需进一步了解鼻腔黏膜免疫机制,可为鼻腔黏膜免疫疫苗的开发提供理论依据。
黏膜相关淋巴组织(mucosal-associated lymphoid tissue,MALT)亦称黏膜免疫系统(mucosal immune system,MIS),是指广泛分布于呼吸道、胃肠道、泌尿生殖道黏膜下及一些外分泌腺体处的淋巴组织,是执行局部特异性免疫功能的主要场所。大部分病毒和细菌感染始于黏膜表面,MALT构成了机体的第一道防线。黏膜表面与外界抗原直接接触,在外来病原微生物或其他外来抗原侵入机体组织之前将其消灭,使其无法损伤机体,在抵抗感染方面发挥极其重要的作用[11-12]。其中,鼻相 关 淋 巴 组 织 (nose-associated lymphoid tissue,NALT)是由鼻腔至咽道黏膜的淋巴样组织构成,在人体中被描述为一个组织环(Waldeyer 环),主要包括鼻咽腺样体(或扁桃体)、咽鼓管扁桃体、腭扁桃体及舌扁桃体。
NALT 是上呼吸道主要的免疫防御屏障,是鼻腔接种疫苗后黏膜免疫反应的主要诱导部位,鼻腔接种疫苗后NALT 的免疫反应机制见图3。NALT 由树突状细胞(dendritic cell,DC)、T 细胞和B细胞等参与诱导免疫反应的抗原呈递细胞构成,这些细胞被一层特殊的上皮细胞所覆盖,称为M细胞。M 细胞位于黏膜组织中的滤泡相关上皮上,主要吸收颗粒抗原,并通过上皮屏障将抗原运送到底层淋巴细胞来诱导黏膜免疫[13-14]。NALT摄取抗原的方式主要通过上皮直接摄取或由M 细胞主动转运,抗原被摄取后,未成熟DC 离开黏膜组织进入引流淋巴结,分化为成熟DC,对抗原进行处理和呈递,抗原特异性CD4+T 细胞被激活,激活的T 细胞与B 细胞相互作用,B 细胞发展为IgA+B 细胞,随后移动到效应部位(如鼻腔中),在那里IgA+B 细胞分化为浆细胞,浆细胞以二聚体形式分泌IgA,然后,二聚体IgA 通过与聚合物Ig受体结合成为分泌型IgA(secretory Immunoglobulin A,SIgA),最后,聚合物Ig受体将IgA转运至效应位点[15-17]。

Figure 3 Mechanism of NALT immune response after nasal vaccination[18]
NALT 能够同时产生细胞、体液和黏膜三重免疫应答,而其他黏膜组织(如,口腔黏膜和阴道黏膜)并不具有这一特性。由于鼻黏膜给药独特的免疫优势,使得鼻腔免疫疫苗成为当前研究的热点。细胞免疫反应通过抗体依赖细胞介导的细胞毒反应和直接细胞毒性T 细胞来实现,能够直接杀死特殊的感染细胞,因而对细菌、病毒和寄生虫等的清除至关重要。黏膜部位的体液免疫反应通过使活化的B 细胞分泌二聚体或多聚体形式的IgA 来实现,能够抵抗酶的降解,发挥黏膜免疫作用。SIgA 是抵御病原体入侵的第一道屏障,它可以结合并中和黏液中的病原体或毒素,阻止病毒与黏膜表面直接接触,进而将病毒清除。因此诱导有效的IgA 应答是黏膜免疫疫苗成功接种的先决条件,是实现黏膜免疫的关键[19]。
3 COVID-19鼻腔黏膜免疫疫苗种类
研究表明,鼻纤毛细胞是SARS-CoV-2 最初的感染和复制部位,SARS-CoV-2一旦到达肺部,会导致严重肺炎并伴有其他疾病的发生[20]。因此在病毒感染的初始位置杀死病毒至关重要,鼻腔给药途径已被证明能预防SARS-CoV-2 病毒感染并提供优越的局部黏膜免疫诱导[21-22]。自COVID-19疫情爆发以来,开发安全有效、易于接种的非侵入性鼻腔疫苗迫在眉睫,以多条技术路线的成百上千个疫苗研发项目在全球应急启动,其中针对SARSCoV-2 的鼻腔黏膜免疫疫苗的开发主要集中在核酸疫苗(DNA 和RNA 疫苗)、病毒载体疫苗及亚单位疫苗。
3.1 核酸疫苗
3.1.1 DNA 疫苗 DNA 疫苗的原理是通过一定的途径使编码免疫原性抗原的重组质粒载体进入人体内表达抗原,诱导人体产生免疫应答。因与传统疫苗相比,DNA 疫苗具有研发和生产周期短、稳定性高,能诱导更强大的细胞毒性T 细胞反应,且没有严重的不良反应等优势[23-26],DNA疫苗成为疫情大流行爆发时的理想疫苗候选者。印度开发的COVID-19 DNA 疫苗(ZyCoV-D)是第一个被批准用于人类的DNA 疫苗,临床数据显示该疫苗在预防症状性感染方面的有效率为67%,在预防中度疾病方面的有效率为100%,由此可证明DNA 疫苗有望有效控制大流行[27-28]。
DNA 疫苗是一种针对特定蛋白的抗体疫苗,已被证明擅长触发细胞免疫反应,且更快速、更容易放大生产,因此鼻腔黏膜免疫DNA 疫苗的开发显示出较好的应用前景。研究人员采用基因转移技术开发了一种新型鼻腔喷雾COVID-19 疫苗,该疫苗以腺病毒为载体递送克隆的DNA 链,能使鼻咽细胞产生病毒蛋白,进而对疫苗产生反应,并且在动物研究中表现良好,人体临床试验也将逐步开展,有望获得上市授权[29]。研究表明,不带电荷的颗粒容易聚集且不稳定,原因可能是DNA 的超螺旋结构和负电荷会阻碍或降低疫苗的包埋效率和稳定性,因此研究人员使用阳离子成分,如壳聚糖以纳米颗粒或微粒的形式与DNA 抗原复合用于鼻腔给药,含有壳聚糖的纳米颗粒可以稳定包载DNA,此外壳聚糖还可以作为免疫增强剂来增强疫苗的免疫原性和效力[30-32]。Kumar 等[33]开发并评价了一种金纳米星形壳聚糖(AuNS-几丁聚糖) 纳米制剂。该制剂采用壳聚糖包覆星形的金纳米颗粒用于鼻腔给药递送表达SARS-CoV-2 S蛋白的DNA,可在小鼠呼吸道黏膜和肺组织中成功表达SARS-CoV-2 S 蛋白抗原,产生广泛的免疫反应,包括鼻腔和呼吸道的局部免疫 (黏膜IgA) 以及全身免疫(中和IgG)。此外,这种鼻腔疫苗接种策略还在肺黏膜和组织驻留记忆T 细胞(tissue-resident memory T,TRM) 中表现出显著的抗SARS-CoV-2 IgA 水平,从而有效地中和了SARS-CoV-2 不同突变体(武汉株、D614G 株和β 突变体)的伪病毒,提供了持久免疫。
3.1.2 RNA 疫苗 RNA 疫苗因其只需进入细胞质而不需进入细胞核内即能发挥作用,所以安全性相对较高,这也促使RNA 疫苗成为当前新型核酸疫苗研究的热点[34]。但大部分RNA疫苗多采用肌肉注射途径,如获批紧急使用授权的mRNA 疫苗BNT162b2(一种编码SARS-CoV-2 S 蛋白的脂质纳米粒mRNA 疫苗)[35]。Tang 等[36]以小鼠为免疫模型进行研究,发现单独进行全身mRNA 疫苗接种仅能诱导弱的呼吸道黏膜中和抗体反应,而全身mRNA 疫苗接种与鼻腔黏膜免疫相结合则诱导了强烈的中和抗体反应。研究表明,黏膜接种加强mRNA 疫苗的方式,能在呼吸道建立强大免疫力,对抗SARS-CoV-2 以及Omicron 亚系等变体的感染。采用鼻腔免疫RNA 疫苗的研究也正在逐步开发中。Amyris 公司与美国传染病研究所(Infectious Disease Research Institute,IDRI)合作研发的鼻腔给药Amyris/IDRI RNA 新冠疫苗展现出鼻内递送潜力[37]。该疫苗基于角鲨烯可以增强人体对疫苗活性成分的免疫反应这一特性,以含有角鲨烯的脂质纳米颗粒为载体,将附着在载体表面的 RNA 送到细胞中。其体内结果表明,Amyris/IDRI RNA 递送至鼻黏膜可产生抗体,对上呼吸道形成保护,有助于更加全面地防御 COVID-19。未来有望研发出更多针对COVID-19的RNA 鼻腔疫苗,并且疫苗研发的鼻黏膜递送技术也可用于其他呼吸道感染疾病。
3.2 病毒载体疫苗
病毒载体疫苗,即使用经过修改的无害的病毒为载体将抗原(如SARS-CoV-2 S蛋白)的遗传密码(DNA 或RNA)传递到人体细胞,模拟自然病毒感染,以产生所需的免疫反应[38]。
研究人员利用复制能力不强、无致病性的人副 流 感 病 毒2 型 (human parainfluenza virus2,HPIV2)载体BC-PIV 研制SARS-CoV-2 鼻腔疫苗。研究表明,表达前预融合稳定S 蛋白的BC-PIV 在小鼠鼻内接种疫苗后可诱导产生抗SARS-CoV-2 的血清中和IgG 和鼻黏膜IgA 抗体,从而预防呼吸道的病毒感染,且无明显的不良反应[39-40]。一种基于新城疫病毒(Newcastle disease virus,NDV)表达SARS-CoV-2S 蛋白的重组NDV-S 载体疫苗,经小鼠鼻内接种后可诱导高水平的SARS-CoV-2 特异性中和IgA、IgG2a 抗体及T 细胞免疫,接种两剂鼻内NDV-S 疫苗能显著减少病毒扩散,对机体起到保护作用[41]。此外,以腺病毒为载体的疫苗也被用于控制感染和阻止病毒传播。Qin 等[42]开发了一种表达SARS-CoV-2 S 蛋白RBD 的9 型腺相关病毒载体疫苗(adeno-associated virus 9-RBD,AAV9-RBD)。该疫苗的设计原理是将一个信号肽插入两个RBD 拷贝的N 端并通过连接子插入9 型腺相关病毒的基因组中。体外实验结果显示,AAV9-RBD 能使HeLa 细胞表达高水平的重组RBD 蛋白,对BALB/c 小鼠进行滴鼻免疫后8 周,小鼠血清中可检测到中和抗体,表明AAV9-RBD 疫苗有望用于SARS-CoV-2鼻腔疫苗的开发。
3.3 亚单位疫苗
基因重组亚单位疫苗仅包含源自致病性细菌或病毒的某些成分,这些成分是能够引起机体免疫反应的主要物质,由于其不含完整病原体,因此安全性好,在临床研究中显示出较好的潜力。
干 扰 素 基 因 刺 激 物 (stimulator of interferon genes,STING)能够感知胞浆核酸,并激活TANK 结合激酶-1(TANK binding kinase 1,TBK1)/干扰素调节因子-3(interferon regulatory factor 3,IRF-3)信号通路,诱导促炎细胞因子和干扰素-β(interferon-β,IFN-β)的表达[43]。研究人员报道了一种针对SARS-CoV-2 的鼻腔亚单位疫苗的研制[44]。该疫苗使用冷冻干燥的S 蛋白并以脂质体STING 激动剂(STING agonist,STINGa)为佐剂。STINGa 是一种新型免疫刺激佐剂,可用于小鼠呼吸道病原体(包括流感和炭疽病)黏膜疫苗。将该疫苗鼻腔免疫小鼠后,结果显示此疫苗安全有效,可诱导小鼠全身中和抗体及肺内T细胞反应,产生肺和鼻腔内IgA,诱导对SARS-CoV-2 的全面免疫。研究证实,在鼻腔接种时,NALT 作为诱导位点发挥作用,导致生发中心B 细胞和T细胞的激活与分化,此外鼻腔接种还在肺部和脾脏局部诱导了特异性T 细胞反应,进一步说明了鼻腔免疫的优势。此外,Du等[45]制备了一种基于SARS-CoV-2 RBD 的重组亚单位疫苗,通过鼻腔接种、微针皮内注射和肌肉注射免疫小鼠,比较小鼠RBD 特异性免疫应答。结果表明,鼻腔免疫接种方式可诱导较强的体液免疫,产生高滴度的IgG 抗体,具有较强的中和活性、平衡的Th1/Th2 应答以及显著的黏膜免疫力。因此,鼻腔免疫亚单位疫苗有望用于缓解当前SARSCoV-2大流行的状况。
4 COVID-19鼻腔黏膜免疫疫苗的临床研究
如前所述,自SARS-CoV-2 基因组序列发布以来,针对COVID-19 的一系列疫苗平台被开发利用,多种候选疫苗处于临床评估阶段,主要以SARS-CoV-2 S 蛋白及RBD 为靶标[46-47],截至2022年12月15日,COVID-19 鼻腔黏膜免疫疫苗不同阶段的临床试验见表1。其中进入Ⅰ期临床试验的COVID-19 鼻腔疫苗占据绝大部分,COVID-19鼻腔黏膜免疫疫苗从开发到临床应用的道路仍任重道远。

Table 1 Clinical trials of a nasal mucosal immunization vaccine against COVID-19
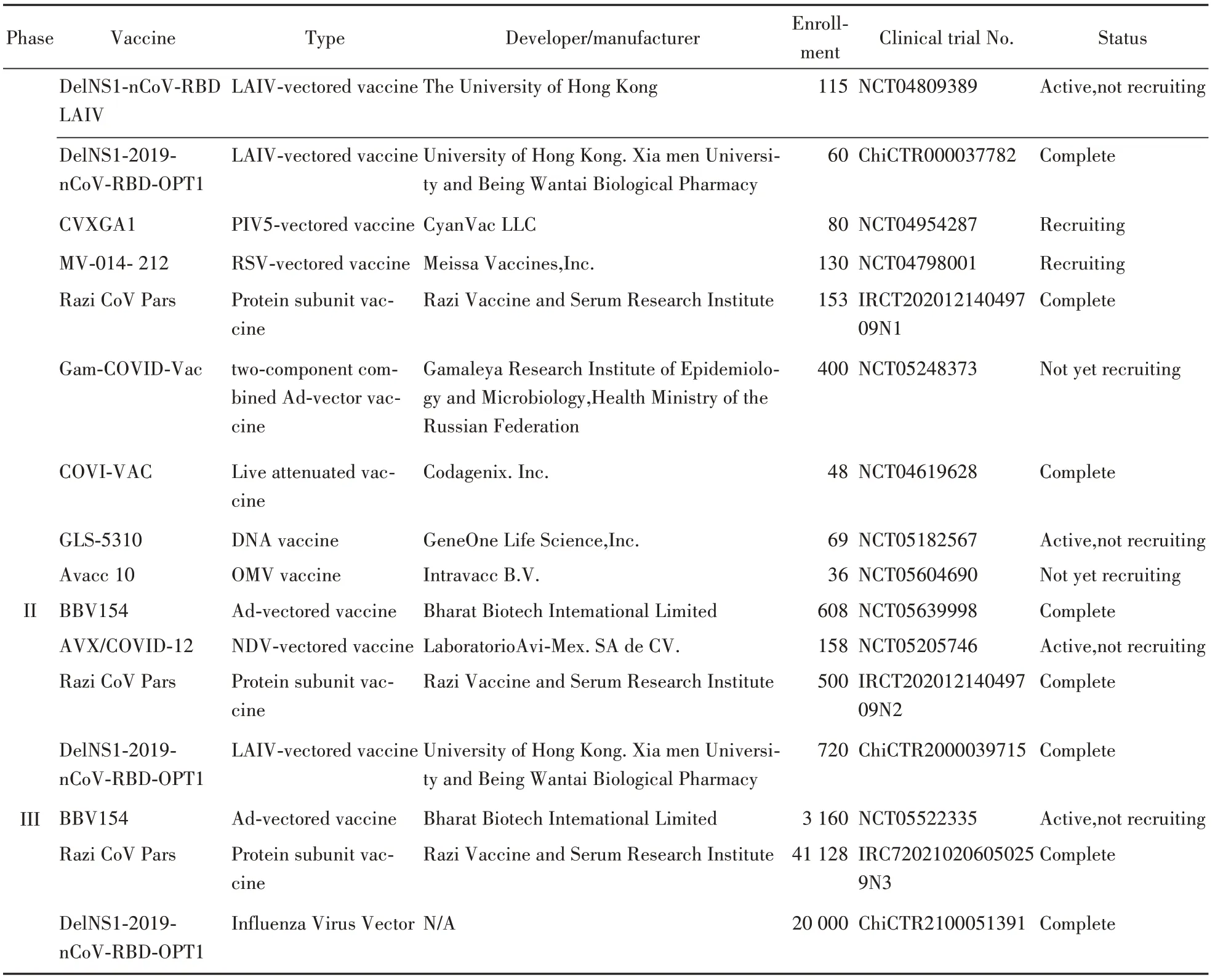
(Continued)
COVID-19鼻腔疫苗主要以病毒载体疫苗开发为主,我国康希诺生物研发团队研发了全球首款可吸入用新冠疫苗克威莎®。该疫苗以5型腺病毒为载体实现机体的免疫记忆功能,可高效激发黏膜、体液和细胞三重免疫保护,目前已在上海等地推广使用[48]。此前在国际权威医学期刊《柳叶刀》发表的Ⅲ期临床研究数据显示,接种1 剂克威莎®14 d 后,总体保护率为63.7%,重症保护率为96.0%,28 d 后,总体保护率为57.5%,重症保护率为91.7%。全球多中心Ⅲ期临床试验的结果达到世界卫生组织建议的保护率标准,严重不良事件发生率低,该临床试验同时证明了克威莎®在60岁以上老年人的安全性[49]。2022年12月5日,万泰生物发布公告,其与厦门大学、香港大学合作研发的鼻喷新冠疫苗获国家药监局同意紧急使用,该疫苗采用流感病毒作为载体并经鼻喷给药,是全球迄今唯一在Ⅲ期临床试验中验证了安全性和广谱有效性的黏膜免疫新冠疫苗。2022年10月完成Ⅲ期临床试验,数据表明,不论用于无免疫史人群的基础免疫还是有免疫史人群的序贯加强免疫,鼻喷新冠疫苗对于Omicron 突变株感染导致的COVID-19 均可产生良好的保护效力,同时具有很好的安全性,在疫情持续高发和防疫措施转向的当下,进一步通过异源加强免疫有利于形成更全面的保护[50]。
5 总结与展望
当前全世界范围内COVID-19 疫情仍在肆虐,接种疫苗是防止疫情迅速大范围传播最有效的方法。免疫途径的选择对于诱导有效免疫保护至关重要,黏膜表面是病原体进入并感染机体的主要部位。SARS-CoV-2 病毒变异快,感染路径由上呼吸道传播转为下呼吸道传播,甚至会同时攻击上呼吸道和下呼吸道,因此建立呼吸道黏膜免疫屏障是对抗COVID-19 的有效策略。鼻腔黏膜免疫疫苗作为一种新型非侵入式疫苗给药系统,具有使用方便、安全有效、患者顺应性好等特点,并能提高免疫治疗效果,诱导细胞、体液和黏膜免疫应答,实现三重免疫,在新冠免疫疫苗的未来发展方向上,鼻腔疫苗接种或将成为预防COVID-19 等呼吸道传染病的有效途径。
与此同时,鼻腔黏膜免疫仍存在一些问题有待改进,如抗原的稳定性、有效摄取及免疫佐剂的安全性,同时由于SARS-CoV-2 病毒变异快,不断出现逃逸株,难以形成针对变异株的群体免疫,迫切需要研发新型抗新冠疫苗。采用广谱的免疫原设计高度活化中和抗体,与T细胞应答协同抗击病毒并有效清除病毒,构建群体有效免疫保护;采用鼻腔黏膜接种或黏膜与肌肉序贯接种,以实现黏膜持久应答,加强免疫反应,持续防御病毒,防止病毒持续变异。随着对鼻腔黏膜免疫机制及COVID-19 鼻腔黏膜免疫疫苗研究的深入,将使鼻腔黏膜免疫在COVID-19 疫情中发挥更强有力的作用,对传染病的防控具有重要意义。

