大肠杆菌裂解性噬菌体生物学特性及其解聚酶活性验证
吕金晖,于诗筠,喻鑫婷,张雅倩,崔玉军,黄海龙,米志强*,张加力*
(1.吉林农业大学 动物科学技术学院,吉林 长春 130118;2.军事科学院 军事医学研究院 微生物流行病研究所 病原微生物生物安全国家重点实验室,北京 100071)
禽致病性大肠杆菌(avian pathogenicEscherichiacoli,APEC)可引起禽类的大肠杆菌病,呈现局部或全身感染。APEC可以诱发不同的临床症状,主要表现为急性败血症、输卵管炎、亚急性心包炎、气囊炎和肝周炎等等[1]。对于不同的养殖场和养殖环境,禽大肠杆菌病的病死率为10%~90%,对禽养殖业造成的经济损失较大[2]。为了防制养殖过程中的细菌感染,养殖户们经常超剂量使用抗生素,致使细菌耐药情况不容乐观。从世界各地关于畜禽养殖中大肠杆菌耐药性的报道情况来看,对临床常见的如氨苄青霉素、复方新诺明、阿莫西林、链霉素、四环素等都普遍存在耐药性,并且出现了较多的多重耐药株[3]。在细菌耐药如此严峻的情况下,寻找抗生素替代物迫在眉睫。
噬菌体是能够感染细菌的病毒,是自然界中数量最为庞大的微生物,约为细菌总数的10倍[4]。随着噬菌体治疗的兴起,许多噬菌体治疗Ⅰ期和Ⅱ期临床试验结果显示噬菌体不存在显著的不良反应问题,但噬菌体制剂的稳定性较差,存在噬菌体滴度显著下降的情况[5]。同时,噬菌体与致病菌共同进化也会导致抗菌作用下降等问题[6]。因此,一部分人探索噬菌体治疗的方向逐渐偏向了噬菌体编码的抗菌蛋白。尽管噬菌体编码的蛋白同样也只能靶向特定细菌,但是更具有稳定性和安全性,具有一定的应用前景。
本试验分离到1株大肠杆菌裂解性噬菌体,对其高通量测序后预测解聚酶的基因,对该噬菌体解聚酶克隆表达后用苯酚硫酸法以及解聚酶联合血清杀菌试验验证其活性,为抗生素替代物提供了一个新的选择。
1 材料与方法
1.1 菌株来源大肠杆菌分离自吉林省长春市某养殖场病鸡的肝脏,分离得到的菌株在麦康凯琼脂鉴别培养基挑选符合大肠杆菌标准的菌落(麦康凯琼脂培养基上生长的大肠杆菌菌落颜色呈粉红色)纯化3次得到APEC,命名为E.coli111。纯化后的菌株使用High Pure Viral RNA Kit试剂盒提取大肠杆菌基因组,并进行全基因组测序,将拼接后的测序数据上传至Center for Genomic Epidemiology(http://genomicepidemiology.org/)网站SpeciesFinder预测菌种,SeroTypeFinder预测大肠杆菌血清型,VirulenceFinder预测毒力基因。预测结果为埃希菌属(Escherichia)大肠杆菌科(Escherichiacoli)成员,血清型为O78:H4,含有iutA、irp2、iss、fyuA、iroN、ompT等常见的毒力基因。菌种保存于吉林农业大学-80℃超低温冰箱和军事科学院军事医学研究院微生物流行病研究所-80℃超低温冰箱各1份。
1.2 主要试剂和仪器以及培养基LB 液体培养基和 LB 固体培养基(含琼脂粉):胰蛋白胨、酵母提取物、琼脂粉(OXOID,英国)、氯化钠(Solarbio,中国);麦康凯琼脂(OXOID,英国);PBS缓冲液(Solarbio,中国);0.22 μm微孔过滤器(Pall Corporation,美国);High Pure Viral RNA Kit(Roche Diagnostics,美国);Qubit 2.0荧光计(赛默飞,美国);Trans1-T1 感受态细胞和 BL21(DE3)感受态细胞(北京全式金生物技术有限公司,中国);Ni-NTA-Sefinose Column(Sangon Biotech,中国);透析袋(Viskase,中国)、浓硫酸(沪试,中国)、苯酚(国药,中国)。
1.3 噬菌体分离大肠杆菌E.coli111接种至LB固体培养基上,37℃恒温箱过夜培养。挑取单克隆菌落接种于5 mL LB液体培养基中,37℃、200 r/min摇床培养3~4 h后,达到对数生长期,与待分离的污水混合后继续培养6 h,0.22 μm滤膜过滤培养液后得到噬菌体原液。利用双层平板法得到单独的噬菌体,挑选带有晕环的噬菌体(噬菌体尾丝蛋白中解聚酶降解细菌表面多糖后会在噬菌斑的周围形成半透明的晕环)进行单斑纯化,纯化后的噬菌体命名为vB_EcoM-P111。
1.4 噬菌体一步生长曲线测定测定噬菌体效价和宿主菌的数量后将噬菌体和宿主菌按照感染复数为0.01的比例进行混合,37℃恒温箱静置孵育5 min,使噬菌体充分吸附于宿主菌上,随后10 000 r/min离心2 min去除上清液中未吸附的噬菌体。用等体积的LB液体培养基洗涤1次,弃去上清液,再用等体积的 LB液体培养基重悬沉淀,37℃、200 r/min摇床培养,分别在0,5,10,15,20,30,40,50,60,90,120,150 min时取样1次,每次取100 μL,用双层平板法估算不同时间点噬菌体vB_EcoM-P111的数量。最后,以时间为横坐标,噬菌体数量为纵坐标,绘制噬菌体vB_EcoM-P111感染大肠杆菌E.coli111的一步生长曲线。
1.5 噬菌体全基因组测序及其解聚酶的预测用High Pure Viral RNA Kit试剂盒提取噬菌体基因组,Illumina MiSeq测序平台进行全基因组测序。将测序得到的数据用SPAdes-3.13.0软件进行拼接,软件拼接结束后形成FASTA文件,在CLC Genomics Workbench 3.6.1软件查看拼接结果。将拼接的结果在NCBI(https://www.ncbi.nlm.nih.gov)网站上进行在线比对,将比对结果为噬菌体基因的序列上传至RAST(http://rast.nmpdr.org/)网站预测开放阅读框(open reading frame,ORF)。在Pfam(http://pfam.xfam.org/)中,通过与pfam蛋白数据库中蛋白的比较,预测ORF的结构域,找到可能具有解聚酶活性的ORF。预测结果表明该噬菌体解聚酶可能为ORF70,命名为Dpo70。
1.6 解聚酶Dpo70的克隆、表达、纯化及活性的初步验证以噬菌体vB_EcoM-P111基因组为模板设计引物Dpo70_F(5′-TAGGATCCATGGCAATTTATGACTTAGG-3′)和Dpo70_R(5′-GGCTC-GAGTTAAATTAATCCATAAATTAC-3′)进行PCR扩增,扩增产物连接至pET-28a质粒上。Sanger测序鉴定目的片段是否正确连接后,将质粒转入BL21感受态细胞中,37℃恒温箱培养12 h 后,挑取单克隆菌落接种至5 mL含有卡纳霉素 的LB液体培养基中,37℃、200 r/min摇床培养至对数期(D600 nm=0.4~0.6)时加入IPTG(终浓度为1 mmol/L),25℃、200 r/min继续培养18 h。将菌液10 000 r/min离心5 min,收集沉淀,用PBS缓冲液重悬。重悬后的菌液冰上超声,10 000 r/min离心5 min后得到含有解聚酶的上清液,0.22 μm的滤膜将上清液过滤,用Ni-NTA-Sefinose Column(Ni-柱)纯化滤液。Ni-柱洗脱液装在截留相对分子质量(MWCO)为8 000~14 000的透析袋内,用磷酸盐缓冲液透析24 h,得到纯化的解聚酶,-80℃超低温保存。SDS-PAGE凝胶电泳鉴定纯化后的解聚酶Dpo70。
用点板的方式初步验证解聚酶活性,具体步骤如下:挑取大肠杆菌E.coli111单克隆置于LB液体培养基,37℃、200 r/min摇床培养3~4 h,至D600 nm约为0.4。取500 μL菌液与4.5 mL LB半固体培养基混合均匀,除去气泡后均匀地倒在LB固体培养基表面。上层半固体凝固后,取2 μL 破碎菌液的上清液滴于细菌表面,待液体完全吸收后,将平板倒置于37℃培养箱过夜培养,若次日平板上有半透明晕环产生,表明该蛋白具有解聚酶活性。
1.7 解聚酶Dpo70对大肠杆菌表面多糖(LPS)的降解作用本试验使用水饱和酚(pH6.6)和氯仿提取纯化E.coli111大肠杆菌表面多糖,试验方法主要参考文献[7]改良后的热水-酚法。试验共分为4组,第1组为150 μL多糖提取物和150 μL PBS缓冲液的混合物;第2组为150 μL多糖提取物与150 μL灭活解聚酶Dpo70(煮沸10 min)的混合物;第3组为150 μL多糖提取物与150 μL 10 mg/L解聚酶Dpo70的混合物;第4组为150 μL 10 mg/L解聚酶Dpo70和150 μL PBS缓冲液。将4组混合液同时在37℃的金属浴中孵育1 h,将孵育后的4组混合物进行SDS-PAGE凝胶电泳,银染观察Dpo70对表面多糖的降解作用。
1.8 解聚酶Dpo70特异性降解大肠杆菌表面多糖测定大肠杆菌在LB液体培养液中过夜培养,取1 mL 菌液,10 000 r/min离心5 min,弃去上清,沉淀用等体积PBS缓冲液重悬,重复3次。得到的E.coli111(宿主菌)和E.coli47(非宿主菌)的沉淀重悬于1 mL质量浓度为1 mg/L的解聚酶Dpo70;同时取1 mL质量浓度为1 mg/L的灭活解聚酶Dpo70作为对照蛋白重悬E.coli111的菌体沉淀。各组在37℃金属浴中孵育1 h后,10 000 r/min离心1 min。将1 mL上清液分别转移至干燥的无菌试管中,分别加入0.5 mL 6%苯酚溶液,立即加入2.5 mL 浓硫酸并混匀,室温静置反应30 min。反应结束后,将试管内液体转移至96孔板中,用酶标仪测定D490 nm值。
1.9 解聚酶Dpo70辅助血清对大肠杆菌的杀灭作用将健康猴的静脉血1 000 r/min离心10 min,收集上层血清-80℃保存备用。将对数期的大肠杆菌E.coli111(D600 nm为0.4~0.6)、解聚酶Dpo70、猴血清以及PBS按照如表1所示的组合混匀。所有试验组均在37℃金属浴中孵育1 h,随后进行梯度稀释,各稀释梯度取2 μL在LB固体培养基上进行点板。待液体完全吸收后,将平板倒置于37℃恒温箱过夜培养。

表1 解聚酶联合血清杀灭宿主菌试验 μL
2 结果
2.1 噬菌体vB_EcoM-P111基本生物学特性本试验从鸡粪中分离得到1株裂解性噬菌体,双层平板法将噬菌体单斑纯化,重复3次,纯化后噬菌体命名为vB_EcoM-P111。该噬菌体可以在含有宿主菌的双层平板上形成透明噬菌斑,且噬菌斑周围有一圈半透明晕环,培养12 h的噬菌斑晕环直径为3~3.5 mm(图1A)。随着培养时间的延长,噬菌斑晕环的直径会变大,培养36 h的噬菌斑晕环直径为5.5~6.5 mm(图1B)。鉴定噬菌体是否能产生解聚酶最直观的方式就是观察噬菌斑周围是否有半透明晕环。

A.培养12 h噬菌斑形态;B.培养36 h噬菌斑形态
2.2 噬菌体的一步生长曲线噬菌体vB_EcoM-P111和大肠杆菌E.coli111以感染复数为0.01的比例进行混合后,分别在0,5,10,15,20,30,40,50,60,90,120,150 min取样估算噬菌体数量,以时间为横坐标,噬菌体数量为纵坐标,绘制噬菌体vB_EcoM-P111感染大肠杆菌E.coli111的一步生长曲线。如图2所示,噬菌体vB_EcoM-P111感染大肠杆菌E.coli111的潜伏期小于5 min,在感染25 min后达到平台期,平台期噬菌体的数量为109~1010PFU/mL。

图2 噬菌体vB_EcoM-P111一步生长曲线
2.3 噬菌体全基因组测序及其解聚酶的预测噬菌体vB_EcoM-P111测序结果经SPAdes-3.13.0拼接后,得到1条全长为50 241 bp的环状DNA序列。BLAST结果显示,与Escherichiaphage P817(Sequence ID:MZ826699.1)最相近,属于有尾噬菌体目(Caudovirales)、Drexlerviridae科成员。通过RAST网站预测得到76个ORF,其中ORF70编码的蛋白序列含有tail spike N结构域,可能具有解聚酶活性。完整的基因组序列及注释信息已提交至GenBank,登录号为OL449681。
2.4 解聚酶的克隆、表达及纯化结果以噬菌体vB_EcoM-P111为模板,Dpo70_F和Dpo70_R为引物进行PCR扩增,PCR产物凝胶电泳条带在2 000~3 000 bp之间,与ORF70碱基序列预测长度(2 406 bp)基本一致(图3A)。通过双酶切将目的片段连接到pET28a质粒上,Sanger测序确定目的片段已正确连接到质粒上。将重组质粒转至BL21感受态细胞中,IPTG诱导解聚酶Dpo70大量表达,超声破碎细菌后解聚酶Dpo70释放至上清液中。Ni-NTA-Sefinose Column(Ni-柱)纯化解聚酶Dpo70,SDS-PAGE凝胶电泳鉴定超声后蛋白上清液和纯化解聚酶Dpo70的蛋白条带(图3B)。点板法初步验证解聚酶活性结果如图3C,解聚酶Dpo70可以在宿主菌E.coli111的半固体平板上形成半透明的晕环,表明该蛋白具有解聚酶活性。

A.PCR扩增Dpo70基因;B.解聚酶Dpo70的表达与纯化;C.解聚酶Dpo70蛋白活性初步验证。M1.DNA Marker;A1.Dpo70基因PCR扩增产物;M2.蛋白Marker;B1.含重组质粒pET28a-Dpo70的BL21(DE3)超声后含蛋白上清液;B2.Ni-柱纯化的解聚酶Dpo70
2.5 硝酸银染色观察解聚酶Dpo70降解大肠杆菌表面多糖水饱和酚提取过夜培养大肠杆菌表面多糖在液体中呈现浅黄色,SDS-PAGE凝胶电泳,经过硝酸银染色可在泳道上看到棕色条带。未处理的表面多糖和灭活解聚酶Dpo70处理过的表面多糖在SDS-PAGE凝胶的中上部,蛋白Marker 50~40 kDa 中间有明显的较宽条带;解聚酶Dpo70处理过的表面多糖则被降解,在SDS-PAGE凝胶的中下部分有较宽的条带;解聚酶Dpo70由于上样量小于30 ng,没有条带产生(图4)。以上结果表明,大肠杆菌表面多糖可以被解聚酶Dpo70降解,并可以通过银染的SDS-PAGE凝胶显示。

M.蛋白Marker;1.未处理的表面多糖;2.表面多糖+灭活解聚酶Dpo70;3.表面多糖+解聚酶Dpo70;4.未处理解聚酶Dpo70
2.6 苯酚硫酸法检测解聚酶Dpo70降解大肠杆菌表面多糖解聚酶Dpo70和PBS重悬的E.coli111(宿主菌)和E.coli47(非宿主菌)在37℃孵育,通过苯酚硫酸法鉴定大肠杆菌表面多糖的降解情况。大肠杆菌表面多糖被解聚酶降解后,会释放多糖至上清液中,通过离心可将其释放的多糖与菌体进行分离,浓硫酸水解上清中的多糖并迅速脱水生成糖醛衍生物,与苯酚生成橙黄色化合物,橙黄色化合物在D490 nm处有吸收峰,可通过光密度值来判断上清中糖的相对浓度。根据得到的数据制作柱状图(图5),从柱状图中可以看出解聚酶Dpo70可特异性的降解E.coli111(宿主菌)表面的多糖D490 nm值为0.759±0.017,并释放至上清液中,而对于非宿主菌(以E.coli47为例),解聚酶Dpo70则不能降解其表面的多糖D490 nm值为0.121±0.001。同时,灭活的解聚酶对于E.coli111(宿主菌)表面多糖也不会产生降解作用(D490 nm值为0.116±0.001),排除了E.coli111自身释放表面多糖的可能性,以上结果表明解聚酶Dpo70对于E.coli111(宿主菌)表面多糖的降解作用是特异的(P<0.000 1)。
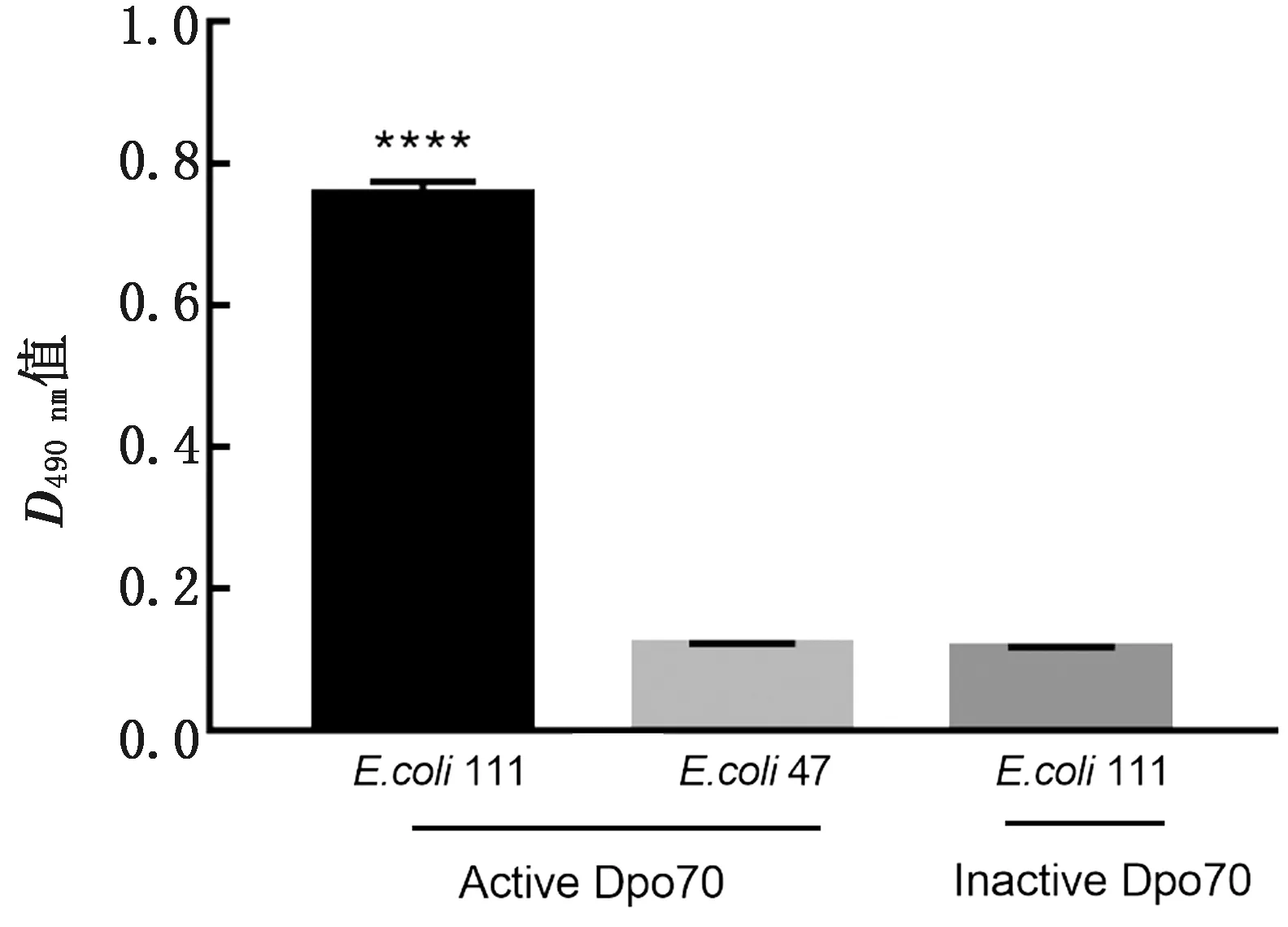
图5 苯酚硫酸法检测解聚酶Dpo70特异性降解大肠杆菌表面多糖
2.7 解聚酶Dpo70辅助血清对大肠杆菌的杀灭作用宿主菌E.coli111经过高通量测序,得到的测序结果拼接后上传至Center for Genomic Epidemiology网站(http://genomicepidemiology.org/)预测其毒力基因。结果显示,大肠杆菌E.coli111含有iss毒力基因,该基因会使菌株具有抗血清补体溶菌作用的能力。如图6A所示,本试验所用的E.coli111同时与解聚酶Dpo70和25%血清混合物经37℃孵育1 h后,存活的宿主菌E.coli111的数量几乎为零,表明在解聚酶Dpo70的辅助下25%血清对于大肠杆菌E.coli111的杀灭作用基本上达到了100%;而解聚酶Dpo70与宿主菌E.coli111对照组(图6B)、宿主菌E.coli111在与25%血清对照组(图6C)经37℃孵育1 h后,宿主菌E.coli111的存活数量与宿主菌E.coli111对照组(图6D)基本持平。
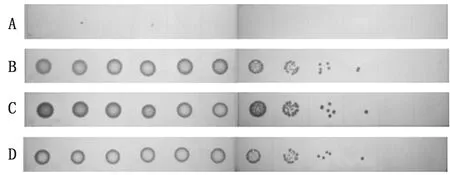
图6 解聚酶Dpo70提高血清对大肠杆菌的杀灭作用
3 讨论
噬菌体是一类可以感染细菌等微生物的病毒,具有很强的专一性。噬菌体存在的意义在于调控菌群的数量,裂解性噬菌体可以控制其宿主菌的过度扩张。溶源性噬菌体通过将自身DNA整合到细菌染色体来改变宿主菌的遗传信息,从而进行耐药或毒力基因的传递[8]。裂解性噬菌体感染的第一步使噬菌体尾相关蛋白(tail fiber 或者 tail spike proteins简称TSPs)与宿主菌上的受体特异性结合,大多数情况下,噬菌体只感染特定血清型的宿主菌[9]。噬菌体吸附宿主菌后,将基因组注入宿主菌体内,利用宿主菌的原料合成自身基因组和蛋白并完成组装,最后由裂解酶将宿主菌细胞壁水解,释放出子代噬菌体[10]。而溶原性噬菌体将自身基因组作为原噬菌体整合到宿主染色体中,进行同步复制,部分RNA噬菌体可能以游离的低拷贝的质粒形式存在[11]。噬菌体除了这2种常见的生存方式,还有慢性感染(子代噬菌体颗粒通过宿主菌的膜不断排到环境中,但不会破坏宿主菌)、持续感染模式(噬菌体颗粒产生并积累在宿主的细胞质中,不释放到细胞外环境中)和伪溶源性感染(噬菌体发育处于停滞阶段,未整合的噬菌体基因组在宿主菌分裂时不对称的传给子代细菌)等不同的感染模式[11]。但是目前关于噬菌体及其衍生物在对抗耐药菌方面主要集中在裂解性噬菌体身上。
革兰阴性菌的表面不仅有外膜,有些细菌表面还有一层较厚的荚膜多糖,其中的多糖成分可以保护细菌免受各种不利的外界的因素[12],并且使其逃避免疫系统的吞噬和补体的杀灭作用。例如,部分大肠杆菌基因组中含有iss毒力基因。iss基因编码的外膜蛋白会导致表面排斥,使菌株具有抗血清补体溶菌作用的能力,同时与大肠杆菌毒力有一定相关性[13]。编码解聚酶的裂解性噬菌体在平板上感染宿主菌时,分泌的解聚酶就会降解细菌表面的多糖,由于其分泌量较大并且可以在琼脂中扩散,在培养基平板上就以半透明晕环的形式表现出来,并且随着培养时间的延长,解聚酶扩散速度大于噬菌体生长的速度,半透明晕环的直径也会随之增大。而裂解性噬菌体编码的解聚酶Dpo70和宿主菌E.coli111在37℃孵育后,解聚酶Dpo70降解宿主菌E.coli111表面多糖产生的还原糖可以被苯酚硫酸法识别到。另一方面,解聚酶Dpo70降解宿主菌E.coli111表面多糖后相当于脱去了细菌表面的“保护罩”,虽然解聚酶不能直接对宿主菌产生杀灭作用,但是可以大幅度提高血清对其的杀灭作用。

