广西鸭坦布苏病毒流行株GXQZ01-DTMUV-2020全基因组序列分子特征分析
谢守玉,熊陈勇,施开创,李 军,郑 敏,韦显凯,冯淑萍,屈素洁,龙 凤,杨 蓉,陆文俊,骆永泉,钟华训,侯慧贤,覃婉婷,韦慧琦,尹彦文*
(1.广西动物疫病预防控制中心,广西 南宁 530001;2.广西大学 动物科学技术学院,广西 南宁 530005;3.贺州市水产畜牧站,广西 贺州 542699)
坦布苏病毒(Tembusu virus,TMUV)是属于黄病毒科黄病毒属恩塔亚病毒群不分节段的单股正链RNA病毒。1955年,首次从马来西亚的三带喙库蚊体内分离到TMUV。目前,已从鸭、鸡、鹅、麻雀及蚊子体内发现该病毒[1]。2010年,上海地区的麻鸭出现生长迟缓、高热、食欲减退、产蛋下降及死亡症状。随后,我国养鸭主产区的东南省份,如浙江、江苏、福建、山东、湖南等地相继有疫情发生,发病率高达90%,病死率为5%~30%,致病原曾被称为“鸭产蛋下降综合征病毒”,后经证实为鸭坦布苏病毒(duck Tembusu virus,DTMUV)[2-4]。马来西亚和泰国的蛋鸭养殖场陆续有DTMUV引发疫情的报道[5-6]。
DTMUV基因组全长约11 kb,包含5′端和3′端非编码区(UTR),以及1个开放阅读框(ORF)。ORF编码C、prM和E 等3种结构蛋白,以及NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5等7种非结构蛋白。E蛋白是DTMUV主要膜蛋白和结构蛋白,为宿主的重要保护性抗原,能够诱导动物机体发生特异性免疫应答,产生中和抗体[7]。NS1蛋白是胞外分泌性蛋白和多效应蛋白,也是在病毒复制过程中产生的重要抗原,可诱导机体产生细胞免疫反应[8]。E蛋白和NS1蛋白均具有良好的免疫原性,是DTMUV亚单位疫苗研发的重点对象。为了解广西DTMUV流行毒株基因组分子特征,本试验利用已建立的DTMUV检测方法[9],从诊断为DTMUV阳性的病料中扩增全基因组序列,与国内外参考毒株进行相似性比较,对ORF、E及NS1基因进行遗传进化分析,发现广西DTMUV流行毒株呈现遗传多样性的特征,以期为广西DTMUV流行情况调查提供数据支持,为DTMUV有效防控和致病机理研究奠定基础。
1 材料与方法
1.1 主要试剂核酸抽提试剂盒(批号:20120110T015)购于天隆科技公司;PrimeScriptTMOne Step RT-PCR Kit Ver.2(批号:ASF0454A)、MiniBEST Agarose Gel DNA Extraction Kit Ver 4.0(批号:AK11054A)、pMD18-T载体(批号:AK91481A)、大肠杆菌DH5α感受态细胞(批号:AK71028A)均购于宝生物(大连)公司。
1.2 病料检测病料来自2020年广西钦州某养鸭场发病的麻鸭。采集患病麻鸭肝脏、脾脏、肾脏、肺脏等组织样品,剪成小块后放入2 mL灭菌离心管中,加入适量PBS,经磨碎仪研磨至糜状,离心后取上清提取核酸,作为模板,利用本实验室已建立的DTMUV检测方法进行检测[9]。
1.3 病毒全基因组扩增测序与比对以DTMUV检测结果为阳性的核酸为模板,利用本试验设计的DTMUV全基因组测序引物(表1)进行RT-PCR扩增。建立50 μL反应体系:模板2 μL,PrimeScript One Step Enzyme Mix 2 μL,2×One Step Buffer 25 μL,上、下游引物各1 μL(20 μmol/L),无RNA酶灭菌水补足体系。反应程序:50℃ 30 min;94℃ 2 min;94℃ 30 s,50℃ 30 s,72℃ 2 min,35个循环。反应结束后,PCR产物通过1.0%琼脂糖凝胶电泳鉴定。

表1 全基因组测序引物
PCR产物胶回收纯化后,连接至pMD18-T载体,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆测序,每个片段重复测序3次。使用DNAStar软件包中的SeqMan拼接测序获得的片段,最终得到GXQZ01-DTMUV-2020株全基因组序列,并将GXQZ01-DTMUV-2020株全基因组序列同参考毒株进行比对。
1.4 DTMUV全基因组序列分析应用BioEdit软件对GXQZ01-DTMUV-2020株及参考毒株(表2)全序列进行核苷酸和氨基酸相似性分析。应用MEGA7软件对比对后的ORF、E及NS1基因序列进行最佳核苷酸替换模型评估:ORF为GTR+G+I;E、NS1基因均为TN93+G。以最佳核苷酸替换模型为基础,采用最大似然法(maximum likelihood)绘制系统发育树,Bootstrap值设置为1 000次。应用RDP 4(recombination detection program 4)和SimPlot(ver 3.5.1)软件对GXQZ01-DTMUV-2020株及参考毒株的全基因组序列进行重组分析,检测是否有重组现象。应用BEAST(ver 1.10.4)软件包估算ORF、E及NS1基因的遗传进化速率,评估进化的快慢。

表2 DTMUV主要参考毒株信息
2 结果
2.1 全基因组测序与比对结果应用SeqMan程序拼接测序的片段,得到1株DTMUV,命名为GXQZ01-DTMUV-2020株。结果显示,GXQZ01-DTMUV-2020株全长为10 991 bp,5′端UTR为94 bp,3′端UTR为619 bp,含有1个开放阅读框(ORF)为10 278 bp,编码3 425个氨基酸。其中,3种结构蛋白基因C、prM和E长度分别为360,501,1 503 bp;7种非结构蛋白基因NS1、NS2A、NS2B、NS3、NS4A、NS4B及NS5长度分别为1 056,681,393,1 857,378,762,2 715 bp。MM_1775和GXQZ01-DTMUV-2020株的E、NS1蛋白氨基酸序列比对结果显示,E、NS1蛋白分别有14个和21个氨基酸位点发生变异(表3)。3′端UTR核苷酸序列比对发现,DTMUV-AH2011株在第82位至155位连续插入74个碱基。SD14株在第43位至49位,第71位至73位不连续插入共10个碱基。在第60个核苷酸位置,包括GXQZ01-DTMUV-2020株在内共有15株DTMUV插入1个G碱基。

表3 MM_1775和GXQZ01-DTMUV-2020株的E、NS1蛋白氨基酸序列对比
2.2 核苷酸与氨基酸相似性分析结果应用BioEdit软件对GXQZ01-DTMUV-2020株与参考毒株全序列相似性分析结果显示,其与广西DTMUV流行株的核苷酸相似性为94.1%~98.5%,氨基酸相似性为95.8%~100.0%;与水禽源TMUV参考毒株的核苷酸相似性为85.7%~99.7%,氨基酸相似性为92.0%~100.0%;与蚊虫源TMUV参考毒株的核苷酸相似性为85.8%~99.1%,氨基酸相似性为92.0%~100.0%。E、NS1基因与广西DTMUV流行株的核苷酸相似性为95.9%~96.4%和96.1%~97.6%,氨基酸相似性为99.0%~99.4%和98.2%~99.1%;与水禽源TMUV参考毒株的核苷酸相似性为89.3%~99.2%和87.4%~99.4%,氨基酸相似性为98.0%~99.8%和94.0%~100.0%;与蚊虫源TMUV参考毒株的核苷酸及氨基酸相似性为88.1%~98.0%和85.8%~99.0%,96.8%~99.4%和93.4%~99.7%;与鸡源TMUV(Sitiawan virus)核苷酸及氨基酸相似性为86.8%/96.8%,85.2%/92.6%(表4)。结果表明,GXQZ01-DTMUV-2020株与广西DTMUV毒株相似性较高,与水禽源TMUV相似性高于其他宿主源TMUV。

表4 GXQZ01-DTMUV-2020株与部分参考毒株同源性分析 %
2.3 遗传进化树绘制应用MEGA7对ORF、E及NS1基因绘制遗传进化树(图1,2)。ORF遗传进化树中(图1A),MM_1775株与 Sitiawan virus组成TMUV群,SD14株为3群,DK/TH/CU-DTMUV2007株为1群。GXQZ01-DTMUV-2020株与广西GX2012,GX2013E株属于2.2亚群,广西GX2011,GX2015株与国内主要DTMUV毒株组成2.1亚群。结果表明,广西DTMUV流行毒株进化方向不完全相同,呈现遗传多样性特征。从图1A 中可以得出,GXQZ01-DTMUV-2020株与参考毒株CHN-YC和DTMUV/Goose/CHN/2019/AQ-19遗传关系距离较近,这与相似性分析结果一致。E基因(图1B)和NS1(图2)基因遗传进化树分布与ORF相似。
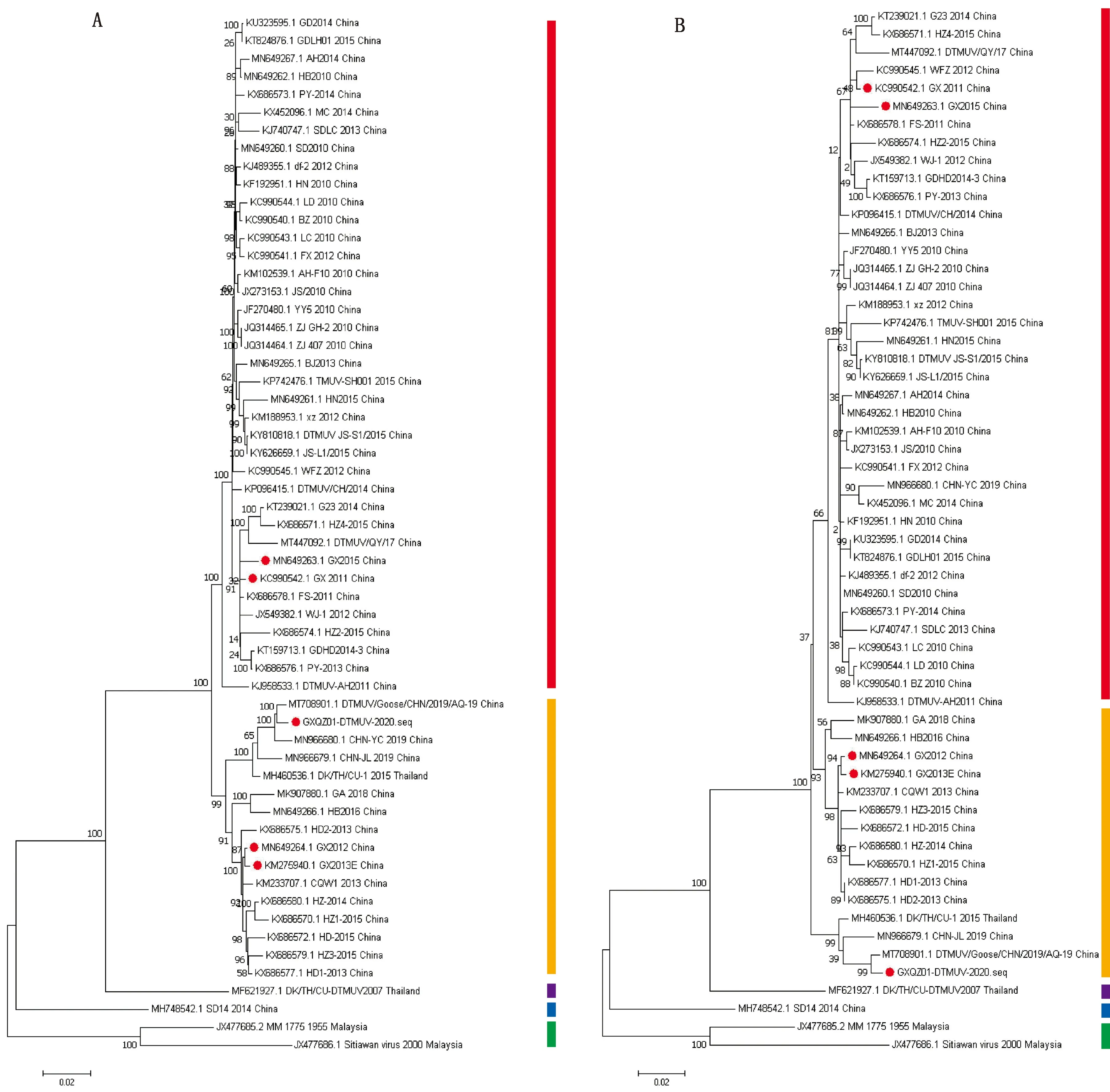
A.ORF;B.E基因。红色.2.2亚群;橙色.2.1亚群;紫色.1群;蓝色.3群;绿色.TMUV。下同
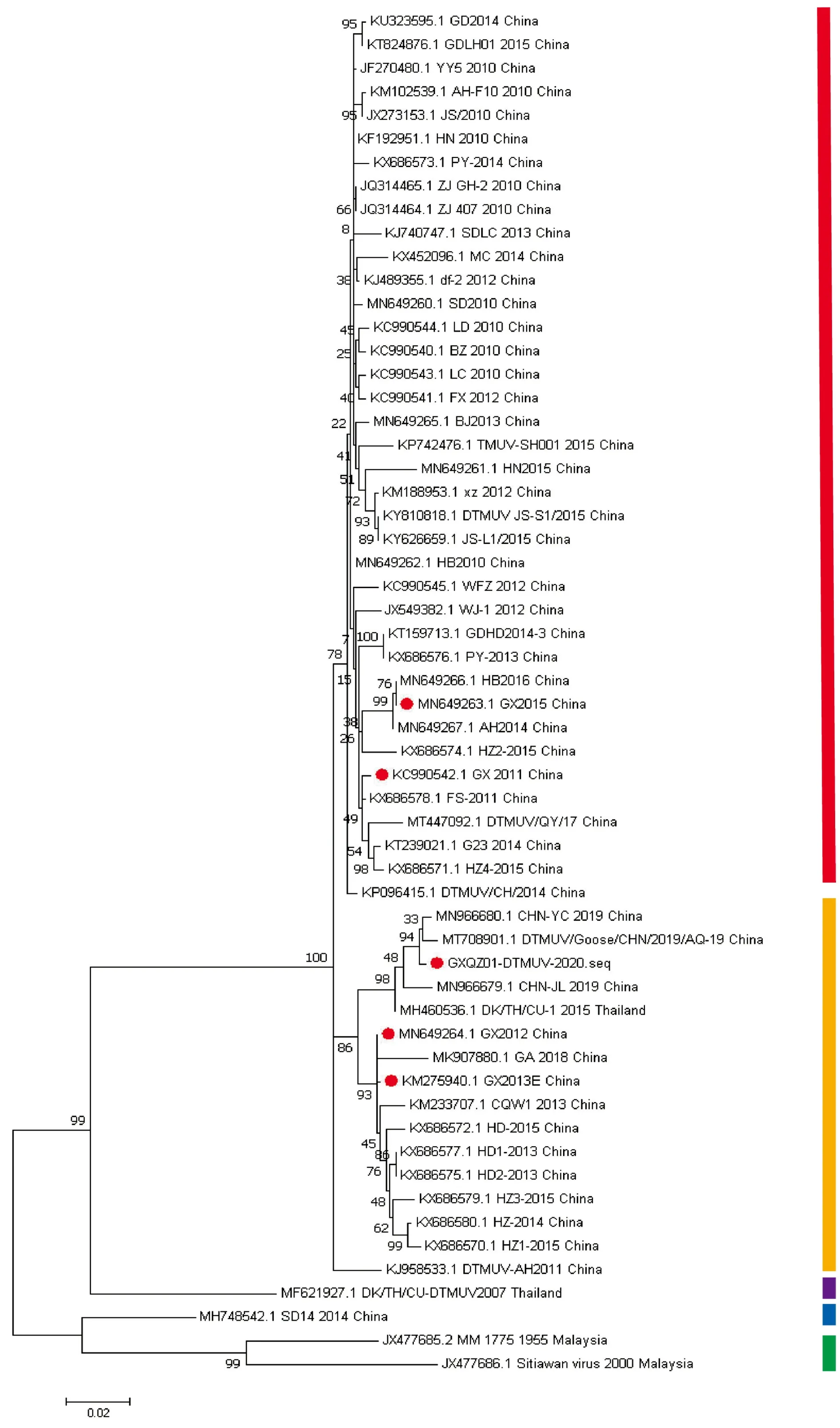
图2 DTMUV NS1基因遗传进化树
2.4 重组分析结果应用RDP4和SimPlot软件对GXQZ01-DTMUV-2020株与参考毒株的全基因组序列进行重组分析。结果显示,HB2016、HD2-2013、CHN-YC及AH2014株检测到重组信号(图3)。HB2016株重组的主要亲本为GA,相似性为98.9%,次要亲本为GX2015株,相似性为100%,重组位点为比对后的第2 049~4 054位;HD2-2013株重组的主要亲本为HD-2015株,相似性为99.3%,次要亲本为GDHD2014-3株,相似性为99.9%,重组位点为第5 675~7 237位;CHN-YC株重组的主要亲本为DTMUV/Goose/CHN/2019/AQ-19株,相似性为99.2%,次要亲本为MC株,相似性为100%,重组位点为第870~1 989位;AH2014株重组的主要亲本为HB2010株,相似性为99.9%,次要亲本为GX2015株,相似性为99.9%,重组位点为第2 044~4 002位。
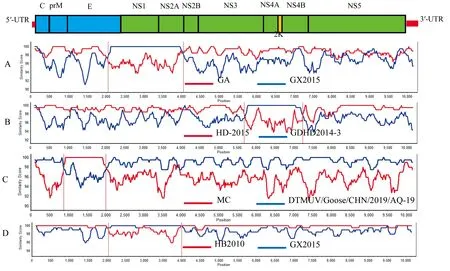
A.HB2016;B.HD2-2013;C.CHN-YC;D.AH2014
2.5 遗传进化速率估算结果应用BEAST软件对GXQZ01-DTMUV-2020株及参考毒株的ORF、E及NS1基因遗传进化速率估算结果为1.146×10-3,1.467×10-3,1.319×10-3替换/(位点·年),表明E基因进化速率最快。
3 讨论
广西壮族自治区地处沿海亚热带,与东南亚国家接壤,属于候鸟迁徙过冬地区,而TMUV宿主谱广泛,存在野鸟传播病毒的潜在风险。据报道,养鸭场从业人员的血清TMUV阳性检出率高达71.9%,说明TMUV宿主范围扩大,对公共卫生安全可能造成威胁[10]。因此,须加强对TMUV的流行情况调查及分子流行病学研究。本试验从广西钦州某蛋鸭养殖场采集病死鸭的脾脏、肝脏、肾脏、肺脏及卵巢组织,利用本实验室已建立的DTMUV病原诊断方法进行检测[9],以阳性核酸为模板,进行DTMUV全基因组序列扩增,得到GXQZ01-DTMUV-2020全序列。通过序列比对发现,E蛋白氨基酸共有14个位点发生变异,其中第154~157位NYPV变异为NYSA。TMUV E蛋白第156位氨基酸的改变将影响病毒的组织嗜性和在动物群体间的传播能力,以及第154位氨基酸的糖基化修饰作用[11-13]。NS1蛋白有2个糖基化位点,通过借助E蛋白疏水信号进入内质网,在参与病毒侵袭、组装、释放及致病性方面都起到关键作用[14-15]。本研究中NS1有21个氨基酸位点发生变异,尚需深入探讨突变的意义。在3′端UTR区域,DTMUV-AH2011株连续插入74个碱基,SD14株不连续插入10个碱基,并且在系统发育树上为独立的分支(数据未列出),尚未见其他文献有相关报道,至于突变对毒株的影响需要进一步研究。
相似性分析结果显示,GXQZ01-DTMUV-2020株基因组结构中,5′UTR、3′UTR、NS1、NS2A及NS4B与CHN-YC株核苷酸相似性最高;prM、E、NS2B、NS3及NS5与DTMUV/Goose/CHN/2019/AQ-19株核苷酸相似性最高。其中,C和NS4A基因核苷酸相似性与CHN-YC和DTMUV/Goose/CHN/2019/AQ-19株并列最高,为99.4%和98.9%,氨基酸相似性均为100%。以上结果表明,GXQZ01-DTMUV-2020基因组呈现分子遗传多样性特征。GXQZ01-DTMUV-2020与国内TMUV参考毒株的核苷酸相似性为85.7%~99.7%,氨基酸相似性为92.0%~100%。E、NS1基因与国内TMUV参考毒株的核苷酸相似性为89.3%~99.2%和87.4%~99.4%,氨基酸相似性为95.4%~99.8%和94.0%~100%。任丹等[16]分离到1株鹅源TMUV全基因组序列与国内DTMUV相似性最高达97.7%,与鹅源TMUV相似性为96.7% 左右。胡峰等[17]分离的2株水禽源TMUV,与参考毒株的相似性大于95.7%,E基因与参考毒株的核苷酸相似性为95.2%以上。李刚[18]分离的山东DTMUV毒株与2017年分离株的ORF氨基酸相似性为98%以上;与2010―2012年分离株的氨基酸相似性为96.8%~98.6%。农海连[19]从广西分离的4株DTMUV与参考毒株的核苷酸相似性高于96%,氨基酸相似性高于98%。刘烈发等[20]从江西省某蛋鸭养殖场分离到1株DTMUV,与已报道的DTMUV参考毒株核苷酸相似性在98.5%以上。李文俊等[21]从鸭组织病料中分离出1株DTMUV,其E基因与DTMUV参考毒株相似性最高达99.2%,与鸡源TMUV毒株相似性为86.7%。以上表明,国内DTMUV毒株之间的相似性普遍较高,与本研究的分析结果相似,说明国内DTMUV毒株遗传变异较小。
水禽源、鸡源及蚊虫源TMUV的ORF遗传进化树可分为4个进化群,GXQZ01-DTMUV-2020株与GX2012、GX2013E株等组成2.1亚群;GX2011、GX2015株与国内主要DTMUV组成2.2亚群,这是国内DTMUV优势群体;马来西亚毒株组成TMUV群;山东SD14株为3群;泰国DK/TH/CU-DTMUV2007株为1群。广西DTMUV有3株位于2.1亚群,2株位于2.2亚群,从毒株分离年份上尚未发现相关性。GXQZ01-DTMUV-2020株与DTMUV/Goose/CHN/2019/AQ-19和CHN-YC处于同一进化分支上,遗传关系距离最近,这与相似性分析结果一致。GX2012、GX2013E株和重庆CQW1株处于相邻进化分支上,GX2011、GX2015株与广东FS-2011株处于同一进化分支。并且,GXQZ01-DTMUV-2020株与广西其他4株DTMUV遗传关系较远,呈现不同的进化趋势。E基因的遗传进化树中,GXQZ01-DTMUV-2020株与2.2亚群的优势毒株遗传距离比GX2012、GX2013E更远,这与ORF和NS1不同。NS1遗传进化趋势与ORF相似。PENG等[22]对国内外TMUV毒株进行遗传进化分析,其中广西毒株的分群结果与本研究一致。NINVILAI等[23]对2015―2017年分离的泰国DTMUV毒株进行遗传特征分析,GX2013E处于2.1亚群,绝大多数中国DTMUV毒株位于2.2亚群。农连海[19]分离的4株广西DTMUV毒株,遗传进化分支上与CQW1遗传关系最近,这与本研究结果一致。综上,广西DTMUV毒株呈现不同的遗传进化趋势,表现遗传多样性的特征。
DTMUV全基因组序列重组分析发现,共有4株存在重组现象。其中,HB2016和AH2014重组的位点相似,位于E、NS1及NS2A基因,CHN-YC重组的位点位于E基因,HD2-2013重组的位点位于NS3、NS4A和NS4B基因。E蛋白作为宿主的重要保护性抗原,在病毒复制过程中,对病毒的吸附、融合及受体结合等发挥着至关重要的作用[7,24]。非结构蛋白在病毒核酸的复制、蛋白的合成加工与病毒粒子组装等方面起关键性作用[25]。因此,这些基因发生重组,须引起密切关注。DAI等[26]利用RDP 4软件检测到一株DTMUV发生重组,重组位点位于prM和E基因。本研究对ORF、E及NS1基因遗传进化速率估算的结果为1.146×10-3,1.467×10-3,1.319×10-3替换/(位点·年)。NINVILAI等[23, 27]对亚洲DTMUV毒株的ORF、E基因遗传进化速率估算结果为1.113×10-3,1.507×10-3替换/(位点·年)。YU等[28]对DTMUV的E基因进化速率评估结果为5×10-4替换/(位点·年)。DAI等[27]对TMUV全基因组序列遗传进化速率估算结果为5.9×10-4替换/(位点·年)。
综上,同一个基因或片段的进化速率估算结果有差异,可能与选择的参考毒株种类、数量及软件参数设置等因素有关。因此,须进一步加强DTMUV流行情况调查及基因组分子结构分析,为DTMUV的有效防控提供数据支持。

