转移因子联合La Sota株免疫对NDV F48E9株强毒重复感染鸡的保护作用
徐 磊,余勋信,廖惠珍,刘毅发,钟云钦,蒋 铃,谢杼倢,闫丽萍,曾亮明,杜 君,宋素泉*,张渊魁*,黄 瑜
(1.福建农业职业技术学院,福建 福州 350119;2.派生特(福州)生物科技有限公司,福建 福州 350500;3.福州市长乐区乡村振兴发展中心,福建 福州 350200;4.福州众为生物科技有限公司,福建 福州 350012;5.南京农业大学 动物医学院,江苏 南京 210095;6.兆丰华生物科技(南京)有限公司,江苏 南京 211102;7.福建省农业科学院 畜牧兽医研究所 福建省禽病防治重点实验室,福建 福州 350013)
新城疫(Newcastle disease,ND)是由ND病毒(Newcastle disease virus,NDV)引起的急性败血性、高度接触性传染病,严重影响禽业健康发展,在我国被列为一类动物疫病,也是世界动物卫生组织法定报告的动物疫病[1]。NDV属于副黏病毒科、正禽腮腺炎病毒属,为单股、负链RNA病毒,只有1个血清型,但有多种基因型(基因Ⅰ~Ⅸ型),不同基因型毒株的生物学特性存在较明显的差异[2],如:分离自1946年的NDV La Sota株,属于基因Ⅱ型,仍是最常用的NDV弱毒疫苗株[3];同年流行于我国的NDV F48株,属于基因Ⅸ型,感染鸡出现呼吸困难、神经症状等ND典型临床症状以及呼吸道、消化道黏膜出血等ND典型剖检病变[4-5],至今仍是进行疫苗效力评价的经典强毒株[6]。目前,我国主要以疫苗免疫防控ND,但是临床免疫鸡群仍时有ND流行。因此,NDV疫苗免疫机理研究及其免疫增强佐剂研发,是ND防控中的重要研究方向[7-8]。
转移因子(transfer factor,TF)属于细胞因子,具有较好的免疫增强作用[9]。本实验室建立了具有自主知识产权的TF制备及检验方法[10-12],并初步验证了TF可以缓解鸡免疫抑制、增强鸡免疫功能和提高鸡疫苗免疫效果[13-16],但是,缺少TF提高NDV疫苗免疫鸡对NDV强毒株感染的攻毒保护效果及作用机理研究。基于此,本研究参考了《中华人民共和国兽药典》2015年版鸡NDV活疫苗质量标准中La Sota株活疫苗的效力检验方法(La Sota株活疫苗免疫后以F48E9株进行攻毒,观察攻毒保护情况,用于评价La Sota株活疫苗效力)[17],围绕TF与NDV La Sota弱毒疫苗株联合免疫对NDV F48E9株强毒攻毒鸡的保护作用及机理进行了研究,应用T淋巴细胞增殖率测定法、B淋巴细胞增殖率测定法、血凝抑制(hemagglutination inhibition,HI)试验测定La Sota弱毒株免疫后鸡T淋巴细胞转化水平、B淋巴细胞转化水平、ND HI抗体效价(log2X)的动态变化规律,并采用荧光定量RT-PCR方法检测F48E9强毒株攻毒鸡的病毒血症、泄殖腔排毒、口咽排毒与肝脏、脾脏、肺脏、肾脏、法氏囊、盲肠扁桃体、脑等主要组织的F48E9株感染情况,为后续开展TF对不同基因型NDV疫苗免疫效力的影响及机理研究提供参考。
1 材料与方法
1.1 疫苗与病毒株NDV La Sota株弱毒疫苗由兆丰华生物科技(南京)有限公司提供,病毒含量为107.17EID50/羽份;NDV F48E9株强毒由福建省农业科学院畜牧兽医研究所提供,病毒含量分别为105.0ELD50/mL和109.4ELD50/mL。
1.2 主要仪器及试剂动物饲养隔离器购自苏州市冯氏实验动物设备有限公司;全自动酶标仪和CFX96型荧光定量PCR仪均购自BioRad公司;植物血凝素P(PHA-P)、脂多糖(LPS)和四甲基偶氮唑盐(MTT)均购自Sigma公司;淋巴细胞分离液购自天津灏洋生物工程公司;完全RPMI-1640培养液购自美国GIBCO公司;犊牛血清购自杭州四季青生物工程材料有限公司;标准NDV HI抗原(La Sota株)购自中国兽医药品监察所;RNA提取试剂盒购自凯杰生物工程(深圳)有限公司;反转录试剂盒购自GE公司;Taq DNA聚合酶购自Promega公司;SPF鸡与SPF鸡胚均购自济南斯帕法斯家禽有限公司。
1.3 TF制备按照本实验室已获得授权的中国发明专利制备猪脾TF[10-12]:以健康猪的脾脏为原料,先后经匀浆、细胞破碎、分离、灭活、微滤和超滤等技术工艺精制而成。经检验,所制备猪脾TF的pH值为7.0,核糖含量和多肽含量分别为72.0 mg/L和3.5 g/L,脱E受体法效力为15%,D260 nm/D280 nm比值为2.23且在252 nm波长处有最大吸收,细菌内毒素含量小于10 EU/mL,热原检验、外源病毒检验、支原体检验、无菌检验、异常毒性检查、蛋白质定性检验、过敏反应检查和安全检验均合格。
1.4 试验动物SPF鸡攻毒前在正压动物饲养隔离器中饲养,30日龄免疫接种,44日龄转至负压动物饲养隔离器中首次攻毒并饲养,58日龄进行二次攻毒并饲养。
1.5 试验设计选取SPF鸡100羽随机分成5组(表1),每组均有SPF鸡20羽,具体如下:单独免疫1组(点眼免疫105.17EID50La Sota株弱毒疫苗)、联合免疫1组(点眼免疫105.17EID50La Sota株弱毒疫苗同时肌肉注射0.2 mL TF)、对照1组(非免疫)、对照2组(非免疫)和空白1组(非免疫)。免疫后14 d,单独免疫1组、联合免疫1组和对照1组均肌肉注射0.5 mL 105.0ELD50/mL NDV F48E9株强毒(即:104.7ELD50)进行首次攻毒,对照组2和空白组1没有进行首次攻毒。首次攻毒后第14天,单独免疫1组、联合免疫1组和对照2组均肌肉注射0.5 mL 109.4ELD50/mL NDV F48E9株强毒(即:109.1ELD50)进行二次攻毒,空白1组没有进行二次攻毒,即空白1组为非免疫非攻毒组。
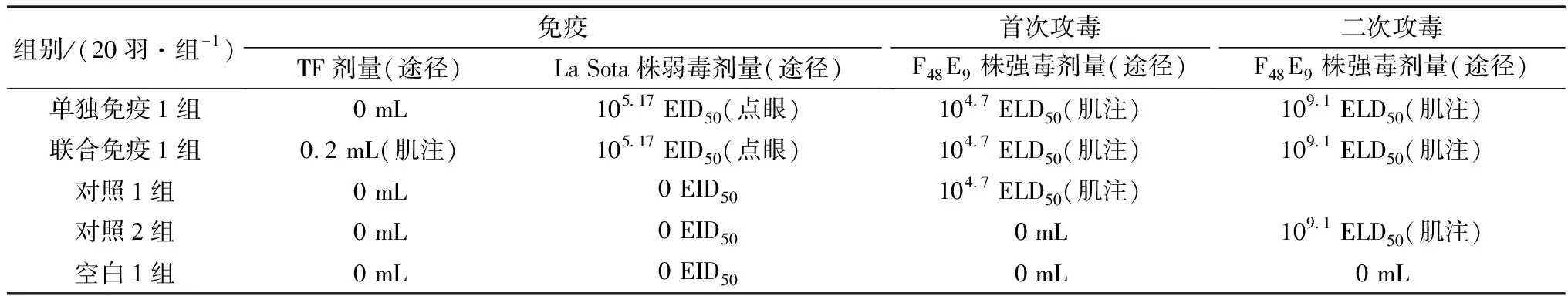
表1 试验设计
观察各组鸡每日临床症状,及时剖检病死鸡,至二次攻毒后21 d剖检存活鸡,及时采集各组剖检鸡的肝脏、脾脏、肺脏、肾脏、法氏囊、盲肠扁桃体、脑等主要组织,进行NDV F48E9株在主要组织中感染情况检测。此外,各组分别于免疫前3 d、免疫后7,14 d、首次攻毒后1,3,7,14 d以及二次攻毒后1,3,7,14,21 d 随机抽取5羽SPF鸡,经前翅静脉采血,分离淋巴细胞进行T淋巴细胞转化水平和B淋巴细胞转化水平测定,分离血清进行ND HI抗体效价和攻毒后NDV F48E9株的病毒血症检测,同时采集攻毒后SPF鸡泄殖腔试子和口咽试子进行攻毒后NDV F48E9株的排毒情况检测。观察各组鸡临床表现和剖检变化,SPF鸡发病即判为不保护[17],统计各组SPF鸡的发病率和病死率。
1.6 T淋巴细胞转化水平测定经淋巴细胞分离液分离并制成淋巴细胞悬液(含8×106/mL淋巴细胞的完全RPMI-1640培养液),按照本实验室已建立的T淋巴细胞增殖率测定方法进行测定[13,18],在96孔细胞培养板上,每份鸡血样设立试验孔(淋巴细胞悬液150 μL,含50 mg/L PHA-P的完全RPMI-1640培养液50 μL)、对照孔(淋巴细胞悬液150 μL,完全RPMI-1640培养液50 μL)、空白孔(完全RPMI-1640培养液200 μL)各3孔,40℃培养68 h后,每孔加入含5 g/L MTT的Hank's液15 μL,40℃培养4 h后,每孔加入100 μL二甲基亚矾,10 min 后测定D490 nm值。每羽鸡T淋巴细胞转化水平用PHA-P刺激指数(stimulation index,SI)表示,PHA-P SI =(试验孔D490 nm均值-空白孔D490 nm均值)/(对照孔D490nm均值-空白孔D490 nm均值)。所得数据用单因素方差分析和最小显著性差法(LSD)分析,P<0.05为差异显著。
1.7 B淋巴细胞转化水平测定经预试验确定测定方法,测定方法与1.6类似,不同点是:制成淋巴细胞悬液(含6×106/mL淋巴细胞的完全RPMI-1640培养液)用于试验,并将“含25 mg/L LPS的完全RPMI-1640培养液”替代“含50 mg/L PHA-P的完全RPMI-1640培养液”。每羽鸡B淋巴细胞转化水平用LPS SI表示,所得数据用单因素方差分析和最小显著性差法(LSD)分析,P<0.05为差异显著。
1.8 ND HI抗体效价测定按照中华人民共和国国家标准测定鸡血清ND HI抗体效价[5],测定结果以log2X表示。HI抗体效价(log2X)≥4,则判为ND抗体阳性;HI抗体效价(log2X)<4,则判为ND抗体阴性。所得数据用单因素方差分析和最小显著性差法(LSD)分析,P<0.05为差异显著。
1.9 NDV F48E9株病毒血症与排毒情况检测将采集的攻毒后泄殖腔试子和口咽试子,分别置于盛有磷酸盐缓冲盐溶液的采样管中,分别混合,离心取上清液。将获得的攻毒后各组鸡血清样品、泄殖腔试子上清液样品及口咽试子上清液样品,按照本实验室已建立的基因Ⅸ型NDV实时荧光定量RT-PCR检测方法[19],提取病毒核酸,合成特异性引物序列(P1:5′-AGGACACTGACTACTTTG-3′,P2:5′-CCGATAATGGCACCTATA-3′)和TaqMan MGB探针(5′-CGT-CTCTGCCTCCTTCCTCC-3′),探针5′端标记的荧光报告基团为FAM,3′端标记的荧光淬灭基团为MGB,预期扩增片段113 bp,进行攻毒后NDV F48E9株的病毒血症与排毒情况检测。
1.10 NDV F48E9株在主要组织中感染情况检测将采集各组鸡的肝脏、脾脏、肺脏、肾脏、法氏囊、盲肠扁桃体、脑等主要组织,按照中华人民共和国国家标准进行组织样品处理、鸡胚接种[5],盲传3代,收取鸡胚尿囊液,按照本实验室已建立的基因Ⅸ型NDV实时荧光定量RT-PCR检测方法[19],进行NDV F48E9株在主要组织中感染情况检测。
2 结果
2.1 攻毒保护情况攻毒保护试验结果显示(表2),免疫后,各组鸡采食、精神等临床表现均正常,TF注射部位无炎症、无肿胀等不良反应。首次攻毒后,单独免疫1组和联合免疫1组发病率和病死率均为0%(0/20),首次攻毒保护率均为100%(20/20);对照1组所有鸡均出现ND典型临床症状,并分别于首次攻毒后2,3,4 d分别死亡4,10,6羽,均出现ND典型剖检病变,发病率和病死率均为100%(20/20);对照2组和空白1组均无发病、无死亡。

表2 各组的保护效率
二次攻毒后,单独免疫1组共有4羽鸡临床表现正常且未发现剖检病变,另有16羽鸡于二次攻毒2 d后开始出现ND典型临床症状,其中12羽鸡分别于二次攻毒后2,3,4 d 各死亡4羽并均出现ND典型剖检病变,余下4羽鸡于二次攻毒13 d后恢复正常而剖检病变不典型,即:单独免疫1组二次攻毒发病率和病死率分别为80%(16/20)和60%(12/20),二次攻毒保护率为20%(4/20);联合免疫1组共有10羽鸡临床表现正常且未发现剖检病变,另有10羽鸡于二次攻毒后3 d开始出现ND典型临床症状,其中8羽鸡分别于二次攻毒后3,4,5,6 d,分别死亡2,2,3,1羽并出现ND典型剖检病变,余下2羽鸡于二次攻毒后10 d恢复正常且剖检病变不典型,即:联合免疫1组二次攻毒发病率和病死率分别为50%(10/20)和40%(8/20),二次攻毒保护率为50%(10/20);对照2组所有鸡均出现ND典型临床症状,并分别于二次攻毒后2,3,4 d分别死亡7,12,1羽,均出现ND典型剖检病变,发病率和病死率均为100%(20/20);空白1组均无发病、无死亡,且未发现剖检病变。
2.2 T淋巴细胞增殖率测定T淋巴细胞增殖率测定结果见图1。免疫前,各组PHA-P SI接近且差异不显著,均值为1.30。免疫后,联合免疫1组PHA-P SI于第7 天达到免疫峰值(1.77),在7,14 d比单独免疫1组分别提高了0.10和0.13,且极显著高于其他组(P<0.01);单独免疫1组于第7 天极显著高于对照2组和空白1组(P<0.01);对照1组、对照2组和空白1组接近且差异不显著,均值为1.30。

图1 各组T淋巴细胞增殖率的变化
首次攻毒后,联合免疫1组PHA-P SI于第1 天达到首次攻毒峰值(1.82),于攻毒后1,3,7,14 d比单独免疫1组分别提高了0.08,0.08,0.10和0.24,且于攻毒后1,3,7,14 d极显著高于其他组(P<0.01);单独免疫1组于第1 天达到首次攻毒峰值(1.75),且于攻毒后1,3,7,14 d极显著高于对照1组、对照2组和空白1组(P<0.01);对照1组于第1 天达到首次攻毒峰值(1.41)且极显著高于对照2组和空白1组(P<0.01);对照2组和空白1组接近且差异不显著,均值为1.32。
二次攻毒后,联合免疫1组PHA-P SI于第7 天达到二次攻毒峰值(1.92),于攻毒后1,3,7,14,21 d 比单独免疫1组分别提高了0.16,0.13,0.18,0.25 和0.14,且于攻毒后1,3,7,14,21 d极显著高于其他组(P<0.01);单独免疫1组于第7 天达到二次攻毒峰值(1.75),且于攻毒后1,3,7,14 d极显著高于对照2组和空白1组(P<0.01);对照2组于第1 天达到二次攻毒峰值(1.42),此时与空白1组接近且差异不显著;空白1组均值为1.29。
2.3 B淋巴细胞增殖率测定B淋巴细胞增殖率测定结果见图2。免疫前,各组LPS SI接近且差异不显著,均值为1.10。免疫后,联合免疫1组LPS SI于第14天达到免疫峰值(1.38),免疫后7,14 d比单独免疫1组分别提高了0.04和0.16,其中第7 天极显著高于对照1组、对照2组和空白1组(P<0.01),且在第14 天极显著高于单独免疫1组、对照1组、对照组2和空白1组(P<0.01);单独免疫1组在第7 天达到免疫峰值(1.26),在免疫后7,14 d极显著高于对照1组、对照2组和空白1组(P<0.01);对照组1、对照2组和空白1组接近且差异不显著,均值为1.12。

图2 各组B淋巴细胞增殖率的变化
首次攻毒后,联合免疫1组LPS SI于第14 天达到首次攻毒峰值(1.59),攻毒后1,3,7,14 d比单独免疫1组分别提高了0.06,0.06,0.14和0.18,在攻毒后1,3 d极显著高于对照1组、对照2组和空白1组(P<0.01),且于攻毒后7 ,14 d极显著高于单独免疫1组、对照2组和空白1组(P<0.01);单独免疫1组在第7 天达到首次攻毒峰值(1.43),在第1 天极显著高于对照1组、对照2组和空白1组(P<0.01),并在攻毒后3,7,14 d极显著高于对照2组和空白1组(P<0.01);对照1组在第3天达到首次攻毒峰值(1.20),且在攻毒后1,3 d极显著高于对照2组(P<0.01);对照2组和空白1组接近且差异不显著,均值为1.11。
二次攻毒后,联合免疫1组LPS SI在第7 天达到二次攻毒峰值(1.83),在攻毒后1,3,7,14,21 d比单独免疫1组分别提高了0.08,0.23,0.20,0.22和0.18,其中攻毒后第1 天极显著高于对照2组和空白1组(P<0.01),在攻毒后3,7,14,21 d极显著高于单独免疫1组和空白1组(P<0.01);单独免疫1组LPS SI在第7 天达到二次攻毒峰值(1.63),在攻毒后1,3,7,14,21 d极显著高于对照2组和空白1组(P<0.01);对照2组LPS SI在第3 天达到二次攻毒峰值(1.15),与空白1组第1 天接近且差异不显著;空白1组均值为1.12。
2.4 ND HI抗体效价ND HI抗体效价测定结果见(图3)。免疫前,各组均没有检出ND HI抗体。免疫后,联合免疫1组ND HI抗体效价在第7 天达到免疫峰值(8.6),免疫后7,14 d比单独免疫1组分别提高了1.6和1.5,且在免疫后7,14 d极显著高于其他组(P<0.01);单独免疫1组在第7 天达到免疫峰值(7.1),在免疫后7,14 d极显著高于对照1组、对照2组和空白1组(P<0.01);对照1组、对照2组和空白1组均没有检出ND HI抗体。

图3 各组ND HI抗体的变化
首次攻毒后,联合免疫1组ND HI抗体效价在第7 天达到首次攻毒峰值(9.7),攻毒后1,3,7,14 d比单独免疫1组分别提高了1.1,1.3,1.2和1.6,在攻毒后1,3,7,14 d极显著高于其他组(P<0.01);单独免疫1组在第7 天达到首次攻毒峰值(8.5),攻毒后1,3,7,14 d极显著高于对照1组、对照2组和空白1组(P<0.01);对照1组在第3 天达到首次攻毒峰值(1.2)且极显著高于对照2组和空白1组(P<0.01),但始终为阴性;对照2组和空白1组接近且差异不显著,均没有检出ND HI抗体。
二次攻毒后,联合免疫1组ND HI抗体效价在第7 天达到二次攻毒峰值(12.1),攻毒后1,3,7,14,21 d比单独免疫1组分别提高了0.6,0.9,2.3,0.5和1.2,在攻毒后1,14 d极显著高于对照2组和空白1组(P<0.01),在攻毒后3,7,21 d极显著高于单独免疫1组和空白1组(P<0.01);单独免疫1组在第14 天达到二次攻毒峰值(9.9),攻毒后1,3,7,14,21 d极显著高于对照2组和空白1组(P<0.01);对照2组在第3 天达到二次攻毒峰值(2.0),与空白1组第1 天接近且差异不显著,但始终为阴性;空白1组均没有检出ND HI抗体。
2.5 NDV F48E9株病毒血症攻毒后NDV F48E9株病毒血症结果见表3。首次攻毒后,单独免疫1组、联合免疫1组、对照2组和空白1组鸡均没有检出NDV F48E9株,病毒血症率均为0%;对照1组始终可以检出NDV F48E9株,病毒血症率为100%。
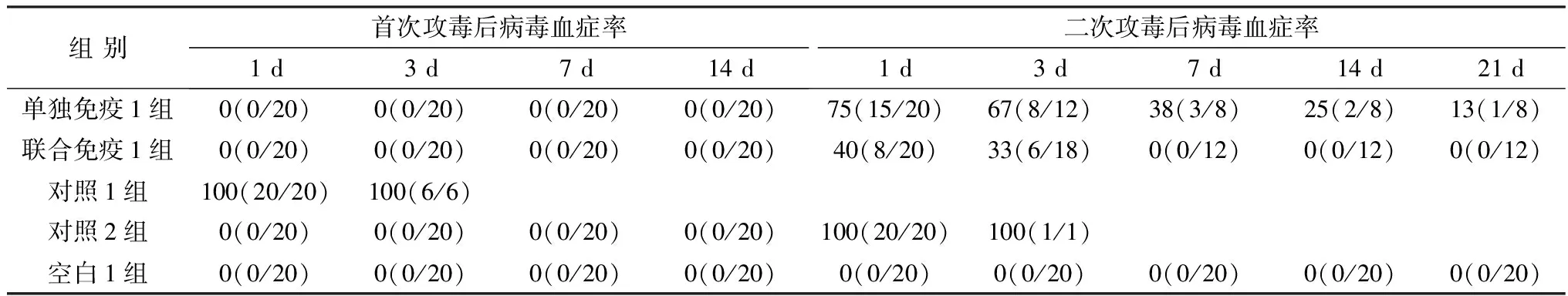
表3 各组病毒血症情况 %
二次攻毒后,单独免疫1组和联合免疫1组鸡的病毒血症率在第1 天分别为75%和40%,之后逐渐下降,其中单独免疫1组病毒血症率在二次攻毒后21 d仍有13%,联合免疫1组病毒血症率在二次攻毒后7 d即为0%,联合免疫1组病毒血症率在二次攻毒后1,3,7,14,21 d分别比单独免疫1组减少了35%,34%,38%,25%和13%;对照2组鸡始终可以检出NDV F48E9株,病毒血症率为100%;空白1组鸡没有检出NDV F48E9株,病毒血症率为0%。
2.6 鸡泄殖腔NDV F48E9株排毒情况攻毒后鸡泄殖腔NDV F48E9株排毒检测结果见表4。首次攻毒后,单独免疫1组、联合免疫1组、对照2组和空白1组鸡泄殖腔均没有检出NDV F48E9株,泄殖腔试子阳性率均为0%;对照1组泄殖腔试子阳性率在首次攻毒后第1 天达到60%,并于首次攻毒后3 d 提高至最高值(100%)。

表4 攻毒后各组鸡泄殖腔NDV F48E9株排毒情况 %
二次攻毒后,单独免疫1组和联合免疫1组泄殖腔试子阳性率在第1 天分别为50%和15%,并均在第3 天达到峰值,此时泄殖腔试子阳性率分别为75%和39%,之后逐渐下降,其中单独免疫1组泄殖腔试子阳性率在二次攻毒后21 d仍有25%;联合免疫1组泄殖腔试子阳性率在二次攻毒14 d后即为0%,联合免疫1组泄殖腔试子阳性率在二次攻毒后1,3,7,14,21 d分别比单独免疫1组减少了35%,36%,42%,38%和25%;对照2组泄殖腔试子阳性率在二次攻毒后第1 天达到75%,并在二次攻毒后第3 天提高至最高值(100%);空白1组鸡泄殖腔各时间点均没有检出NDV F48E9株,泄殖腔试子阳性率均为0%。
2.7 鸡口咽NDV F48E9株排毒情况攻毒后鸡口咽NDV F48E9株排毒检测结果见表5。首次攻毒后,单独免疫1组、联合免疫1组、对照2组和空白1组鸡口咽均没有检出NDV F48E9株,口咽试子阳性率均为0%;对照1组口咽试子阳性率在首次攻毒后第1 天达到80%,攻毒后3 d提高至最高值(100%)。
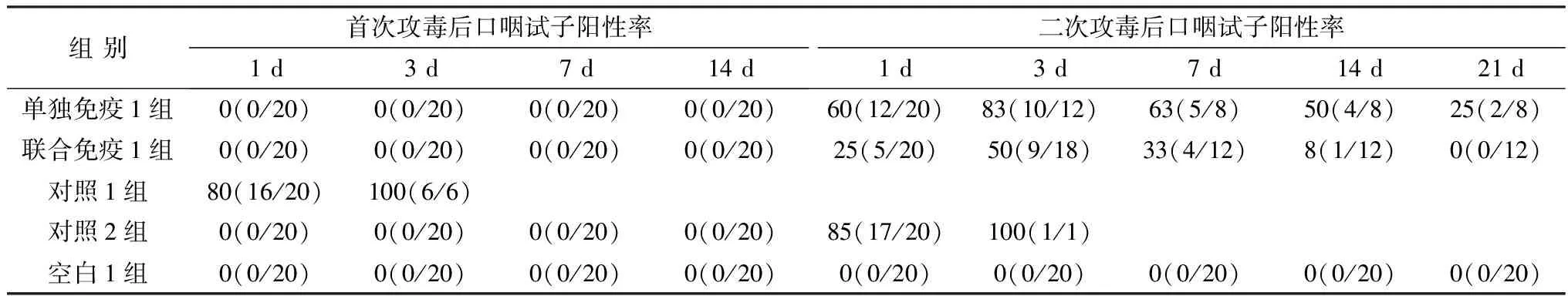
表5 攻毒后各组鸡口咽NDV F48E9株排毒情况 %
二次攻毒后,单独免疫1组和联合免疫1组口咽试子阳性率在第1天分别为60%和25%,攻毒后3 d达到峰值,此时口咽试子阳性率分别为83%和50%,之后逐渐下降,其中单独免疫1组口咽试子阳性率在二次攻毒后21 d仍有25%,联合免疫1组口咽试子阳性率在二次攻毒后21 d下降为0%,联合免疫1组口咽试子阳性率在二次攻毒后1,3,7,14,21 d分别比单独免疫1组减少了35%,33%,30%,42%和25%;对照2组口咽试子阳性率在二次攻毒后第1 天达到85%,攻毒后3 d提高至最高值(100%);空白1组鸡口咽各时间点均没有检出NDV F48E9株,口咽试子阳性率均为0%。
2.8 鸡主要组织NDV F48E9株感染情况攻毒后鸡主要组织NDV F48E9株感染情况检测结果见表6。首次攻毒后,对照1组鸡肝脏、脾脏、肺脏、肾脏、法氏囊、盲肠扁桃体、脑等主要组织均有NDV F48E9株感染,阳性率均为100%(20/20)。二次攻毒后,联合免疫1组鸡肝脏、脾脏、肺脏、肾脏、法氏囊、盲肠扁桃体、脑等主要组织NDV F48E9株感染阳性率比单独免疫1组分别减少了30%,30%,35%,30%,40%,35%和30%,其中联合免疫1组鸡主要组织NDV F48E9株感染阳性率为50%~60%,单独免疫1组鸡主要组织NDV F48E9株感染阳性率为80%~95%。二次攻毒后,对照2组鸡肝脏、脾脏、肺脏、肾脏、法氏囊、盲肠扁桃体、脑等主要组织均有NDV F48E9株感染,阳性率均为100%(20/20)。空白1组鸡主要组织未检出NDV F48E9株。

表6 攻毒后各组鸡主要组织NDV F48E9株感染阳性率 %
3 讨论
TF是活性T淋巴细胞释放的由核糖和多肽组成的一类可透析、可超滤的可溶性小分子物质,可传递免疫信息、激活免疫细胞活性、增强机体特异性和非特异性免疫功能,是一种重要的免疫增强佐剂[9-16,20-21]。不同免疫剂量的La Sota弱毒株对不同攻毒剂量不同基因型NDV强毒的攻毒保护效果不同[22-23],为评价TF对La Sota株活疫苗攻毒保护率的影响,本试验基于《中华人民共和国兽药典》2015年版鸡NDV活疫苗质量标准中La Sota株活疫苗的效力检验方法,采用0.01羽份La Sota株活疫苗点眼免疫14 d后,选择高于《中华人民共和国兽药典》规定的104.0ELD50F48E9株攻毒剂量,以104.7ELD50F48E9株进行攻毒,观察攻毒保护情况,结果显示点眼免疫105.17EID50La Sota株弱毒疫苗后,单独免疫1组和联合免疫1组对104.7ELD50NDV F48E9株强毒的首次攻毒保护率均为100%。为了进一步明确NDV La Sota株弱毒疫苗与TF联合免疫的效力,本试验继续提高攻毒剂量至109.1ELD50对单独免疫1组和联合免疫1组进行二次攻毒,结果显示单独免疫1组和联合免疫1组对109.1ELD50NDV F48E9株强毒的二次攻毒保护率分别为20%和50%,二次攻毒病死率分别为60%和40%。单独免疫1组鸡最早出现临床症状的日龄和最早出现死亡的日龄均比联合免疫1组提前1 d,病死鸡的病程比联合免疫1组缩短1 d,而其病愈鸡恢复临床健康的日龄比联合免疫1组推迟3 d。本试验结果表明,TF可提高NDV La Sota株弱毒疫苗的攻毒保护率,为后续开展TF对不同基因型NDV疫苗免疫效力的影响及机理研究提供了参考。
TF具有无抗原性、无毒性、不产生对抗抗体、不引起过敏反应及使用安全等优点[9-16,20-21],本试验也验证了TF使用安全,各组鸡肌注TF未见不良反应。已有研究显示[24-25],来源不同动物T淋巴细胞的TF,其免疫增强作用不同,如鸡脾TF对鸡疫苗和鸡免疫功能的免疫增强作用会高于猪脾TF。与此结果类似,本课题组已开展试验也显示(待发表),La Sota弱毒株与鸡法氏囊素联合免疫效力会明显高于与猪脾TF联合免疫效力,这是否与2种免疫增强剂来源动物种属差异有关则需要后续验证,为疫苗佐剂研发提供了参考。
NDV F48E9株以不同剂量攻毒导致鸡临床表现不同,相比首次攻毒104.7ELD50剂量时对照1组有70%的鸡在首次攻毒后 3 d内死亡,攻毒剂量提高至109.1ELD50时对照2组有95%的鸡在二次攻毒后 3 d内死亡且临床发病症状更严重。本试验对不同毒株不同剂量NDV接种后鸡免疫相关分子的动态变化进行了监测,其中淋巴细胞增殖率测定试验是检测机体免疫功能的一项重要体外试验,T淋巴细胞转化水平和B淋巴细胞转化水平分别反映了机体的细胞免疫功能和体液免疫功能。目前,T淋巴细胞转化水平测定常用PHA-P或刀豆素A(ConA)作为T细胞丝裂原,B淋巴细胞转化水平测定常用LPS、纯蛋白衍生物结核菌素(PPD)或抗球蛋白作为B细胞丝裂原[13,18,26]。此前,本课题组试验已证实TF具有增强禽白血病病毒A/B亚群(avian leucosis virus subgroup A/B,ALV-A/B)抗体阳性鸡群外周血T淋巴细胞转化水平的作用[13],与此结果类似,本试验T、B淋巴细胞转化水平结果显示,联合免疫1组的PHA-P SI于免疫后、首次攻毒后、二次攻毒后比单独免疫1组分别提高了0.10~0.13,0.08~0.24和0.13~0.25,并于免疫后7,14 d和首次攻毒后1,3,7,14 d及二次攻毒后1,3,7,14,21 d均极显著高于其他组(P<0.01);联合免疫1组的LPS SI于免疫后、首次攻毒后、二次攻毒后比单独免疫1组分别提高了0.04~0.16,0.06~0.18和 0.08~0.23,在免疫后14 d和首次攻毒后7,14 d及二次攻毒后3,7,14,21 d均极显著高于单独免疫1组(P<0.01)。本试验结果表明,TF可提高NDV La Sota弱毒株、F48E9强毒株接种后鸡外周血T淋巴细胞和B淋巴细胞转化水平。此外,单独免疫1组的PHA-P SI在免疫后7 d和LPS SI在免疫后7,14 d极显著高于对照1组、对照2组和空白1组(P<0.01),表明NDV La Sota弱毒株可增强鸡外周血T淋巴细胞和B淋巴细胞转化水平。首次攻毒后对照1组的PHA-P SI在第1 天、LPS SI在攻毒后1,3 d极显著高于对照2组(P<0.01),而二次攻毒后对照2组的PHA-P SI、LPS SI均与空白1组接近且差异不显著,表明NDV F48E9株以不同剂量攻毒导致鸡T和B淋巴细胞转化水平不同。
ND HI抗体效价常用于衡量机体对ND免疫或感染的体液免疫反应水平[27-28]。本实验室已有研究结果显示[13-14],TF点眼可将La Sota弱毒株免疫后7,14,21,28,35,42 d SPF鸡的ND HI抗体效价提高1.1~1.4,将La Sota弱毒株免疫后 21 d ALV-A/B抗体阳性鸡群的ND HI抗体效价提高1.2左右,与此结果类似,本试验ND HI抗体效价结果显示,联合免疫1组的ND HI抗体效价于免疫后、首次攻毒后、二次攻毒后比单独免疫1组分别提高了1.5~1.6,1.1~1.6和0.5~2.3,免疫后7,14 d和首次攻毒后1,3,7,14 d及二次攻毒后3,7,21 d极显著高于单独免疫1组(P<0.01),表明TF可提高NDV La Sota弱毒株、F48E9强毒株接种后鸡的ND HI抗体效价。ND HI抗体效价测定结果还显示,各组鸡首次攻毒后7,14 d的ND HI抗体效价均分别高于其免疫后7,14 d的ND HI抗体效价,各组鸡二次攻毒后1,3,7,14 d的ND HI抗体效价均分别高于其首次攻毒后1,3,7,14 d的ND HI抗体效价,表明一定病毒量F48E9株感染后免疫鸡的抗体水平会更高,F48E9强毒株感染的病毒量与感染后鸡ND HI抗体效价具有一定正相关性,与已有报道类似[29]。
NDV F48E9株的病毒血症检测结果显示,首次攻毒后,单独免疫1组和联合免疫1组的病毒血症率均为0%,对照组1的病毒血症率为100%,表明点眼免疫La Sota弱毒株可以阻止一定病毒量F48E9株攻毒后的病毒血症。结果还显示,单独免疫1组在二次攻毒后1,3,7,14,21 d均有鸡可检出病毒血症,且至21 d病毒血症率仍有13%。相比之下二次攻毒后,联合免疫1组的病毒血症时间更短,于7 d后病毒血症率即为0%,且联合免疫1组病毒血症率于二次攻毒后1,3,7,14,21 d分别比单独免疫1组减少了35%,34%,38%,25%和13%,这些表明TF可降低攻毒后NDV F48E9株的病毒血症率和病毒血症时间。
减少NDV强毒感染后鸡群的带毒与排毒,是防控ND流行的关键[30]。V4、La Sota、MUKTESWAR等NDV疫苗株可诱导鸡产生特异性免疫应答,降低ND的发病率和死亡率,但是不能有效阻止NDV强毒在体内的复制和对体外的排毒[31-32]。鸡主要组织NDV F48E9株感染情况检测结果显示,攻毒后对照1组和对照2组鸡的肝脏、脾脏、肺脏、肾脏、法氏囊、盲肠扁桃体、脑等主要组织均有NDV F48E9株感染,与其他学者研究结果类似[33],而联合免疫1组鸡的主要组织NDV F48E9株感染阳性率比单独免疫1组分别减少了30%~40%,表明TF可降低攻毒后NDV F48E9株在鸡体内的复制。
此外,NDV F48E9株排毒情况检测结果显示,经105.17EID50La Sota弱毒株点眼免疫的各组鸡首次攻毒后,其泄殖腔试子和口咽试子均没有检测出排毒现象,表明La Sota弱毒株点眼免疫可以阻止一定病毒量F48E9株攻毒后的泄殖腔排毒和口咽排毒,与其他学者研究结果类似[22]。对比各组鸡排毒时间结果显示,单独免疫1组鸡的泄殖腔试子和口咽试子在二次攻毒后1,3,7,14,21 d均可以检测出排毒。相比之下,联合免疫1组的排毒时间更短,其泄殖腔试子仅在二次攻毒后1,3 ,7 d而口咽试子仅在二次攻毒后1,3,7,14 d可检出NDV F48E9株,表明TF可降低NDV F48E9株攻毒后鸡排毒时间。对比各组鸡试子阳性率结果显示,二次攻毒后1,3,7,14,21 d相比单独免疫1组,联合免疫1组泄殖腔试子阳性率分别减少了35%,36%,42%,38%和25%,而口咽试子阳性率分别减少了35%,33%,30%,42%和25%,表明TF可降低NDV F48E9株攻毒后排毒鸡比例。已有研究显示,鸡感染不同NDV强毒株后排毒规律不同[30,34],其中,NDV F48E9株强毒感染后鸡口咽排毒率比泄殖腔排毒率更高[35]。与此研究类似,在本试验中相比口咽试子阳性率,对照1组鸡的泄殖腔试子阳性率在首次攻毒后1 d减少了20%,对照2组鸡的泄殖腔试子阳性率于二次攻毒后1 d减少了10%,单独免疫1组和联合免疫1组鸡的泄殖腔试子阳性率在二次攻毒后1,3,7,14 d均分别减少了8%~13%和8%~25%。结合各组鸡的ND HI抗体和病毒血症检测结果分析显示,二次攻毒后单独免疫1组和联合免疫1组的ND HI抗体效价均为阳性且较高,此时F48E9强毒株如何在此高抗体水平的体内环境中复制增殖、产生病毒血症并通过泄殖腔和口咽排毒,仍需进一步研究,这些为ND防控提供了参考。

