生物信息学分析干扰素信号通路在神经母细胞瘤远处转移中的作用
王捷频,张雨婷,肖 东
(1.汕头大学医学院,广东 汕头 515041;2.汕头大学医学院第一附属医院,广东 汕头 515041;3.深圳市儿童医院,广东 深圳 518000)
神经母细胞瘤作为最常见的儿童恶性肿瘤之一,发病机制尚不明确。其5年生存率在37%~69%之间[1]。患者早期通常是无症状,少数因肿瘤的数量及位置伴有腹痛、腹胀及便秘[2]。由于缺乏特异性的早期症状与肿瘤标志物,50%的高风险患者在诊断时已伴有肿瘤的远处转移[3]。因此,识别神经母细胞瘤中参与肿瘤转移的预后标志物,对于早期诊断及阻断转移过程具有重要意义。本研究通过生物信息学分析识别神经母细胞瘤远处转移相关的网络枢纽基因并分析其参与的调控过程,以期为神经母细胞瘤的诊断及治疗提供新的策略。
1 资料与方法
1.1 芯片数据下载和预处理
在GEO数 据库 (http://www.ncbi.nlm.gov/geo)中检索种属为人并且与神经母细胞瘤相关的测序数据集,并下载GSE90689数据集。该数据集基于GPL6480平台,包含神经母细胞瘤原发灶、转移灶和正常骨髓细胞共57例样本。根据研究目的,我们选择了14例来自神经母细胞瘤原发病灶的神经节苷脂2细胞与10例来自转移灶的神经节苷脂2细胞的mRNA数据,并将数据进行ID转换及标准化处理,以进行下一步研究。
1.2 筛选差异表达基因
筛选神经母细胞瘤原发灶与转移灶的差异表达基因,利用R 3.460软件Limma程序包进行分析,通过样本中各个基因的表达量的均值±2倍标准差计算出|log2FC|的阈值为0.723。根据P<0.05与|log2FC|>0.723条件对数据进行过滤,将标本间的差异表达基因导出。
1.3 功能与通路富集分析
为进一步解释差异表达基因在神经母细胞瘤转移过程中发挥的作用,利用DAVID数据库(http://david.ncifcrf.gov)对差异表达基因进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析和基因本体论(gene ontology,GO)富集分析,以此实现基因与生物学功能上的连接,P<0.05的功能与通路有统计学意义。
1.4 蛋白质互作用网络的构建及关键基因筛选
采用STRING 11.0(https://string-db.org)数据库预测蛋白质互作用网络,进一步研究蛋白之间相关作用的关系。将STRING中导出的网络图数据导入Cytoscape进一步优化和分析,安装MCODE插件聚类基因富集模块,绘制蛋白质互作用网络。安装Cytohubba插件,选取候选模块中相关性高的基因,通过最大团中心性(maximal clique centrality,MCC)算法筛选出神经母细胞瘤转移过程的枢纽基因。作为Cytohubba插件中11种算法之一,MCC已被证实在蛋白质互作用网络中对关键蛋白的预测具有更好的效能[4]。
1.5 枢纽基因的表达水平与生存分析
利用R2平台分析枢纽基因在肿瘤不同分期的表达水平与患者的生存时间。R2平台(http://r2.amc.nl)是由荷兰阿姆斯特丹学术医学中心肿瘤基因组学系开发的基于网络的基因组学分析和可视化平台。基于10个枢纽基因高低表达组中患者的生存时间,我们在平台中进行了Kaplan-Meier生存分析。
1.6 共表达网络的构建
为验证枢纽基因是否具有相同的表达模式,即是否存在共调控、功能相关或处于同一通路,使用R软件的加权基因共表达网络筛选包,构建差异表达基因共表达网络。基于各基因的Pearson相关矩阵分析结果,确立β值并建立无尺度网络,并通过层次聚类,将网络中相关性较高的基因分成不同模块。计算每个模块的特征向量值,并合并了距离近的模块。最后计算模块基因与肿瘤分期及是否转移之间的相关性,筛选出重要的模块及其中的基因,以此验证枢纽基因是否属于同一通路,共同调控神经母细胞瘤的远处转移。
1.7 验证差异基因
在GEO数据库中检索并下载GSE90121数据集。该数据集基于GPL570平台,包含神经母细胞瘤原发灶和转移灶共16例样本。对比10个枢纽基因在原发灶和转移灶中的表达量,验证其在神经母细胞瘤转移过程中的作用。
2 结果
2.1 筛选差异表达基因
以P<0.05与|log2FC|>0.723筛 选 差 异 表 达 基因,共得到320个差异表达基因,其中包括上调基因162个,下调基因158个(图1与图2)。
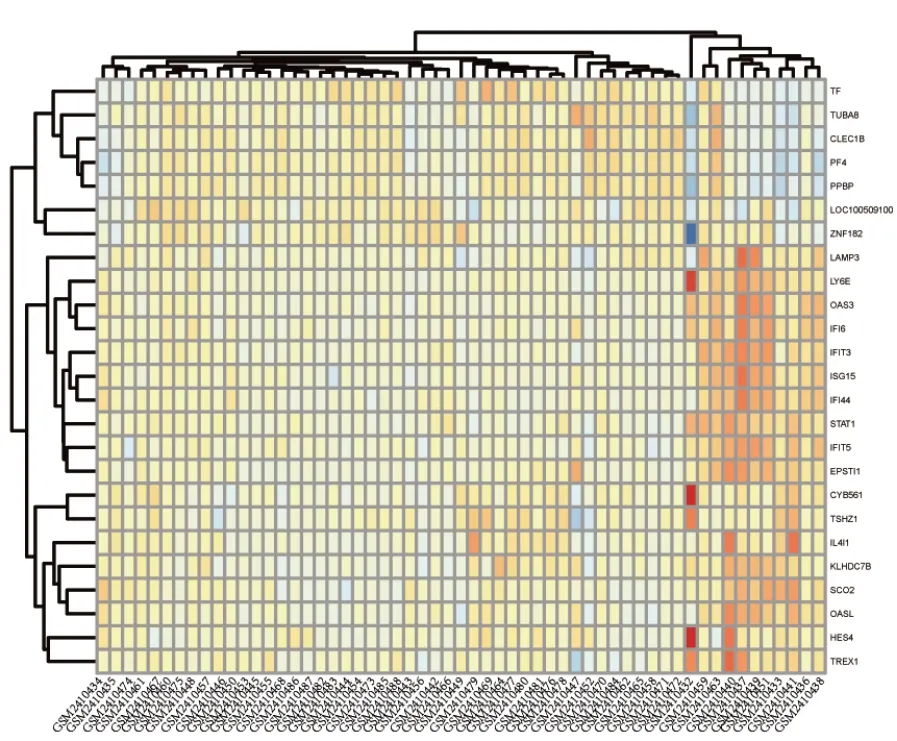
图1 差异表达基因的表达热图
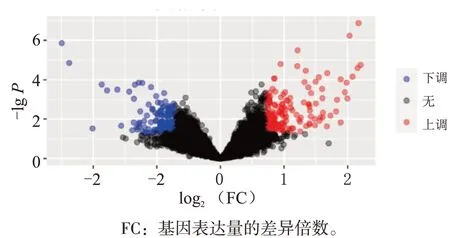
图2 差异表达基因的韦恩图
2.2 差异表达基因的KEGG和GO富集分析
根据DAVID数据库对原发灶与转移灶之间差异表达基因进行生物学功能和通路的富集分析。GO富集分析结果显示,差异表达基因生物学功能明显富集在I型干扰素信号通路、对病毒的反应、免疫反应、细胞黏附、细胞分裂、血小板活化与血小板脱粒。细胞成分主要富集在细胞质、细胞表面与染色质。分子功能主要富集在蛋白结合。KEGG通路分析显示,上调基因主要富集在矿物质的吸收,而下调基因主要富集在造血系统与血小板的活化(图3、图4与图5)。
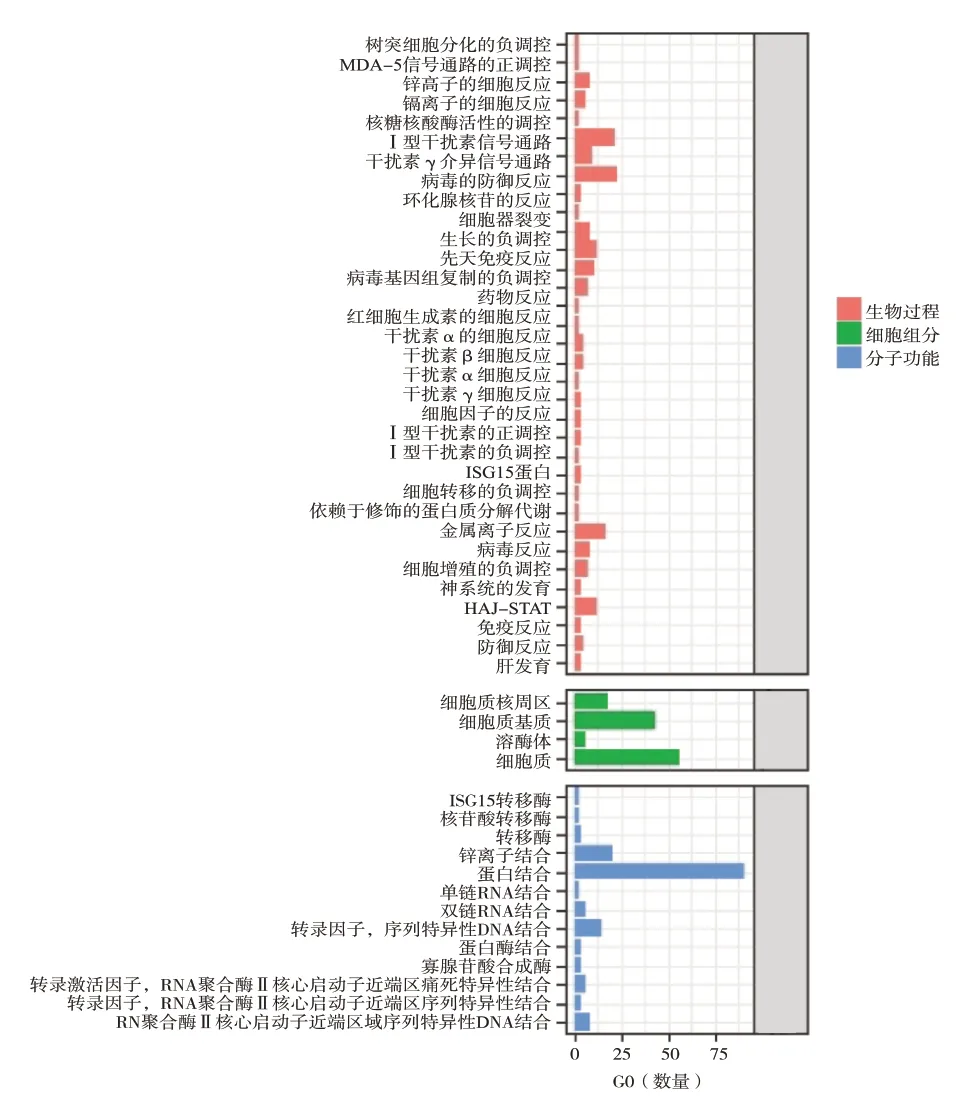
图3 上调差异表达基因的GO富集分析
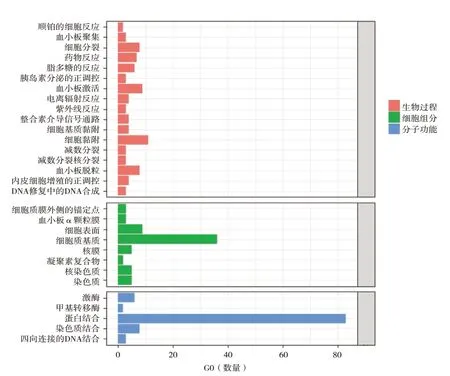
图4 下调差异表达基因的GO富集分析

图5 KEGG富集分析
2.3 蛋白质互作用网络构建与枢纽基因筛选
利用STRING数据库构建蛋白质互作用网络,将其导入Cytoscape进一步分析,并通过Cytohubba插件中的MCC算法得到网络中的枢纽基因,包括IFI44L、IFI44、HERC5、HERC6、USP18、DDX60、ISG15、MX1、RSAD2、MX2(图6)。
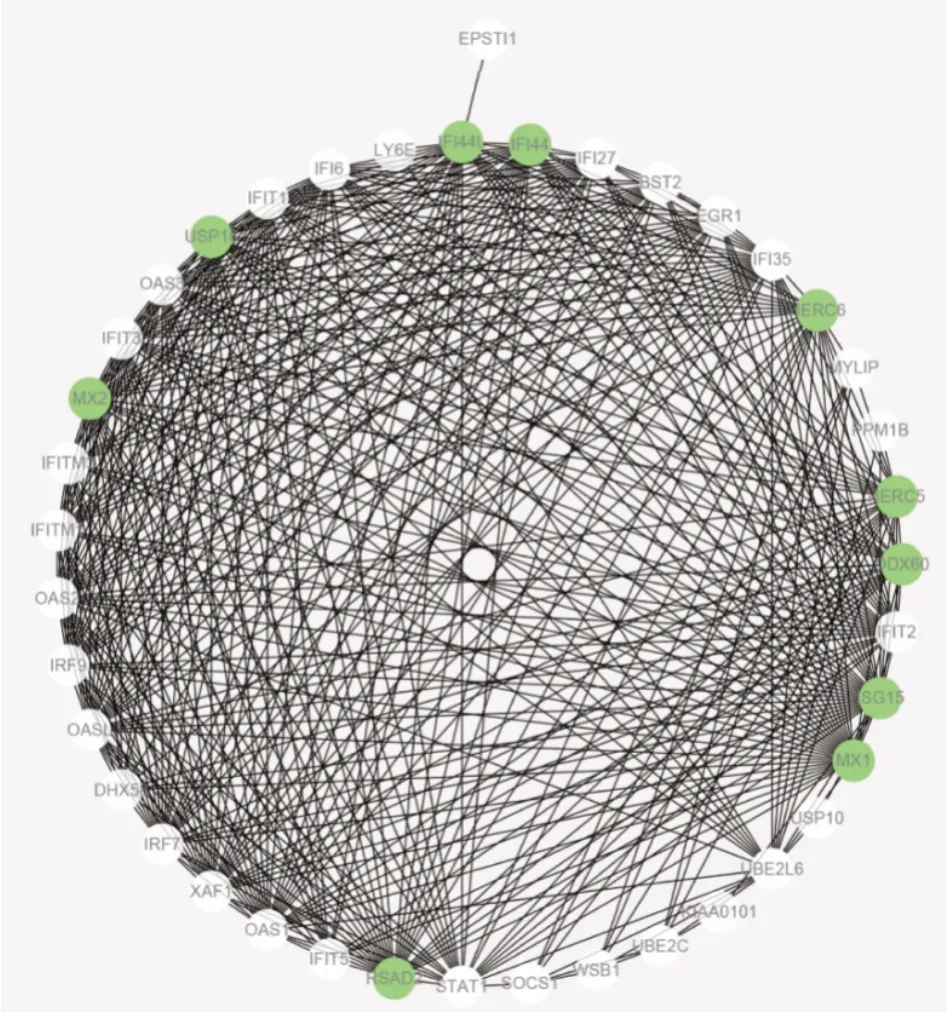
图6 蛋白质互作用网络
2.4 枢纽基因的生存预后与表达分析
通过R2平台获得10个枢纽基因在神经母细胞瘤患者中的预后分析。其中,在IFI44L、HERC5、USP18、MX1、MX2高表达患者中,总体生存率更高。MX2是唯一一个在不同分期中表达水平差异有统计学意义的枢纽基因(P=0.02)(图7)。
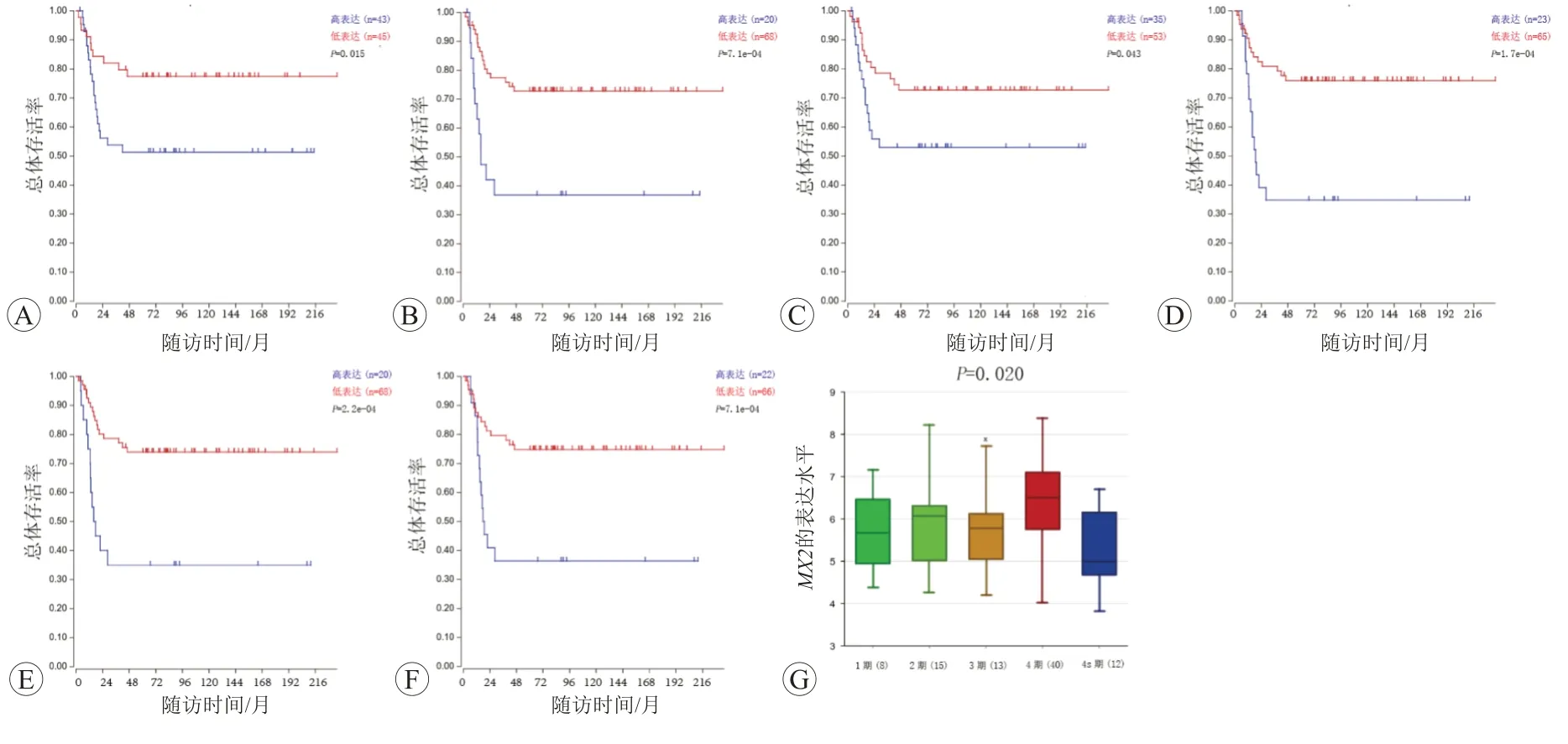
图7 生存分析与不同分期的表达水平
2.5 共表达网络的构建
将320个差异表达基因纳入共表达网络分析,定义网络拓扑拟合指数为0.8,得到最佳软阈值β=8时的邻接矩阵。基因按照相关性被分成10个模块,经模块间相关性分析合并后得到9个模块,其中与临床性状(是否转移)和肿瘤分期相关性最高的为灰色模块,且蛋白质互作用网络中10个枢纽基因皆从属于灰色模块(图8)。
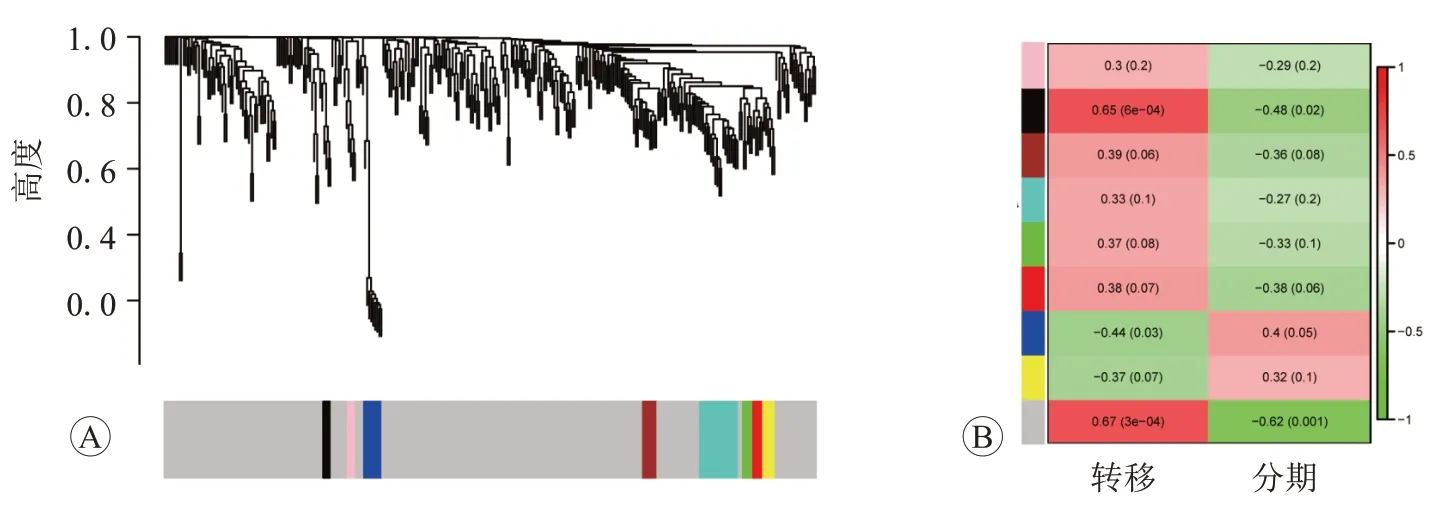
图8 加权共表达网络分析
2.6 枢纽基因筛选后验证
通过数据集GSE90121不同样本差异表达分析,结果显示10个枢纽基因在神经母细胞瘤转移灶与原发灶中表达量存在差异。在转移灶中以IFI44L、IFI44的高表达及MX2、MX1、USP18、ISG15、RSAD2、HERC5、DDX60的低表达为主(图9)。
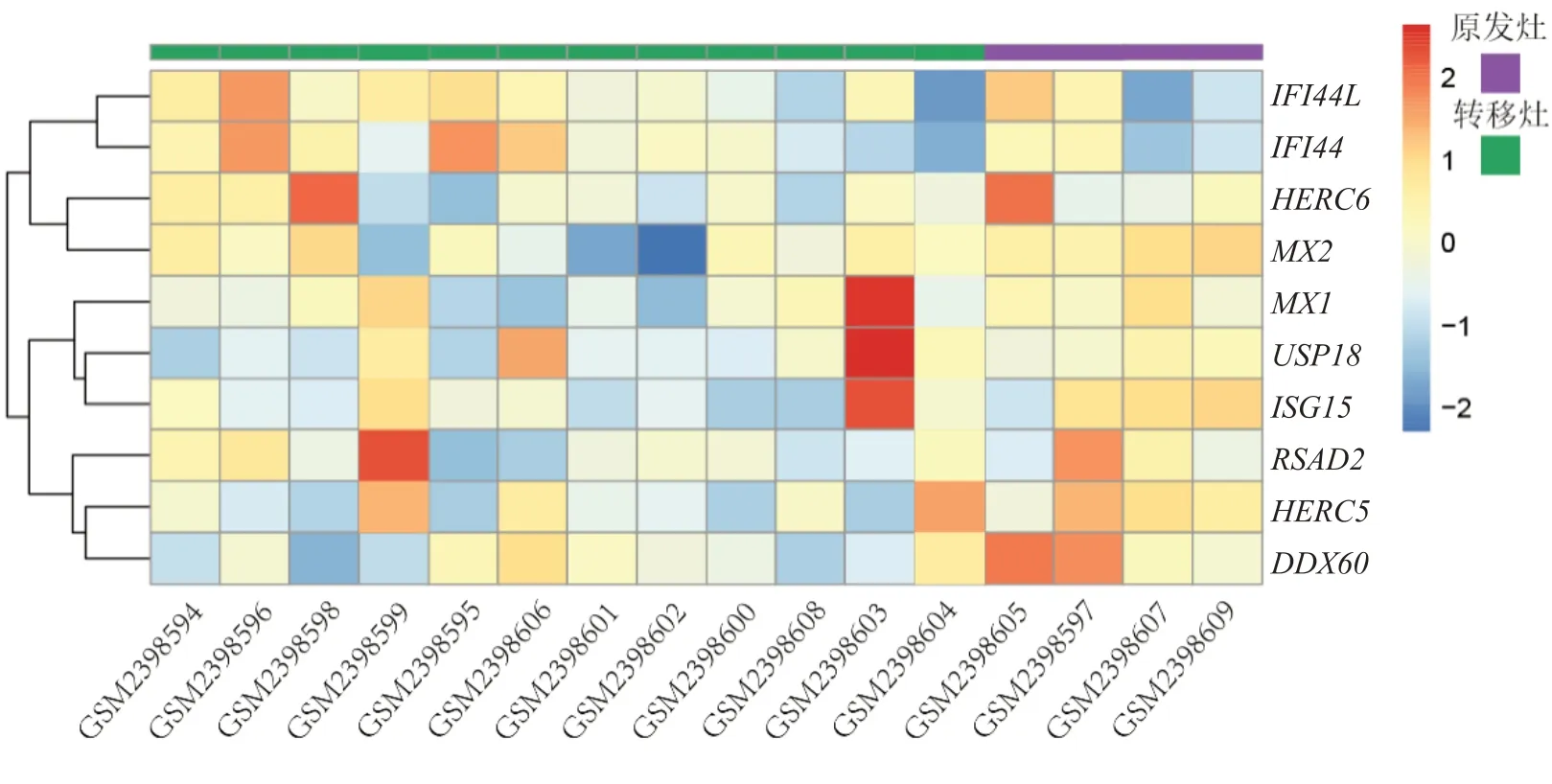
图9 外部数据集中枢纽基因的表达热图
3 讨论
神经母细胞瘤作为儿童最常见的恶性肿瘤之一,其远处转移是患儿死亡的重要危险因素,然而其转移机制目前尚不明确。本研究通过一系列生物信息学分析,筛选神经母细胞瘤原发灶与转移灶之间的差异表达基因,并通过蛋白质互作用网络与共表达网络对基因进行进一步筛选,确定了10个与神经母细胞瘤转移密切相关的枢纽基因。基于研究的结果,我们旨在寻找潜在的治疗靶点,以减少患者早期转移的可能。
我们研究中共筛选出320个差异表达基因,其中包括上调基因162个与下调基因158个。进行GO、KEGG富集分析,以探究差异表达基因之间的相互作用。上调基因主要富集在干扰素相关的信号通路与对病毒的反应。研究表明,干扰素通路的激活可以影响不同肿瘤的生长和转移[5]。还有一种观点认为Ⅰ型干扰素是由恶性细胞产生的,可以通过肿瘤细胞内在或外在的方式引发免疫反应[6]。至于对病毒的反应,我们认为与通过Ⅰ型干扰素所引发的免疫反应有关。在Xin等[7]的研究表明CD200在神经母细胞瘤中的过度表达,可下调机体的抗肿瘤免疫,调节肿瘤的免疫微环境。相比之下,下调基因主要富集于细胞黏附过程。细胞黏附过程在肿瘤的转移过程中发挥了关键作用,整合素作为主要的细胞黏附受体,决定了肿瘤转移过程中的定植位置[8]。此外下调的基因也富集于血小板的活化和脱粒。Stone等[9]证明P-选择素介导的血小板结合促进了肺小细胞癌和神经母细胞瘤的转移。
研究中最终获得10个与神经母细胞瘤转移相关的枢纽基因,分别是IFI44L、IFI44、HERC5、HERC6、USP18、DDX60、ISG15、RSAD2、MX1、MX2。通过分析枢纽基因的主要功能,我们发现Ⅰ型干扰素在其中扮演着关键角色[10]。为了研究10个枢纽基因在神经母细胞瘤转移中的作用,我们进行了加权基因共表达网络筛选分析并定位每个枢纽基因所在的模块,10个枢纽基因皆属于灰色模块,说明枢纽基因可能通过I型干扰素信号通路在神经母细胞瘤转移的过程中共表达。Ⅰ型干扰素被认为是癌症治疗的双刃剑[11]。据报道,干扰素特征基因在肿瘤的进展中起着不同的作用。Kim等[12]报道,干扰素诱导双链RNA依赖蛋白激酶在黑色素瘤淋巴结转移中和结肠癌转化中高度表达。Ⅰ型干扰素还可以上调免疫检查点抑制剂的表达水平,抑制剂对程序性死亡受体1通路治疗的阻断具有抗性[13]。干扰素-α不仅可以增强程序性死亡受体1的表达,还可以在持续的免疫反应中对T细胞反应造成衰减[14]。然而,一些研究表明在神经母细胞瘤中,Ⅰ型干扰素具有抗肿瘤作用。Streck等[15]在神经母细胞瘤小鼠模型中测试了I型干扰素的抗血管生成活性。在干扰素-α治疗的小鼠中,皮下和腹膜后的肿瘤明显变小。他们还发现干扰素-α可以降低瘤内成纤维细胞生长因子和血管内皮生长因子的表达水平[16]。Dedoni等[17]报道干扰素-β可以通过调节P38 MAPK诱导人神经母细胞瘤细胞的凋亡。这些研究表明,干扰素特征基因高表达的原因可能是神经母细胞瘤进展中机体的自身免疫反应。我们认为干扰素特征基因可以作为神经母细胞瘤患儿潜在的预后标志物与治疗的分子靶点。
总而言之,我们通过一系列生物信息学研究识别了10个神经母细胞瘤转移相关的枢纽基因。这些基因与Ⅰ型干扰素信号通路关系密切,具有作为神经母细胞瘤的诊断标志物及治疗靶点的潜能。这些发现对揭示神经母细胞瘤远处转移的研究进展具有重要意义。

