毛钩藤碱调控Shh信号通路对结直肠癌荷瘤鼠的抑瘤作用及CD4+、CD8+T细胞的影响①
王晨宇 李兴旺 张军杰 姚坤厚 华 龙 胡军红(河南大学淮河医院普通外科一病区,开封 475000)
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤,因其进展快、恶性程度高严重威胁人类的健康[1]。毛钩藤碱(hirsutine,HS)为我国传统中药钩藤中的吲哚类生物碱,属于非竞争性拮抗剂和钙离子通道阻断剂,具有降压、抗感染、心脏保护及抗肿瘤等药理活性[2-3]。研究显示,HS可抑制结肠癌细胞的增殖、迁移和侵袭,促进其凋亡[4],并具有逆转结肠癌多药耐药的作用,但未见其对CRC体内实验的相关报道。Shh(sonic hedgehog)信号通路与消化道多种恶性肿瘤密切相关[5]。研究显示Shh信号通路相关蛋白在食管癌、胃癌及CRC组织中均有高度表达[6],HS的抗肿瘤作用是否与此有关,未见相关报道,为此,本研究拟建立CRC裸鼠移植瘤动物模型,观察Shh信号通路蛋白及CD4+、CD8+T细胞的变化,进一步探讨HS抑瘤作用的具体机制和靶点,为临床上抗结肠癌新药的研制提供新的理论依据。
1 材料与方法
1.1材料
1.1.1动物BALB/c-nu裸鼠,4~6周龄,雄性,40只,体质量18~22 g,购自北京维通利华实验动物技术有限公司。动物合格证号:201911179。动物许可证号:SCXK(京)2019-1-003,动物批次号:201907013。
1.1.2药品与试剂HS(批号:16122-307,纯度≥98%,5 mg/支)购自成都普菲德生物技术有限公司;SW480结肠癌细胞购自中国科学院上海细胞库;Shh信号通路特异性抑制剂环巴胺(cyclopamine)购自美国Sigma公司;兔抗人Glil、Gli2及Shh多克隆抗体购自美国Abcam公司;兔抗人Smo和Ptch1多克隆抗体购自美国Santa Cruz公司;胎牛血清、胰蛋白酶及青霉素-链霉素混合液均购自浙江天杭生物科技有限公司。
1.1.3仪器IX73倒置荧光显微镜购自日本奥林巴斯光学有限公司;BD FACS Calibur流式细胞仪购自Beckman公司;B5060EK CO2细胞培养箱购自德国Hearers公司;JY92-2D超声波细胞粉碎机购自美国Bio-Tek生物仪器有限公司;ZHYLS1C型动物自主活动仪购自安徽正华生物仪器设备有限公司。
1.2方法
1.2.1细胞培养 常规复苏结肠癌SW480细胞,转移至含10%热灭活的胎牛血清RPMI1640培养液,迅速置于饱和湿度、37℃、5%CO2的培养箱内培养并进行传代,收集对数生长期的细胞,用0.5%胰蛋白酶消化传代,使用PBS溶液配置成细胞浓度为1.8×107个/ml的细胞悬液。
1.2.2CRC荷瘤鼠模型建立 将配置好的结肠癌SW480细胞混悬液接种于实验裸鼠的右腋部皮下,每只裸鼠接种0.1 ml,接种5 d后,可观察到裸鼠接种瘤细胞的部位出现扁平或椭圆形的包块,并且逐渐增大,视为裸鼠结肠癌皮下移植瘤模型建立成功[7]。
1.2.3动物分组和给药方法 将造模成功的40只BALB/c-nu裸鼠按照随机数字表法分为:荷瘤鼠模型组(Model)、阳性药对照组(环巴胺组,Cyclopamine)、HS低剂量(HS-low)、HS中剂量(HS-medium)和高剂量组(HS-high),每组8只。在造模第8天,皮下移植瘤直径生长至1 cm左右时进行各组的药物干预,阳性药对照组腹腔注射20 µmol/L环巴胺0.2 ml,HS干预组分别腹腔注射5、10、20 mg/kg的HS,荷瘤鼠模型对照组给予等量的生理盐水,1次/d,连续给药21 d。
1.2.4检测荷瘤鼠体质量和相对肿瘤体积的变化 各组于给药后每天测量每只荷瘤鼠的体质量,计算各组荷瘤鼠平均体质量,每天的体质量增长率(%)=(m给药第n天-m给药第1天)/m给药第1天×100%。各组荷瘤鼠在停药后第2天处死前,隔天使用游标卡尺测量每只荷瘤鼠肿瘤的短径(b)与长径(a),肿瘤体积=(a×b2)×1/2,计算各组荷瘤鼠平均瘤体积,并计算相 对 瘤 体 积 增 长 率(%)=(V给药第n天-V给药第1天)/V给药第1天×100%[8]。停药后第2天,眼眶收集静脉血后,处死各组裸鼠,无菌操作剥离肿瘤组织,放于分析天平上称取瘤重,计算各组平均瘤重,抑瘤率(%)=(m模型组平均瘤重-m实验组平均瘤重)/m模型组平均瘤重×100%[9]。
1.2.5自主活动实验检测荷瘤鼠自主活动次数的变化 在各组裸鼠处死前每隔1 d观察小鼠状态,并测定各组荷瘤鼠的自主活动次数。将荷瘤鼠放在动物自主活动仪里适应2 min,待小鼠稳定后,记录5 min内各组小鼠的自发活动次数(隔断光线活动次数)[8]。
1.2.6免疫组化法(IHC)检测荷瘤鼠移植瘤Shh信号通路关键蛋白的表达水平 采用10%的中性甲醛固定各组裸鼠无菌操作剥离的肿瘤组织,并制备石蜡切片,脱蜡至水,参考文献[10-11]的方法进行免疫组化法操作,热抗原修复,3%H2O2去离子水阻断内源性过氧化物酶,山羊血清封闭,加入兔抗人Glil(1∶1 000)、Gli2(1∶1 000)、Shh(1∶1 000)多克隆一抗及Smo(1∶1 000)和Ptch1(1∶1 000)多克隆一抗,4℃过夜,二抗(1∶1 000)37℃孵育60 min,DAB显色,苏木精染核,二甲苯透明,中性树胶封固,光学显微镜下观察。Shh、Ptch1、Smo蛋白以细胞膜或细胞浆内出现棕黄色颗粒者为阳性,Gli1、Gli2蛋白则以细胞浆或细胞核内出现棕黄色颗粒为阳性。高倍镜视野下各切片根据阳性细胞数(率)的判断标准,采用Universal Imaging Porporation图像分析系统和Meta Morph软件系统分析各组阳性细胞的IOD值,并进行定量分析。
1.2.7流式细胞术检测荷瘤鼠移植瘤和外周血中CD4+及CD8+T细胞水平 参考文献[12]的方法制备肿瘤细胞和外周血细胞混悬液。外周血细胞混悬液制备:收集外周血,加入3 ml红细胞裂解液低温裂解10 min,随后离心(300 r/min,离心半径15 cm)10 min,分离上清后再次加入3 ml红细胞裂解液低温裂解,再次低温离心(300 r/min,离心半径15 cm)10 min后,使用PBS重悬收集细胞沉淀。肿瘤细胞混悬液制备:无菌眼科手术剪破碎移植瘤组织,使用大量程移液枪吹散后过200目细胞滤网,低温离心(300 r/min,离心半径15 cm)10 min,分离上清后使用PBS重悬即可。分别吸取肿瘤和外周血细胞悬液,加入500 µl Binding Buffer悬浮细胞,再加入相应抗体染色后避光孵育,低温离心(300 r/min,离心半径15 cm)10 min后,分离上清,PBS洗涤后使用多聚甲醛定容,在过350目滤网后,流式上机检测混悬液中CD4+及CD8+T细胞水平。
1.3统计学处理 采用SPSS21.0进行统计分析,计量资料采用±s表示,多组间均数比较采用oneway ANOVA检验,两两比较采用LSD-t检验;P<
0.05表示差异具有统计学意义。
2 结果
2.1各组CRC荷瘤鼠自主活动次数比较 如图1所示,CRC肿瘤的生长明显影响各组裸鼠的自主活动次数,随着时间的推移,各组裸鼠的自主活动次数均明显减少。各用药组用药7 d后,模型组活动次数下降最为显著,与其他各药物干预组相比,差异均有统计学意义(P<0.05)。值得注意的是,在HS干预11 d后,低、高剂量组荷瘤鼠的自主活动次数与阳性药环巴胺组相比差异均有统计学意义(P<0.05),且HS高剂量组荷瘤鼠的自主活动次数下降最为缓慢(P<0.05)。
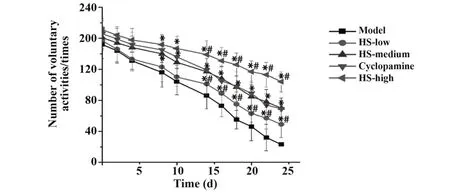
图1 各组CRC荷瘤鼠自主活动次数(±s)Fig.1 Number of autonomous activities of in each group(±s)
2.2各组CRC荷瘤鼠肿瘤质量和抑瘤率比较 如图2、表1所示,与模型组比较,阳性药环巴胺组及HS中、高剂量组肿瘤质量均显著降低(P<0.05),HR低剂量组肿瘤质量差异无统计学意义(P>0.05)。与阳性药环巴胺组比较,HS各剂量组肿瘤质量和抑瘤率差异具有统计学意义(P<0.05),且随着HR剂量增加,肿瘤质量显著降低,抑瘤率明显提高。
表1 各组CRC荷瘤鼠肿瘤质量和抑瘤率比较(±s,n=8)Tab.1 Comparison of tumor quality and tumor inhibition rate of colorectal cancer-bearing mice in each group(±s,n=8)
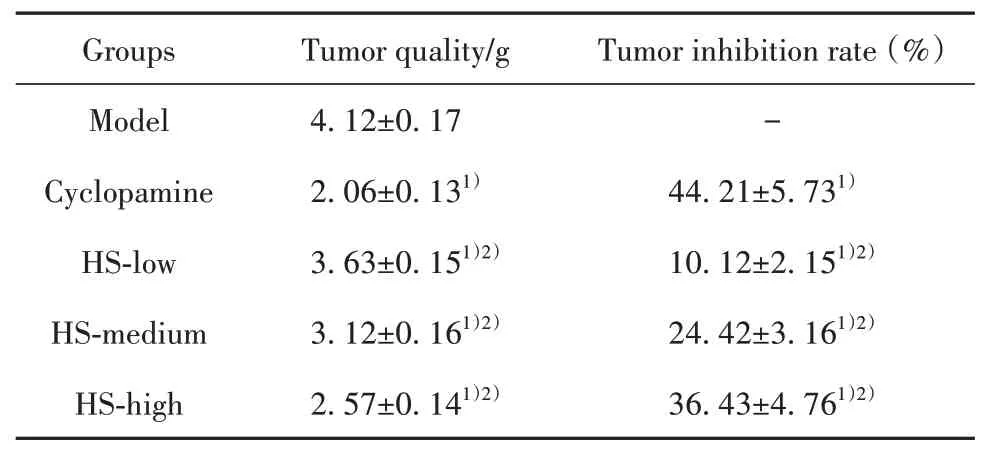
表1 各组CRC荷瘤鼠肿瘤质量和抑瘤率比较(±s,n=8)Tab.1 Comparison of tumor quality and tumor inhibition rate of colorectal cancer-bearing mice in each group(±s,n=8)
Note:Compared with model group,1)P<0.05;compared with cyclopamine group,2)P<0.05.
?

图2 各组CRC荷瘤鼠移植瘤图示Fig.2 Diagram of transplanted tumors in each group of CRC tumor-bearing mice
2.3各组CRC荷瘤鼠体质量增长率和相对肿瘤体积的比较 如图3所示,各组荷瘤鼠体质量增长率增长趋势基本一致,其中以荷瘤鼠模型组的体质量增长率提高最为显著。与模型组比较,阳性药环巴胺组在干预10 d后,相对肿瘤体积增长率显著降低(P<0.05);HS中、高剂量组在干预12 d后相对肿瘤体积增长率均显著降低(P<0.05),HS低剂量则差异无统计学意义(P>0.05)。与阳性药环巴胺组比较,HS各剂量组在干预12 d后相对肿瘤体积增长率差异均有统计学意义(P<0.05),随着HS剂量的增加,相对肿瘤体积增长率明显降低。

图3 各组CRC荷瘤鼠体质量增长率和相对肿瘤体积增长率比较Fig.3 Weight growth rate and relative tumor volume growth rate of CRC tumor-bearing mice in each group were compared
2.4HS对CRC荷瘤鼠移植瘤中Shh信号通路关键蛋白的影响 如表2所示,与模型组比较,阳性药环巴胺组及HR中、高剂量组Shh信号通路关键蛋白Glil、Gli2及Shh、Smo和Ptch1表 达 量 均 显 著 降 低(P<0.05或P<0.01),而HS低剂量差异无统计学意义(P>0.05)。与阳性药环巴胺组比较,HR各剂量组Glil、Gli2及Shh、Smo和Ptch1表达量差异均有统计学意义(P<0.05或P<0.01),并且随着剂量的增加,上述蛋白的表达量均下降。
表2 各组CRC荷瘤鼠移植瘤中Shh信号通路关键蛋白表达量的比较(±s,n=8)Tab.2 Comparison of expression of key proteins of Shh signaling pathway in transplanted tumors of CRC tumor-bearing mice in each group(±s,n=8)
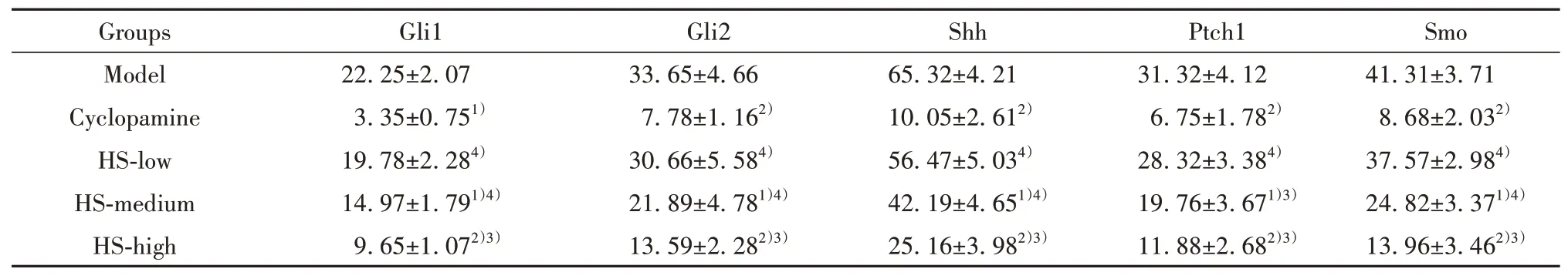
表2 各组CRC荷瘤鼠移植瘤中Shh信号通路关键蛋白表达量的比较(±s,n=8)Tab.2 Comparison of expression of key proteins of Shh signaling pathway in transplanted tumors of CRC tumor-bearing mice in each group(±s,n=8)
Note:Compared with model group,1)P<0.05,2)P<0.01;compared with cyclopamine group,3)P<0.05,4)P<0.01.
?
2.5HS对CRC荷瘤鼠移植瘤和外周血中CD4+及CD8+T细胞水平的影响 如表3、图4、5所示,与模型组比较,阳性药环巴胺组及HS中、高剂量组移植瘤和外周血中CD4+及CD8+T细胞水平均显著提高(P<0.05或P<0.01),而HS低剂量差异无统计学意义(P>0.05)。与阳性药环巴胺组比较,HS各剂量组移植瘤和外周血中CD4+及CD8+T细胞水平差异具有统计学意义(P<0.05或P<0.01),并且随着剂量的增加,CD4+及CD8+T细胞水平提高。
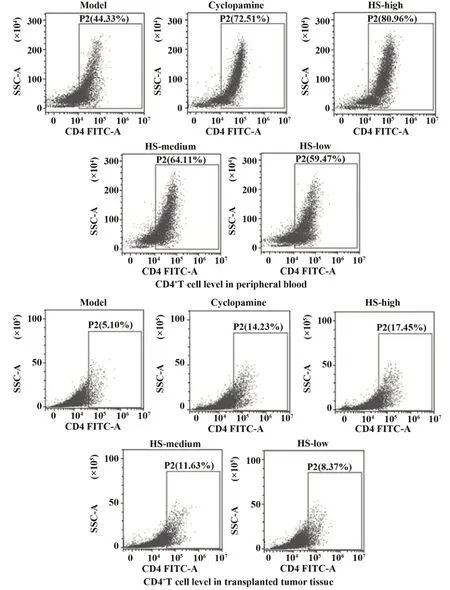
图4 各组CRC荷瘤鼠外周血和移植瘤中CD4+T细胞水平Fig.4 Levels of CD4+T cells in peripheral blood of CRC tumor-bearing mice and transplanted tumors in each group
表3 各组CRC荷瘤鼠移植瘤和外周血中CD4+及CD8+T细胞水平的比较(±s,n=8)Tab.3 Comparison of levels of CD4+and CD8+T cells in transplanted tumor and peripheral blood of CRC tumor-bearing mice in each group(±s,n=8)
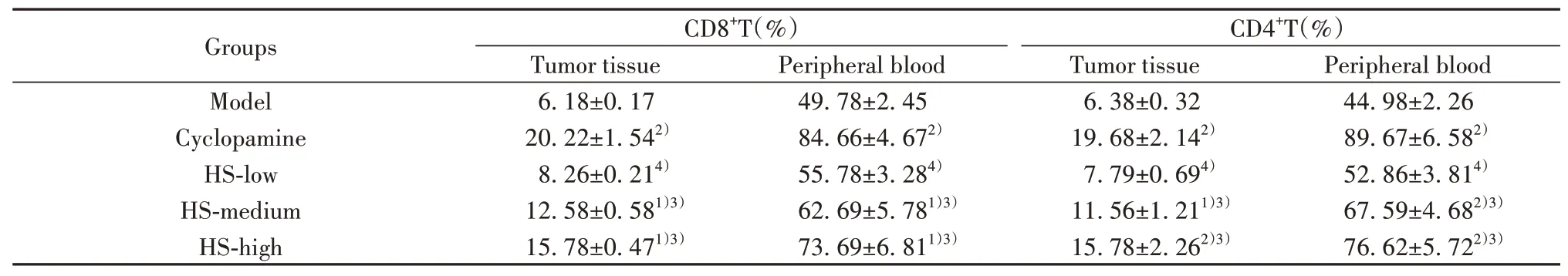
表3 各组CRC荷瘤鼠移植瘤和外周血中CD4+及CD8+T细胞水平的比较(±s,n=8)Tab.3 Comparison of levels of CD4+and CD8+T cells in transplanted tumor and peripheral blood of CRC tumor-bearing mice in each group(±s,n=8)
Note:Compared with model group,1)P<0.05,2)P<0.01;compared with cyclopamine group,3)P<0.05,4)P<0.01.
?
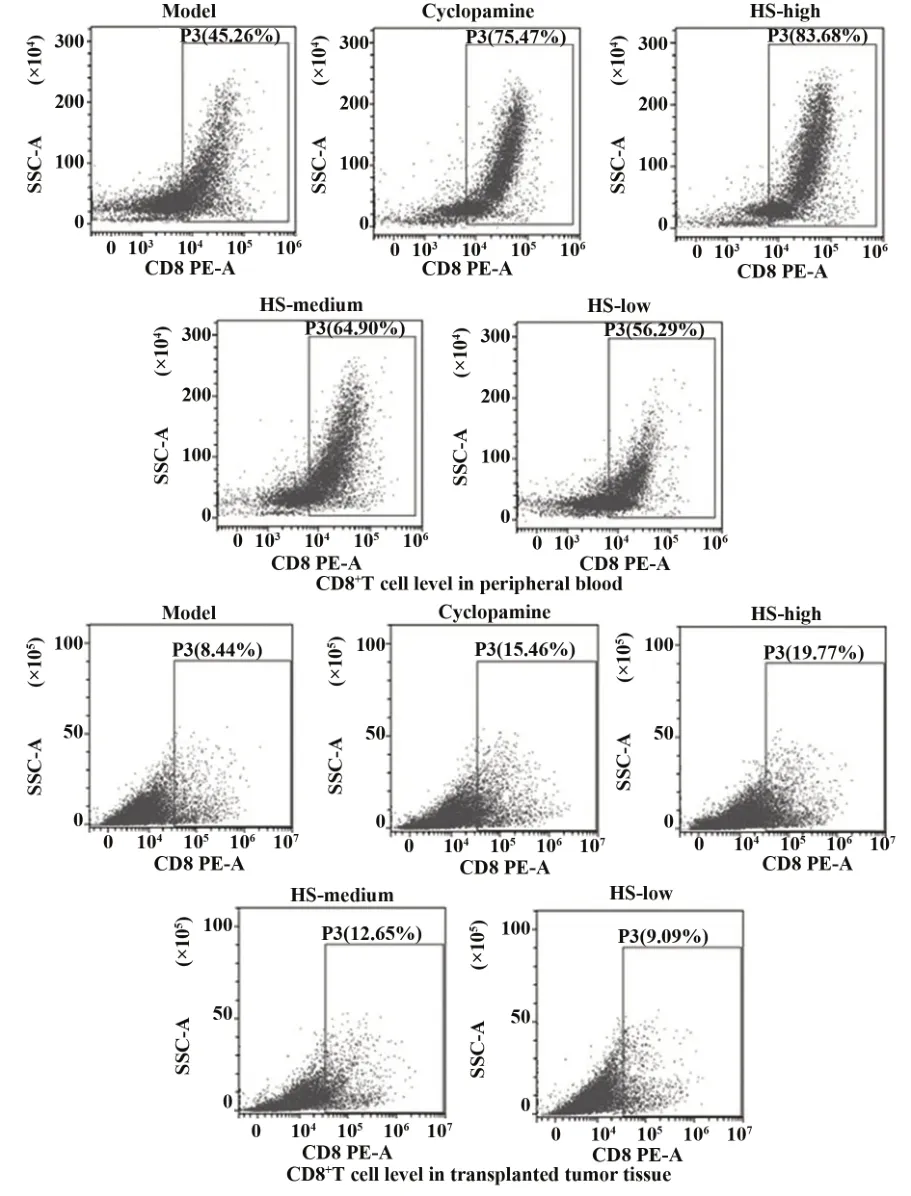
图5 各组CRC荷瘤鼠外周血和移植瘤中CD8+T细胞水平Fig.5 Levels of CD8+T cells in peripheral blood of CRC tumor-bearing mice and transplanted tumors in each group
3 讨论
茜草科植物钩藤在我国资源丰富,广泛应用于治疗心脑血管系统疾病方面,其中HS为其主要的吲哚类生物碱,在抗肿瘤方面表现出较强的药理学活性[13]。研究显示,HS可下调Bcl-2/Bax蛋白,通过线粒体途径诱导乳腺癌MDA-MB-231细胞和肝癌SMMC-7721细胞凋亡,同时HS可选择性诱导多种肺癌细胞凋亡,并能有效抑制肺癌裸鼠移植瘤的生长[14-16]。HS抑制结肠癌细胞的增殖、迁移和侵袭,促进其凋亡[4]。本研究同样发现HS能有效抑制结肠癌裸鼠移植瘤的生长,HS的干预显著提高荷瘤鼠的自主活动次数,改善荷瘤鼠的活动状态,降低瘤重,并且随着剂量的增加,抑瘤率明显提高、相对肿瘤体积增长率明显降低。本研究还发现,Shh信号通路特异性抑制剂环巴胺组在抑瘤作用方面同样具有较优的效果,提示HS对结肠癌裸鼠的抑瘤作用可能与Shh信号通路有关。
Shh信号通路在调控干细胞分化和胚胎发育中具有重要作用,近年来在食管癌、胃癌、胰腺癌、结肠癌等恶性肿瘤中均发现了Shh信号的异常激活,通路中的Ptch、Gli基因及蛋白存在明显的过表达,抑制Shh信号通路可以下调肿瘤细胞的恶性表型,诱导多种肿瘤细胞的凋亡[17-19]。研究显示,半乳糖凝集素9诱导CRC HT29细胞凋亡的作用与抑制Shh信号通路有关[20]。异甾体类生物碱环巴胺作为Shh信号通路特异性抑制剂在不同时间应用均可抑制裸鼠直肠癌移植瘤的生长,表现出了较好的抑瘤作用[21]。在本研究中,阳性药环巴胺组在提高荷瘤鼠自主活动次数,降低瘤重方面同样具有较好的作用,这与以往报道一致,同时发现HS干预组Shh信号通路关键蛋白Glil、Gli2及Shh、Smo和Ptch1表达量与环巴胺组一样均明显降低,并且随着毛钩藤碱剂量的增加,Shh信号通路关键蛋白表达量呈显现不同程度的降低,以上均可表明HS对结肠癌裸鼠的抑瘤作用与Shh信号通路有关。
研究显示,CRC组织的发生发展与癌组织局部微环境中调节性T细胞及其亚型数量的变化相关[22]。CD4+、CD8+T细胞作为动物体内自然发生的调节性T细胞的重要亚群,广泛参与多种免疫性疾病,同时还与多种恶性肿瘤有关[23]。在CRC患者癌组织和癌旁组织中CD4+、CD8+T淋巴细胞水平存在显著差异,外周血中两者的比例也明显增加[24]。多项研究已证实,CD8+及CD4+水平对判断CRC患者的预后有较好的参考价值[25]。在本研究中,环巴胺组及HS干预组中瘤体内和外周血中CD4+及CD8+T细胞水平均显著提高,并且随着HS剂量的增加,CD4+及CD8+T细胞水平均呈现不同程度的提高,以上均表明,HS与环巴胺组在改善结肠癌裸鼠细胞免疫功能,提高机体免疫状态方面同样具有较好的作用,这也可能是HS改善荷瘤鼠的自主活动状态,发挥较好抑瘤作用的另一个原因。
综上所述,HS对CRC荷瘤鼠可改善荷瘤鼠的自主状态,发挥较好的抑瘤作用,这可能与其抑制Shh信号通路,改善CD4+及CD8+T细胞水平有关。

