NLR对TACE联合仑伐替尼及免疫治疗的中晚期肝癌患者预后的预测价值
申雪晗,周江敏,张志伟,陈孝平
(华中科技大学同济医学院附属同济医院 肝脏外科,湖北 武汉 430030)
在我国,肝癌在肿瘤致死的病因中排名前三,严重威胁着我国公民的生命健康。大多数患者发病早期无明显症状,就诊时已属中晚期,失去了手术切除的机会[1]。肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)治疗联合分子靶向治疗和免疫治疗在中晚期肝癌治疗中取得了较好的效果,给部分患者带来了较好的生存获益,但部分患者治疗效果不佳[2]。有研究表明,肿瘤患者的全身炎症反应及其自身的免疫功能状态与肿瘤治疗的预后有着密切的联系[3-4],患者体内炎症反应、肿瘤微环境影响肿瘤的发生、发展[5-6]。外周血中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)是反映机体炎症状态和免疫功能的临床标志物,对多种实体肿瘤如肝癌、肺癌、胃癌、结直肠癌等的疗效、复发有一定的预测价值[7-10],但在接受联合治疗的中晚期肝癌患者中,对NLR的预测价值的研究较少。本研究旨在探索NLR(中性粒细胞/淋巴细胞)对TACE联合仑伐替尼及免疫治疗中晚期肝癌疗效的预测价值。
1 资料和方法
1.1 一般资料
回顾性分析2019年1月至2021年10月在华中科技大学同济医学院附属同济医院接受TACE联合仑伐替尼及免疫治疗的104 例中晚期肝细胞癌患者的临床资料。纳入标准:(1)BCLC分期为B期或C期;或者CNLC分期Ⅱ期或Ⅲ期;(2)肝功能Child-Pugh分级为A级或B级;(3)未行肝肿瘤切除手术、射频消融、放射治疗。排除标准:(1)合并患有全身感染、自身免疫系统疾病或患有其他类型的肿瘤;(2)曾行脾切除术;(3)应用干扰素、白介素或其他类似药物。对每例患者的住院或门诊病历资料进行查询,并记录基线检查资料、肿瘤特征、患者的死亡时间等。
1.2 方法
1.2.1 指标检测:炎症指标均在治疗前1周内获得,使用每位患者2 mL静脉血进行全血计数。采用血液分析仪进行细胞计数。NLR的值通过采用中性粒细胞和淋巴细胞的绝对计数值来获得。
1.2.2 TACE治疗:患者平卧后行腹股沟区消毒并铺巾,用2%利多卡因局部浸润麻醉后,以Seldinger技术穿刺右股动脉,置入5 F导管鞘,送入5 F Yashiro导管至腹腔干动脉、肠系膜上动脉,注入对比剂后,进行动脉造影及DSA摄影检查,明确肿瘤的位置及大小后,以适量超液化碘油、洛铂及明胶海绵颗粒行化疗栓塞,栓后造影显示栓塞效果满意。
1.2.3 靶向及免疫治疗:患者在TACE治疗后1~2周内开始口服仑伐替尼治疗,剂量为8 mg/d;同时联合免疫治疗(卡瑞利珠单抗或帕博利珠单抗、替雷利珠单抗、信迪利单抗静脉滴注治疗,剂量为200 mg),每3周进行1次免疫治疗。其中使用卡瑞利珠单抗14例,帕博利珠单抗28例,替雷利珠单抗12例,信迪利单抗50例。
1.3 随访
患者在接受第1次TACE术后1个月进行肝脏影像学检查(增强CT或MRI)及AFP等肝癌肿瘤标志物的检测,评估肿瘤治疗疗效采用改良实体瘤评价标准(mRESIST);之后每2个月进行复查评估。本研究随访截至研究随访终点(2021年10月31日)或患者死亡。
1.4 统计学分析
采用SPSS 26.0进行统计学分析。无进展生存时间(rogression-free survival,PFS)为从开始治疗到影像学评估进展或死亡的时间。总生存时间(overall survival,OS)为从治疗之日起至任何原因死亡之日止。存活的患者在最后一次随访记录时被删失。NLR的最佳截断值通过ROC曲线来确定。患者的临床特征比较通过χ2检验。NLR对PFS和OS的影响采用Kaplan-Meier法,比较生存率时采用使用log-rank检验。用Cox回归模型分析PFS和OS的危险因素。采用向前步进法Cox回归分析,将单因素分析中有统计学差异的重要因素纳入多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 NLR的ROC曲线分析
根据NLR与总体疗效的关系绘制ROC曲线并确定NLR理想界值为2.57,AUC为0.751(95%CI0.650~0.853,P<0.001),敏感度为61.3%,特异度为92.8%,见图1。
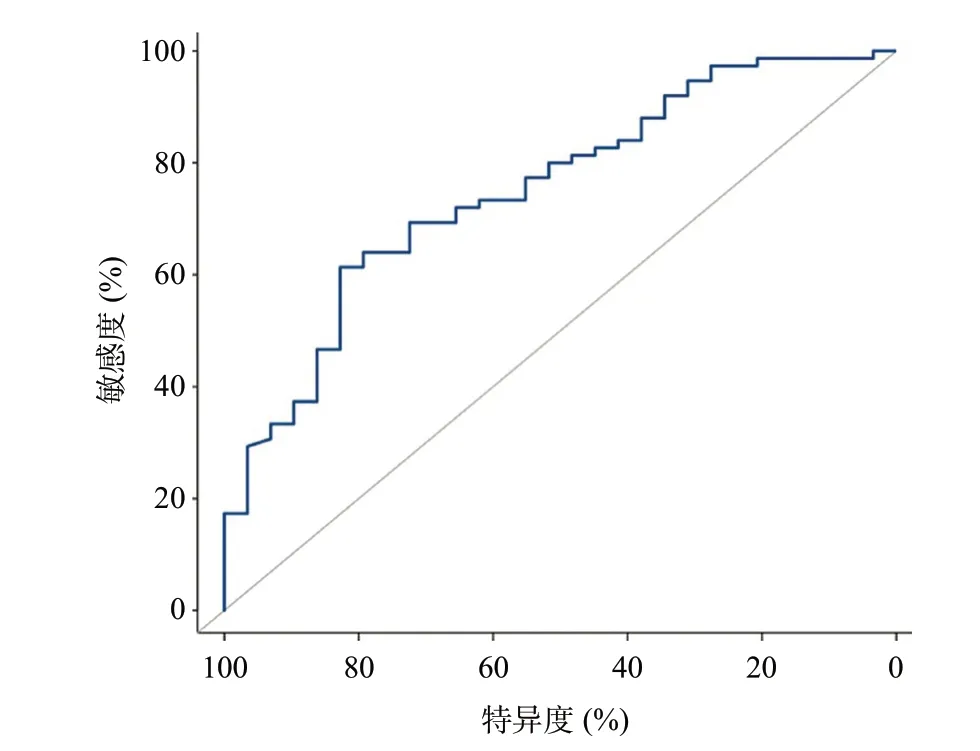
图1 NLR预测肝癌患者疗效的ROC曲线
2.2 不同NLR水平中晚期肝癌患者临床特征比较
根据NLR的理想界值,将NLR<2.57的患者归为低NLR组(n=52),将NLR≥2.57 的患者归为高NLR组(n=52)。结果显示,两组巴塞罗那肝癌临床分期、肝功能Child-Pugh分级及其他临床因素均无统计学差异。见表1。
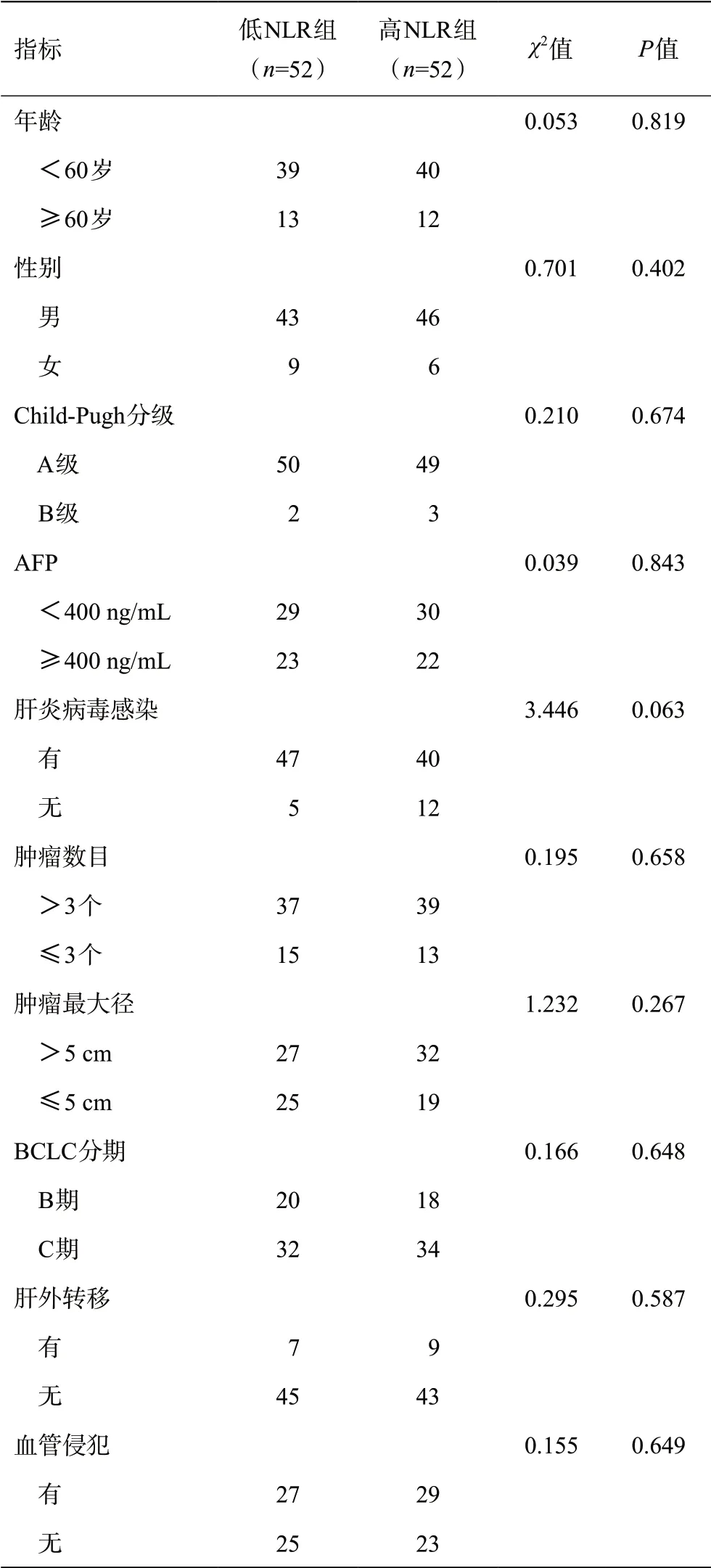
表1 不同NLR水平中晚期肝癌患者临床特征比较(例)
2.3 不同NLR水平中晚期肝癌患者生存分析
截止到2021 年10 月31 日,本研究104 例患者的中位随访时间为17(95%CI14.5~19.5)个月。中位OS为13(95%CI10.3~15.7)个月,中位PFS为6(95%CI2.8~9.2)个月。Kaplan-Meier生存显示低NLR组的中位OS(19个月vs12个月,P=0.013)与中位PFS(9个月vs3个月,P=0.002)均优于高NLR组(见图2及图3)。根据mRECIST标准评价,104例中10例(9.6%)患者达到完全缓解(complete remission,CR),24例(23.1%)患者达到部分缓解(partial remission,PR),客观缓解率(objective response rate,ORR)为32.7%;低NLR组的ORR也优于高NLR组(44.2%vs21.2%,P=0.012)。

图2 低NLR组与高NLR组中晚期肝癌患者OS曲线
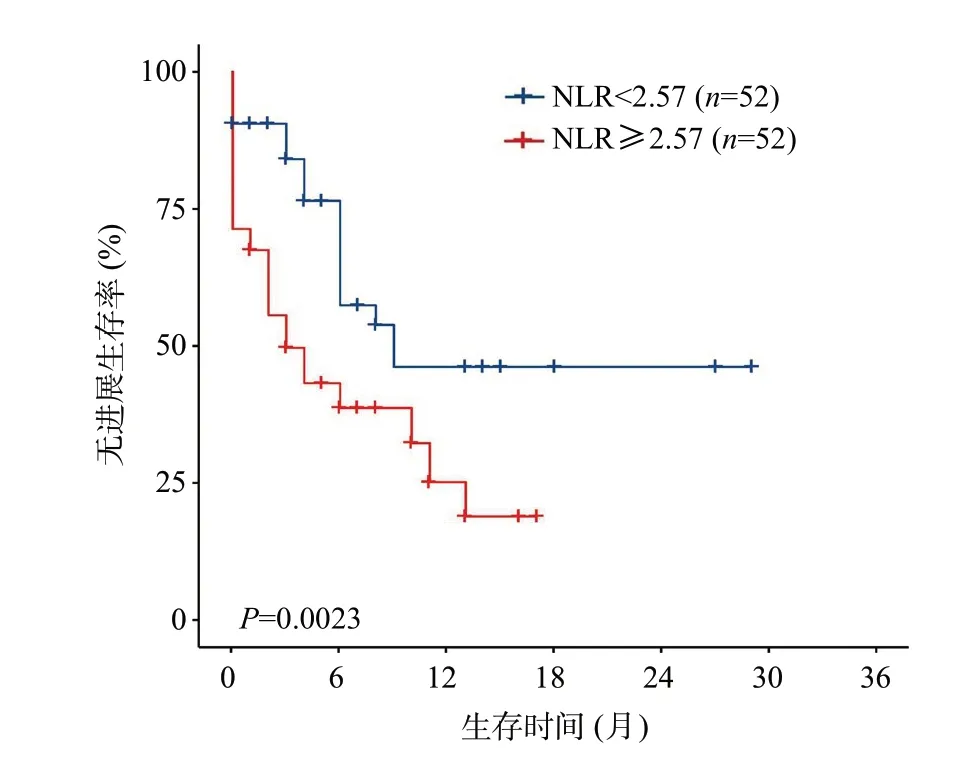
图3 低NLR组与高NLR组中晚期肝癌患者PFS曲线
2.4 预后的影响因素分析
2.4.1 OS的影响因素分析:单因素分析显示年龄、AFP水平、肿瘤大小、NLR水平与患者OS相关。将有统计差异的单因素纳入多因素分析,采用向前步进法Cox回归分析显示AFP水平、肿瘤大小、NLR水平是影响肝癌患者OS的独立危险因素(见表2)。

表2 肝癌患者OS的单因素和多因素Cox比例风险回归分析
2.4.2 PFS的影响因素分析:单因素分析显示年龄、AFP水平、肿瘤大小、NLR水平与患者 PFS相关;将有统计差异的单因素纳入多因素分析发现只有肿瘤大小、NLR水平是影响肝癌患者PFS的独立危险因素(见表3)。
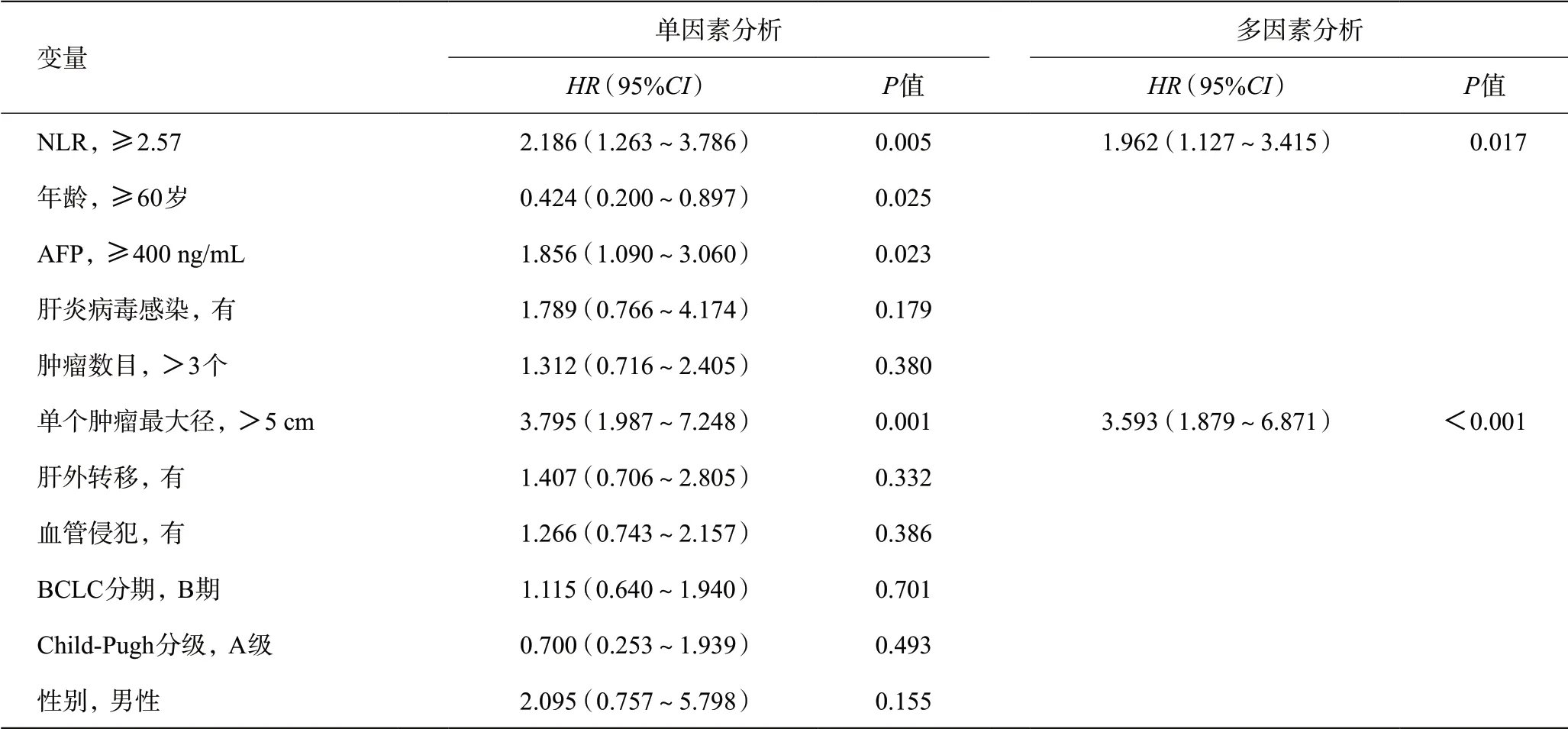
表3 肝癌患者PFS的单因素和多因素Cox比例风险回归分析
3 讨论
TACE联合靶向及免疫治疗的方案在中晚期肝癌患者的治疗中受到了越来越多的关注,在肝癌临床应用中取得了较好的疗效[2,11]。TACE是治疗原发性肝癌的有效手段[12],但由于多种生长因子(例如血管内皮生长因子)可以在缺血、缺氧的病灶组织中被激活释放,导致肿瘤微血管生成增多,从而影响治疗效果[13]。仑伐替尼作为一种受体酪氨酸激酶(receptor tyrosine kinase,RTK)抑制剂,可以抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR),对TACE术后的肿瘤微血管形成具有抑制作用[14]。REFLECT研究结果显示对于中晚期肝细胞癌患者,与单纯TACE治疗比较,TACE联合仑伐替尼的方案可有效提高ORR[15]。免疫治疗近年来的应用十分迅速,其中一项机制就是通过阻断T细胞上的程序性细胞死亡蛋白(PD-1)与其配体(PD-L1)结合,从而恢复机体免疫活性,达到消灭肿瘤细胞的目的。临床研究数据表示,免疫联合TACE治疗或靶向治疗可有效提高肝癌治疗的客观缓解率[16-18]。但是由于不同患者身体的异质性,部分患者在接受联合治疗方案后并未获得很好生存获益,因此,如何通过经济的检测手段来预测治疗的效果,筛选出接受联合治疗方案后可能会有较好的生存获益的患者是我们需要关注的重要方面。
近年来,炎症反应与恶性肿瘤之间的关系已经被广泛研究[19]。NLR可大致反映机体全身的炎性反应,人们越来越关注其与恶性肿瘤治疗的预后关系。Chon等[20]研究分析了1 697例接受了TACE治疗的肝癌患者资料,多因素分析结果显示NLR≥5 是影响患者总体生存时间的危险因素。目前尚不清楚NLR影响肝癌预后的确切分子机制。越来越多的证据表明,中性粒细胞在肝癌发生、局部肿瘤进展和转移中发挥重要作用[21]。淋巴细胞减少预示机体对肿瘤的防御能力减弱,可促进肿瘤细胞产生免疫耐受或免疫逃逸,导致肿瘤进展或转移,例如在肝癌微环境中,CD8+T细胞的监控和杀伤功能被抑制,从而促进了肝癌细胞生长[22]。
本研究显示,联合治疗前NLR<2.57的患者的中位OS及PFS均优于NLR≥2.57的患者,表明NLR表达水平升高提示患者预后不佳,这与Lin等[23]的一项荟萃分析结果类似。本研究中,通过单因素及多因素分析发现,联合治疗前NLR水平是接受联合治疗的患者OS及PFS的独立预测指标。本研究均为中晚期肝癌患者,血管侵犯及BCLC C期的患者占比较高,有研究表明在不可切除的肝癌患者中,联合治疗对有血管侵犯和肝外转移的患者有较好的疗效[18,24-25],因此这可能是本研究中血管侵犯及肿瘤分期等与预后无明显相关性的部分原因,这与Li等[26]的研究结果类似。本研究的结果为如何更加个体化地预测中晚期肝癌患者联合治疗的疗效提供了参考。本研究存在局限性:本研究为单中心的回顾性研究存在一定的选择性偏倚,样本量不高,需要进一步的前瞻性研究证实。另外,本研究中使用了多种PD-1抑制剂,影响了治疗方案的一致性。
综上所述,NLR这一可靠并容易在临床获得的生物指标可用于预测肿瘤患者的治疗效果,可帮助临床医师提早识别出可能对TACE联合仑伐替尼及免疫治疗效果较差的中晚期肝癌患者,从而制定其他的治疗方案。

