术前临床指标对肝细胞癌患者微血管侵犯分级的预测价值
张璐,任昊桢,施晓雷
(1.徐州医科大学 鼓楼临床学院,江苏 徐州 221004;2.南京大学医学院附属鼓楼医院 肝胆外科,江苏南京 210008)
原发性肝癌是全球常见的恶性肿瘤,其发病率位居恶性肿瘤第六位,死亡率位居第三位,严重危害人类的生命健康[1]。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要病理类型,全球每年约有新发病例78.2 万,占原发性肝癌的75%~85%[2]。尽管HCC的治疗方案不断推陈出新,尤其是靶向、免疫等药物治疗,但根治性肝切除仍然是HCC的首选治疗方法。然而HCC的高复发转移特性大大降低了根治性肝切除患者的远期生存率[3]。既往研究证实,微血管侵犯(microvascular invasion,MVI)是影响HCC根治性肝切除后复发转移和总生存期的独立危险因素[4]。为了降低MVI阳性HCC患者的复发转移率、改善总生存期,临床采用解剖性肝切除,扩大R0切除及术后早期辅助靶向治疗等方法,取得了很好的疗效[5-6]。如何在术前准确预测HCC患者是否存在MVI,是目前仍需解决的问题。通过循环肿瘤细胞检测、先进的影像学检查等方法对预测术前MVI分级已经取得了一定的成果,但这些方法对于硬件设备、技术支持的要求较高,无法广泛推广[7-8]。因此,探索简单易行的临床指标模型对HCC患者行MVI术前预测对于指导手术规划、制定术后辅助治疗方案、预测患者预后等具有重要意义。
1 资料和方法
1.1 一般资料
收集2017年3 月至2022年6 月在南京鼓楼医院肝胆外科收治的579例行根治性肝切除术的HCC患者的临床资料,按手术时间将2017年3月至2020年3月的279例患者归为模型组,2020年4月至2022年6月的300例患者归为验证组。纳入标准:(1)肝切除术后病理确诊HCC;(2)行根治性肝切除手术,即符合R0切除标准;(3)Child-Pugh评分为A级或B级;(4)术前未行HCC相关治疗如分子靶向、免疫等药物治疗,放疗、化疗等;(5)术前均行普美显磁共振检查明确是否存在卫星灶。排除标准:(1)合并其他恶性肿瘤或转移性肝癌;(2)合并严重心脑血管疾病或麻醉禁忌证;(3)临床资料不全。纳入病例一般情况及临床特征见表1。
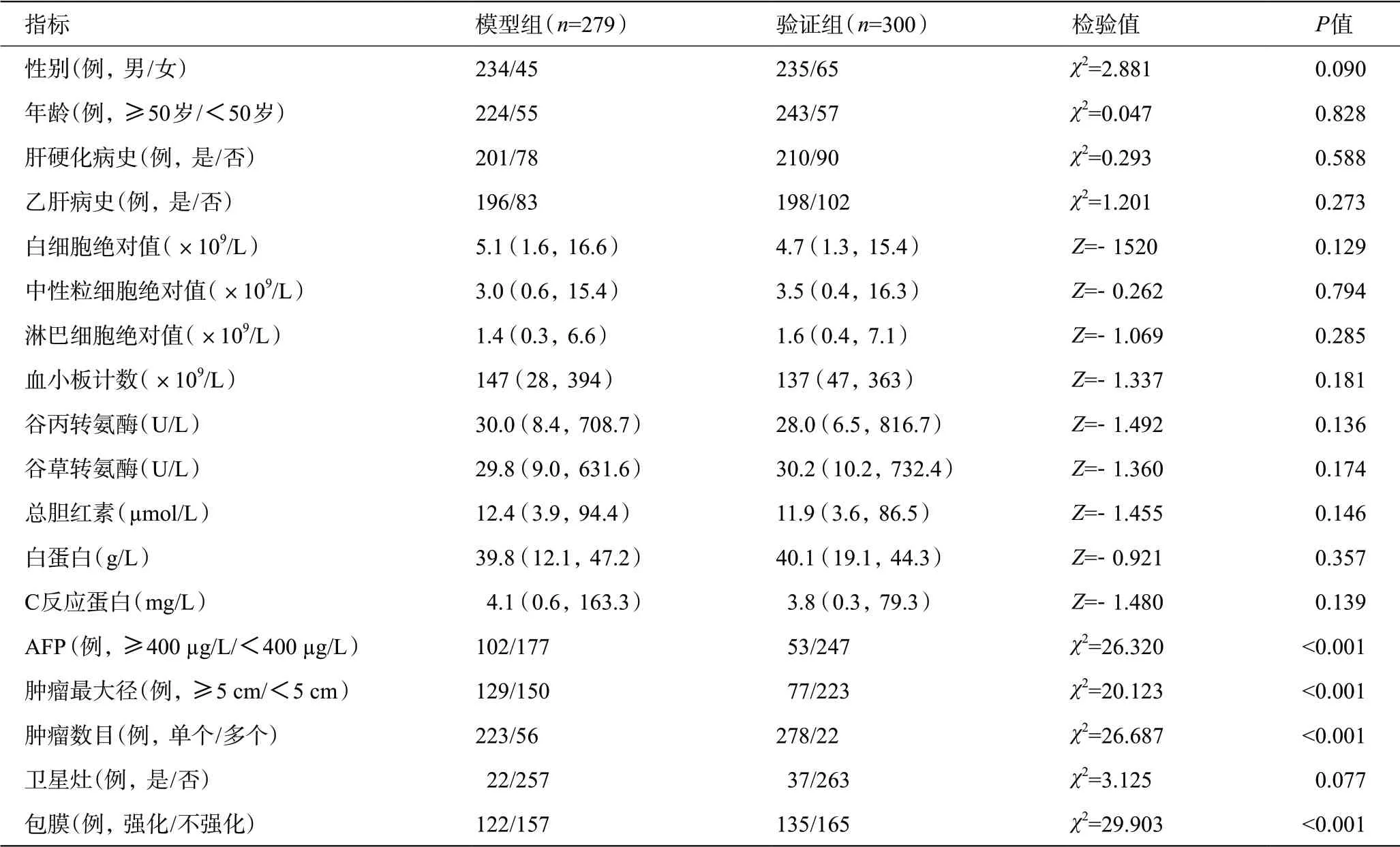
表1 纳入病例的一般情况及临床特征
1.2 观察指标
(1)一般临床资料:性别、年龄、有无肝硬化、有无乙肝感染等;(2)术前实验室检查:白细胞绝对值、中性粒细胞绝对值、淋巴细胞绝对值、白蛋白(albumin,ALB)、总胆红素、血小板计数、C反应蛋白、纤维蛋白原、丙氨酸氨基转移酶(alanine transaminase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、甲胎蛋白(alpha fetoprotein,AFP);(3)术前影像学检查:取腹部增强CT或普美显磁共振的肿瘤最大径、肿瘤数目、肿瘤包膜、卫星灶。其中肿瘤包膜强化为在影像学上表现为门静脉期或延迟期HCC边缘完整环形强化影;无完整包膜为除外完整包膜的所有病例;卫星灶为普美显磁共振显示的肝内卫星型转移灶。
1.3 统计学分析

2 结果
2.1 模型组预测MVI指标的最佳临界值
利用ROC曲线确定术前临床指标预测MVI的最佳临界值。白细胞绝对值>6.45×109/L、中性粒细胞绝对值>2.25×109/L、淋巴细胞绝对值>1.25×109/L、血小板计数>110.5 g/L(图1)。本研究中ALT>50 IU/L、AST>45 IU/L,总胆红素>34 μmol/L,白蛋白>35 g/L,C反应蛋白>8 mg/L,指标界值采用南京鼓楼医院实验室检查正常范围上限。

图1 术前临床指标预测MVI的ROC曲线
2.2 模型组MVI危险因素
本研究模型组男234 例,女45 例,年龄24~87岁,平均(55.7±0.7)岁;HCC单发223例,多发56例。术后病理提示189例(67.7%)MVI阳性,90例(32.3%)MVI阴性。单因素分析显示(表2):AFP>400 μg/L、肿瘤数目>1个、肿瘤最大径>5 cm、存在卫星灶、有包膜强化与MVI相关。采用逐步向前法对上述指标进行多因素Logistic回归分析结果显示(表3):肿瘤最大径>5 cm、肿瘤数目>1 个、有包膜强化及AFP>400 μg/L是MVI发生的独立危险因素。
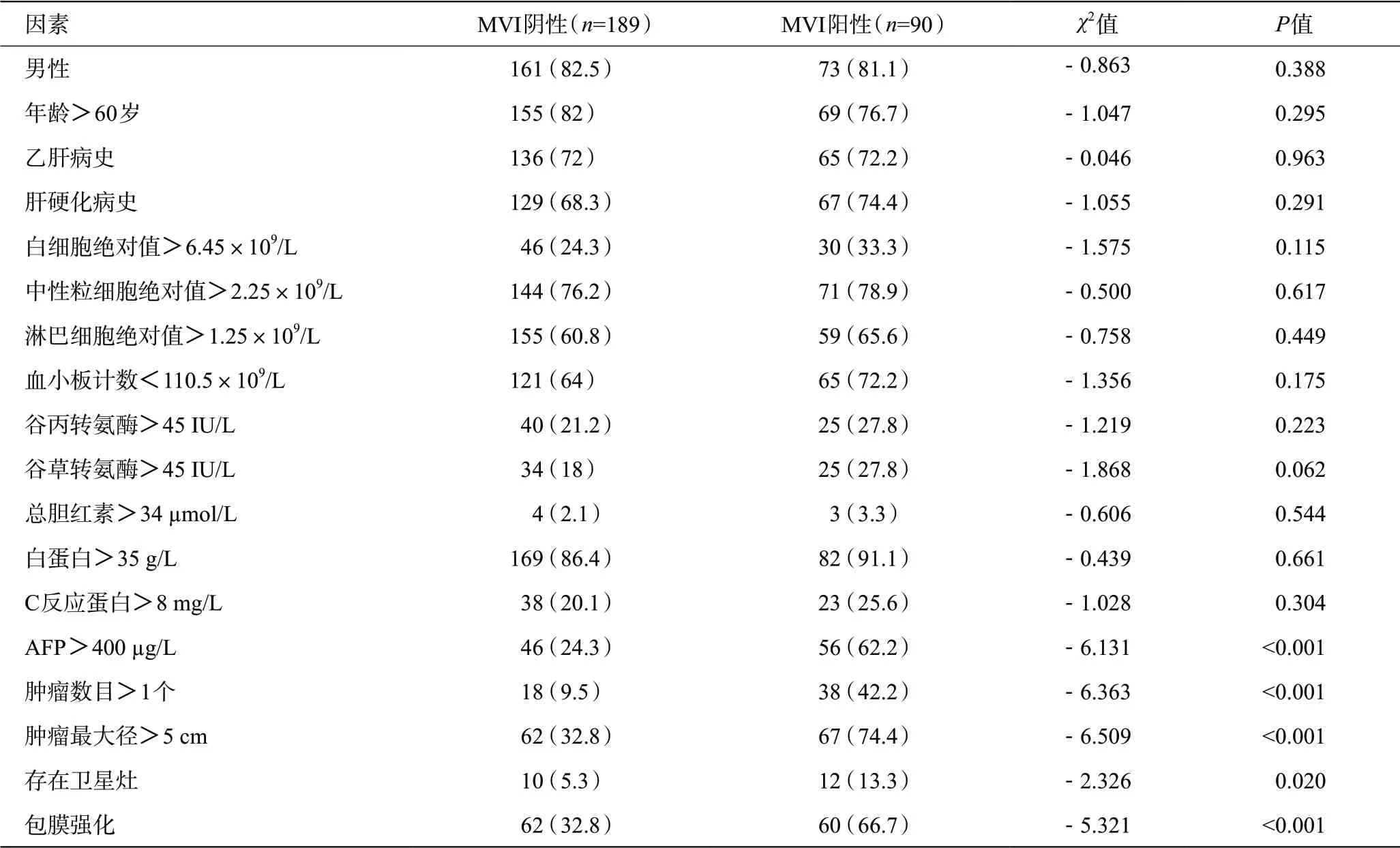
表2 模型组并发MVI的单因素分析[例(%)]
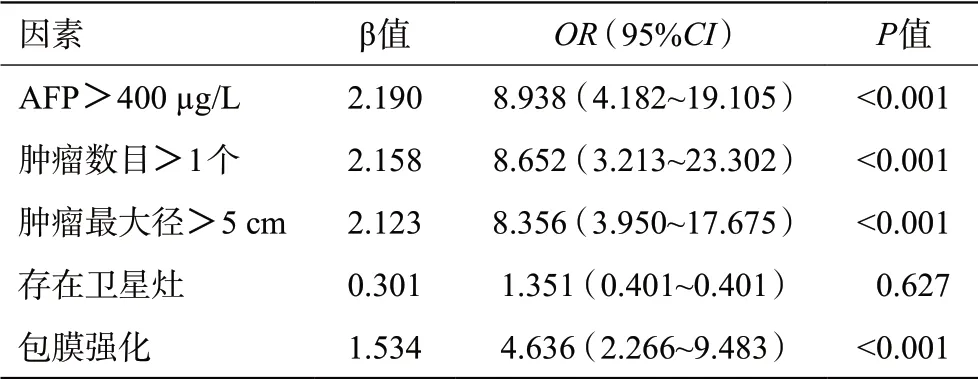
表3 模型组并发MVI的多因素分析
2.3 预测模型构建及验证
若存在AFP≥400 μg/L,肿瘤最大径≥5 cm或肿瘤数目大于1,计3分;若存在有肿瘤包膜强化则分别记2分。采用ROC曲线分析评分模型和组成因素对MVI的诊断价值,预测模型预测模型组术前MVI的曲线下面积(AUC)为0.866,应用Youden’s指数计算预测模型的截断值为4,以该截断值诊断MVI的灵敏度为81.1%,特异度为79.9%(表4,图2)。

图2 预测模型及其组成因素的ROC曲线
2.4 MVI预测模型的验证
验证组男235例,女65例,年龄34~91岁,平均(60.1±0.7)岁,HCC单发278例,多发22例。术后病理提示100例(33.3%)患者MVI阳性,200例(66.7%)患者MVI阴性,以截断值4 预测模型在验证组中预测MVI的AUC为0.815,灵敏度为84.0%,特异度为79.5%(表4,图3)。

表4 预测模型的ROC分析结果
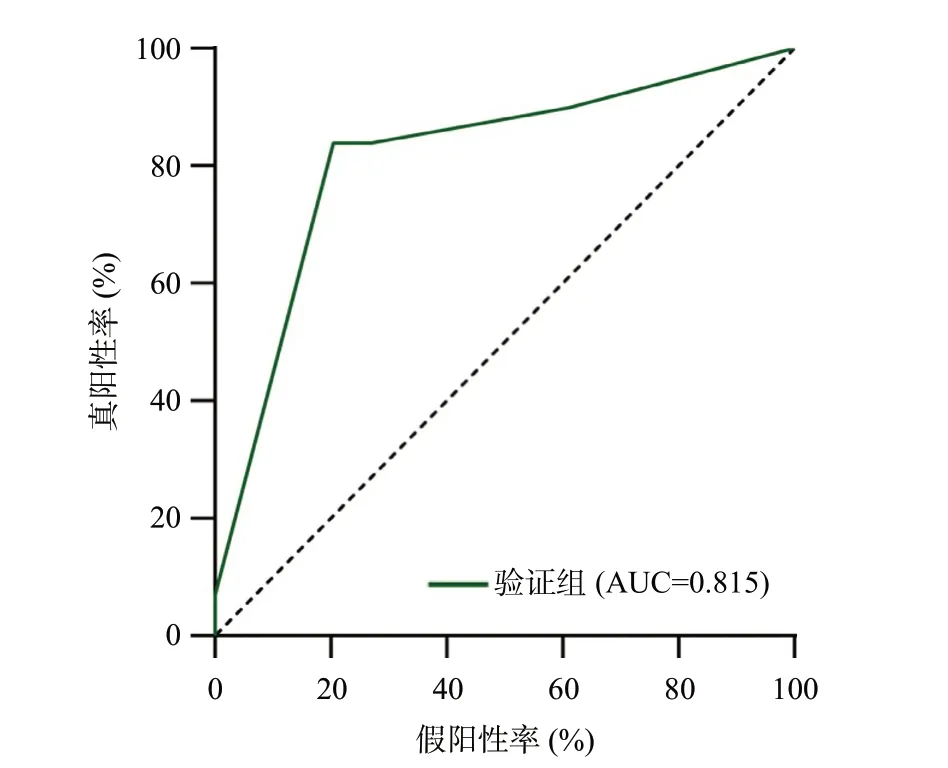
图3 验证组预测模型的ROC曲线
3 讨论
MVI常见于临床HCC患者,是预后不良的危险因素,随着研究的不断深入,其在指导临床决策、预测复发和评估预后方面发挥着不可或缺的临床价值[9]。MVI指微静脉内有成团的癌细胞且周围有明确的内皮细胞环绕,分为三个级别。(1)M0:未发现MVI;(2)M1:近癌旁肝组织中出现且不超过5个MVI,为低危组;(3)M2:近癌旁肝组织中出现或至少有6个MVI,为高危组[10]。MVI已应用于肝移植手术指征判断、手术方式选择、R0切除范围判定和是否使用新辅助化疗[11-12]。而HCC行肝切除治疗的手术切缘目前尚未有公认的标准。美国肝胆胰协会及肿瘤外科学会推荐1~2 cm的手术切缘,但在实际情况下,受切除后肝脏剩余体积、肿瘤与重要大血管的关系等因素的制约,实际往往难以确定合适的R0切除范围[13]。虽然大部分关于HCC肝切除切缘的研究未考虑MVI的因素,强光辉等[14]研究发现,较大手术切缘对于改善MVI阳性组患者的DFS及OS具有统计学差异;而手术切缘对于MVI阴性组患者的预后未表现明显的统计学差异。因此,MVI可以在一定程度上指导临床决策、判断R0切除范围。MVI阳性的HCC患者应在满足肝脏剩余体积的条件下,争取更大的切缘和R0切除范围,以减少肿瘤复发转移可能,提高患者预后。
此外,如何准确在术前判断患者是否存在MVI也是目前临床面临的问题。MVI的诊断金标准为术后病理,虽然肝肿瘤穿刺活检对于MVI的诊断有一定的敏感性和特异性,但仍然处于较低水平,因此临床上缺少无创的准确预测手段,术前难以明确患者MVI的程度和分级[15]。目前,关于MVI术前预测的研究大多局限于影像学检查,且基于这些理论的研究结论存在较大偏差,因为不同影像学判读人员对于MVI的判断存在差异,导致术前诊断MVI的准确性降低[16-17]。因此,基于临床的术前预测MVI的相关指标获得了广泛关注,包括AFP、microRNA、循环肿瘤细胞等,它们对MVI的诊断都具有一定的价值[18]。
单个因素预测MVI往往存在敏感度和特异度相对较低的问题,通过建立预测模型可以综合多个因素,提升诊断效能。Cucchetti等[19]使用特定的软件通过AFP水平、肿瘤数目、大小和体积等临床指标,建立的预测模型可有效预测MVI的发生,但方便性和推广性受限。Lei等[20]发现肿瘤最大径、数量、包膜、AFP、血小板、HBV-DNA载量和典型影像学动态变化图像这7 个因素跟MVI的发生相关,以此建立的MVI预测模型,其敏感度、特异度分别为73.5%、76.6%,但仍具有较大的限制性。黄晨军等[21]通过年龄、血小板、白蛋白、IgAFP、AFP-L3、异常凝血酶原等指标构建的诊断模型,其敏感度、特异度分别为72.70%、62.00%,然而Logistic回归方程运算复杂,不方便临床应用,且其预测的特异性相对较低。
本研究多因素回归分析结果显示:肿瘤数目、肿瘤最大径≥5 cm、AFP>400 μg/L、肿瘤包膜强化等术前临床指标均是MVI的独立预测因子。血清AFP作为预测早期MVI的重要血清学指标已得到广泛认可,Zhao等[22]研究结果显示截断值为400 μg/L,对MVI均有较好的预测效能,与本文研究结果相符。Eguchi等[23]研究证实提出肝癌肿瘤最大径>5 cm是预测MVI的危险因素,与本研究多因素结果相同,随着肿瘤最大径增大MVI发生的风险也会随之增加。这可能是由于肿瘤血管为肿瘤生长提供营养,改变免疫微环境,加速肿瘤的恶性进程导致[24]。Banerjee等[25]研究显示肿瘤数量越多,MVI存在的可能性越大,提出MVI通常与肿瘤负荷有关。Wang等[26]的一项纳入469例HCC患者的回顾性研究发现肿瘤包膜是否强化是预测MVI的独立危险因素,并且与患者预后相关,本研究进一步验证了上述观点。根据回归方程分析,由上述四种因素构成的评分预测模型,并通过ROC曲线分析发现此评分预测模型对MVI诊断的敏感度和特异度可达到81.1%和77.9%,验证组的敏感度为84.0%和特异度79.5%,高于上述任一预测因子单独应用。此外,本研究预测模型的各个构成因素均为术前简易可得的临床指标,具有较好的实用性、推广性和临床诊断价值。
综上所述,本研究通过临床特征指标进行统计分析,构建基于AFP水平、肿瘤最大径及数目、包膜强化的预测模型可有效判断术前是否合并MVI,筛选高危复发人群,对于指导临床决策、全面术前预后评估具有重要参考价值。

