花生籽仁品质性状高通量表型分析模型的构建
纪红昌 胡畅丽 邱晓臣 吴兰荣 李晶晶 李 鑫 李晓婷 刘雨函 唐艳艳 张晓军 王晶珊 乔利仙,*
花生籽仁品质性状高通量表型分析模型的构建
纪红昌1胡畅丽1邱晓臣1吴兰荣2李晶晶1李 鑫1李晓婷1刘雨函1唐艳艳1张晓军1王晶珊1乔利仙1,*
1青岛农业大学农学院 / 山东省花生产业协同创新中心 / 山东省旱作农业技术重点实验室, 山东青岛 266109;2青岛市农业技术推广中心, 山东青岛 266100
花生是重要的油料作物之一, 其籽仁品质直接影响加工特性, 是花生品质评价的重要指标。建立花生籽仁品质高通量分析模型, 快速高效地对花生籽仁品质进行评价, 可显著提高花生育种效率。本研究选用宇花14与LOP215杂交构建的140个RIL家系和35份其他品系为建模材料, 使用Thermo公司生产的Antaris II型傅立叶变换近红外光谱分析仪对175份样品籽仁进行光谱采集。采用索氏提取法测定籽仁含油量, 杜马斯定氮法测定蛋白含量, 蒽酮比色法测定糖含量, 气相色谱法测定脂肪酸含量。利用偏最小二乘法(partial least squares, PLS)构建花生籽仁含油量、蛋白含量、糖含量以及部分脂肪酸含量的多粒近红外定标模型。选用未参与建模的30份花生样品对该模型进行验证, 模型决定系数2值均大于0.9000, 表明该模型可用于花生籽仁品质性状的分析预测。本研究为花生籽仁品质性状高通量表型分析提供了检测模型。
花生; 籽仁; 含油量; 近红外模型; RIL群体
花生(L.)是重要的经济作物和油料作物之一, 花生籽仁中脂肪、蛋白质及糖含量约为50%~ 55%、25%~30%和3%~10%。目前, 榨油是我国花生的首要用途, 约占花生总产量的51%, 花生油中含有约80%的不饱和脂肪酸, 属于被大众认可的健康食用油[1]。随着人们生活水平的逐步提高及消费习惯的变化, 花生作为食品消费呈上升趋势, 加工企业对花生原料的需求也越来越多样化。花生蛋白质含量约25%~30%, 含人体所必需的8种氨基酸, 是一种完全蛋白质, 花生蛋白质非常容易被人体消化吸收, 消化系数在90%以上[2]。榨油后的花生粕成为优质的蛋白质源用作动物饲料[3]。对于食用性花生而言, 花生的甜度是一个重要的评价指标, 直接影响食用性花生的加工风味, 花生甜度与籽仁中可溶性糖含量密切相关, 可溶性糖含量的高低对于食用花生的经济价值有重要影响[4]。花生中脂肪酸含量的差异也直接影响到花生的品质, 如提高油酸含量被认为有利于心血管健康, 并可延长花生制品的货架期[5]。
我国花生品种丰富, 但长期以来育种者主要侧重于对重要农艺性状及产量进行选择, 对荚果及籽仁的品质特性选择重视不够[6-8]。新时期花生新品种选育不仅要注重产量, 更要注重品质, 以满足不同加工企业的原料采购需求。品质性状包括含油量、蛋白含量、糖含量以及各种不同的脂肪酸、氨基酸、微量元素等的含量[9]。利用传统的化学分析方法进行检测需要专门的实验设备、费时费力、投入成本高、而且需要破碎种子, 难以用于花生早期育种材料的选择。高通量表型分析平台的建立是育种的刚需, 具有检测速度快、无损伤且可以实现高通量测定等优势。本研究拟选用花生遗传群体材料进行含油量、蛋白质含量、可溶性糖含量以及不同脂肪酸含量等品质性状检测模型的构建, 旨在满足花生品质性状高通量分析的实际检测需求[10-11]。
近红外光谱检测法因其简单方便以及对籽仁无损伤的优点而得到广泛应用, 但首先需要针对具体的性状建立检测模型; 所建模型不具有通用性, 需针对不同的仪器建立不同的模型[12-13]。本研究利用花生重组近交系(recombinant inbred lines, RIL)群体进行花生籽仁品质性状的测定。通过一次取样, 分别采用索氏提取法、杜马斯燃烧法、蒽酮比色法和气相色谱法(GC)来测定花生籽仁脂肪含量、蛋白质含量、可溶性糖含量和不同脂肪酸含量, 利用Thermo公司生产的Antaris II型傅立叶变换近红外光谱分析仪建立花生籽仁品质性状的定标模型, 可以实现花生籽仁无损伤高通量的早期筛选, 对于加快花生品质性状选择以及选育适合不同加工需求的花生专用品种具有重要意义。
1 材料与方法
1.1 试验材料
本研究采用的花生材料是由宇花14与LOP215杂交构建的重组自交系群体中140个F7家系和35份育种高代品系。宇花14由青岛农业大学花生研究中心选育, 籽仁脂肪含量大于55%, 油酸含量约为40%。LOP215为低油高油酸品系, 其籽仁脂肪含量小于50%, 油酸含量大于75%。175份供试花生材料按1~175编号。选成熟饱满的花生籽仁为试验材料进行后续模型构建。
1.2 花生籽仁的光谱采集
采用Thermo公司(美国)生产的Antaris II型近红外光谱仪对175份花生材料进行光谱采集。将近红外光谱仪预热30 min, 调整环境温度为25℃, 在Thermo RESULT工作软件中校准仪器、选择工作流和调整光谱仪参数。从每个株系中随机挑选30~40粒花生籽仁装入样品杯进行光谱采集, 采集光谱时, 将花生籽仁铺满整个样品杯。重复装样扫描3次, 获取平均光谱用于模型的建立。
1.3 花生籽仁脂肪含量、蛋白含量及可溶性糖含量的测定
参照油料种籽含油量测定法(残余法) (NY/T 1285-2007)[14]测定花生籽仁脂肪含量, 脂肪含量(%) = (m2-m1)/m2× 100% (m2为提取前的样品质量, m1为提取后的样品质量)。每份花生样品重复测定3次取均值。
采用杜马斯燃烧法[15]测定蛋白含量, 设定载气流量为He流量220.4 mL min–1, O2流量405.7 mL min–1。设备温度为燃烧管温度950℃, 还原管温度为650.4℃。在进样盘中装入4个空锡纸, 燃烧排进仪器内的空气, 取脱脂后的花生粉约0.1 g, 精确至0.0001 g, 使用锡囊包裹, 置于进样盘中进行检测。定氮仪将根据样品N面积得出样品的蛋白质含量, 脱脂样品蛋白质含量(%) = 样品N百分含量´6.25´100%, 花生籽仁原样蛋白质含量(%) = 脱脂样品蛋白质含量(%)´花生原样脂肪含量(%)。每个样品重复测定3次。取均值为标准值。
采用蒽酮比色法[16]测定可溶糖含量。按照表1所示配制可溶性糖标准品溶液, 结合比色法绘制可溶性糖标准曲线。取脱脂后的花生粉1~1.5 g于50 mL离心管中, 加入45 mL蒸馏水, 置于超声波水浴锅中80℃超声加热45 min, 每隔10 min混匀试管一次。冷却至室温后过滤定容至100 mL容量瓶中, 摇晃混匀, 取1.5 mL溶液采用蒽酮比色法进行可溶糖含量的检测。每份样品测定3次, 取均值作为标准值, 根据标准曲线计算可溶性糖含量。脱脂粉含糖量 = 曲线所得的数值×稀释倍数/脱脂粉重量×100%。

表1 可溶性糖标准曲线绘制所需标准品溶液
1.4 花生籽仁脂肪酸含量测定
采用1.3方法提取的花生脂肪, 取1 mL样品加入 1 mL 0.4 mol L–1甲醇钠甲酯化处理, 采用安捷伦7890气相色谱仪进行脂肪酸分析, 色谱柱采用DB-23毛细管柱(30 m × 0.25 mm × 0.25 μm, 美国Agilent公司), 进样量为1 µL。根据标准品利用面积归一化法[17]计算各种脂肪酸的相对含量。每个样品重复测定3次取均值为脂肪酸含量标准值。
1.5 花生籽仁品质性状近红外模型的构建
利用Antaris II型光谱仪中自带软件TQ Analyst构建模型。将175份花生样品的化学测定值及原始光谱导入软件。将化学值与所选光谱区域进行拟合, 利用偏最小二乘法(partial least squares, PLS)进行模型构建。去除异常值反复计算, 通过对比模型的决定系数(2)和内部交叉验证均方差(root mean square error of cross validation, RMSECV)来筛选最优模型。
1.6 近红外模型的外部验证
选用未参与建模的30份花生材料对所建近红外模型进行外部验证。利用所建模型对30份花生样品的脂肪、蛋白质、可溶性糖和脂肪酸含量进行扫描, 记录近红外光谱(NIR)的预测值。再利用本研究所采用的化学检测方法对30份样品的上述5个指标进行检测, 每个样品重复测定3次, 取均值为标准值。比较每份材料NIR预测值与化学值的相关性和准确性, 以验证所构建近红外模型的置信水平。
2 结果与分析
2.1 可溶性糖含量标准曲线的绘制
由图1可知, 标准曲线的决定系数2为0.9922, 表明该标准曲线置信度达到极显著性水平, 符合线性关系, 能够用于可溶性糖含量的测定。

图1 可溶性糖含量标准曲线
2.2 蛋白质燃烧曲线分析
由图2可知, 样品的燃烧曲线峰度平缓, 总燃烧时间为150 s, 在105 s时, N吸收峰值达到最大值为125。表明样品在燃烧器中充分燃烧, 可满足后续数据分析所需的要求。

图2 杜马斯定氮仪的样品燃烧曲线
2.3 花生籽仁中脂肪含量、蛋白含量及可溶性糖含量化学测定值的变幅范围
175份花生样品中, 脂肪含量的变异范围为41.95%~ 58.48%, 脂肪含量极差为16.53%, 脂肪含量分布范围广(图3-A); 蛋白质含量分布范围为20.38%~29.48%, 蛋白质含量极差为9.10% (图3-B); 可溶性糖含量变化范围为3.46%~10.07%, 极差为6.61% (图3-C)。说明175份花生样品的脂肪含量、蛋白质含量以及可溶性糖含量化学测定值均表现为变化范围大, 覆盖范围广, 数据丰富, 可以作为近红外检测模型构建的样本数据。
2.4 花生籽仁脂肪酸含量化学测定值的统计分析
采用气相色谱法测定175份花生样品中油酸、亚油酸和棕榈酸3种脂肪酸含量。175份样品的油酸含量变异范围为32.51%~83.33%, 极差为50.82% (图4-A); 亚油酸含量的变化范围为3.69%~44.35%, 极差为40.66% (图4-B); 棕榈酸含量变异范围为5.90%~12.30%, 极差为6.40% (图4-C)。脂肪酸含量变异范围广, 数据分布区间大, 可以满足近红外模型构建的要求。
2.5 近红外模型的构建与优化
脂肪模型的均方差(RMSECV)为1.04, 决定系数2= 0.9084, 蛋白质模型的均方差为0.579, 决定系数2= 0.9011; 可溶性糖模型的均方差为0.371, 决定系数2= 0.9090; 油酸模型的均方差为1.40, 决定系数2=0.9932; 亚油酸模型的均方差为1.33, 决定系数2=0.9915; 棕榈酸模型的均方差为0.261, 决定系数2=0.9835 (图5)。各性状所建模型的决定系数2均在0.90以上, 表明各模型可以对各相关性状指标进行有效预测。
2.6 近红外模型的外部验证
选用30份未参与建模的花生材料作为外部验证样品, 分别获得模型预测值及化学测定值, 计算2个测定值的相关系数, 检验模型预测效果。脂肪含量预测值与化学检测值相关系数2=0.9017, 蛋白质含量相关系数2=0.9011, 可溶性糖含量相关系数2=0.9063, 油酸含量相关系数2=0.9525, 亚油酸含量相关系数2=0.9504, 棕榈酸含量相关系数2=0.9125 (图6)。各性状检测指标相关性均达到极显著水平, 表明利用各个模型得到的预测结果具有很高的可信度, 可用于花生育种过程中籽仁品质性状的快速高通量分析鉴定。
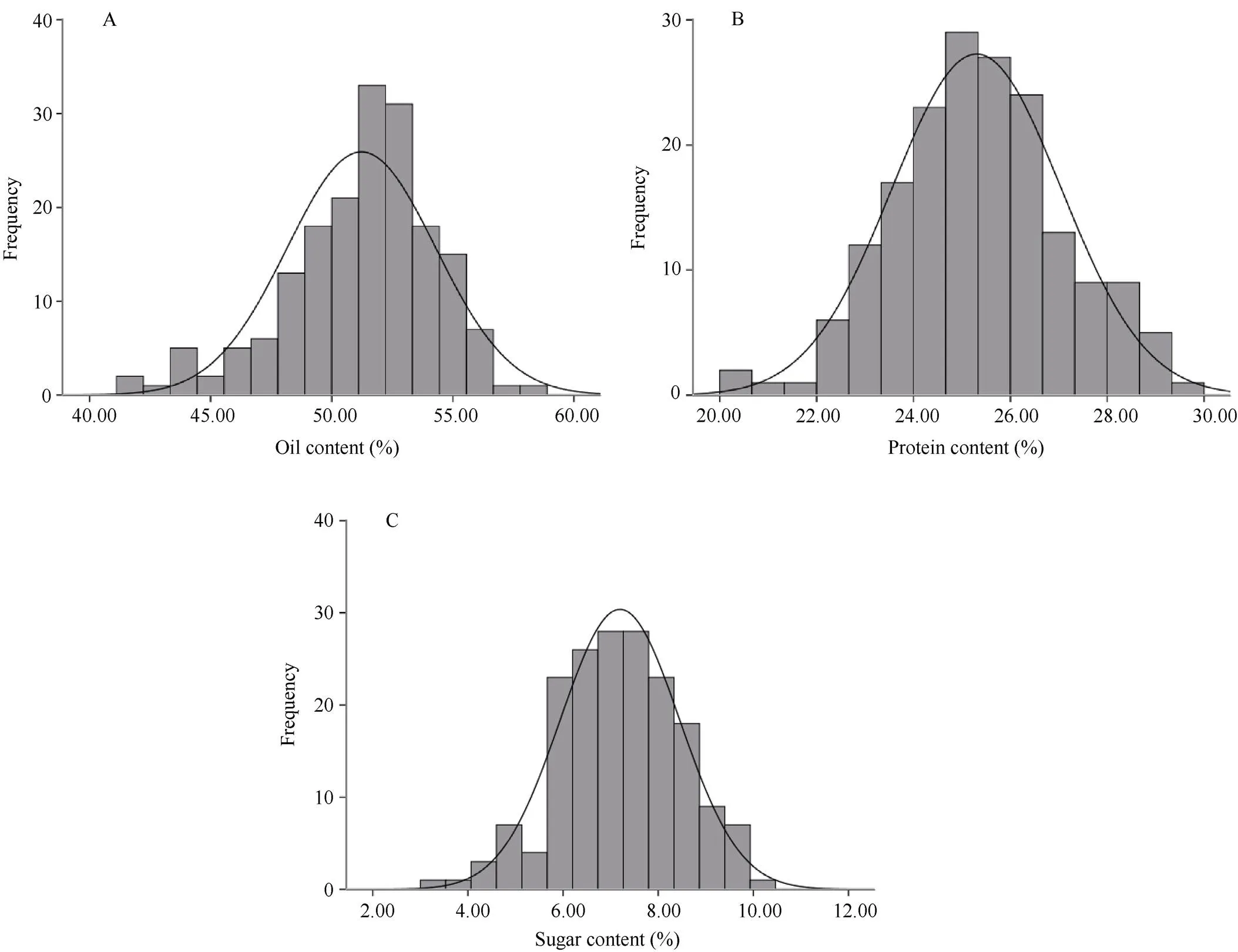
图3 175份花生样品脂肪含量(A)、蛋白质含量(B)和可溶性糖含量(C)化学法测定值
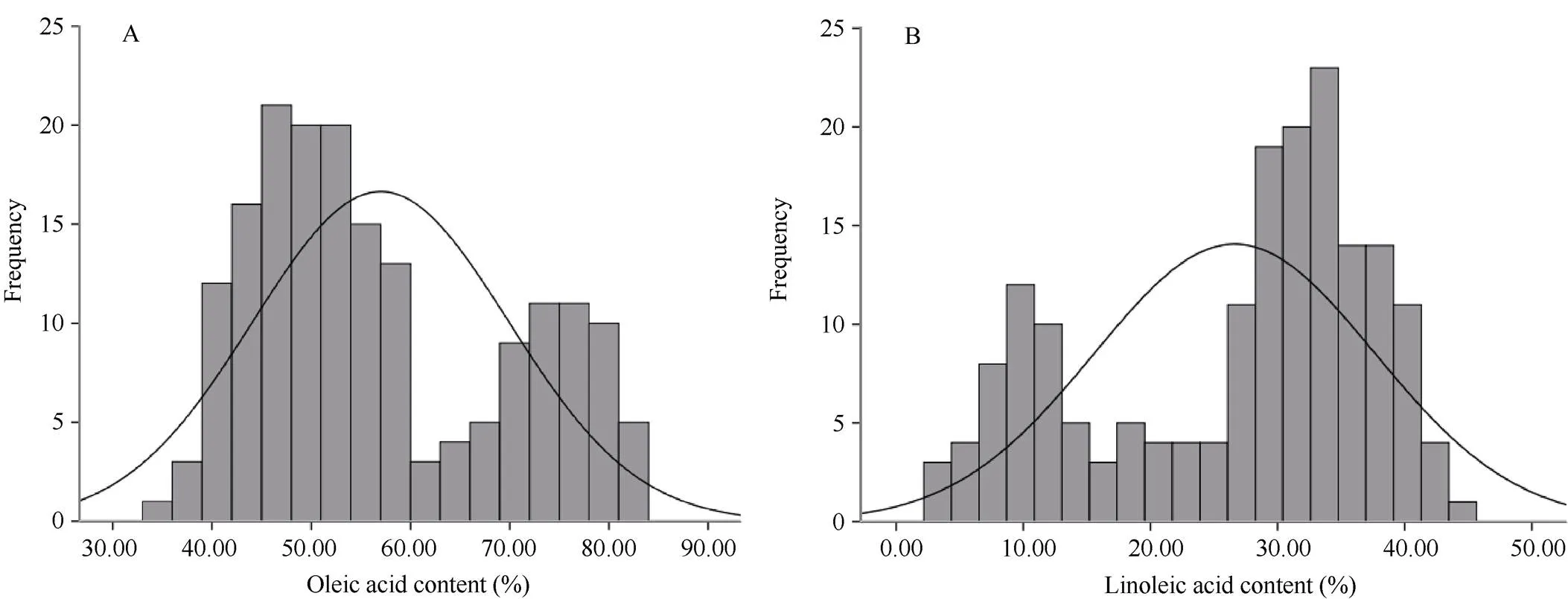
(图4)
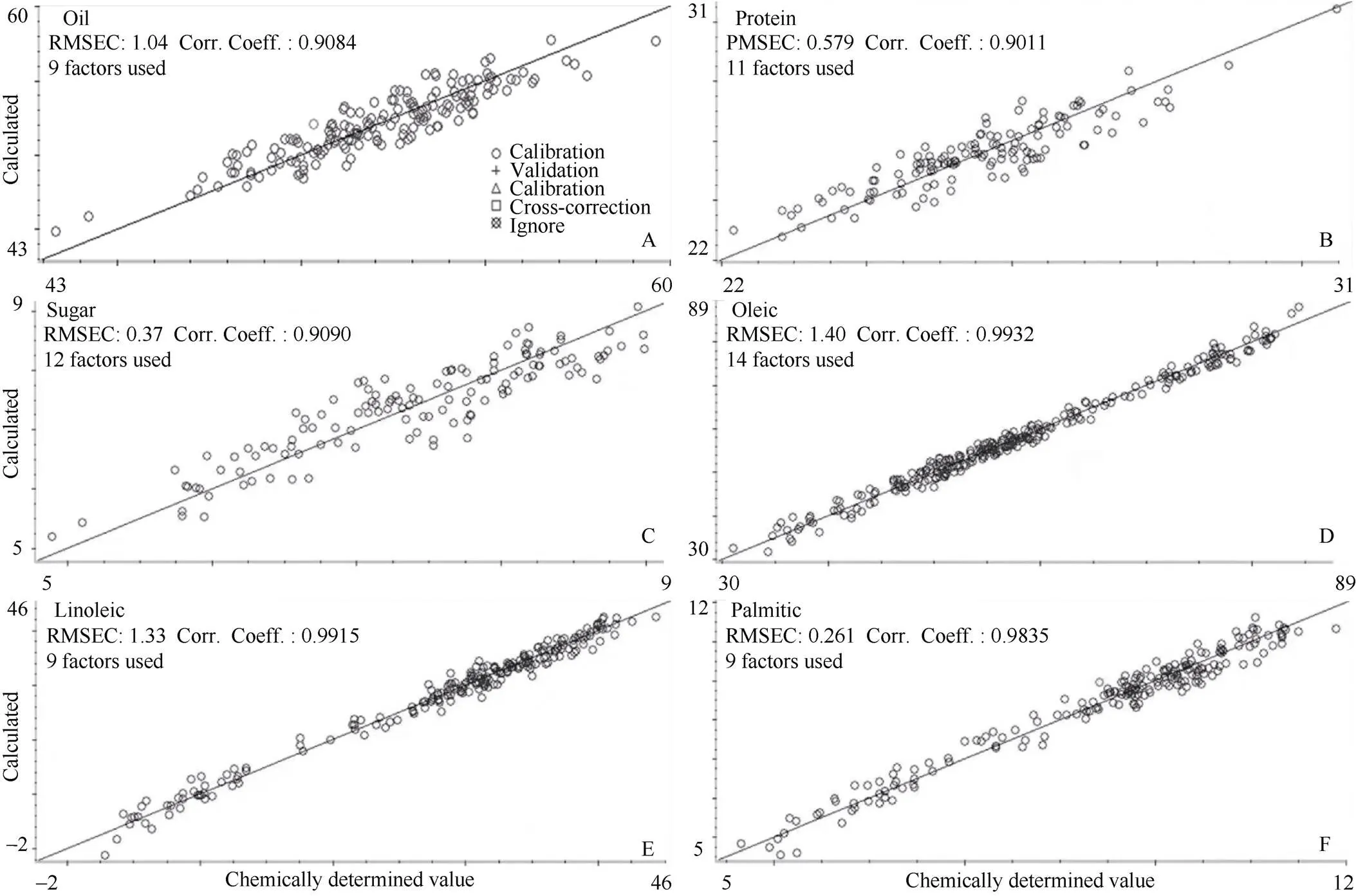
图5 花生脂肪、蛋白质、可溶性糖、油酸、亚油酸和棕榈酸含量(A~F)的决定系数
3 讨论
花生是重要的油料作物之一, 近年来其品质相关性状研究工作主要集中在含油量、蛋白质、可溶性糖和脂肪酸含量等主要性状上[18]。针对这些品质性状指标均有精准的化学测定方法, 但化学检测方法存在耗时长、样品处理过程复杂等问题[19]。如何有效筛选育种材料, 实现在早期世代的品质性状选择, 建立高效的花生籽仁表型分析模型是一个值得关注的问题[20-21]。本研究选用宇花14和LOP215杂交产生的重组自交系群体中140个家系作为建模材料, 宇花14和LOP215在含油量和油酸含量这2个性状上存在显著差异, 因此该群体在这2个性状上分布范围广, 完全能够满足建模需求。为了避免单一家系的局限性, 增加了另外的35份高代品系材料, 这35份材料在蛋白质和可溶性糖含量的差异可进一步增加建模群体的变异范围。不同花生品种的籽仁大小及形状存在明显差异, 放入样品杯时籽仁之间的空隙无法保证均匀一致, 可能会对近红外光谱的吸收和散射产生影响[22]。因此花生籽仁光谱的采集过程应保证从光谱仪投射出的近红外光充分照射花生样品, 应将样品铺满样品杯防止近红外光损失。在扫描过程中还应多次充分混匀样品, 重复采集光谱, 获取平均光谱数据, 以最大程度地减少扫描引起的误差[23]。

图6 花生脂肪、蛋白质、可溶性糖、油酸、亚油酸和棕榈酸含量(A~F)预测值与化学测定值的相关性
对花生多项品质性状的快速测定一直是育种工作的目标[24]。李建国等[25]利用1200粒花生籽仁建立了花生单粒脂肪酸近红外检测模型, 可有效检测花生早期世代材料。金华丽等[26]利用69份花生材料建立了花生含油量的近红外检测模型。禹山林等[27]建立了花生籽仁蛋白质含量和含油量的近红外模型。雷永等[11]利用185份花生材料结合液相色谱(HPLC)构建了花生籽仁蔗糖含量的近红外定标模型。以上研究均是针对单一品质性状进行模型构建。本研究使用同一份待测样品, 通过分步测定分别获得花生脂肪含量、蛋白质含量、可溶性糖含量和脂肪酸含量等各个品质性状的化学测定值, 并在检测之前探索出一系列最优实验条件, 最大程度减少了化学测定值的实验误差。利用所测数据与一次扫描光谱值关联分析建立了多个品质性状的近红外高通量检测模型, 减少了因多次取样以及多次光谱扫描所造成的系统误差, 最大程度地保证所建模型的准确性。利用所建立的高通量检测模型, 可以通过一次光谱扫描检测花生籽仁的多个品质性状, 为花生品质性状的早期选择提供了高通量的表型分析模型。
高油酸育种是目前花生育种的重要目标, 油酸含量的快速鉴定可加快高油酸花生品种选育进程[28]。本研究针对花生中3种最主要脂肪酸油酸、亚油酸以及棕榈酸构建近红外检测模型, 可用于花生高油酸材料的早期世代单株选择。花生中还含有另外的5种脂肪酸, 总含量约占花生总脂肪酸含量的10%以下, 对这些含量较低的性状指标进行建模需要选择在这些性状上具有丰富变异的材料, 否则近红外建模会存在较大误差。后期将专门针对脂肪酸含量选取代表性材料, 建立花生全脂肪酸含量的检测模型。除此外, 花生中维生素、氨基酸、白黎芦醇、风味物质等的差异也会影响到花生的营养及加工品质[29], 后期也将尝试建立针对这些微量成分的近红外检测模型, 全方面满足花生品质改良所需要的高通量表型分析需求。
[1] 廖伯寿, 殷艳, 马霓. 中国油料作物产业发展回顾与展望. 农学学报, 2018, 8(1): 107–112.
Liao B S, Yin Y, Ma N. Review and prospect of China’s oil crop industry., 2018, 8(1): 107–112 (in Chinese with English abstract).
[2] 金华丽, 李琳琳. 近红外光谱技术测定花生蛋白质含量研究. 河南工业大学学报(自然科学版),2014, 35(1): 26–29.
Jin H L, Li L L. Determination of peanut protein content by near infrared spectroscopy.(Nat Sci Edn), 2014, 35(1): 26–29 (in Chinese with English abstract).
[3] 宋丽华, 刘立峰, 陈焕英, 穆国俊, 卢萍萍. 花生籽仁蛋白质含量近红外光谱模型的建立. 中国农学通报,2011, 27(15): 85–89.
Song L H, Liu L F, Chen H Y, Mu G J, Lu P P. Establishment of near infrared spectral model of protein content in peanut kernel.,2011, 27(15): 85–89 (in Chinese with English abstract).
[4] 马寅斐, 何东平, 王文亮, 刘丽娜, 徐同成, 陶海腾, 杜方岭. 我国花生产业的现状分析. 农产品加工学刊, 2011, (7): 122–124.
Ma Y F, He D P, Wang W L, Liu L N, Xu T C, Tao H T, Du F L. Analysis on the current situation of China’s peanut industry.,2011, (7): 122–124 (in Chinese with English abstract).
[5] Bishi S K, Lokesh K, Mahatma M K. Misra quality traits of Indian peanut cultivars and their utility as nutritional and functional food., 2015, 167: 107–114.
[6] 刘娟, 汤丰收, 张俊, 臧秀旺, 董文召, 易明林, 郝西. 国内花生生产技术现状及发展趋势研究. 中国农学通报, 2017, 33(22): 13–18.
Liu J, Tang F S, Zhang J, Zang X W, Dong W Z, Yi M L, Hao X. Study on the current situation and development trend of peanut production technology in China., 2017, 33(22): 13–18 (in Chinese with English abstract)
[7] 房元瑾, 孙子淇, 苗利娟, 齐飞艳, 黄冰艳, 郑峥, 董文召, 汤丰收, 张新友. 花生籽仁外观和营养品质特征及食用型花生育种利用分析.植物遗传资源学报,2018, 19: 875–886.
Fang Y J, Sun Z Q, Miao L J, Qi F Y, Huang B Y, Zheng Z, Dong W Z, Tang F S, Zhang X Y. Characteristics of appearance and nutritional quality of peanut kernel and analysis of breeding and utilization of edible peanut.,2018, 19: 875–886 (in Chinese with English abstract).
[8] 齐伟杰. 现代近红外光谱分析在食品检测中的应用. 中国食品, 2021, (16): 124–125.
Qi W J. Application of modern near infrared spectroscopy in food detection., 2021, (16): 124–125 (in Chinese with English abstract).
[9] Islelb T G, Pattee H E, Giesbrecht F G. Oil, sugar, and starch characteristics in peanut breeding lines selected for low and high oil content and their combining ability., 2004, 52: 3165–3168.
[10] Jitndra B M, Ram S M, Dilip M B. Near-infrared transmittance spectroscopy: a potential tool for non-destructive determination of oil content in groundnuts., 2000, 80: 237–240.
[11] 雷永, 王志慧, 淮东欣, 高华援, 晏立英, 李建国, 李威涛, 陈玉宁, 康彦平, 刘海龙, 王欣, 薛晓梦, 姜慧芳, 廖伯寿. 花生籽仁蔗糖含量近红外模型构建及在高糖品种培育中的应用. 作物学报, 2021, 47: 332–341.
Lei Y, Wang Z H, Huai D X, Gao H Y, Yan L Y, Li J G, Li W T, Chen Y N, Kang Y P, Liu H L, Wang X, Xue X M, Jiang H F, Liao B S. Construction of near infrared model of sucrose content in peanut kernel and its application in cultivation of high sugar varieties.,2021, 47: 332–341 (in Chinese with English abstract).
[12] 杨军军, 庞洪利, 韩宏伟, 王秀贞, 孙妍, 王志伟, 王传堂. 花生油油酸亚油酸含量近红外模型构建. 农业与技术,2021, 41(15): 4–7.
Yang J J, Pang H L, Han H W, Wang X Z, Sun Y, Wang Z W, Wang C T. Construction of near infrared model of oleic acid and linoleic acid content in peanut oil.,2021, 41(15): 4–7 (in Chinese with English abstract).
[13] 秦利, 刘华, 杜培, 董文召, 黄冰艳, 韩锁义, 张忠信, 齐飞艳, 张新友. 基于近红外光谱法的花生籽仁中蔗糖含量的测定. 中国油料作物学报,2016, 38: 666–671.
Qin L, Liu H, Du P, Dong W Z, Huang B Y, Han S Y, Zhang Z X, Qi F Y, Zhang X Y. Determination of sucrose content in peanut kernel based on near infrared spectroscopy., 2016, 38: 666–671 (in Chinese with English abstract).
[14] 李培武, 陈小媚, 张文. 油料种籽含油量的测定残余法. 中华人民共和国行业标准, NY/T 1285–2007.
Li P W, Chen X M, Zhang W. Determination of oil content in oilseeds residual method. Industrial Standard of the People’s Republic of China,NY/T 1285–2007 (in Chinese with English abstract).
[15] 汪红, 魏亮亮, 李通, 王铁良, 许超, 刘冰杰, 郭洁. 杜马斯燃烧法快速测定粮油中粗蛋白质含量研究. 粮油食品科技, 2018, 26(2): 49–53.
Wang H, Wei L L, Li T, Wang T L, Xu C, Liu B J, Guo J. Rapid determination of crude protein content in grains and oils by Dumas combustion method., 2018, 26(2): 49–53 (in Chinese with English abstract).
[16] 李安妮, 刘敏敏, 庾翠梅, 徐妙颜. 用蒽酮法测定花生荚果和植株可溶性糖和淀粉. 中国油料, 1983, (3): 50–51.
Li A N, Liu M M, Yu C M, Xu M Y. Determination of soluble sugar and starch in peanut pods and plants by anthrone method., 1983, (3): 50–51 (in Chinese with English abstract).
[17] 金诚诚, 杨振中, 曹莹, 于慧佳. 气相色谱归一化法测定高油酸花生中油酸、亚油酸含量. 农业科技与装备,2021, (1): 52–55.
Jin C C, Yang Z Z, Cao Y, Yu H J. Determination of oleic acid and linoleic acid in high oleic peanut by gas chromatography normalization., 2021, (1): 52–55 (in Chinese with English abstract).
[18] 张建成, 王传堂, 王秀贞, 唐月异, 张树伟, 李贵杰. 花生自然风干种子油酸、亚油酸和棕榈酸含量的近红外分析模型构建. 中国农学通报, 2011, 27(3): 90–93.
Zhang J C, Wang C T, Wang X Z, Tang Y Y, Zhang S W, Li G J. Construction of near infrared analysis model for oleic acid, linoleic acid and palmitic acid content of naturally air dried peanut seeds., 2011, 27(3): 90–93 (in Chinese with English abstract).
[19] 杨传得, 唐月异, 王秀贞, 吴琪, 孙全喜, 王传堂, 关淑艳. 傅立叶近红外漫反射光谱技术在花生脂肪酸分析中的应用. 花生学报, 2015, 44(1): 11–17.
Yang C D, Tang Y Y, Wang X Z, Wu Q, Sun Q X, Wang C T, Guan S Y. Application of fourier near infrared diffuse reflectance spectroscopy in the analysis of peanut fatty acids.,2015, 44(1): 11–17 (in Chinese with English abstract).
[20] 唐月异, 王秀贞, 刘婷, 吴琪, 孙全喜, 王志伟, 张欣, 王传堂, 邵俊飞. 花生自然风干种子蔗糖含量近红外定量分析模型构建. 山东农业科学, 2018, 50(6): 159–162.
Tang Y Y, Wang X Z, Liu T, Wu Q, Sun Q X, Wang Z W, Zhang X, Wang C T, Shao J F. Construction of near infrared quantitative analysis model of sucrose content in naturally air dried peanut seeds., 2018, 50(6): 159–162 (in Chinese with English abstract).
[21] 李威涛, 郭建斌, 喻博伦, 徐思亮, 陈海文, 吴贝, 龚廷锋, 黄莉, 罗怀勇, 陈玉宁, 周小静, 刘念, 陈伟刚, 姜慧芳. 基于HPLC-RID的花生籽仁可溶性糖含量检测方法的建立. 作物学报, 2021, 47: 368–375.
Li W T, Guo J B, Yu B L, Xu S L, Chen H W, Wu B, Gong T F, Huang L, Luo H Y, Chen Y N, Zhou X J, Liu N, Chen W G, Jiang H F. Establishment of a method for the determination of soluble sugar content in peanut kernel based on HPLC-RID., 2021, 47: 368–375 (in Chinese with English abstract).
[22] 曲艺伟, 张鹤, 韩笑, 李雪莹, 王传堂, 王丕武, 姚丹, 张君. 花生脂肪酸近红外模型的建立. 分子植物育种, 2019, 17: 568–578.
Qu Y W, Zhang H, Han X, Li X Y, Wang C T, Wang P W, Yao D, Zhang J. Establishment of near infrared model of peanut fatty acids., 2019, 17: 568–578 (in Chinese with English abstract).
[23] 纪红昌, 邱晓臣, 柳文浩, 胡畅丽, 孔铭, 胡晓辉, 黄建斌, 杨雪, 唐艳艳, 张晓军, 王晶珊, 乔利仙. 花生籽仁含油量近红外模型的构建及其应用. 中国油料作物学报, 2022, 44: 1089–1097.
Ji H C, Qiu X C, Liu W H, Hu C L, Kong M, Hu X H, Huang J B, Yang X, Tang Y Y, Zhang X J, Wang J S, Qiao L X. Construction and application of near infrared model of oil content in peanut kernel., 2022, 44: 1089–1097.
[24] 昝光敏, 张玲, 张延瑞, 盛英华, 周凯, 王贤智. 大豆籽粒脂肪酸组分气相色谱检测方法的建立. 中国农学通报, 2021, 37(9): 118–124 (in Chinese with English abstract).
Jiu G M, Zhang L, Zhang Y R, Sheng Y H, Zhou K, Wang X Z. Establishment of a gas chromatographic method for the determination of fatty acid components in soybean seeds., 2021, 37(9): 118–124 (in Chinese with English abstract).
[25] 李建国, 薛晓梦, 张照华, 王志慧, 晏立英, 陈玉宁, 万丽云, 康彦平, 淮东欣, 姜慧芳, 雷永, 廖伯寿. 单粒花生主要脂肪酸含量近红外预测模型的建立及其应用. 作物学报, 2019, 45: 1891–1898.
Li J G, Xue X M, Zhang Z H, Wang Z H, Yan L Y, Chen Y N, Wan L Y, Kang Y P, Huai D X, Jiang H F, Lei Y, Liao B S. Establishment and application of near infrared prediction model for main fatty acid content of single peanut., 2019, 45: 1891–1898 (in Chinese with English abstract).
[26] 金华丽, 崔彬彬. 花生种子含油量近红外测定模型建立. 粮食与油脂, 2014, 27(9): 49–51.
Jin H L, Cui B B. Establishment of near infrared measurement model of oil content in peanut seeds., 2014, 27(9): 49–51 (in Chinese with English abstract).
[27] 禹山林, 朱雨杰, 闵平, 杨庆利, 曹玉良, 王传堂, 刘旭, 周学秋. 傅立叶近红外漫反射非破坏性测定花生种子主要脂肪酸含量. 花生学报,2010, 39(1): 11–14.
Yu S L, Zhu Y J, Min P, Yang Q L, Cao Y L, Wang C T, Liu X, Zhou X Q. Nondestructive determination of main fatty acids in peanut seeds by fourier near infrared diffuse reflectance., 2010, 39(1): 11–14 (in Chinese with English abstract).
[28] Pattee H E, Islelb T G, Giesbrecht F G. Relationships of sweet, bitter, and roaste peanut sensory attributes with carbohydrate components in peanuts., 2000, 48: 757–776.
[29] 陈海文, 徐思亮, 郭建斌, 陈伟刚, 罗怀勇, 刘念, 黄莉, 周小静, 吴贝, 姜成红, 任小平, 姜慧芳. 不同花生品种白藜芦醇含量鉴定评价. 中国油料作物学报, 2021, 43: 942–946.
Chen H W, Xu S L, Guo J B, Chen W G, Luo H Y, Liu N, Huang L, Zhou X J, Wu B, Jiang C H, Ren X P, Jiang H F. Evaluation of resveratrol content in different peanut varieties., 2021, 43: 942–946 (in Chinese with English abstract).
High-throughput phenotyping models for quality traits in peanut kernels
JI Hong-Chang1, HU Chang-Li1, QIU Xiao-Chen1, WU Lan-Rong2, LI Jing-Jing1, LI Xin1, LI Xiao-Ting1, LIU Yu-Han1, TANG Yan-Yan1, ZHANG Xiao-Jun1, WANG Jing-Shan1, and QIAO Li-Xian1,*
1College of Agriculture, Qingdao Agricultural University / Shandong Peanut Industry Collaborative Innovation Center / Shandong Key Laboratory of Dryland Agricultural Technology, Qingdao 266109, Shandong, China;2Qingdao Agricultural Technology Extension Center, Qingdao 266100, Shandong, China
Peanut is one of the important oil crops. Its kernel quality directly affects its processing characteristics and is an important index for peanut quality evaluation. Establishing a high-throughput phenotyping model for peanut kernel quality and evaluating peanut kernel quality quickly and efficiently might significantly improve the efficiency of peanut breeding. In this study, the spectra of 175 peanut kernel samples (140 RIL populations derived from Yuhua 14 × LOP 215 and 35 other breeding lines) were collected by Antaris II Fourier Transform Near Infrared Spectroscopy Analyzer (Thermo company), and the oil content, protein content, sugar content, and fatty acid content of seed kernel were determined by Soxhlet extraction method, Dumas nitrogen method, anthrone colorimetry, and gas chromatography, respectively. Partial least squares (PLS) was used to construct the near-infrared calibration models of oil content, protein content, sugar content and some fatty acid content of peanut kernel. 30 other peanut materials whichwere not involved in the modelling were selected to verify the model externally. The determination coefficients (2) of the models were greater than 0.90, indicating that the models could be applied to the high-throughput prediction of peanut kernel quality traits. This study provides a detection platform for high-throughput phenotypic analysis of peanut kernel quality traits.
peanut; kernel; oil content; near infrared model; RIL population
10.3724/SP.J.1006.2023.24030
本研究由青岛市科技惠民示范引导专项重点项目(20-3-4-25-nsh), 山东省农业良种工程项目(2020LZGC001)和山东省自然科学基金项目(ZR2020MC102)资助。
This study was supported by the Special Key Project of Qingdao Science and Technology Benefiting the People Demonstration and Guidance (20-3-4-25-nsh), the Shandong Agricultural Improved Seed Project (2020LZGC001), and the Natural Science Foundation of Shandong (ZR2020MC102).
通信作者(Corresponding author):乔利仙, E-mail: lxqiao73@163.com
E-mail: 17806285316@163.com
2022-01-24;
2022-07-22;
2022-08-01.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220816.1321.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

