水稻早衰基因ESL8的遗传与定位
朱晓彤 叶亚峰 郭均瑶 杨惠杰 王紫瑶 詹 玥 吴跃进 陶亮之 马伯军 陈析丰,* 刘斌美,*
水稻早衰基因的遗传与定位
朱晓彤1,2叶亚峰2郭均瑶2杨惠杰2王紫瑶1詹 玥2吴跃进2陶亮之2马伯军1陈析丰1,*刘斌美2,*
1浙江师范大学化学与生命科学学院, 浙江金华 321004;2中国科学院合肥物质科学研究院, 安徽合肥 230031
早衰突变体是研究植物细胞凋亡分子机制的重要遗传材料。从水稻“科辐粳7号”诱变库中, 筛选到一个早衰突变体()。与野生型相比, 该突变体叶片在抽穗期表现出严重的早衰, 其株高、分蘖数、穂长、每穗粒数以及结实率, 在成熟期均极显著降低, 但千粒重无显著变化; 该突变体叶片的叶绿素含量显著下降, 组织化学染色进一步检测到细胞死亡、活性氧与丙二醛过量积累。遗传分析发现, 该突变体的早衰表型受单隐性核基因控制。采用图位克隆技术将基因精细定位在12号染色体的FM12-14和FM12-15分子标记之间, 物理距离为359 kb。候选基因预测与PCR测序结果表明,基因是基因的一个新等位变异, 突变位点发生在该基因的保守区域。以上结果为进一步研究该基因编码蛋白的功能及其早衰分子机制提供理论依据。
早衰; 水稻;; 细胞凋亡; 定位克隆
水稻作为我国重要的粮食作物之一, 其产量一直是育种家关注的重点。衰老(senescence)是植物生长发育进程中不可或缺的环节之一, 衰老过程伴随着细胞程序性死亡(programmed cell death, PCD)。过早的衰老会使植株的生理机能退化, 光合速率降低, 从而影响作物的产量[1-3]。水稻结实率常受到各种叶片早衰的影响而下降, 研究如何避免水稻发生早衰, 具有重要的研究意义。水稻早衰突变体根据其叶色表型的差异, 可分为叶片黄化早衰和叶片斑点早衰[4]; 根据对环境的敏感程度, 又可分为环境敏感型和环境钝感型, 一般会受到黑暗环境等外界条件的诱导; 根据遗传特征, 还可分为显性突变和隐性突变, 通常是单个基因控制的, 但也有少数受双基因控制[5-8]。不同早衰突变体的表型出现时期也有所不同, 在水稻各生育期中均有可能出现早衰[9-10]。
目前, 在水稻中已报道约200个早衰突变体, 这些控制早衰的基因分布于水稻12条染色体上[11]。基因定位于11号染色体, 是由于淀粉积累和糖代谢异常导致早衰表型的出现[12];基因定位在4号染色体, 编码粪卟啉原III氧化酶, 其叶片的早衰斑点出现是光依赖型的, 并伴随着活性氧(reactive oxygen species, ROS)的积累[13];基因定位于10号染色体, 编码原叶绿素酸酯氧化还原酶B, 产生淡绿叶的表型, 与其他突变体不同的是, 在固定或强光照条件下, 新出的叶片会迅速黄化并形成黄白斑和坏死病斑[14];基因与水稻叶片衰老有关, 其编码一个含有AAA型ATP酶结构域的转运蛋白, 该基因的突变导致叶片衰老延迟[15];基因定位于1号染色体, 编码一个网格蛋白复合体中间亚基μ1, 该蛋白的功能缺失导致了斑点的形成, 进而引发植株的早衰[16];(又称)基因定位于12号染色体, 编码细胞色素P450单加氧酶, 其功能的缺失会影响叶绿体的发育, 导致水稻叶片细胞死亡与早衰[17-18];基因定位于7号染色体, 编码SF3b3型剪接因子, 该基因突变也导致叶片出现斑点及细胞死亡[19];基因定位于8号染色体, 编码锌指蛋白, 也会受到光的诱导, 参与细胞程序性死亡的过程[20]。因此, 获得更多的早衰突变体以及克隆相应基因是研究水稻早衰分子机制的关键, 同时也为研究水稻叶片早衰带来的产量影响提供理论依据。本研究采用重离子束辐射诱变技术对粳稻品种科辐粳7号进行处理, 筛选到了一个可稳定遗传的早衰突变体, 命名为()。通过对早衰突变体的表型鉴定、生理生化分析以及目的基因的定位克隆, 为进一步研究水稻早衰的分子机制及育种应用提供一定的理论依据。
1 材料与方法
1.1 试验材料
中国科学院合肥物质科学研究院技术生物与农业工程研究所利用氮离子束辐射诱变粳稻(L. subsp.)品种科辐粳7号, 获得早衰突变体, 在田间连续种植多代后稳定遗传。在抽穗期, 取突变体及其野生型对照科辐粳7号相同部位的叶片, 用于后续的组织染色与各类生理指标测定。待水稻成熟后,突变体及其野生型对照用于农艺性状分析。以突变体为母本, 与野生型籼稻品种华粳籼74杂交, 其F1代自交得到的F2代分离群体, 用于目的基因的遗传分析与精细定位。
1.2 水稻农艺性状统计
随机选取突变体及其野生型对照各15个单株, 统计其株高、有效分蘖数、穗长、每穗粒数、结实率和千粒重等农艺性状。利用SPSS软件进行显著性差异的统计分析。
1.3 叶片组织染色分析
台盼蓝(Trypan Blue)染色: 水稻叶片裁剪适当长度, 置于15 mL试管中, 添加15 mL台盼蓝染液, 完全浸没叶片, 抽真空处理后, 在沸水浴中煮10 min;随后, 将试管用锡箔纸包好, 于黑暗条件下保存12 h以上; 再将叶子转移到装有水合氯醛溶液的15 mL试管中, 完全浸没叶片, 水合氯醛溶液脱色3 d, 每天更换溶液[21]。
二氨基联苯胺(diaminobenzidine, DAB)染色: 水稻叶片裁剪适当长度, 浸泡在1 mg mL–1DAB (pH 5.8)溶液中, 抽真空处理后, 用锡箔纸包好, 在黑暗条件下染色8 h以上; 取出叶片, 在95%乙醇沸水浴中脱色10 min, 直至叶片透明; 再次浸入装有95%乙醇的15 mL试管中, 放置1~2 d[22]。
四唑氮蓝(nitro blue tetrazolium chloride, NBT)染色: 在琥珀色瓶中, 将0.1 g NBT溶解在50 mmol L–1的磷酸钠缓冲溶液(pH 7.5)中, 使得体积为50 mL, 得到0.2%的NBT染液。将水稻叶片裁剪适当长度, 直接浸入NBT溶液中, 抽真空处理后, 于28℃避光保存4 h以上; 将叶片置于装有95%乙醇的试管中, 在沸水浴中脱色10 min, 至叶片透明; 再次浸入装有95%乙醇的15 mL试管中, 放置1~2 d[23]。
1.4 叶绿素含量测量
突变体与野生型对照各取3个生物学重复。叶片去除中脉后剪碎, 每个样品称取约0.1 g于10 mL的离心管中, 每管中加入9 mL 80%丙酮, 避光抽提12 h以上; 以丙酮为空白对照, 通过分光光度计测量644、662 nm处的吸光值, 计算公式[24]为:
叶绿素浓度(mg L–1):C= 9.78×662–0.99×644;
叶绿素浓度(mg L–1):C= 21.43×644–4.65×662;
总叶绿素浓度(mg L–1):总=C+C= 5.13×662– 20.44×644。
1.5 生理生化指标测定
采用MDA含量检测试剂盒(Solarbio公司)测定丙二醛(malondialdehyde, MDA)含量, 采用SOD活性检测试剂盒(Solarbio公司)测定超氧化物歧化酶(superoxide dismutase, SOD)活性, 操作方法均参照产品说明。
1.6 目的基因遗传分析
利用突变体与华粳籼74杂交, 其F1自交获得的F2分离群体, 在早衰突变表型最明显的时候, 统计F2群体中早衰型植株与野生型植株的个数, 计算群体的表型分离比, 并进行卡方检验[25]。
1.7 目的基因连锁分析与定位
取F2群体中早衰突变单株的叶片, 采用CTAB法提取DNA[26]。选取均匀分布12条染色体的SSR多态分子标记对单株DNA进行PCR扩增, 对目的基因进行遗传连锁分析与定位。PCR扩增的体系为20 μL, 包括10 μL 2× PCR Mix, 2.0 μL 10 μmol L–1引物, 2.0 μL DNA模板, 6 μL ddH2O。PCR反应程序为: 94℃预变性5 min; 94℃ 20 s、56℃ 20 s、72℃ 20 s, 36个循环; 72℃延伸5 min。精细定位分子标记引物如表1所示。
1.8 ESL8基因的PCR扩增与测序
设计PCR引物(表2), 采用高成功率PCR酶KOD FX试剂盒(TOYOBO公司)对基因进行PCR扩增。PCR体系为50 μL, 包括25 μL 2× PCR buffer for KOD FX, 10 μL dNTP, 3.0 μL 10 μmol L–1引物, 2.0 μL DNA模板, 1 μL KOD FX, 9 μL ddH2O。PCR程序为: 94℃预变性5 min; 98℃ 10 s、56℃ 30 s、68℃ 1 min, 30个循环; 68℃延伸7 min。PCR产物经1%的琼脂糖凝胶电泳鉴定后送公司测序。

表1 水稻ESl8基因精细定位分子标记的引物序列
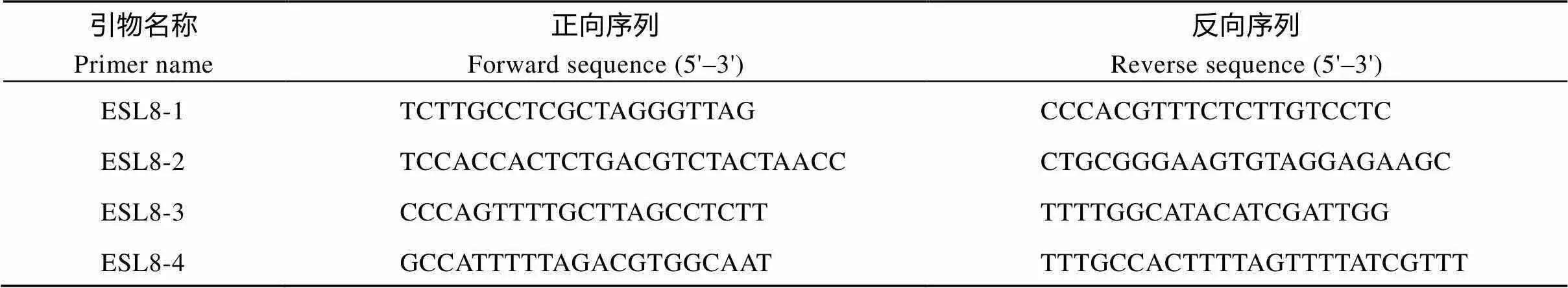
表2 水稻ESL8基因PCR扩增的引物序列
2 结果与分析
2.1 水稻esl8突变体的早衰特征
水稻科辐粳7号经辐射诱变后, 获得了一个类典型的叶片斑点型早衰突变体。在苗期,突变体上就开始出现斑点(图1-A); 在抽穗时, 斑点已扩散至整个叶片, 导致叶片出现严重的早衰表型(图1-B); 此时突变体的倒四叶和倒五叶全部枯死, 其余叶片也出现早衰表型, 而野生型对照科辐粳7号的所有叶片几乎还是正常状态(图1-C)。通过比较突变体与野生型对照的农艺性状差异, 发现该突变体的株高、穂长、有效分蘖数、结实率和每穗粒数均显著性下降, 但是千粒重没有明显变化(表3)。
A: 苗期的植株表型; B: 抽穗期的植株表型; C: 抽穗期的单个分蘖表型; D: 台盼蓝染色; E: DAB染色; F: NBT染色; G: SOD酶活检测; H: MDA含量测定; I: 叶绿素含量测定。WT: 野生型对照科辐粳7号;: 早衰突变体; 标尺为10 cm; **表示突变体与野生型对照之间存在显著性差异(< 0.01)。
A: plant phenotype at seedling stage; B: plant phenotype at heading stage; C: single tiller phenotype at heading stage; D: Trypan blue staining; E: DAB staining; F: NBT staining; G: the measurement of SOD enzyme activity; H: the measurement of MDA content; I: the measurement of chlorophyll content. WT refers to the wide-type control Kefujing 7, andrefers to the early-senescence mutant. Bar: 10 cm; ** represents the significance between the mutant and wild-type control at< 0.01.
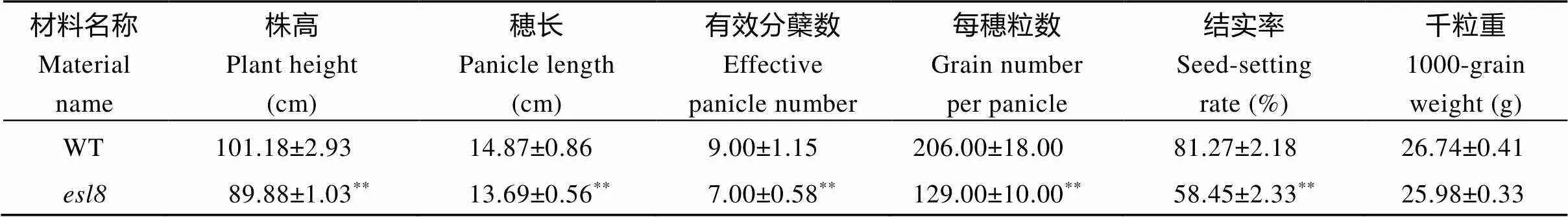
表3 水稻突变体esl8与野生型对照的农艺性状统计
WT为野生型对照科辐粳7号;为早衰突变体;**表示突变体与野生型对照之间存在显著性差异(< 0.01)。
WT refers to the wild-type control Kefujing 7 andrefers to the early-senescence mutant.**represents significance between the mutant and wild-type control at< 0.01.

2.2 水稻esl8突变体的遗传分析
将突变体与野生型华粳籼74进行杂交, 其F1代植株表型正常。F1代自交后, 获得的F2代群体中出现了早衰的表型分离。对495个F2单株的调查后, 发现正常表型植株有382株, 早衰表型植株有113株, 2类表型的分离比经卡方检验(c2)符合3∶1。遗传分析表明突变性状受单隐性核基因控制。因此, 可以利用该群体对目的基因进行图位克隆。
2.3 水稻esl8基因的精细定位
在基因的图位克隆过程中, 首先利用课题组自行开发的覆盖水稻12条染色体的64个SSR多态分子标记, 对21个F2代突变单株进行分析, 将基因初定位在12号染色体的LSR6与LSR14两个标记之间(图2-A)。进一步利用387个F2代突变单株对基因进行精细定位, 最终将基因锁定在FM12-14和FM12-15两个标记之间, 物理距离为359 kb (图2-B)。通过生物信息学分析, 目的基因的定位区域包含一个已报道的调控早衰的基因()[17-18], 而且突变表型与突变体的早衰表型相近。因此, 对突变体及其野生型对照的基因进行了PCR扩增与测序, 结果显示在突变体中该基因的第2个外显子上发现序列突变, 造成6个碱基(TGCCCC)缺失和3个碱基(GCG)插入(图2-C), 导致了其编码蛋白序列中1个氨基酸丢失和1个氨基酸替换。因此, 推断突变体中的基因发生了基因的等位变异。
2.4 目的基因编码蛋白序列的比对与进化分析
基因编码一个细胞色素P450单加氧酶, 能催化色胺转变成血清素, 血清素在调控防御基因表达、细胞死亡以及增强抗稻瘟病的抗性等方面发挥着重要作用, 同时其还影响了水稻叶绿体的发育和功能[18]。通过突变基因与其野生型基因的各自编码蛋白序列比对, 结果显示基因突变导致了ESL8蛋白在第452与453位缺失2个氨基酸(半胱氨酸、脯氨酸), 同时在第452位又插入了1个丙氨酸, 其余序列与野生型完全一致(图3-A)。
为研究突变体中该蛋白突变位点对其功能的影响, 首先在拟南芥和水稻中对ESL8及其同源蛋白进行了系统发育树分析, 结果表明基因编码的细胞色素P450单加氧酶与ESL8亲缘关系最近(图3-B)。此外, 进一步对ESL8及其同源蛋白进行序列比对, 发现突变位点位于亚铁血红素结合(heme-binding motif)的保守结构域(图3-C), 对细胞色素P450单加氧酶的活性有重要意义。推测该区域的半胱氨酸和脯氨酸在维持此类蛋白的功能上具有关键作用。
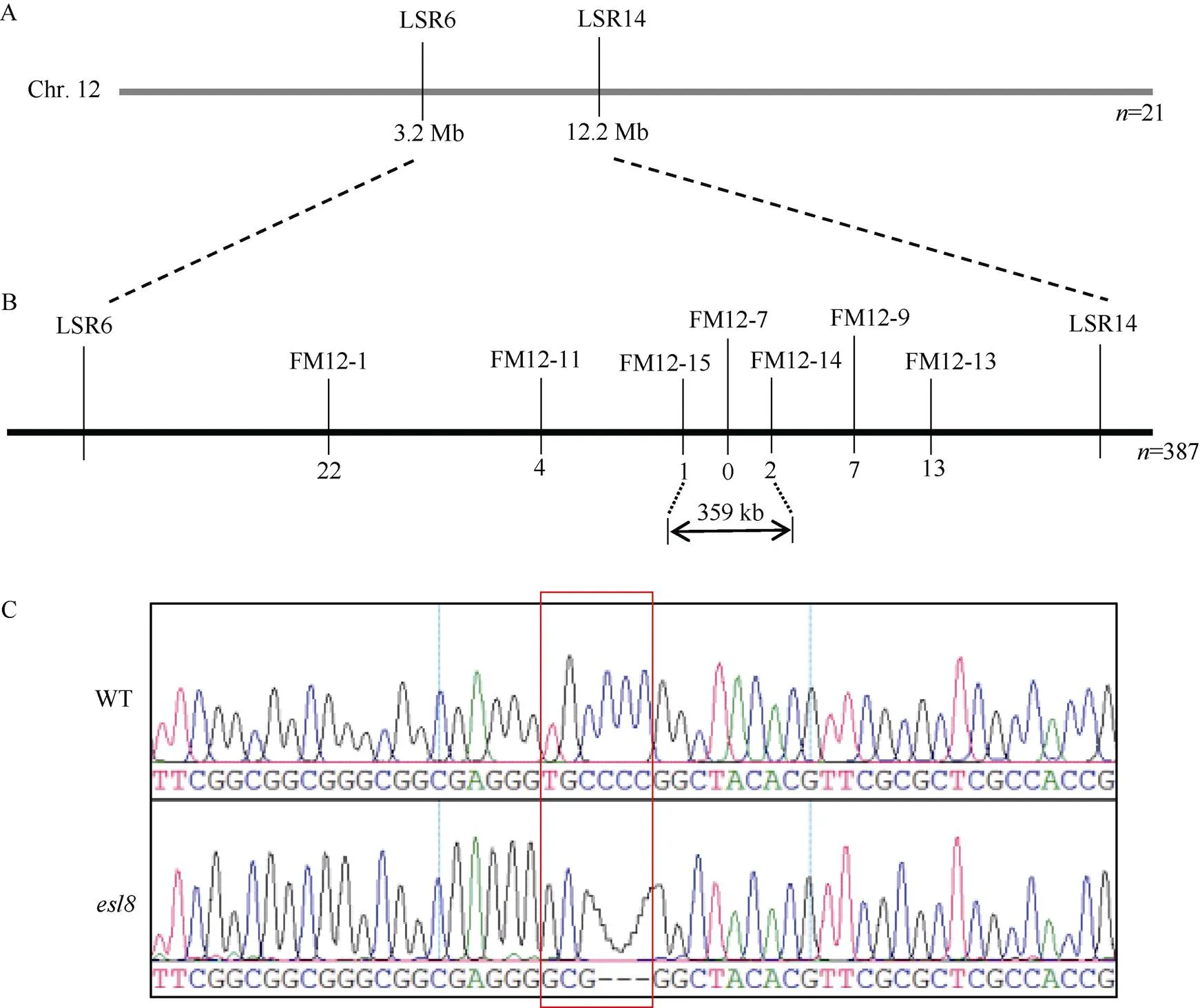
图2 水稻ESL8基因定位与测序分析
A:基因初定位的物理图谱; B:基因精细定位的遗传图谱;为定位分析所用到F2突变单株数, 标记下的数字为该标记检测到的交换事件数; C:基因突变位点的测序结果, WT为野生型对照科辐粳7号,为早衰突变体, 红框标出了TGCCCC碱基缺失与GCG碱基插入的位置。
A: the physical map of thegene by preliminary mapping; B: the genetic map ofthegene by fine mapping; ‘’ refers to the number of F2mutants used for mapping; the number under each marker represents the recombinant number detected by the corresponding marker. C: the sequencing results ofgene in the mutation site. WT refers to the wild-type control Kefujing 7 andrefers to the early-senescence mutant. The red box indicates the location of ‘TGCCCC’ deletion and ‘GCG’ insertion.

(图3)
A:及其野生型基因的编码蛋白序列比对; B: ESL8及其拟南芥与水稻同源蛋白的系统发育树; C: ESL8及其同源蛋白的保守序列比对。
A: the sequence alignment of the proteins coding by theand its wild-type gene; B: phylogenetic tree of ESL8 and its homologous proteins inand rice; C: the comparison of conserved sequences of ESL8 and its homologous proteins.
3 讨论
虽然目前已经克隆了大量的水稻早衰基因[27],但是发现更多的早衰突变体和克隆更多的早衰基因对研究水稻叶片早衰的分子机制有着重要的意义。研究表明, 早衰突变的发生机制通常涉及自身和外界等众多因素, 包括叶龄、细胞程序性死亡失控、相关蛋白酶功能失活、再生植物激素的参与调控以及非生物胁迫的温度、光照、湿度以及损伤等影响[28]。基因突变使得水稻中水杨酸含量升高以及ROS的积累, 导致水稻出现早衰[29]; 根与病原体相互作用也会对水稻早衰产生影响,-突变体和野生型之间鉴定出根部土壤的赤霉素含量有所差异并且分泌的糖也不同, 突变体中赤霉素含量的显著增加导致活性氧的积累, 而利用拮抗细菌抑制特定的病原体, 能够延缓早衰[30]; 水稻编码细胞分裂素氧化酶基因的突变体表现出叶片适度延缓衰老表型, 且分蘖数和穗粒数均显著增加[31];水稻早衰突变体中编码钙依赖性蛋白激酶的基因发生突变, 使水稻早衰, 过表达会延迟植株衰老[32];突变体对强光更加敏感, 细胞加快衰老, 叶绿体发育受影响[33];基因编码具有AAA+结构域的蛋白, 突变后表现出叶绿体迅速降解、叶片衰老[34]。我们通过重离子诱变筛选获得的早衰突变体中SOD酶活性明显降低, 且ROS与MDA过量积累, 很可能导致了严重的脂质过氧化, 从而触发细胞死亡, 最终出现早衰表型。光合色素是植株进行光合作用的关键因素,突变体中光合色素含量明显低于野生型, 可能影响了光合作用及其生物量的合成, 前人报道也表明在叶绿体发育中也发挥重要的作用[17]。
同一基因不同的等位变异对植物的生长发育有着明显的差异, 主要是因为不同的等位变异对该基因的表达或者该基因编码蛋白的功能有着明显差异, 因此获得基因的不同等位变异对研究该基因以及其编码的蛋白功能有着重要的意义[17-18]。基因与前人报道的/属于等位基因, 该基因编码细胞色素P450单加氧酶家族的CYP71P1蛋白, 具有亚铁血红素结合结构域[17-18]。的突变位点在第452位氨基酸后缺失1个半胱氨酸和1个脯氨酸, 且插入1个丙氨酸, 该突变位点刚好在CYP71P1的非常保守的亚铁血红素结合结构域中, 很可能是导致其功能缺失的关键原因, 进一步表明了该保守结构域中这2个氨基酸的重要作用。突变体的千粒重与野生型没有明显差异, 说明该突变位点对千粒重没有影响, 而已报道的突变体其籽粒明显变小, 千粒重显著性低于野生型对照。突变位点位于氨基酸序列的第92位, 由丙氨酸突变成了天冬氨酸, 同样该位点在CYP71蛋白家族中非常保守, 该位点的突变体除了影响叶片叶绿体的发育以及植物先天免疫外, 还影响水稻籽粒的发育[17]。另一种可能的解释是2个突变体的遗传背景不同导致最终表型的差异。突变体是由氮离子束辐射诱变科辐粳7号得到的, 而已报道的突变体是由武运粳7号经甲烷磺酸乙酯诱变处理获得的[17], 虽然2个品种都是粳稻品种, 但也在遗传背景上还是有一定的差异。由此可见,基因不同位点的突变对水稻的生长发育有着不同的作用, 不同等位突变也对其编码蛋白的功能研究提供了更多的遗传资源。
4 结论
通过对水稻突变体的表型观察与生理生化分析, 发现基因会导致植株的倒四叶和倒五叶在抽穗期出现严重早衰; 使水稻叶片细胞死亡数目的大幅度增加, 同时ROS和MDA含量也大量积累; 导致了水稻叶片叶绿素含量下降, 很可能影响了植株的光合作用, 从而使产量性状下降。基因位于水稻12号染色体上, 是编码细胞色素P450单加氧酶基因的新等位变异, 其突变位于CYP71蛋白家族的亚铁血红素结合保守结构域中, 缺失2个氨基酸(半胱氨酸、脯氨酸)且插入1个丙氨酸, 导致其功能性缺失突变, 造成了水稻早衰表型, 进一步证明了该位点中半胱氨酸和脯氨酸的关键作用, 也为下一步研究该蛋白的功能提供新的思路。
[1] 李可, 禹晴, 徐云姬, 杨建昌. 水稻叶片早衰突变体的农艺与生理性状研究进展. 中国水稻科学, 2020, 34: 104–114.
Li K, Yu Q, Xu Y J, Yang J C. Research progress in agronomic and physiological traits of early senescence mutant in rice., 2020, 34: 104–114 (in Chinese with English abstract).
[2] 刘林, 张迎信, 刘群恩, 李枝, 曹立勇. 植物类病变突变体及其信号传导途径. 核农学报, 2014, 10: 1811–1818.
Liu L, Zhang Y X, Liu Q E, Li Z, Cao L Y. Plant lesion mimic mutants and their signaling pathways., 2014, 10: 1811–1818 (in Chinese with English abstract).
[3] 马梓铭, 白慧娇, 金永梅, 吴涛, 朴日花, 马艳, 姜文洙, 都兴林. 水稻早衰突变体-的鉴定、遗传分析与基因定位. 分子植物育种, 2021, 19: 4550–4556.
Ma Z M, Bai H J, Jin Y M, Wu T, Piao R H, Ma Y, Jiang W Z, Du X L. Identification, genetic analysis and gene mapping of early senescence mutant-in rice., 2021, 19: 4550–4556 (in Chinese with English abstract).
[4] 郑崇珂, 周冠华, 牛淑琳, 和亚男, 孙伟, 谢先芝. 水稻早衰突变体-的表型鉴定与基因定位. 作物学报, 2022, 48: 1389–1400.
Zheng C K, Zhou G H, Niu S L, He Y N, Sun W, Xie X Z. Phenotypic characterization and gene mapping of an early senescence leaf(-) mutant in rice (L.)., 2022, 48: 1389–1400 (in Chinese with English abstract).
[5] 肖艳华, 陈新龙, 杜丹, 邢亚迪, 张天泉, 祝毛迪, 刘明明, 朱小燕, 桑贤春, 何光华. 水稻叶片淀粉积累及早衰突变体的鉴定与基因定位. 作物学报, 2017, 43: 473–482.
Xiao Y H, Chen X L, Du D, Xing Y D, Zhang T Q, Zhu M D, Liu M M, Zhu X Y, Sang X C, He G H. Identification and gene mapping of starch accumulation and early senescence leaf mutantin rice., 2017, 43: 473–482 (in Chinese with English abstract).
[6] 刘思辰, 曹晓宁, 王海岗, 王君杰, 陈凌, 田翔, 秦慧彬, 乔治军. 植物类病变突变体的研究进展. 山西农业科学, 2020, 48: 272–276.
Liu S C, Cao X Y, Wang H L, Wang J J, Chen L, Tian X, Qin H B, Qiao Z J. Research progress of plant lesion mimic mutants., 2020, 48: 272–276 (in Chinese with English abstract).
[7] Ma J, Wang Y F, Ma X D, Meng L Z, Jing R N, Wang F, Wang S, Cheng Z J, Zhang X, Zhang L, Wang J L, Wang J, Zhao Z C, Guo X P, Lin Q B, Wu F Q, Zhu S S, Wu C Y, Ren Y L, Lei C L, Zhai H Q, Wan J M. Disruption of gene, encoding a novel CUE domain-containing protein, leads to cell death and enhanced disease response in rice., 2019, 17: 1679–1693.
[8] Shirsekar G S, Vega-Sanchez M E, Bordeos A, Baraodan M, Swisshelm A, Fan J B, Park C H, Leung H, Wang G L. Identification and characterization of suppressor mutants of-mediated cell death in rice.-, 2014, 27: 528–536.
[9] Wu C, Bordeos A, Madamba M, Ramos M, Wang G L, Leach J E, Leung H. Rice lesion mimic mutants with enhanced resistance to diseases., 2008, 279: 605–619.
[10] Wang J C, Liu X, Zhang A, Ren Y L, Wu F Q, Wang G, Xu Y, Lei C L, Zhu S S, Pan T, Wang Y F, Zhang H, Wang F, Tan Y Q, Wang Y P, Jin X, Luo S, Zhou C L, Zhang X, Liu J L, Wang S, Meng L Z, Wang Y H, Chen X, Lin Q B, Zhang X, Guo X P, Cheng Z J, Wang J L, Tian Y L, Liu S J, Jiang L, Wu C Y, Wang E Y, Zhou J M, Wang Y F, Wang H Y, Wan J M. A cyclic nucleotide-gated channel mediates cytoplasmic calcium elevation and disease resistance in rice., 2019, 29: 1–12.
[11] Ma H G, Li J, Ma L, Wang P L, Xue Y, Yin P, Xiao J H, Wang S P. Pathogen-inducible OsMPKK10.2-OsMPK6 cascade phosphorylates the Raf-like kinaseand inhibits its scaffold function to promote rice disease resistance., 2021, 14: 620–632.
[12] Zhu M D, Chen X L, Zhu X Y, Xing Y D, Du D, Zhang Y Y, Liu M M, Zhang Q L, Lu X, Peng S S, He G H, Zhang T Q. Identification and gene mapping of the starch accumulation and premature leaf senescence mutantin rice., 2020, 19: 2150–2164.
[13] Sun C H, Liu L C, Tang J Y, Lin A H, Zhang F T, Fang J, Zhang G F, Chu C C., encoding a putative coproporphyrinogen III oxidase, is involved in lesion initiation in rice., 2011, 38: 29–37.
[14] Sakuraba Y, Rahman M L, Cho S H, Kim Y S, Koh H J, Yoo S C, Paek N C. The rice faded green leaflocus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions., 2013, 74: 122–133.
[15] Song G H, Kwon C T, Kim S H, Shim Y J, Lim C Y, Koh H J, An G H, Kang K Y, Paek N C. The rice()encodes a plant spastin that inhibits ROS accumulation in leaf development and functions in leaf senescence., 2019, 9: 1925.
[16] Qiao Y L, Jiang W Z, Lee J H, Park B S, Choi M S, Piao R, Woo M O, Roh J H, Han L Z, Paek N C, Seo H S, Koh H J.encodes a clathrin-associated adaptor protein complex 1, medium subunit μ1 (AP1M1) and is responsible for spotted leaf and early senescence in rice ()., 2010, 185: 258–274.
[17] Cui Y J, Peng Y L, Zhang Q, Xia S S, Ruan B P, Xu Q K, Yu X Q, Zhou T T, Liu H, Zeng D L, Zhang G H, Gao Z Y, Hu J, Zhu L, Shen L, Guo L B, Qian Q, Ren D Y. Disruption of, encoding a cytochrome P450 monooxygenase, induces ROS accumulation and cell death in rice., 2021, 105: 942–956.
[18] Fujiwara T F, Maisonneuve S M, Isshiki M, Mizutani M, Chen L, Wang H L, Kawasaki T, Shimamoto K. Sekiguchi lesion gene encodes a cytochrome P450 monooxygenase that catalyzes conversion of tryptamine to serotonin in rice., 2010, 285: 11308–11313.
[19] Chen X F, Hao L, Pan J W, Zheng X X, Jiang G H, Yang J, Gu Z M, Qian Q, Zhai W X, Ma B J., a cell death and defense-related gene, encodes a putative splicing factor 3b subunit 3 (SF3b3) in rice., 2012, 30: 939–949.
[20] Wang L J, Pei Z Y, Tian Y C, He C Z. OsLSD1, a rice zinc finger protein, regulates programmed cell death and callus differentiation., 2005, 18: 375–384.
[21] 刘林, 张迎信, 李枝, 刘群恩, 余宁, 孙滨, 杨正福, 周全, 程式华, 曹立勇. 水稻类病变突变体的鉴定和基因定位. 中国水稻科学, 2014, 28: 465–472.
Liu L, Zhang Y X, Li Z, Liu Q E, Yu N, Sun B, Yang Z F, Zhou Q, Cheng S H, Cao L Y. Characterization and gene mapping of a lesion mimic mutantin rice., 2014, 28: 465–472 (in Chinese with English abstract).
[22] Christensen T H, Zhang Z G, Wei Y D, Collinge D B. Subcellular localization of H2O2in plants. H2O2accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction., 1997, 11: 1187–1194.
[23] Kumar D, Yusuf M A, Singh P, Sardar M, Sarin N B. Histochemical detection of superoxide and H2O2accumulation inseedlings., 2014, 4: e1108.
[24] Porra R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophyllsand., 2002, 73:149–156.
[25] 谢宇, 任金波, 黄煌辉, 张翔. 基于卡方检验的计算流体动力学网络无关性分析. 科学技术与工程, 2020, 20: 123–127.
Xie Y, Ren J B, Huang H H, Zhang X. Grid independence analysis of computational fluid dynamics based on Chi-square test., 2020, 20: 123–127 (in Chinese with English abstract).
[26] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321–4326.
[27] 杨波, 夏敏, 张孝波, 王晓雯, 朱小燕, 何沛龙, 何光华, 桑贤春. 水稻早衰突变体的鉴定与基因定位. 作物学报, 2016, 42: 976–983.
Yang B, Xia M, Zhang X B, Wang X W, Zhu X Y, He P L, He G H, Sang X C. Identification and gene mapping of an early senescent leaf mutantinL., 2016, 42: 976–983 (in Chinese with English abstract).
[28] 黄雅敏, 朱杉杉, 赵志超, 蒲志刚, 刘天珍, 罗胜, 张欣. 水稻早衰突变体的基因定位及克隆. 作物学报, 2017, 43: 51–62.
Huang Y M, Zhu S S, Zhao Z Q, Pu Z G, Liu T Z, Luo S, Zhang X. Gene mapping and cloning of a premature leaf senescence mutantin rice., 2017, 43: 1–62 (in Chinese with English abstract).
[29] Yang X, Gong P, Li K Y, Huang F D, Cheng F M, Pan G. A single cytosine deletion in thegene encoding vacuolar-type H+-ATPase subunit A1 leads to premature leaf senescence and seed dormancy in rice., 2016, 67: 2761–2776.
[30] Lin F F, Letuma P L, Li Z W, Lin S, Christopher R S, Lin W X. Rhizospheric pathogen proliferation and ROS production are associated with premature senescence of the-rice mutant., 2021, 72: 7247–7263.
[31] Zhang W, Peng K X, Cui F B, Wang D L, Zhao J Z, Zhang Y J, Yu N N, Wang Y Y, Zeng D L, Wang Y H, Cheng Z K, Zhang K W. Cytokinin oxidase/dehydrogenase OsCKX11 coordinates source and sink relationship in rice by simultaneous regulation of leaf senescence and grain number., 2021, 19: 335–350.
[32] Wang J, Liu X, Zhang A, Ren Y, Wu F, Wang G, Xu Y, Lei C, Zhu S, Pan T, Wang Y, Zhang H, Wang F, Tan Y, Wang Y, Jin X, Luo S,Zhou C, Zhang X, Liu J, Wang S, Meng L, Wang Y, Chen X, Lin Q, Zhang X, Guo X, Cheng Z, Wang J, Tian Y, Liu S, Jiang L, Wu C, Wang E, Zhou J, Wang Y, Wang H, Wan J. A cyclic nucleotide-gated channel mediates cytoplasmic calcium elevation and disease resistance in rice., 2019, 29: 820–831.
[33] Chen D D, Qiu Z N, He L, Hou L L, Li M, Zhang G H, Wang X Q, Chen G, Hu J, Gao Z Y, Dong G J, Ren D Y, Lan S, Zhang Q, Guo L B, Qian Q, Zeng D L, Zhu L. The rice LRR-like1 protein YELLOW AND PREMATURE DWARF 1 is involved in leaf senescence induced by high light., 2021, 72: 1589–1605.
[34] Lin Y H, Tan L B, Zhao L, Sun X Y, Sun C Q. RLS3, a protein with AAA+domain localized in chloroplast, sustains leaf longevity in rice., 2016, 58: 971–982.
Heredity and fine mapping of an early-senescence leaf genein rice
ZHU Xiao-Tong1,2,YE Ya-Feng2, GUO Jun-Yao2, YANG Hui-Jie2, WANG Zi-Yao1, ZHAN Yue2, WU Yue-Jin2, TAO Liang-Zhi2, MA Bo-Jun1, CHEN Xi-Feng1,*, and LIU Bin-Mei2,*
1College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, Zhejiang, China;2Hefei Institutes of Physical Science, Chinese Academy of Science, Hefei 230031, Anhui, China
Early-senescence mutants are genetic materials important for the researches on the molecular mechanism of cell apoptosis in plants. An early-senescence mutant named(arly enescence eaf 8) has been screened from the mutagenesis library of rice variety Kefujing 7. Compared with the wild-type control, the leaves of themutant displays a severe of early-senescence phenotype at heading stage in rice, and its agronomic traits, including plant height, tiller number, grain length, grains per panicle, and seed setting rate, were obviously impaired except for the 1000-grain weight. In leaves of themutant, the chlorophyll content was abnormally decreased, and the programmed cell death accompanied by excessive accumulation of the reactive oxygen species and the malondialdehyde were detected by histochemical staining. Genetic analysis indicated that the early-senescence phenotype of themutant was controlled by a recessive nuclear gene. Based on the strategy of map-based cloning, thegene was finely mapped into a 359-kb region flanking by two molecular markers (FM12-14 and FM12-15) on chromosome 12. The prediction and verification of candidate genes by PCR sequencing confirmed thatwas a new variational allele of thegene. The sequence of mutationoccurred in the conserved region of the corresponding wild-type gene. Our results provide a theoretical basis for further study on the biofunction and molecular mechanism of the protein encoding byin early-senescence process.
early senescence; rice;; cell apoptosis; mapping and cloning
10.3724/SP.J.1006.2023.22012
本研究由安徽省自然科学基金项目(2108085MC99), 合肥市“借转补”科技专项(J2020G45), 安徽省科技重大专项(202003c08020006)和浙江省自然科学基金重大项目(LD19C130001)资助。
This study was supported by the Natural Science Foundation of Anhui Province (2108085MC99), the Hefei Science and Technology Project (J2020G45), the Anhui Science Technology Major Project (202003c08020006), and the Natural Science Foundation of Zhejiang Province (LD19C130001).
通信作者(Corresponding authors):陈析丰, E-mail: xfchen@zjnu.cn; 刘斌美, E-mail: liubm@ipp.ac.cn
E-mail: 1634453295@qq.com
2022-03-03;
2022-07-21;
2022-08-19.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220819.1451.010.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

