D-β-羟基丁酸通过激活Notch1/Hes1通路和抑制内质网应激改善大鼠急性心肌梗死
刘婷婷 董红艳 马艳兰 王婷婷 王学武
(1.新疆维吾尔自治区人民医院干部保健科,新疆 乌鲁木齐 830000;2.新疆昌吉州中医医院针灸科,新疆 昌吉 831100;3.新疆伊犁州妇幼保健院儿童康复科,新疆 伊宁 835000;4.新疆维吾尔自治区人民医院药学部,新疆 乌鲁木齐 830000;5.新疆维吾尔自治区人民医院中医科,新疆 乌鲁木齐 830000)
缺血性心脏病已成为世界范围内发病率和死亡率的主要原因,给社会造成了严重的经济负担。急性心肌梗死(Acute myocardial infarction,AMI)是缺血性心脏病最严重的亚型,常导致猝死[1]。据统计,美国每年有150万人被诊断患有AMI。全世界每年约有2000万人死于AMI[2]。因此,开发新的AMI治疗药物对于改善AMI疾病现状具有重要意义。AMI的发病机制十分复杂,已有研究表明,Notch1信号通路调节多种细胞过程,如发育、增殖、分化、凋亡和再生[3]。Hes1是Notch1信号通路的下游靶基因,Hes1通过调节Notch1/Hes1磷酸酶及下游信号通路来保护心肌细胞[4]。此外,已有证据显示,急性心肌缺血性损伤后,内质网应激水平升高,导致线粒体损伤和细胞凋亡[5]。D-β-羟基丁酸(D-β-hydroxybutyrate,DβHB)是酮体家族成员之一,是由肝脏中脂肪酸降解产生,随后转移到肝外组织(包括大脑,心脏和骨骼肌)的重要代谢基质之一[6]。有研究表明,DβHB在糖尿病、神经退行性疾病、心力衰竭、败血症相关的肌肉萎缩、偏头痛和癫痫等疾病中均有潜在的治疗作用[7]。目前,关于DβHB在AMI中的作用及其可能的机制尚不明确。因此,本研究旨在探究DβHB是否通过调节Notch1/Hes1通路和内质网应激水平发挥对AMI的保护作用,以期为开发新的AMI治疗药物提供新的科学依据。
1 材料与方法
1.1 实验动物 40只SPF级雄性Sprague-Dawley(SD)大鼠,体质量(210±10)g,6~7周龄,购自新疆医科大学实验动物中心。所有大鼠饲养于标准动物房,环境温度(20±2)℃,湿度45%~55%,提供充足饮水及饲料。待大鼠适应环境一周后,进行后续实验。本研究经医院动物伦理委员会审批通过。
1.2 实验材料 D-β-羟基丁酸(D-β-hydroxybutyrate,DβHB)购自美国Sigma公司,倍他乐克购自阿斯利康制药有限公司,乳酸脱氢酶(LDH)检测试剂盒购自上海通善生物科技有限公司,肌酸激酶同工酶(CK-MB)测定试剂盒购自北京九强生物技术股份有限公司,TUNEL试剂盒购自瑞士Roche公司,Bax、Bcl-2和GAPDH抗体购自北京义翘神州,Notch1、NICD、Hes1、ATF4和CHOP抗体购自英国Abcam,p-PERK、PERK、p-eIF2α和eIF2α抗体购自美国Santa Cruz Biotechnology公司,ECL发光液购自北京普利莱基因技术有限公司。
1.3 AMI模型的建立[8]及给药处理 将40只SD大鼠随机分为对照组、心梗组、DβHB组和阳性对照组,每组10只。戊巴比妥钠腹腔麻醉大鼠(35 mg/kg),仰卧位固定,气管插管,连接呼吸机及心电监护仪。心梗组、DβHB组和阳性对照组大鼠无创丝线结扎冠状动脉左前降支近端,随后前降支供血区域心肌颜色发白,心电图导联ST段弓背抬高,此时AMI大鼠模型成功建立。对照组大鼠进行穿线,但不结扎。DβHB组大鼠腹腔注射DβHB 100 mg·kg-1·d-1[9],阳性对照组大鼠腹腔注射倍他乐克12 mg·kg-1·d-1[10],对照组和心梗组大鼠注射等量生理盐水,持续给药3周。造模过程中,心梗组大鼠死亡1只,阳性对照组大鼠死亡1只。给药期间,心梗组大鼠死亡1只,DβHB组大鼠死亡1只。最后,每组大鼠各取8只进行后续实验。
1.4 超声心动图检测大鼠心功能 最后一次给药24 h后,麻醉大鼠,通过二维M型和B型超声心动图评估左心室功能。检测指标包括左室射血分数(Left ventricular ejection fraction,LVEF)、左室短轴缩短率(Left ventricular fractional shortening,LVFS)、左室收缩末内径(Left ventricular end systolic diameter,LVSD)、左心室收缩末期容积(Left ventricular end systolic volume,LVESV)。
1.5 HE染色检测大鼠心脏病理学变化 最后一次给药24 h后,麻醉大鼠,腹主动脉取血,4℃,2500 rpm离心15 min,取上清液,-80℃条件下保存。随后取心脏,4%多聚甲醛固定左心室组织72 h,梯度酒精脱水,二甲苯透明。石蜡包埋、切片。石蜡切片常规二甲苯、乙醇脱蜡至水,苏木素染色10 min,0.7%盐酸乙醇分化5 s,流水洗涤后,伊红液浸染3 min。梯度酒精脱水,二甲苯透明,中性树胶封片。切片于光学显微镜下观察分析。
1.6 TTC染色检测大鼠心肌梗死面积 取各组大鼠心脏组织,于-20℃条件下冷冻30 min后切片。2%TTC溶液37℃避光孵育30 min,PBS洗涤心脏,4%多聚甲醛固定心脏24 h。Image J软件分析梗塞面积。
1.7 ELISA试剂盒检测LDH和CK-MB的水平 取-80℃保存的血清,解冻。按照ELISA试剂盒说明书步骤所示,检测血清中LDH和CK-MB的水平。
1.8 TUNEL染色检测心肌细胞凋亡 按照1.5所示,制备心脏组织石蜡切片。切片常规脱蜡至水,PBS漂洗后,加入蛋白酶K工作液,37℃反应30 min,PBS漂洗3次,3%H2O2封闭10 min。滴加TUNEL反应混合液,湿盒中37℃孵育1 h。PBS漂洗,加入转化剂,湿盒中37℃孵育20 min。PBS漂洗,加入IDAB底物,反应10 min。PBS漂洗后,苏木素复染,梯度酒精脱水、二甲苯透明,中性树胶封片。切片于光学显微镜下进行观察分析。
1.9 Western blot检测凋亡、Notch1/Hes1通路和内质网应激相关蛋白水平 将各组大鼠心脏组织剪碎,RIPA裂解液裂解组织,离心取上清,BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE分离并转至PVDF膜上。10%脱脂奶粉封闭,随后加入Bax(1∶2000)、Bcl-2(1∶1000)、Notch1(1∶1500)、NICD(1∶2000)、Hes1(1∶2000)、p-PERK(1∶2000)、PERK(1∶2000)、p-eIF2α(1∶2000)、eIF2α(1∶2000)、ATF4(1∶2000)、CHOP(1∶2000)和GAPDH(1∶1500)抗体,4℃条件下孵育过夜。加入二抗(1∶5000)室温孵育1 h后,滴加ECL发光液到膜上,化学发光成像仪检测。

2 结果
2.1 各组大鼠心功能及病理学变化的比较 与对照组相比,心梗组大鼠LVEF和LVFS明显降低,LVSD和LVESV明显升高(P<0.05),肌原纤维排列紊乱,存在明显炎性细胞浸润和间质水肿;与心梗组相比,DβHB组和阳性对照组大鼠LVEF和LVFS明显升高,LVSD和LVESV明显降低(P<0.05),心肌病理学变化有明显改善,见图1、2和表1。
表1 各组大鼠心功能指标的比较Table 1 Comparison of cardiac function indexes of rats in each group

图1 超声心动图检测各组大鼠心功能Figure 1 Echocardiogram was used to detect the heart function of rats in each group
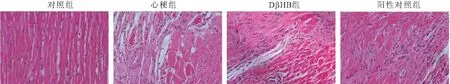
图2 HE染色检测各组大鼠心肌病理学变化(400×)Figure 2 HE staining was used to detect myocardial pathological changes of rats in each group
2.2 各组大鼠梗死面积的比较 与对照组相比,心梗组大鼠心肌梗死面积明显升高(P<0.05);与心梗组相比,DβHB组和阳性对照组大鼠心肌梗死面积明显降低(P<0.05),见图3、表2。

图3 TTC染色检测各组大鼠心肌梗死面积Figure 3 TTC staining was used to detect the area of myocardial infarction in each group of rats
表2 各组大鼠梗死面积的比较Table 2 Comparison of infarct area of rats in each group
2.3 各组大鼠血清LDH和CK-MB活性的比较 与对照组相比,心梗组大鼠血清LDH和CK-MB活性明显升高(P<0.05);与心梗组相比,DβHB组和阳性对照组大鼠血清LDH和CK-MB活性明显降低(P<0.05),见表3。
表3 各组大鼠血清LDH和CK-MB活性的比较Table 3 Comparison of serum LDH and CK-MB activities of rats in each group
2.4 各组大鼠心肌细胞凋亡率及凋亡相关蛋白水平比较 与对照组相比,心梗组大鼠心肌细胞凋亡率和Bax蛋白水平明显升高(P<0.05),Bcl-2蛋白水平明显降低(P<0.05);与心梗组相比,DβHB组和阳性对照组大鼠心肌细胞凋亡率和Bax蛋白水平明显降低(P<0.05),Bcl-2蛋白水平明显升高(P<0.05),见图4、5和表4。

表4 各组大鼠心肌细胞凋亡率、Bax和Bcl-2蛋白水平比较Table 4 Comparison of rat cardiomyocyte apoptosis rate, Bax and Bcl-2 protein expression in each group

图4 TUNEL染色检测各组大鼠心肌细胞凋亡(400×)Figure 4 TUNEL staining was used to detect the apoptosis of rat cardiomyocytes in each group
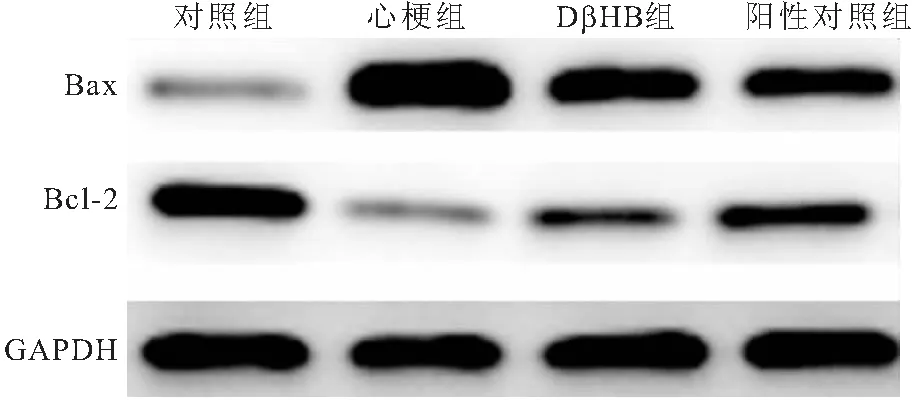
图5 Western blot检测各组大鼠Bax和Bcl-2蛋白的表达Figure 5 Western blot was used to detect the expression of Bax and Bcl-2 protein in each group of rats
2.5 各组大鼠Notch1/Hes1通路相关蛋白表达水平的比较 与对照组相比,心梗组大鼠Notch1、NICD和Hes1蛋白表达差异无统计学意义(P>0.05);与心梗组相比,DβHB组和阳性对照组大鼠Notch1、NICD和Hes1表达明显升高(P<0.05),见图6、表5。
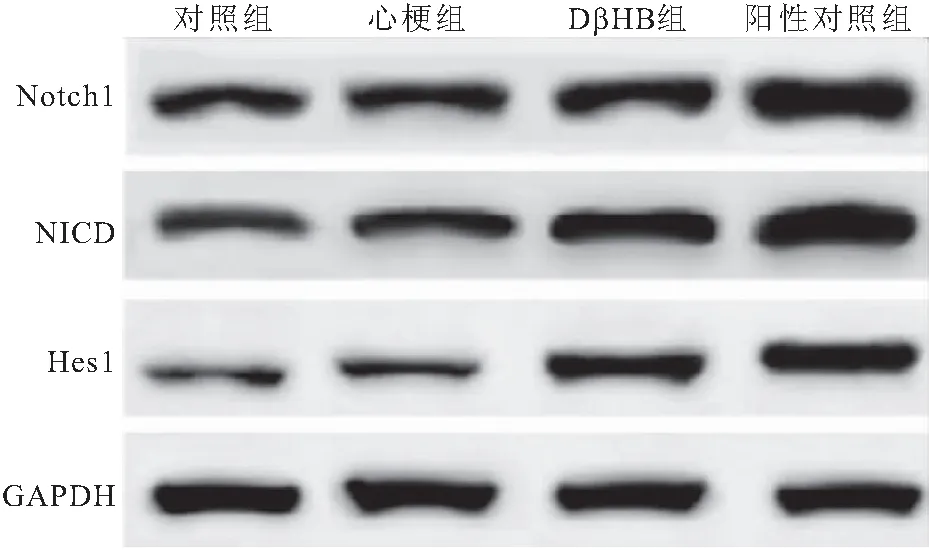
图6 Western blot检测各组大鼠Notch1/Hes1通路相关蛋白的表达Figure 6 Western blot was used to detect the expression of Notch1/Hes1 pathway related proteins in each group of rats
表5 各组大鼠Notch1、NICD和Hes1蛋白表达的比较Table 5 Comparison of protein expression of Notch1, NICD and Hes1 in each group of rats
2.6 各组大鼠内质网应激相关蛋白表达水平的比较 与对照组相比,心梗组大鼠p-PERK/PERK、p-eIF2α/eIF2α、ATF4和CHOP蛋白水平明显升高(P<0.05);与心梗组相比,DβHB组和阳性对照组大鼠p-PERK/PERK、p-eIF2α/eIF2α、ATF4和CHOP蛋白水平明显降低(P<0.05),见图7、表6。
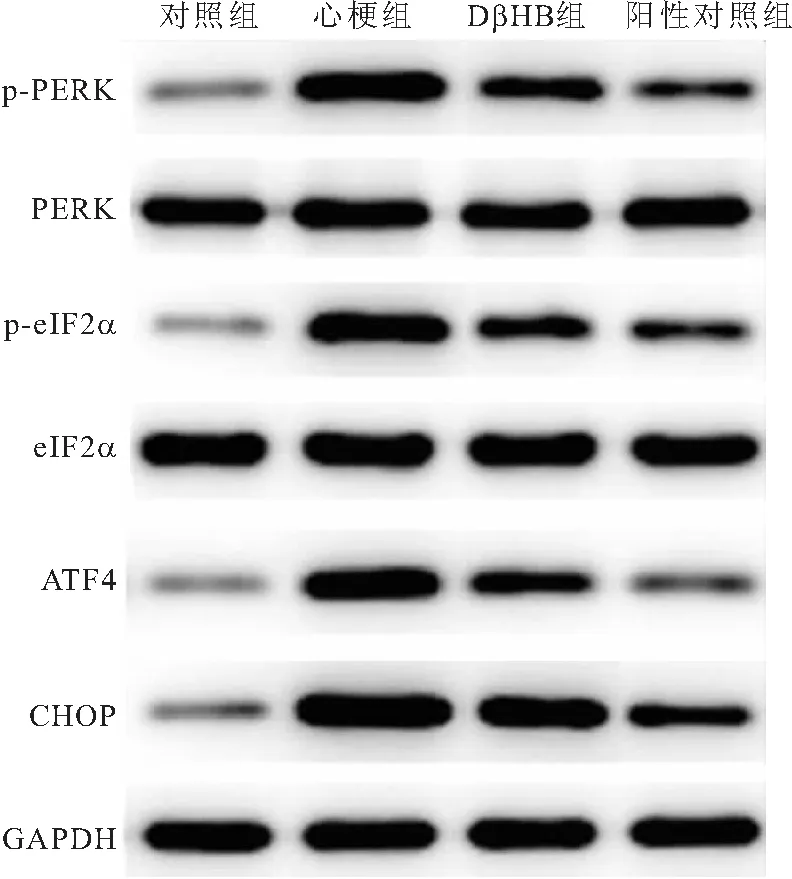
图7 Western blot检测各组大鼠内质网应激相关蛋白的表达Figure 7 Western blot was used to detect the expression of endoplasmic reticulum stress-related proteins in each group of rats
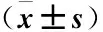
表6 各组大鼠内质网应激相关蛋白表达的比较Table 6 Comparison of the expression of endoplasmic reticulum stress-related proteins in each group of rats
3 讨论
AMI已成为全球发病率和死亡率的主要原因之一,尽管药物和导管再灌注(如纤溶和经皮冠状动脉介入治疗)是目前AMI的主要治疗策略,但其会导致系统性出血和微血管血流再灌注失败等不良结果[11]。因此,开发新的治疗策略刻不容缓。本研究旨在探究DβHB对AMI的作用及其可能的作用机制,以期为开展新的治疗策略提供新的科学依据。
酮氧化可提高心脏ATP的产生,心衰时酮体氧化增加。然而,心力衰竭患者很少有足够高的DβHB血浓度来满足心脏需求[12]。最近一项针对心力衰竭患者的研究报告表明,输注DβHB后,心输出量改善40%,LVEF提高8%[13]。另有研究表明,DβHB治疗可减少梗死面积,降低血清中心肌肌钙蛋白Ⅰ、LDH和CK-MB水平,减少心肌细胞凋亡,在心肌缺血再灌注小鼠中发挥保护作用[14]。本研究结果表明,DβHB治疗可改善AMI大鼠心功能及心肌病理学变化,降低大鼠心肌梗死面积、LDH和CK-MB活性,抑制心肌细胞凋亡,提示DβHB在AMI中发挥保护作用。
Notch1/Hes1通路在心脏发生过程中发挥着控制组织形成的不可或缺的功能,激活Notch1/Hes1通路可能在预防心肌缺血再灌注损伤中发挥重要作用[15]。越来越多的证据表明,Notch通路的重新激活可能是对病理应激后提高生存率或刺激组织再生的适应性反应。心肌梗死后内源性Notch激活可促进抗凋亡,提高存活率,改善心脏功能[16]。此外,已有研究证明,褪黑素通过激活Notch1/Hes1通路改善大鼠心肌缺血再灌注(Myocardial ischemia/reperfusion,MI/R)损伤,减少心肌细胞凋亡和氧化损伤[17]。此外,激活Notch1/Hes1通路可通过抑制高糖诱导的氧化应激损伤,改善心肌细胞肥大[18]。这些研究表明Notch1/Hes1通路在维持心脏功能内稳态中的关键作用。本研究结果显示,AMI后Notch1/Hes1通路无明显变化,而DβHB治疗可激活Notch1/Hes1通路,在AMI中发挥保护作用,抑制心肌细胞凋亡。
近年来,越来越多的研究关注内质网应激在急性心肌梗死中的作用。有证据显示,内质网应激相关信号通路与缺血性心脏病、原发性心肌病、心肌肥大和心力衰竭的发生、发展密切相关[19]。已有研究表明,抑制内质网应激可对AMI后心脏产生保护作用[20]。葛红吉等[21]的体外实验结果证明,抑制内质网应激可抑制缺氧/复氧诱导的心肌细胞凋亡,缓解细胞损伤。哺乳动物中未折叠蛋白反应的激活是由三种不同的内质网应激传感器介导的,即蛋白激酶R样内质网激酶(Protein kinase R-like ER kinase,PERK)、转录因子ATF6和内核糖核酸酶IRE-1[22]。MI/R损伤激活内质网应激,促进PERK及其靶蛋白真核起始因子2α(Eukaryotic initiation factor 2α,eIF2α)磷酸化,广泛抑制细胞内功能蛋白的合成,进而增强ATF4的翻译,诱导CHOP的表达,并促进细胞凋亡[23]。有研究表明,抑制PERK/eIF2α介导的内质网应激可以减轻大鼠心脏的MI/R损伤[24]。本研究结果显示,AMI可激活PERK/eIF2α通路,升高ATF4和CHOP表达,而DβHB治疗可抑制PERK/eIF2α通路活化,抑制ATF4和CHOP表达,抑制内质网应激,在AMI中发挥保护作用,抑制心肌细胞凋亡。
4 结论
DβHB可能通过激活Notch1/Hes1通路和抑制内质网应激改善大鼠AMI,抑制心肌细胞凋亡,为明确DβHB对AMI的作用及作用机制提供了新的科学依据。
——疾病防治的新靶标

