川芎嗪通过调控AKT/mTOR信号通路抑制膀胱癌细胞增殖和迁移
刘宏伟,熊 洪,陈瑞琦,朱 奕,左 玲(广东医科大学附属医院泌尿外科,湛江 5400;广东医科大学附属第二医院中医科;通讯作者,E-mail:doctorzuoling@63.com)
膀胱癌是世界上第十大常见的癌症,是男性第四常见的癌症。据估计,在全世界范围内,每年大约有50万新增病例和20万死亡病例,男性的发病率约是女性的4倍[1,2]。大约70%~75%的膀胱癌患者是非肌层浸润性膀胱癌(non-muscle invasive bladder cancer, NMIBC),而其余25%~30%患者则是肌层浸润性膀胱癌(muscle invasive bladder cancer, MIBC)[3,4]。卡介苗是治疗中高危非肌层浸润性膀胱癌和原位癌的有效药物,但总体不良反应率高达71.8%[5]。MIBC患者行膀胱根治性切除术后仍有近50%的患者进展为转移性膀胱癌[6]。自20世纪80年代开始,以铂类为基础的联合化疗方案是转移性尿路上皮癌的标准治疗方案[6],但有部分患者因毒副作用难以耐受。因此寻找新的抑制膀胱癌的药物具有重要的临床意义。
川芎嗪(tetramethylpyrazine,TMP)是从植物川芎(Ligusticum)的根茎提取的有效成分,化学名为2,3,5,6,-四甲基吡嗪,具有抗炎、镇痛、抗凝血、抗氧化、抗肿瘤等作用[7]。有研究表明,TMP可以通过mTOR信号通路抑制前列腺癌细胞增殖[8],还可以通过调控上皮间质转化抑制肾癌细胞的增殖、迁移和侵袭[9],然而TMP对膀胱癌是否有抑癌作用尚不清楚。本研究拟探讨TMP对膀胱癌UM-UC-3细胞增殖、迁移、周期的作用及可能的作用机制。
1 材料与方法
1.1 材料与仪器
TMP(货号:100022)购自江苏永健医药科技有限公司;人永生化尿路上皮细胞SV-HUC-1和人膀胱癌细胞株UM-UC-3细胞均购自中国科学院上海细胞库。F-12K、DMEM培养基购自美国Gibco公司。AKT单克隆抗体(货号:60203-2-Ig)、p-AKT(Ser473)单克隆抗体(货号:66444-1-Ig)、mTOR单克隆抗体(货号:66888-1-Ig)、p-mTOR(Ser2448)单克隆抗体(货号:67778-1-Ig)、β-actin单克隆抗体(货号:66009-1-Ig)、Cyclin D1多克隆抗体(货号:26939-1-AP)、CDK4多克隆抗体(货号:11026-1-AP)购自美国Proteintech公司;PI/RNase染色液购自天津三箭生物技术股份有限公司;Multiscan MK3型号酶标仪(美国Thermo Fisher Scientific);Tanon5200型号全自动化学发光图像分析系统(上海天能科技有限公司);BD FACSCantoTM Ⅱ流式细胞仪(美国BD Biosciences公司)。
1.2 细胞培养和药物制备
UM-UC-3和SV-HUC-1细胞分别用含10%浓度的胎牛血清、1%浓度的青霉素/链霉素溶液的DMEM和F-12K细胞培养基培养,置于37 ℃,5% CO2培养箱中培养。TMP用DMSO溶解配制成20 mg/L的储存液,避光储存于-20 ℃冰箱中,实验时用DMEM培养基稀释成需要的浓度。
1.3 CCK-8实验检测TMP对UM-UC-3细胞增殖能力的影响
将UM-UC-3细胞用胰酶消化离心后,按照1×103个/孔铺到96孔板中,培养24 h后弃培养基,向对应实验孔中分别加入不同浓度(0,200,400,800 mg/L)的TMP,同时设置空白对照组(不含细胞,只加培养基),每个孔100 μl,每个浓度设置5个复孔,在细胞培养箱中分别孵育24 h后弃培养基,然后将10 μl CCK-8试剂加入到100 μl细胞培养液中,放培养箱内继续孵育。2 h后使用酶标仪检测450 nm处的OD值。
1.4 CCK-8实验检测TMP对正常尿路上皮SV-HUC-1细胞活力的影响
将SV-HUC-1细胞用胰酶消化离心后,按照1×103个/孔铺到96孔板中,培养24 h后弃培养基,向对应实验孔中分别加入不同浓度(0,200,400,800 mg/L)的TMP,同时设置空白对照组(不含细胞,只加培养基),每个孔100 μl,每个浓度设置5个复孔,在细胞培养箱中分别孵育24 h后弃培养基,然后将10 μl CCK-8试剂加入到100 μl细胞培养液中,放培养箱内继续孵育。2 h后使用酶标仪检测450 nm处的OD值。
1.5 划痕实验检测TMP对UM-UC-3细胞迁移能力的影响
取对数生长期UM-UC-3细胞,以3×105个/孔的密度接种于6孔板中并置于细胞培养箱培养。待细胞贴壁长满后用200 μl移液枪头尖端垂直于培养板底划痕,弃去培养基并用PBS清洗细胞碎片。依据TMP不同浓度分为2组:0 mg/L组和400 mg/L组。用0 mg/L和400 mg/L的TMP培养基2 ml孵育细胞24 h,每个浓度3个复孔。分别在划痕后0 h和24 h在倒置显微镜下拍摄3个视野,计算同一视野划痕向内迁移的距离。划痕愈合率=(划痕后0 h宽度-划痕后24 h宽度)/划痕后0 h宽度×100%。
1.6 Transwell迁移实验检测TMP对UM-UC-3细胞迁移能力的影响
将对数生长的UM-UC-3细胞,胰酶消化离心后重悬细胞,以1.5×105个/孔的密度种植于6孔板,24 h后吸掉原有培养基,依据TMP不同浓度分为2组:0 mg/L组和400 mg/L组。药物处理后24 h,胰酶消化细胞,用无血清培养基悬浮细胞,计数。在Transwell下室内加入600 μl含20%胎牛血清的培养基,在上室内加入200 μl无血清培养基(6×104个细胞),继续在培养箱中培养,24 h后用4%多聚甲醛液固定Transwell小室30 min,然后置于0.1%结晶紫中染色30 min,将小室内上表面的细胞擦除,晾干后在倒置显微镜下随机选取3个视野拍照,统计细胞数,取平均值。
1.7 Western blot实验检测TMP对AKT/mTOR信号通路和细胞周期相关蛋白的影响
分别以0 mg/L和400 mg/L的TMP处理细胞24 h后加入RIPA裂解液(含蛋白酶抑制剂),冰上放置30 min,提取细胞总蛋白。用BCA法测定蛋白浓度,采用SDS-PAGE凝胶电泳,每孔加入30 μg蛋白,浓缩胶设定80 V,分离胶设定100 V,电泳2 h,然后恒流电转,将蛋白转移到PVDF膜。然后用5%脱脂奶粉溶液在室温封闭1 h,在4 ℃冰箱内孵育一抗AKT(1 ∶5 000)、p-AKT(1 ∶5 000)、mTOR(1 ∶5 000)、p-mTOR(1 ∶5 000)、Cyclin D1(1 ∶1 000)、CDK4(1 ∶1 000)和β-actin(1 ∶10 000)过夜,TBST洗涤3次,室温孵育二抗1 h,TBST洗涤3次,化学发光法曝光,拍照。
1.8 流式细胞术检测TMP对UM-UC-3细胞周期的影响
取对数生长期UM-UC-3细胞,接种于6孔板中并置于细胞培养箱中孵育培养。24 h后弃培养基,以0 mg/L和400 mg/L的TMP处理细胞,24 h后收集细胞至1.5 ml EP管中并调整细胞数至1×106。在室温下用70%乙醇固定1 h,用预冷的PBS洗涤两次,然后用0.5 ml PI/RNase染色液重悬细胞,轻轻混匀后在室温下避光静置30 min,用流式细胞仪检测细胞周期。
1.9 统计学分析
每个实验均重复3次,Graphpad Prism7.0软件和SPSS20.0分析数据,计量资料以均数±标准差表示。两组的均数比较采用独立样本t检验,多组的均数比较采用单因素方差分析,P<0.05代表差异有统计学意义。
2 结果
2.1 TMP对UM-UC-3细胞增殖的影响
当TMP浓度为0 mg/L时,其作用于UM-UC-3细胞24,48,72 h,细胞增殖未见明显抑制。不同浓度(200,400,800 mg/L)TMP处理细胞24,48,72 h后增殖抑制率逐渐增加;在相同浓度下不同时间点的细胞增殖抑制率比较,差异有统计学意义(P<0.05);在相同时间点不同浓度的细胞增殖抑制率比较,差异有统计学意义(P<0.05,见表1)。提示TMP对膀胱癌UM-UC-3细胞的增殖抑制作用呈剂量依赖性和时间依赖性。400 mg/L的TMP对细胞增殖具有良好的抑制作用,且对细胞无明显致死作用,故选择400 mg/L作为后续研究的浓度。
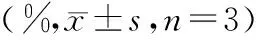
表1 不同浓度TMP作用不同时间对UM-UC-3细胞增殖抑制率的比较Table 1 Comparison of the inhibitory rate of different concentrations of TMP on the proliferation of UM-UC-3 cells at different time
2.2 TMP对SV-HUC-1细胞活力的影响
与0 mg/L浓度相比,不同浓度(200,400,800 mg/L)TMP处理24 h后,SV-HUC-1细胞活力均降低(见图1)。随着给药浓度增大,细胞活力逐渐下降,但不同浓度(200,400,800 mg/L)TMP处理组细胞的活力均大于80%,说明TMP对正常尿路上皮细胞SV-HUC-1的细胞毒性在可接受范围之内。
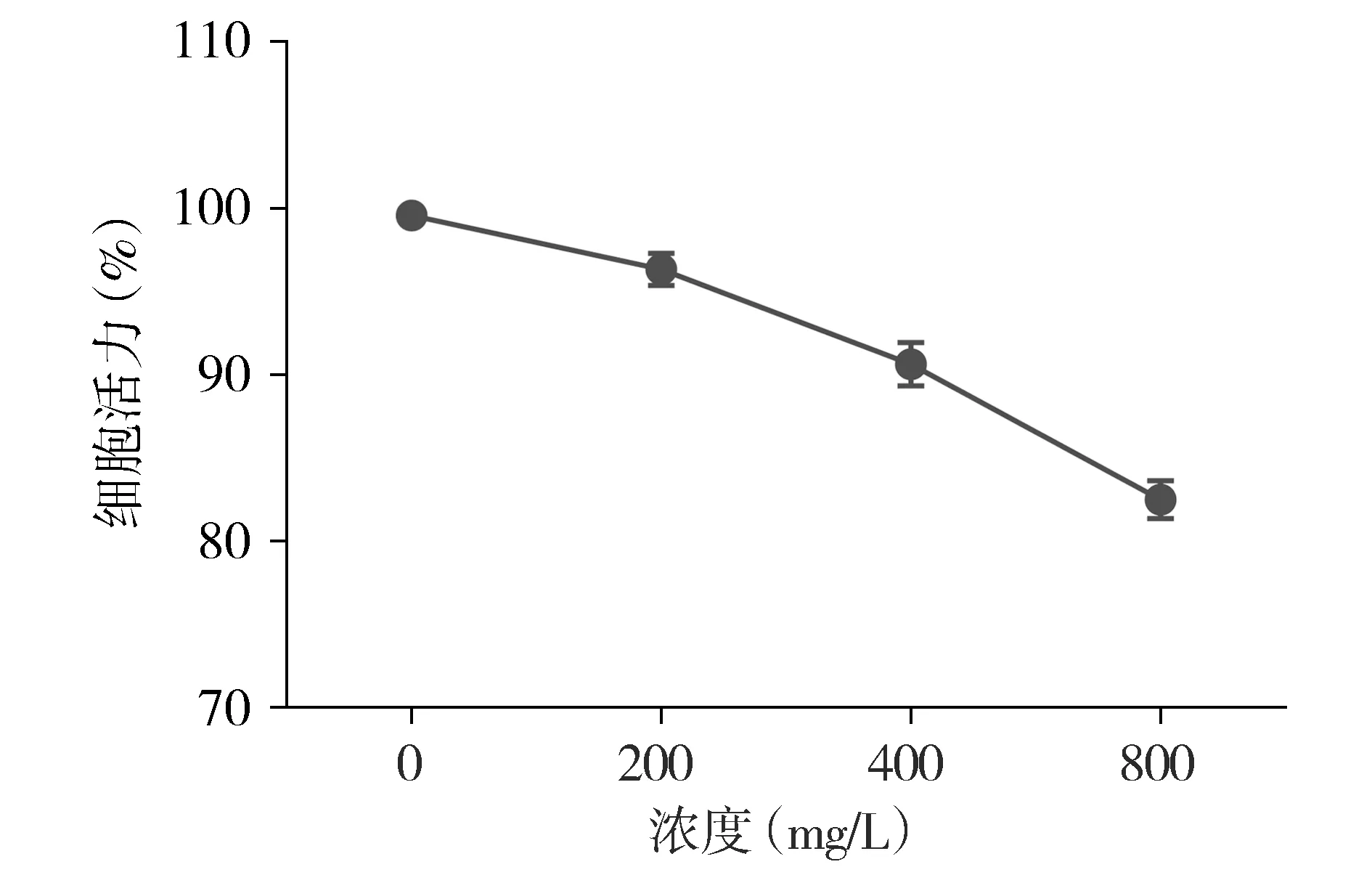
图1 TMP对SV-HUC-1细胞活力的影响Figure 1 Effect of TMP on SV-HUC-1 cell viability
2.3 TMP对UM-UC-3细胞迁移能力的影响
划痕实验结果显示UM-UC-3细胞划痕24 h,400 mg/L TMP组细胞划痕的愈合率低于0 mg/L TMP组,差异有统计学意义(P<0.01,见图2A);Transwell迁移实验表明400 mg/L TMP组细胞迁移能力低于0 mg/L TMP,差异有统计学意义(P<0.01,见图2B)。提示TMP可抑制UM-UC-3细胞的迁移能力。
与0 mg/L组比较,**P<0.01图2 川芎嗪作用24 h对UM-UC-3细胞迁移的影响 (×200)Figure 2 Effect of TMP on migration of UM-UC-3 cells after treatment for 24 h (×200)
2.4 TMP对UM-UC-3细胞周期的影响
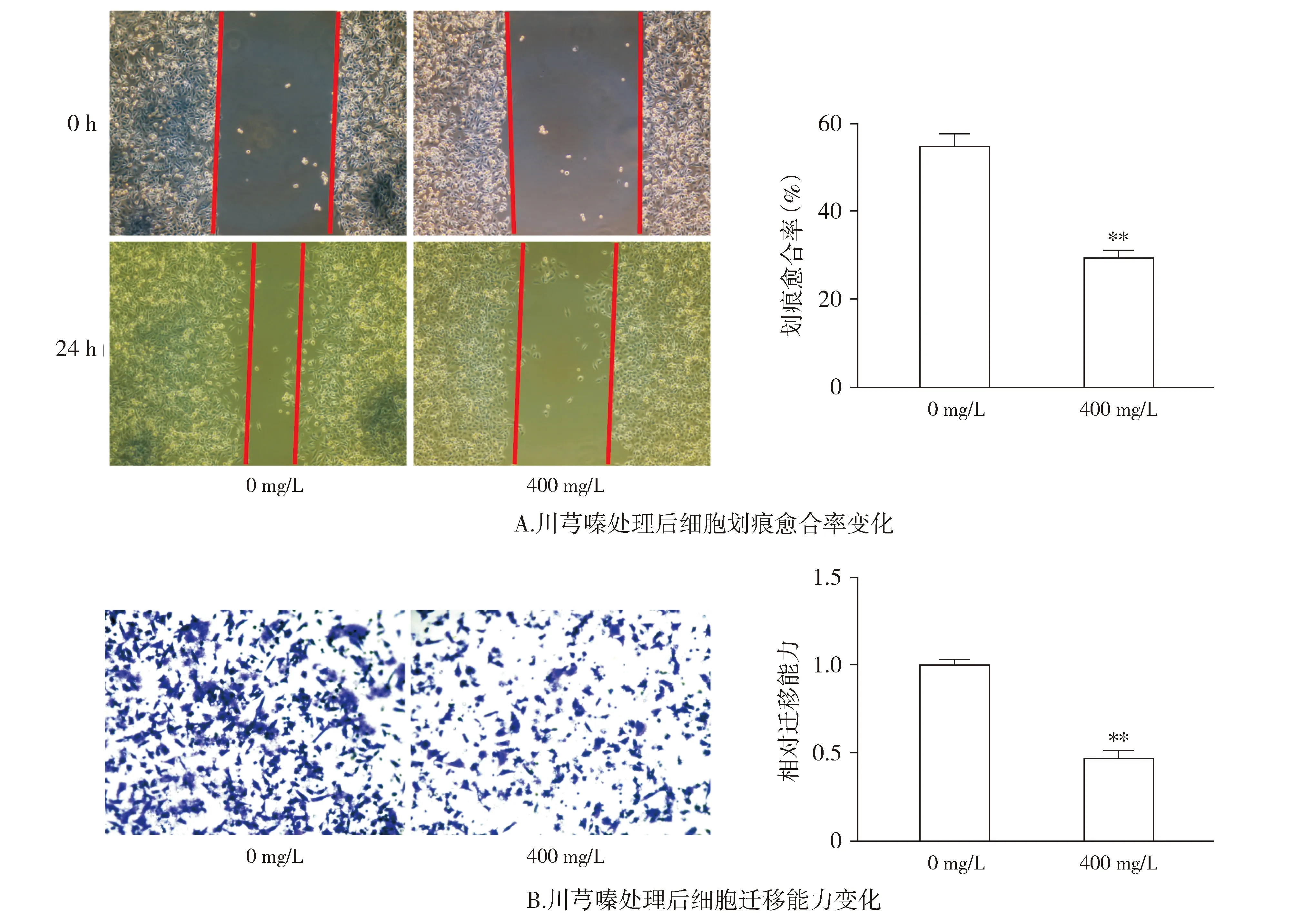
流式细胞术检测表明,分别用0 mg/L和400 mg/L TMP处理UM-UC-3细胞24 h,发现400 mg/L TMP组处于G0/G1期的细胞比例高于0 mg/L TMP组,差异有统计学意义(P<0.05,见图3)。
与0 mg/L组比较,*P<0.05,**P<0.01图3 川芎嗪作用24 h对UM-UC-3细胞周期的影响Figure 3 Effect of TMP on cell cycle of UM-UC-3 cells after treatment for 24 h
2.5 TMP对UM-UC-3细胞Cyclin D1及CDK4蛋白表达的影响
Western blot检测细胞周期相关蛋白表达水平,结果显示,与0 mg/L TMP组相比,400 mg/L TMP组Cyclin D1和CDK4蛋白表达水平下降,差异有统计学意义(P<0.01,见图4)。

与0 mg/L组比较,**P<0.01图4 川芎嗪作用24 h对UM-UC-3细胞Cyclin D1和CDK4蛋白的影响Figure 4 Effect of TMP on the expression of Cyclin D1 and CDK4 in UM-UC-3 cells after treatment for 24 h
2.6 TMP对AKT/mTOR信号通路的影响
Western blot实验结果显示,与0 mg/L TMP组相比,400 mg/L TMP组的AKT和mTOR的蛋白表达未见明显变化,但p-AKT、p-mTOR蛋白表达水平下降,差异有统计学意义(P<0.05,见图5),提示TMP可以抑制AKT和mTOR的磷酸化水平。
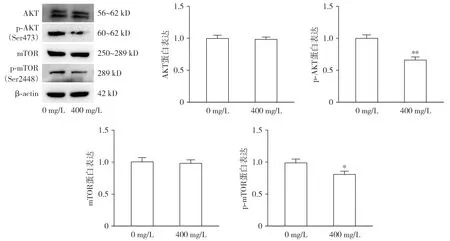
与0 mg/L组比较,*P<0.05,**P<0.01图5 川芎嗪对UM-UC-3细胞AKT/mTOR信号通路相关蛋白的影响Figure 5 Effect of TMP on the expression of AKT/mTOR signaling pathway-related proteins in UM-UC-3 cells
3 讨论
膀胱癌是泌尿系统最常见的恶性肿瘤,也是全球最普遍的肿瘤之一[10]。虽然手术切除是早期膀胱癌的主要治愈疗法,但对肌层浸润性膀胱癌或转移性膀胱癌患者需要应用以铂类为基础的联合化疗[6]。近年来,很多植物都被证明含有抗癌成分,长春新碱、紫杉醇、托泊替康等植物化合物已经被应用到癌症的临床治疗中。TMP是一种常见于中草药根或茎中的生物碱单体,其在中药中应用已有较长的历史。近来,已有研究表明其对肺癌[11]、乳腺癌[12]、肝癌[13]等癌症具有一定的抗癌作用。目前,TMP对膀胱癌细胞的抗肿瘤作用还有待进一步的探讨。
本研究首先检测了不同浓度TMP对膀胱癌UM-UC-3细胞增殖的影响。CCK-8实验表明,TMP以剂量和时间依赖性的方式显著抑制UM-UC-3细胞增殖;划痕实验表明,用400 mg/L的TMP处理UM-UC-3细胞,细胞划痕愈合率显著低于0 mg/L组;Transwell迁移实验也证实用400 mg/L的TMP处理的UM-UC-3细胞的迁移细胞数低于0 mg/L组,说明TMP也可以抑制膀胱癌UM-UC-3细胞的迁移能力。癌细胞中的细胞周期停滞通常与抑制细胞增殖有关。与正常细胞相比,不受控制的增殖是肿瘤细胞最显著的生物学特征之一[14]。Bian等[15]研究发现TMP可以诱导人结直肠癌细胞凋亡并导致细胞周期阻滞在G0/G1期。我们进一步通过流式细胞术检测了TMP对细胞周期的影响,结果显示,TMP诱导UM-UC-3细胞的细胞周期停滞在G0/G1期,表明TMP通过诱导G0/G1细胞周期停滞来抑制UM-UC-3细胞的增殖。Cyclin D1和CDK4是细胞周期进程中重要的调控因子,Cyclin D1和CDK4可以促进G1/S期的细胞周期进程[16,17]。本研究进一步检测TMP对细胞周期相关蛋白Cyclin D1和CDK4表达的影响,结果提示TMP抑制了Cyclin D1和CDK4的蛋白表达。AKT信号通路已被证明在恶性肿瘤的增殖和迁移过程中发挥着重要的作用[18]。AKT信号通路的激活可以导致GSK-3降低,促进Cyclin D1的表达,在细胞周期进程中起着重要作用[19]。庞皓玥等[20]研究发现TMP联合顺铂处理人肺癌A549细胞后,PI3K/AKT/mTOR通路蛋白表达降低,细胞的增殖和侵袭能力受到抑制。本研究进一步探讨了TMP对UM-UC-3细胞AKT/mTOR信号通路的影响,Western blot结果显示,TMP抑制了细胞中p-AKT和p-mTOR的蛋白表达,但对AKT和mTOR的蛋白表达无明显影响。以上结果表明,TMP可以通过影响AKT/mTOR信号通路的表达,抑制下游信号蛋白Cyclin D1和CDK4,阻滞细胞周期于G0/G1期,从而抑制膀胱癌细胞的增殖和迁移。
综上所述,本研究表明TMP可以抑制膀胱癌细胞的增殖和迁移,并且诱导膀胱癌细胞周期阻滞在G0/G1期。此外,TMP可以通过AKT/mTOR信号通路影响下游分子Cyclin D1和CDK4发挥抑癌作用。TMP作为传统中药川芎的提取物,有望成为膀胱癌的一种潜在治疗药物。

