lncRNA MEG3对胃癌细胞侵袭、转移及miR-373-5p/BTG3轴的影响
胡广军,宗殿亮,孙清森,赵俊卿,张新如,谷 斌
(沧州市人民医院胃肠外科,沧州 061000;*通讯作者,E-mail:huguangjun666@163.com)
胃癌(gastric cancer, GC)是全球常见消化系统恶性肿瘤,在全球发病率排列第四位,死亡率排列第二[1]。胃癌与大多数肿瘤疾病相似,早期无明显临床症状,确诊时多数为中晚期,肿瘤细胞侵袭及转移能力较强,可直接侵入血管而引起远处转移,导致患者预后较差[2]。近些年,随着分子生物技术的发展,发现长链非编码RNA(long non-coding RNA,lncRNA)及微小RNA(miRNA)与多种恶性肿瘤疾病发生发展关系密切。母系表达基因3(materally expressed gene 3, MEG3)属于lncRNA家族成员之一,是首个具有肿瘤抑制作用的长链RNA,在胃癌组织中显著低于癌旁组织[3]。lncRNA MEG3在胃癌组织表达降低,随着肿瘤体积增加及TNM分期升高而降低,并认为转染类似物或抑制物对胃癌细胞增殖及凋亡具有调控作用。微小RNA(miRNA)是由多个核苷酸组成小分子RNA,可进行基因转录、DNA复制等作用,miR-373最初在人类胚胎干细胞中发现的一种特异性RNA,在睾丸生殖细胞癌细胞中miR-373具有致癌作用[4]。研究发现,胃癌中miR-373-5p表达升高,通过转染抑制物降低表达后可减少胃癌细胞增殖,对控制胃癌疾病发展具有重要作用。miR-373-5p可以受到lncRNA调节在恶性肿瘤中发挥作用。例如在宫颈癌细胞中,上调lncRNA SATB2-AS1的表达水平可通过调控miR-373-5p/BTG3轴参与宫颈癌的进展,抑制癌细胞增殖并诱导细胞凋亡。在胃癌中B细胞易感基因3(B-cell translocation gene 3,BTG3)被作为抑癌基因,可以抑制胃癌细胞增殖且促进凋亡[5]。但是关于lncRNA MEG3在胃癌细胞中对miR-373-5p/BTG3活性的影响还不明确。本文通过观察lncRNA MEG3靶向miR-373-5p/BTG3轴对胃癌细胞侵袭及转移的影响,有望为相关研究提供参考依据。
1 材料与方法
1.1 细胞来源及培养
正常胃上皮细胞GES-1,胃癌细胞SGC-7901细胞均购自美国菌种保存中心(ATCC)。细胞培养所有的培养基为RPMI1640,在培养基中加入7%的胎牛血清、100 μg/ml的链霉素、100 IU/ml的青霉素,细胞在37 ℃、CO2的细胞培养箱中培养。间隔48 h,当细胞生长密度为90%时可进行传代,取对数细胞进行实验。
1.2 主要试剂及仪器
lncRNA MEG3、miR-373-5p引物均购自上海吉凯制药有限公司;Lipofectamine2000转染试剂购自重庆市华雅干细胞技术有限公司;DMEM培养基购自上海微科生物技术有限公司;牛血清、0.25%胰蛋白酶均购自上海素尔生物科技有限公司;鼠抗人BTG3单克隆抗体购自上海圻明生物科技有限公司;山羊抗兔IgG购自武汉纯度生物科技有限公司;Cell Counting Kit-8(CCK-8)试剂盒购自弗元(上海)生物科技有限公司;流式细胞仪购自美国贝克曼库尔特公司;荧光素酶报告基因质粒购自翌圣生物科技(上海)股份有限公司;逆转录试剂盒及PCR试剂盒购自江西江蓝纯生物有限公司;实时荧光定量PCR仪购自中山大学达安基因股份有限公司。
1.3 分组及细胞转染
SGC-7901细胞株分为:空白组(无转染)、空载组(转染空质粒pcDNA)、MEG3组(转染pcDNA-MEG3)。PBS缓冲液将胃癌细胞株洗净,重复3次,胰蛋白酶消化2 min,离心15 min后,将数目为5×103细胞平铺到6孔板中,融合率达到70%,采用无血清培养基按照3 μl稀释,在37 ℃下孵育20 min,转染按照Lipofectamine 2000说明书操作,分别将pcDNA-MEG3、pcDNA转染到细胞株中,37.5 ℃,5%CO2继续培养。12 h后将无血清培养基更换为完全培养基,继续培养24 h后,提取细胞RNA,采用qRT-PCR法验证转染效率。
1.4 qRT-PCR检测正常胃上皮细胞及胃癌细胞中MEG3、miR-373-5p、BTG3mRNA表达
正常胃上皮细胞GES-1及胃癌SGC-7901细胞移入离心管中,加入100 μl的总RNA抽提试剂Trizol,进行摇晃,加入40 μl的氯仿,持续震动10 s。静置5~10 min,低温3 500 r/min,离心15 min,样品出现明显分离层,将上层RNA进行吸取,加入离心管中冷却后再次加入氯仿,摇匀后孵育10 min,然后按照3 500 r/min,再次离心15 min后,保留下方沉淀物,加入2 ml的乙醇,对沉淀物进行洗涤。保留下方沉淀,干燥,加入15 μl的超纯水,待RNA完全水解后,75 ℃保温20 min,采用分光光度计检测RNA的紫外吸收值比值。反应条件:①第1阶段:预变性(95 ℃ 30 s);②第2阶段:PCR反应(95 ℃ 5 s,60 ℃ 30 s)40个循环;③第3阶段:溶解曲线分析获得的cDNA,反应条件为95 ℃反应15 s,60 ℃反应60 s,95 ℃再次反应15 s,将提取的RNA进行转录为cDNA,获得反应体系,条件为:42 ℃反应时间60 min,72 ℃反应时间5 min,4 ℃终点。将每组细胞设置复孔3个,以U6为内参,反应条件为95 ℃预反应3 min,95 ℃反应5 s,58 ℃退火,整个实验做40个循环,检测结果采用2-ΔΔCt方法进行分析,引物序列见表1。

表1 基因引物序列Table 1 Gene primer sequences
1.5 Transwell小室检测细胞侵袭能力
将各组SGC-7901细胞调整密度为1×108/L,用DMEM稀释到0.25 μg/μl工作液放置冰盒中,将100 μl基底膜基质平铺在24孔小室内,37 ℃,5%CO2培养箱中孵育,使基底膜基质凝固,上室中加入100 μl细胞培养液,下室中加入少量胎牛血清培养基,37 ℃培养箱中培养24 h,取出小室,拭去残留细胞,冲洗,染色。计算SGC-7901细胞侵袭细胞数,实验3次,复孔2次。
1.6 细胞划痕实验检测细胞迁移距离
将各组SGC-7901细胞常规消化离心,每孔5×103细胞,均匀接种到6孔培养板内,每孔加入1 ml细胞悬液,待细胞铺满整个孔底部后,用1 ml枪头缓慢竖直划出一条笔直划痕,放弃去培养液,PBS冲洗2次,吸取残留细胞,每孔内加入含有1 mg/L丝裂霉素的PBS 200 μl,37 ℃孵育1 h。固定染色,超纯水清洗2次,倒置显微镜拍照观察并计算划痕区的细胞数,实验3次,复孔2次。
1.7 免疫荧光检测各组SGC-7901细胞BTG3表达
将各组SGC-7901细胞消化后接种于6孔板中,培养24 h加入多聚甲醛(4%)固定,15 min后PBS冲洗加入0.1%聚乙二醇辛基苯基醚透明15 min,PBS冲洗,采用5%的牛血清白蛋白(BSA)封闭液封闭30 min,加入BTG3(1 ∶500)一抗,室温孵育2 h,加入荧光标记的二抗(1 ∶2 000)避光作用1 h,采用DAPI细胞核染色在聚焦显微镜观察并拍照。
1.8 双荧光素酶报告基因验证MEG3对miR-373-5p调控作用
将SGC-7901细胞接种于6孔板中,按照LipofectamineTM2000说明将miR-373-5p-3′-UTR-WT、miR-373-5p-3′-UTR-MUT、BTG3-3′-UTR-WT、BTG3-3′-UTR-MUT质粒转染空载组及MEG3组,按照说明书,使用双荧光素酶报告系统试剂盒测量MEG3对miR-373-5p及BTG3的表达活性的调控能力。
1.9 统计学分析

2 结果
2.1 正常胃上皮细胞GES-1和SGC-7901细胞中MEG3、miR-373-5p、BTG3 mRNA表达
正常胃上皮细胞GES-1及SGC-7901细胞的MEG3 mRNA表达量分别为1.00±0.00和0.18±0.04,差异有统计学意义(t=50.210,P<0.05);miR-373-5p mRNA表达量分别为1.00±0.00和1.63±0.20,差异有统计学意义(t=7.716,P<0.05);BTG3mRNA表达量分别为1.00±0.00和0.38±0.09,差异有统计学意义(t=16.870,P<0.05,见图1)。
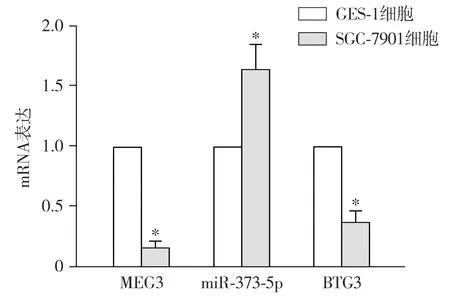
与GES-1相比,*P<0.05图1 正常胃上皮细胞GES-1和SGC-7901细胞中MEG3 mRNA表达Figure 1 MEG3 mRNA level in GES-1 and SGC-7901
2.2 各组SGC-7901细胞中MEG3 mRNA表达
空白组和空载组MEG3 mRNA表达比较差异无统计学意义(t=1.960,P=0.078),MEG3组MEG3 mRNA表达分别高于空白组和空载组(t空白组vs MEG3组=16.530,P<0.001;t空载组vs MEG3组=14.510,P<0.001,见图2)。
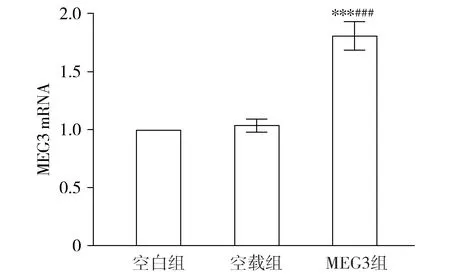
与空白组相比,***P<0.001;与空载组相比,###P<0.001图2 各组SGC-7901细胞中MEG3 mRNA表达Figure 2 MEG3 mRNA expression in SGC-7901 cells
2.3 各组SGC-7901细胞侵袭数目比较
空白组、空载组及MEG3组细胞中侵袭数目分别为(92.50±10.33)个、(89.69±12.50)个及(49.63±4.56)个,差异有统计学意义(F=36.480,P<0.001)。进一步两两比较,空白组和空载组差异无统计学意义(t=0.425,P=0.680),MEG3组与空白组、空载组比较差异有统计学意义(t空白组vs MEG3组=7.375,P=0.001;t空载组vs MEG3组=9.300,P=0.001,见图3)。

图3 各组SGC-7901细胞侵袭数目比较 (×200)Figure 3 Comparison of SGC-7901 cell invasion numbers among groups (×200)
2.4 各组SGC-7901细胞迁移比较
空白组、空载组及MEG3组细胞中划痕愈合率分别为(84.10±5.61)%,(83.05±6.16)%及(48.33±5.04)%,差异有统计学意义(F=78.660,P<0.001)。进一步两两比较,空白组和空载组细胞划痕愈合率比较差异无统计学意义(t=0.309,P=0.764),与空白组和空载组比较,MEG3组细胞划痕愈合能力减弱,细胞划痕愈合率降低,差异有统计学意义(t空白组 vs MEG3组=11.620,P=0.001;t空载组 vs MEG3组=10.690,P=0.001,见图4)。

图4 各组SGC-7901细胞迁移比较 (×200)Figure 4 Comparison of SGC-7901 cell migration among groups (×200)
2.5 各组SGC-7901细胞中BTG3蛋白水平比较
DAPI呈现蓝色、BTG3为绿色,两个叠加呈蓝色绿色双染,空白组和空载组BTG3荧光强度相似,与空白组和空载组相比,MEG3组BTG3荧光强度增加。空白组、空载组及MEG3组胃癌细胞中BTG3蛋白水平分别为0.54±0.04,0.57±0.03及1.12±0.08,差异有统计学意义(F=224.200,P<0.001)。进一步两两比较,空白组和空载组BTG3蛋白水平比较差异无统计学意义(t=1.470,P=0.172),与空白组和空载组比较,MEG3组BTG3蛋白水平升高,差异有统计学意义(t空白组 vs MEG3组=15.88,P<0.001;t空载组 vs MEG3组=15.770,P<0.001,见图5)。

图5 各组SGC-7901细胞中BTG3蛋白水平比较Figure 5 BTG3 protein levels in SGC-7901 cells in each group
2.6 各组SGC-7901细胞中miR-373-5p和BTG3 mRNA水平比较
空白组和空载体组SGC-7901细胞中miR-373-5p、BTG3 mRNA水平比较差异均无统计学意义(P>0.05);与空载体组相比,MEG3组SGC-7901细胞中miR-373-5p mRNA水平降低、BTG3 mRNA水平升高(均P<0.001,见表2)。

表2 各组SGC-7901细胞中miR-373-5p、BTG3 mRNA水平比较Table 2 Comparison of miR-373-5p and BTG3 mRNA levels in SGC-7901 cells between groups
2.7 MEG3、miR-373-5p、BTG3 mRNA相关性分析
胃癌SGC-7901细胞中MEG3与miR-373-5p呈现负相关性(r=-0.336,P<0.001),胃癌SGC-7901细胞中MEG3与BTG3呈现正相关性(r=0.413,P<0.001),胃癌SGC-7901细胞中miR-373-5p与BTG3呈现负相关性(r=-0.400,P<0.001,见图6)。

图6 MEG3、miR-373-5p、BTG3 mRNA相关性分析Figure 6 Correlation between MEG3, miR-373-5pand BTG3 mRNA
2.8 荧光素酶验证MEG3对miR-373-5p、BTG3靶向作用
观察上调lncRNA MEG3对miR-373-5p、BTG3的荧光活性变化,结果发现,与空载组相比,MEG3组的miR-373-5p-3′-UTR-WT水平降低,BTG3-3′-UTR-WT水平升高(P<0.05,见图7,8)。

图7 MEG3对miR-373-5p、BTG3靶向作用Figure 7 MEG3 targeting miR-373-5p and BTG3

与空载组相比,#P<0.05图8 空载组及MEG3组miR-373-5p、BTG3水平比较Figure 8 Comparison of the levels of miR-373-5p and BTG3 between empty vector group and MEG3 group
3 讨论
胃癌是消化系统常见肿瘤疾病[6]。研究发现,lncRNA、miRNA在恶性肿瘤疾病具有重要作用,采用高通量测序技术鉴定出多种与胃癌相关的1ncRNAs、miRNAs,并认为其水平的改变在胃癌中可发挥致癌或抑癌作用[7]。
长链非编码RNA(long non-coding RNA, lncRNA)是长度大于200个核苷酸的非编码RNA,最初被认为是基因组转录的噪音,但后有研究证实,lncRNA在调控基因表达中具有不可或缺性[8]。lncRNA MEG3位于人类染色体14q32,MEG3在脑垂体组织中呈现高表达,当垂体癌变时其表达水平降低或缺失,认为MEG3低表达与肿瘤细胞浸润增加相关[9]。肿瘤细胞侵袭及转移均是在癌细胞增殖的基础,癌细胞游离原病灶,通过细胞外基质,游走在血液循环系统内,逃避免疫监视,发生免疫逃窜。赵力等[10]研究认为在鼻咽癌细胞中MEG3表达缺失,通过质粒转染后水平升高可减少鼻咽癌细胞侵袭及转移,研究机制可能与抑制细胞上皮细胞-间质转化(epithelial-mesenchymal transition,EMT)相关。MEG3是一种抑制胃癌细胞活性内源RNA,与miRNA存在竞争性,MEG3在miR-181位点依赖因子中可影响胃癌细胞表型,并通过改善miRNA靶向调控miR-181进而抑制胃癌细胞活性[11]。刘婵等[12]研究发现lncRNA MEG3可以通过抑制胃癌细胞中基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)及基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)表达而抑制肿瘤细胞侵袭及转移。郭苹等[13]研究表明,胃癌细胞中上调MEG3水平可提高顺铂化疗敏感性,研究机制与抑制STAT3磷酸化及Bcl-2表达相关。本文研究表明,上调lncRNA MEG3可显著降低胃癌细胞侵袭及转移,可能与其改善细胞EMT转化,降低细胞侵袭及转移能力,并调控Bcl-2而加快细胞凋亡。
miR-373定位于染色体19q13.42,miR-373可被核酸酶Dicer剪切成两个成熟的miR-373-3p和miR-373-5p,认为其表达与肿瘤发生发展相关。miR-373最初被认为是在胚胎干细胞中存在的特异性miRNA,在乳腺癌中可通过降低大肿瘤抑制因子2(large tumor suppressor kinase2,Lats2)表达而抑制乳腺癌细胞侵袭及迁移[14]。Looijenga等[15]研究发现,在睾丸生殖细胞癌中miR-373可以抑制p53基因通路与癌基因RAS协同作用而增加细胞生物活性。在以往的文献中发现miR-373-5p可以直接靶向沉默信息调节因子2相关酶1(silent information regulator 2 homolog 1,Sirt1)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路而增加转录因子核因子κB(nuclear factor kappa-B,NF-κB)表达而增加肿瘤细胞侵袭及转移的能力[16]。研究表明,与正常胃组织相比,miR-373在胃腺癌组织和胃癌细胞系中表达上调。miR-373在胃癌细胞中的过表达增加了细胞增殖,miR-373的过表达导致HEK293细胞中含有TNFAIP1 3′UTR的荧光素酶报告蛋白的抑制,并降低了AGS细胞中TNFAIP1蛋白的水平,证明了miR-373的致癌作用,并通过下调TNFAIP1来控制细胞生长[17]。BTG3是B细胞迁移基因/erbB2转录因子家族成员之一,具有调控细胞生物活性及参与细胞DNA损伤修复的作用。研究发现,BTG3在胃癌组织中表达降低并与肿瘤分期及分化程度相关,随着胃癌分期增加其表达更低[18]。胃癌细胞中过表达BTG3可以抑制胃癌细胞活性,减少侵袭及迁移的同时增加肿瘤细胞凋亡[19]。本文研究结果表明,在胃癌细胞中miR-373-5p表达较高,但是转染lncRNA MEG3后的胃癌细胞中miR-373-5p表达降低,说明上调lncRNA MEG3可以抑制miR-373-5p、增加BTG3表达而减少胃癌细胞侵袭及迁移。
lncRNA MEG3在多种恶性肿瘤中已经被证实发挥抑癌作用,并通过调节miRNA或相关基因来实现的[20]。陈丹等[21]研究显示,七氟醚处理后lncRNA MEG3调控miR-222抑制胃癌细胞增殖,促进胃癌细胞凋亡。lncRNA能够作为海绵体靶点定点miRNA而参与到遗传监督过程,进一步对miRNA及下游相关基因的表达进行调控而参与细胞增殖、凋亡及侵袭。表观遗传学的监管机制放松是导致肿瘤发生发展的原因之一。在胃癌细胞中,敲降XIST可抑制AGS细胞增殖、侵袭和EMT,其作用机制是通过靶向miR-337-3p并下调HOXC8的表达[22]。另有研究表明,上调lncRNA SATB2-AS1的表达水平可通过调控miR-373-5p/BTG3轴参与CC的进展,抑制癌细胞增殖并诱导细胞凋亡[23]。本文研究结果显示:通过荧光素酶报告进一步证实,MEG3对miR-373-5p及BTG3具有靶向调控作用。lncRNA MEG3及BTG3在胃癌细胞表达降低,miR-373-5p表达升高,通过上调lncRNA MEG3表达而降低miR-373-5p表达,激活BTG3表达。生物信息学网站预测到几者之间存在相似的结合位点,而miR-373-5p能够调控癌胃癌细胞间质转化,降低其表达而抑制胃癌细胞侵袭及迁移行为。
综上所述,上调lncRNA MEG3可能靶向抑制miR-373-5p、激活BTG3水平从而抑制SGC-7901细胞侵袭及转移。本文尚存在不足之处,miR-373-5p对胃癌细胞活性及lncRNA MEG3对调控miR-373-5p的作用机制还不清楚,这是本文下一步研究方向,希望为胃癌的相关研究提供参考依据。

