TRIM44基因对子宫内膜癌细胞生长及放疗敏感性的影响
王 丽,陆 军,刘金鹏,万 伟,秦少磊,张雅敏*
(1西安国际医学中心医院肿瘤五病区,西安 710100;2西安国际医学中心医院肿瘤三病区;*通讯作者,E-mail:m17782639858@163.com)
子宫内膜癌(endometrial cancer,EC)是世界范围内最常见的妇科恶性肿瘤之一,其发病率正在迅速上升[1]。尽管EC的常规治疗方法在不断优化,然而EC患者的预后仍然很差[2]。因此,了解EC发生的分子机制对提高诊断和治疗水平具有重要意义。三结构域蛋白44(tripartite motif-containing protein 44, TRIM44)属于三结构域蛋白(tripartite motif, TRIMs)家族的成员,是一种含有锌指泛素蛋白酶结构域的脱泛素酶[3,4]。TRIMs家族蛋白参与多种生物学功能,包括病毒介导的免疫反应及抑制或促进肿瘤进展[3,4]。TRIM44在多种癌症中上调,包括结直肠癌、卵巢癌、甲状腺乳头状癌等,并且具有促进癌细胞增殖、迁移和侵袭的功能[5-7]。有文献报道,TRIM44的高表达可增强多发性骨髓瘤细胞的放射抗性,抑制细胞凋亡[8]。最近,Li等[9]报道,TRIM44在EC组织中高表达,TRIM44的表达与国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期、组织学分级、肌层侵犯深度、淋巴结转移、总生存期和无瘤生存期有关。基于目前的研究,本课题组推测TRIM44可能在EC进展中发挥重要作用,可能调节EC细胞的放疗敏感性。因此,本研究通过观察TRIM44在EC癌组织中的表达模式以及TRIM44对照射处理的人子宫内膜癌细胞系(HEC-1A)增殖、凋亡、迁移、侵袭、P62蛋白表达及核转位、细胞核FLNA和RAD51蛋白表达的影响,旨在探讨TRIM44基因对EC细胞生长及放疗敏感性的影响及机制。
1 材料与方法
1.1 材料
1.1.1 实验试剂 人子宫内膜癌细胞系(HEC-1A)和正常人宫颈上皮细胞(HcerEpic)购自美国ATCC公司。靶向TRIM44的siRNA(siRNA-TRIM44)、阴性对照siRNA(siRNA-NC)、TRIM44过表达慢病毒(LV-TRIM44)和阴性对照慢病毒(LV-NC)均由上海吉玛制药技术有限公司合成。Dulbecco改良的Eagle培养基(DMEM)购自美国Gibco公司。胎牛血清(FBS)、链霉素、青霉素购自美国Thermo Scientific公司。Lipofectamine 2000试剂、TRIzol试剂购自美国Invitrogen公司。Transwell板购自美国Corning公司。Matrigel购自美国BD Biosciences公司。PrimeScript RT试剂盒、SYBR Premix ExTaq Ⅱ Kit购自日本Takara公司。细胞计数试剂盒-8(CCK-8)、Annexin Ⅴ-FITC凋亡检测试剂盒、二氨基联苯胺(DAB)、RIPA裂解液、增强型ECL试剂盒购自碧云天生物技术研究所。抗体均购自英国Abcam公司。
1.1.2 组织标本收集 收集西安国际医学中心医院30例确诊的EC患者的癌组织和临近癌旁组织,所有患者在手术前均未接受化疗或放射治疗。患者年龄31~81岁,平均(48.45±14.35)岁。统计患者的FIGO分期、组织学分级、淋巴结转移等资料。其中,FIGO分期为Ⅰ+Ⅱ期14例,Ⅲ+Ⅳ期16例;组织学分级为G1级7例,G2+G3级23例;淋巴结未转移16例,转移14例。通过免疫组化法检测癌旁组织以及EC组织中TRIM44的表达。通过qRT-PCR检测癌旁组织以及不同FIGO分期、组织学分级、淋巴结转移/未转移的EC患者的癌组织中TRIM44 mRNA水平。本研究已获得西安国际医学中心医院伦理委员会的批准(审批号:2019GJYXZX015),所有参与研究的患者均签署知情同意书。
1.2 方法
1.2.1 免疫组化法检测组织标本中TRIM44的表达 组织标本用10%福尔马林固定,石蜡包埋,切成4 μm厚的切片。切片在二甲苯中脱蜡,梯度乙醇溶液中复水,然后在3%的过氧化氢中孵育10 min。在柠檬酸盐缓冲液中煮沸进行抗原修复2 min,然后用10%的山羊血清封闭20 min。将切片在4 ℃下与TRIM44一抗(1 ∶200)孵育过夜,然后在37 ℃与山羊抗兔IgG H&L(ab207995)孵育30 min,所有切片均进行DAB染色。在200倍放大倍数下拍摄具有代表性的照片。
1.2.2 细胞培养、分组及处理 HEC-1A和HcerEpic细胞在DMEM培养基中在37 ℃和5%的CO2条件下培养,培养基中添加10%胎牛血清(FBS)、链霉素(100 μg/ml)和青霉素(100 U/ml)。
通过qRT-PCR和Western blot检测HcerEpic细胞和HEC-1A细胞中TRIM44的mRNA和蛋白表达水平。
将HEC-1A细胞分为对照组、siRNA-NC组、siRNA-TRIM44组、LV-NC组和LV-TRIM44组。根据说明书,使用Lipofectamine 2000试剂将siRNA-NC、siRNA-TRIM44、LV-NC或LV-TRIM44转染到对应分组的HEC-1A细胞中。对照组细胞不进行转染。细胞转染后,通过qRT-PCR和Western blot验证各组细胞中TRIM44的mRNA和蛋白表达水平。
根据是否进行照射,将HEC-1A细胞分为siRNA-NC组、siRNA-TRIM44组、LV-NC组、LV-TRIM44组、8 Gy+siRNA-NC组、8 Gy+siRNA-TRIM44组、8 Gy+LV-NC组、8 Gy+LV-TRIM44组。使用Lipofectamine 2000试剂对细胞进行转染,siRNA-NC组、siRNA-TRIM44组、LV-NC组和LV-TRIM44组细胞正常培养,8 Gy+siRNA-NC组、8 Gy+siRNA-TRIM44组、8 Gy+LV-NC组和8 Gy+LV-TRIM44组细胞进行照射处理。照射处理方法如下:将HEC-1A细胞接种到60 mm培养皿中(3×104细胞/培养皿)。采用美国瓦里安直线加速器6-MV X射线照射细胞,源靶距:100 cm,剂量率:240 cGy/min,总剂量:8 Gy。细胞转染及照射后,通过CCK-8法检测细胞增殖,Annexin Ⅴ-FITC法检测细胞凋亡,Transwell检测细胞迁移和侵袭。通过qRT-PCR检测细胞中TRIM44的mRNA水平。通过Western blot检测细胞中TRIM44、p62、细丝蛋白A(FLNA)和RAD51蛋白表达水平。
1.2.3 CCK-8法测定细胞增殖 通过CCK-8法测定细胞增殖。将100 μl细胞悬液接种在96孔板中(1×104个/孔),然后培养48 h。加入10 μl的CCK-8并在37 ℃、5% CO2条件下避光孵育3 h。使用分光光度计在450 nm波长处检测OD值。
1.2.4 流式细胞仪上检测细胞凋亡 使用Annexin Ⅴ-FITC凋亡检测试剂盒进行细胞凋亡检测。将106个/ml的细胞用PBS洗涤,1 500 r/min离心5 min,弃上清,重悬于195 μl的结合缓冲液中。然后,用5 μl的Annexin Ⅴ-FITC和5 μl的PI在25 ℃避光孵育15 min,在流式细胞仪上检测细胞凋亡。
1.2.5 Transwell测定细胞迁移和侵袭 使用24孔Transwell板进行细胞迁移和侵袭测定。用无血清培养基重悬细胞,按2×105/ml密度接种于Transwell小室上部,下部加入含10%胎牛血清的培养基,在37 ℃和5% CO2条件下孵育48 h后,将迁移到下室的细胞用甲醇固定30 min,然后用结晶紫染色15 min。使用光学显微镜在400倍放大倍数下测量迁移细胞数量。
将上室预先用Matrigel涂覆,其他步骤相同,用于评价细胞的侵袭。
1.2.6 qRT-PCR测定TRIM44基因表达水平 使用TRIzol试剂提取组织和细胞总RNA,使用PrimeScript RT试剂盒逆转录为cDNA。使用SYBR Premix ExTaq Ⅱ Kit在美国Applied Biosystems 7500型实时荧光定量PCR系统上PCR。PCR反应程序如下:50 ℃ 2 min,95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。TRIM44和GAPDH(内部对照)的引物如下:TRIM44正向5′-CCATCTGGCCGAAT-ACGTCC-3′,反向5′-TGCCTCGCTTTCTATCTCCCT-3′。GAPDH正向5′-ACAACTTTGGTATCGTGGAAGG-3′,反向5′-GCCATCACGCCACAGTTTC-3′。使用2-ΔΔCt方法计算TRIM44的mRNA相对表达水平。
1.2.7 Western blot测定TRIM44、p62、FLNA和RAD51蛋白表达水平 通过Western blot测定对照组、siRNA-NC组、siRNA-TRIM44组、LV-NC组和LV-TRIM44组的TRIM44蛋白表达水平。通过Western blot测定siRNA-NC组、siRNA-TRIM44组、LV-NC组、LV-TRIM44组、8 Gy+siRNA-NC组、8 Gy+siRNA-TRIM44组、8 Gy+LV-NC组和8 Gy+LV-TRIM44组的TRIM44、p62、FLNA和RAD51蛋白表达水平。收集各组细胞并采用RIPA裂解液将细胞裂解,通过Bradford法测定蛋白质浓度。等量的蛋白质在10%SDS-PAGE上进行电泳分离,并转移到PVDF。将膜用5%脱脂奶粉封闭2 h,然后与TRIM44、p62、FLNA、RAD51、Lamin B1和GAPDH一抗(均为1 ∶2 000)于4 ℃孵育过夜。第2天,将膜与山羊抗兔IgG H&L(HRP)二抗(1 ∶2 000)在室温下孵育2 h。通过增强型ECL试剂盒显影。Lamin B1和GAPDH分别作为细胞核蛋白内参和总蛋白内参。
1.3 统计学分析
细胞实验均重复6次。所有数据以平均值±标准差表示,使用SPSS 21.0和GraphPad Prism 8.0软件进行统计分析。两组间比较采用t检验,多组间比较采用单因素方差分析及LSD事后检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 TRIM44在EC组织和细胞系中的表达
免疫组化染色结果显示,TRIM44在EC癌组织或癌旁组织中主要表达于细胞质和细胞膜,细胞核中表达很少(见图1A)。qRT-PCR检测结果显示,与癌旁组织相比,癌组织中TRIM44的mRNA表达水平显著升高(t=8.906,P<0.001,见图1B)。与FIGO分期Ⅰ+Ⅱ期相比,Ⅲ+Ⅳ期癌组织中TRIM44的mRNA表达水平显著升高(t=3.943,P<0.001,见图1B)。与组织学分级G1级相比,G2+G3级癌组织中TRIM44的mRNA表达水平显著升高(t=4.046,P<0.001,见图1B)。与未转移的患者相比,淋巴结转移患者癌组织中TRIM44 mRNA表达水平显著升高(t=4.576,P<0.001,见图1B)。与HcerEpic细胞相比,HEC-1A细胞中TRIM44的mRNA和蛋白表达水平均显著升高(P<0.001,见图2)。

与相应对照组比较,***P<0.001图1 TRIM44在EC组织中的表达Figure 1 Expression of TRIM44 in EC tissues

与HcerEpic细胞相比,***P<0.001图2 HEC-1A和HcerEpic细胞中TRIM44的表达Figure 2 Expression of TRIM44 in HEC-1A and HcerEpic cells
2.2 TRIM44对HEC-1A细胞增殖和凋亡的影响
转染siRNA和慢病毒后,与对照组相比,siRNA-TRIM44组TRIM44的mRNA和蛋白表达水平均降低(P<0.05),LV-TRIM44组TRIM44的mRNA和蛋白表达水平均升高(P<0.05,见图3)。
与对照组相比,*P<0.05图3 HEC-1A细胞的siRNA和慢病毒转染效率Figure 3 Transfection efficiency of siRNA and lentivirus in HEC-1A cells
CCK-8测定结果显示,与siRNA-NC组相比,siRNA-TRIM44组和8 Gy+siRNA-NC组相对细胞活力均降低(P<0.05)。与LV-NC组相比,LV-TRIM44组相对细胞活力升高,而8 Gy+LV-NC组降低(P<0.05)。与8 Gy+siRNA-NC组相比,8 Gy+siRNA-TRIM44组相对细胞活力降低(P<0.05)。与8 Gy+LV-NC组相比,8 Gy+LV-TRIM44组相对细胞活力升高(P<0.05,见图4)。

与siRNA-NC组相比,*P<0.05;与LV-NC组相比,#P<0.05;与8 Gy+siRNA-NC组相比,&P<0.05;与8 Gy+LV-NC组相比,△P<0.05图4 CCK-8测定的各组HEC-1A细胞的相对细胞活力Figure 4 Relative cell viability of HEC-1A cells in each group determined by CCK-8
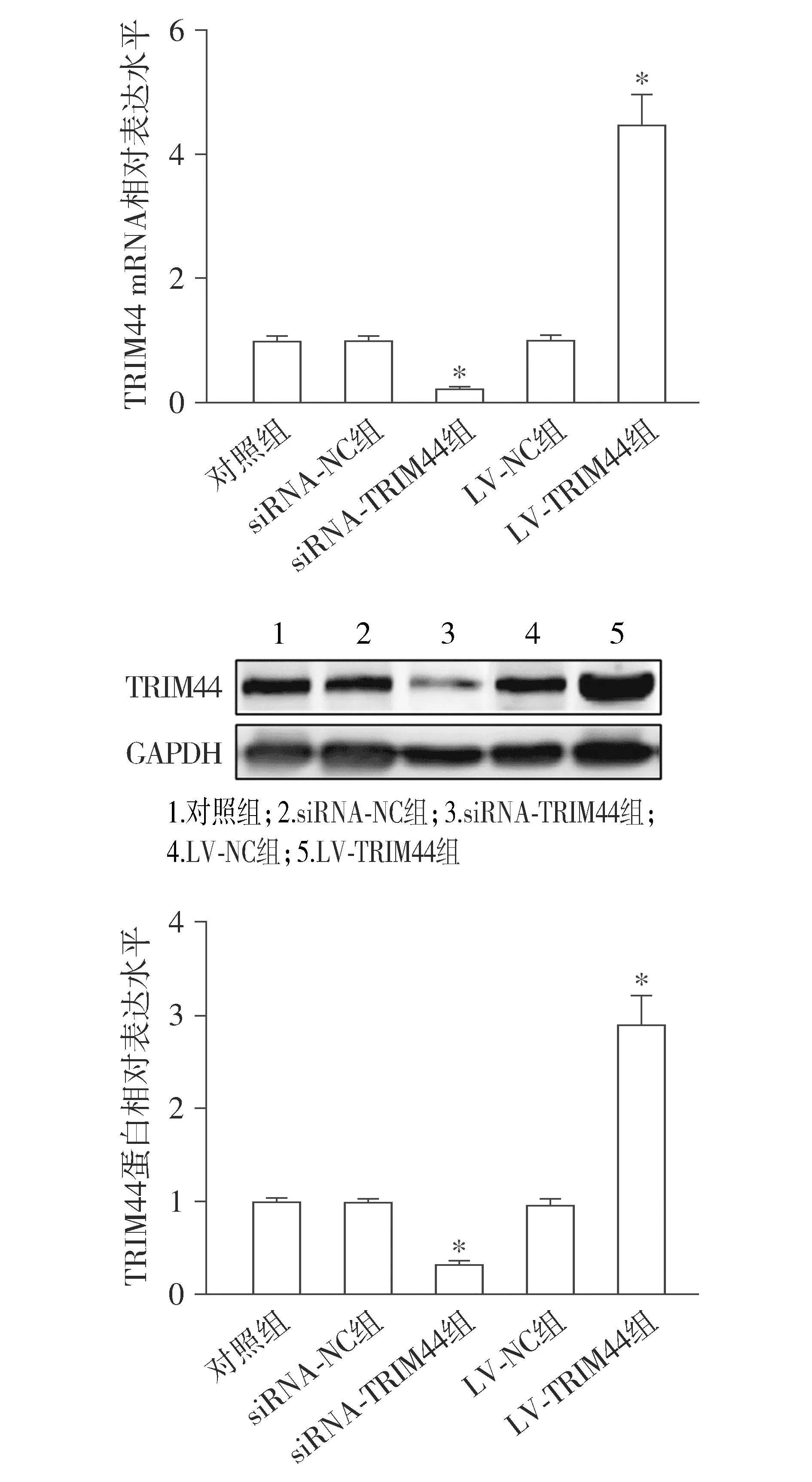
Annexin Ⅴ-FITC测定结果显示,与siRNA-NC组相比,siRNA-TRIM44组和8 Gy+siRNA-NC组的凋亡率均升高(P<0.05)。与LV-NC组相比,8 Gy+LV-NC组的凋亡率升高(P<0.05)。与8 Gy+siRNA-NC组相比,8 Gy+siRNA-TRIM44组的凋亡率升高(P<0.05)。与8 Gy+LV-NC组相比,8 Gy+LV-TRIM44组的凋亡率降低(P<0.05,见图5)。
与siRNA-NC组相比,*P<0.05;与LV-NC组相比,#P<0.05;与8 Gy+siRNA-NC组相比,&P<0.05;与8 Gy+LV-NC组相比,△P<0.05图5 Annexin Ⅴ-FITC测定的各组HEC-1A细胞的凋亡率Figure 5 Apoptosis rate of HEC-1A cells in each group by Annexin Ⅴ-FITC
2.3 TRIM44对HEC-1A细胞迁移和侵袭的影响
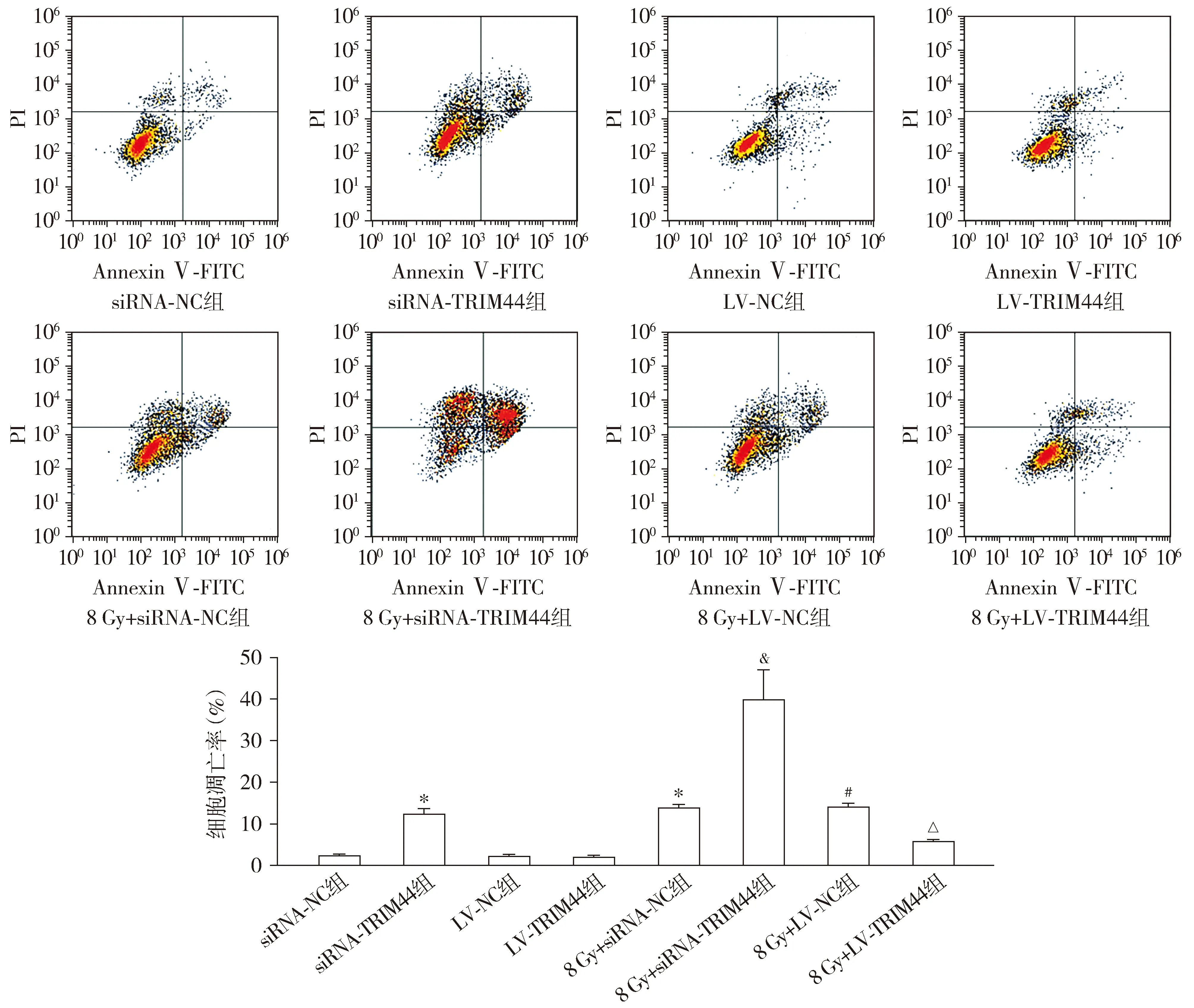
Transwell测定结果显示,与siRNA-NC组相比,siRNA-TRIM44组和8 Gy+siRNA-NC组迁移细胞数量均降低(P<0.05)。与LV-NC组相比,LV-TRIM44组迁移细胞数量升高,而8 Gy+LV-NC组降低(P<0.05)。与8 Gy+siRNA-NC组相比,8 Gy+siRNA-TRIM44组迁移细胞数量降低(P<0.05)。与8 Gy+LV-NC组相比,8 Gy+LV-TRIM44组迁移细胞数量升高(P<0.05,见图6)。
与siRNA-NC组相比,*P<0.05;与LV-NC组相比,#P<0.05;与8 Gy+siRNA-NC组相比,&P<0.05;与8 Gy+LV-NC组相比,△P<0.05图6 Transwell测定各组HEC-1A细胞的迁移 (×400)Figure 6 Migration of HEC-1A cells in each group by Transwell assay (×400)
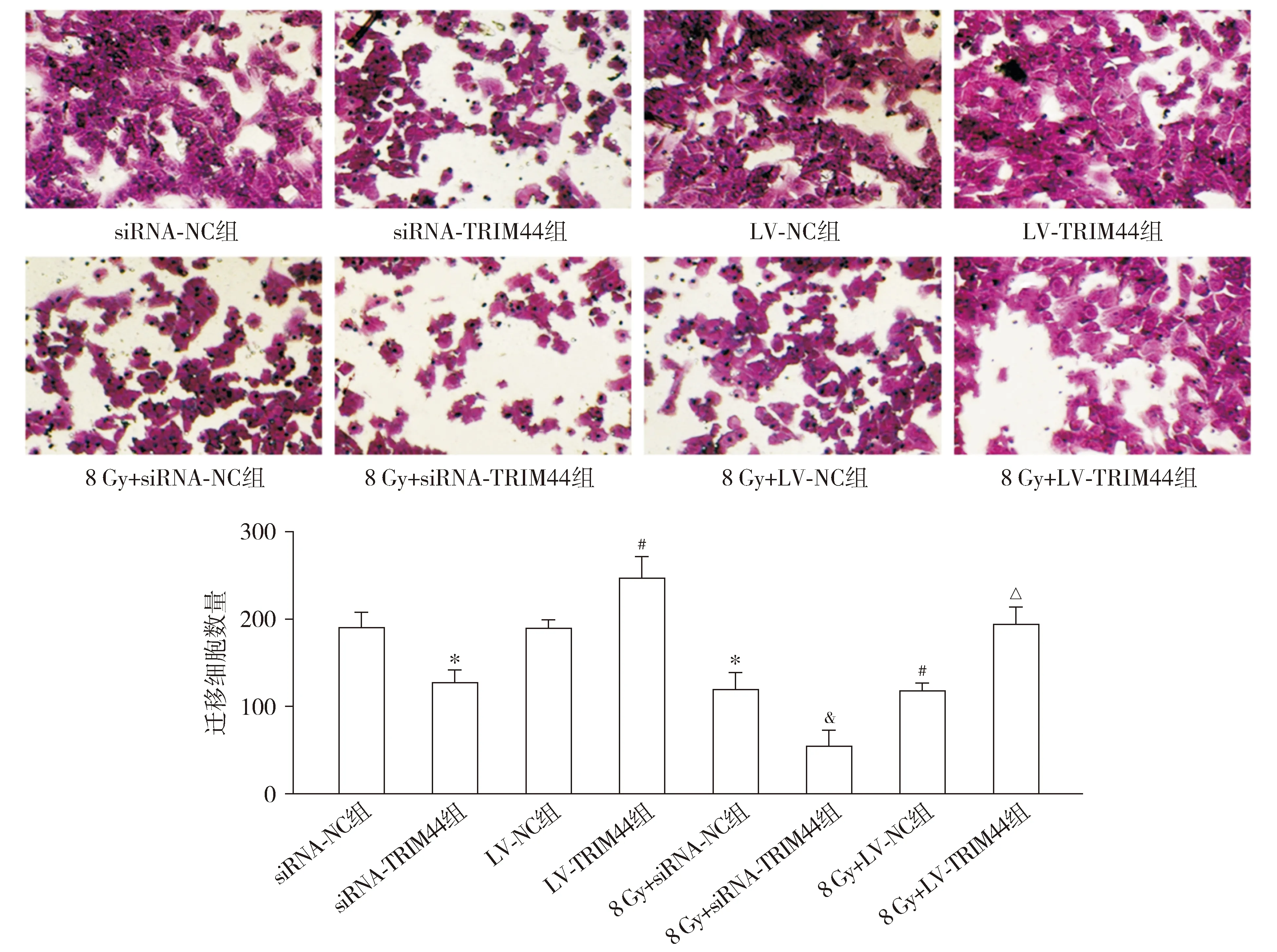
Transwell测定结果显示,与siRNA-NC组相比,siRNA-TRIM44组和8 Gy+siRNA-NC组侵袭细胞数量均降低(P<0.05)。与LV-NC组相比,LV-TRIM44组侵袭细胞数量升高,而8 Gy+LV-NC组降低(P<0.05)。与8 Gy+siRNA-NC组相比,8 Gy+siRNA-TRIM44组侵袭细胞数量降低(P<0.05)。与8 Gy+LV-NC组相比,8 Gy+LV-TRIM44组侵袭细胞数量升高(P<0.05,见图7)。
与siRNA-NC组相比,*P<0.05;与LV-NC组相比,#P<0.05;与8 Gy+siRNA-NC组相比,&P<0.05;与8 Gy+LV-NC组相比,△P<0.05图7 Transwell测定各组HEC-1A细胞的侵袭 (×400)Figure 7 Invasion of HEC-1A cells in each group by Transwell assay (×400)
2.4 TRIM44对HEC-1A细胞中P62蛋白表达及核转位的影响
各组HEC-1A细胞中TRIM44蛋白表达水平结果显示,与siRNA-NC组相比,siRNA-TRIM44组和8 Gy+siRNA-NC组TRIM44蛋白相对表达量均降低(P<0.05)。与LV-NC组相比,LV-TRIM44组TRIM44蛋白相对表达量升高,而8 Gy+LV-NC组降低(P<0.05)。与8 Gy+siRNA-NC组相比,8 Gy+siRNA-TRIM44组TRIM44蛋白相对表达量降低(P<0.05)。与8 Gy+LV-NC组相比,8 Gy+LV-TRIM44组TRIM44蛋白相对表达量升高(P<0.05,见图8)。
各组HEC-1A细胞的总P62蛋白和细胞核中P62蛋白表达水平结果显示,各组HEC-1A细胞的总P62蛋白相对表达量比较差异均无统计学意义(P>0.05,见图8)。与siRNA-NC组相比,siRNA-TRIM44组和8 Gy+siRNA-NC组细胞核P62蛋白相对表达量均升高(P<0.05)。与LV-NC组相比,LV-TRIM44组的细胞核P62蛋白相对表达量降低,而8 Gy+LV-NC组升高(P<0.05)。与8 Gy+siRNA-NC组相比,8 Gy+siRNA-TRIM44组细胞核P62蛋白相对表达量升高(P<0.05)。与8 Gy+LV-NC组相比,8 Gy+LV-TRIM44组的细胞核P62蛋白相对表达量降低(P<0.05,见图8)。

与siRNA-NC组相比,*P<0.05;与LV-NC组相比,#P<0.05;与8 Gy+siRNA-NC组相比,&P<0.05;与8 Gy+LV-NC组相比,△P<0.05图8 各组HEC-1A细胞中的TRIM44和P62蛋白表达Figure 8 TRIM44 and p62 protein expression in HEC-1A cells in each group
2.5 TRIM44对HEC-1A细胞核FLNA和RAD51蛋白表达的影响
各组HEC-1A细胞的细胞核FLNA和RAD51蛋白表达水平结果显示,与siRNA-NC组相比,siRNA-TRIM44组和8 Gy+siRNA-NC组的细胞核FLNA和RAD51蛋白相对表达量均降低(P<0.05)。与LV-NC组相比,LV-TRIM44组的细胞核FLNA和RAD51蛋白相对表达量升高,而8 Gy+LV-NC组降低(P<0.05)。与8 Gy+siRNA-NC组相比,8 Gy+siRNA-TRIM44组的细胞核FLNA和RAD51蛋白相对表达量降低(P<0.05)。与8 Gy+LV-NC组相比,8 Gy+LV-TRIM44组的细胞核FLNA和RAD51蛋白相对表达量升高(P<0.05,见图9)。
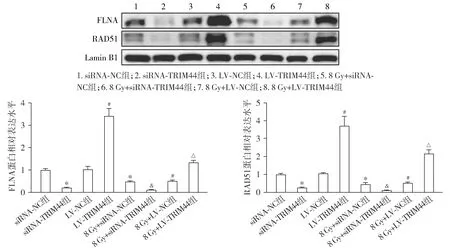
与siRNA-NC组相比,*P<0.05;与LV-NC组相比,#P<0.05;与8 Gy+siRNA-NC组相比,&P<0.05;与8 Gy+LV-NC组相比,△P<0.05图9 各组HEC-1A细胞中的细胞核FLNA和RAD51蛋白表达Figure 9 Nuclear FLNA and RAD51 protein expression in HEC-1A cells in each group by Western blot
3 讨论
TRIMs家族成员具有E3泛素连接酶的作用,参与多种肿瘤发生[10]。作为TRIMs蛋白家族的一员,TRIM44也属于一种泛素水解酶[11],并且在多种癌症中属于致癌基因,如TRIM44在前列腺癌[12]和卵巢癌[6]中高表达。Li等[13]研究表明,TRIM44在结直肠癌中上调,并且其高表达是患者预后不良的危险因素。Kawabata等[10]研究表明,TRIM44的高表达与乳腺癌的无瘤生存期和总生存期相关。Xiong等[14]研究表明,TRIM44高表达的食道癌患者的癌细胞分化差、TNM分期高并且预后不良。本研究结果也显示,TRIM44在EC组织中高表达,并且与FIGO分期、组织学分级和淋巴结转移有关。该结果与Li等[9]报道的结果一致,然而,TRIM44在EC中的具体功能尚不明确。
本研究结果表明,TRIM44的下调抑制了EC细胞系HEC-1A细胞的增殖、迁移和侵袭,并且促进了细胞凋亡。然而,TRIM44的上调则促进了HEC-1A细胞的增殖、迁移和侵袭,但未影响细胞凋亡,其原因可能是正常情况下HEC-1A细胞的凋亡较少,TRIM44的上调对凋亡的影响微乎其微。本研究中TRIM44对EC细胞的影响基本与其他癌细胞一致,主要发挥致癌作用。最近,有文献报道TRIMs家族成员参与调节癌细胞的放化疗敏感性[15-17]。本研究进一步考察了TRIM44对EC细胞放疗敏感性的影响,结果显示,HEC-1A细胞经照射后,TRIM44的表达水平降低。TRIM44的下调增强了HEC-1A细胞对放疗的敏感性,表现为增殖、迁移和侵袭水平降低,而细胞凋亡水平升高。然而,TRIM44的上调则起到了相反的作用。因此,本研究揭示了TRIM44参与调节EC细胞的放疗敏感性。
自噬是一种保守的细胞内自我降解过程,细胞蛋白或细胞器被双膜自噬小体包裹,最终与溶酶体融合[18]。在EC的发病机制中,自噬具有双重作用,自噬在早期抑制肿瘤的形成,然后在随后的发展阶段促进肿瘤的生长[19]。另外,自噬参与癌细胞的放疗抵抗,通过不同途径来抑制自噬、增加自噬和改变自噬可增加癌细胞的放疗敏感性[20-22]。p62是一种参与形成细胞内泛素化蛋白质聚集体的自噬相关蛋白,又称为SQSTM1[23],p62参与细胞生长、发育、代谢等多种复杂生理活动[24]。由于TRIM44属于一种泛素水解酶,本研究推测TRIM44可能通过调节p62来影响自噬,从而调节EC细胞的放疗敏感性。本研究表明,HEC-1A细胞经照射后,细胞核P62蛋白的表达水平升高。TRIM44的上调或下调未影响P62总蛋白的表达水平,然而,TRIM44的上调抑制了p62的核转位,而TRIM44的下调则促进了p62的核转位。Lyu等[8]研究表明,TRIM44可与p62结合,并通过其去泛素化作用促进了p62寡聚化,阻止p62响应照射易位到细胞核。这些结果说明TRIM44可能通过抑制p62的核转位来调节EC细胞的放疗敏感性。
DNA损伤修复是一个感知DNA损伤并招募修复因子的系统,控制基因组的完整性[25]。因此,靶向DNA损伤修复可能会改善癌症治疗结局。细丝蛋白A(filamin A,FLNA)是一种DNA损伤修复蛋白[26],RAD51是一种DNA双链断裂修复蛋白[27]。Hewitt等[28]研究表明,在诱导DNA损伤时,p62与FLNA相互作用,后者招募RAD51,p62促进细胞核内FLNA和RAD51的蛋白酶体降解,导致核RAD51水平降低和DNA修复减慢。本研究表明,TRIM44的上调促进了细胞核FLNA和RAD51的蛋白表达,而TRIM44的下调则抑制了细胞核FLNA和RAD51的蛋白表达。这些结果说明TRIM44阻止了p62易位到EC细胞核,导致FLNA和RAD51在细胞核内不会降解,从而促进了DNA损伤修复并增加了癌细胞活性。Lyu等[8]研究表明,TRIM44高表达增强了多发性骨髓瘤细胞的DNA损伤修复,与本文研究结果一致。
综上所述,本研究表明TRIM44的高表达促进了EC细胞的增殖和转移能力,TRIM44的高表达抑制了p62的核转位,从而无法降解细胞核内FLNA和RAD51,导致DNA修复增加、癌细胞活性和放疗抗性升高。因此,TRIM44可能是EC治疗和改善放疗敏感性的潜在靶标。

