miR-32-5p对胃癌细胞增殖和凋亡的影响
朱梦琪,张新鑫,李 靖,贾建光
(蚌埠医学院第一附属医院肿瘤外科,蚌埠 233000;*通讯作者,E-mail:jiajianguang1978@126.com)
胃癌作为一种全球性的重要癌症,其发生原因来自多个方面,包括家族史、幽门螺杆菌的慢性感染、EB病毒的感染、饮酒、吸烟、饮食等[1]。基于这些常见危险因素,据估计,2020年就有超过100万的新增病例、76.9万的死亡病例[2]。尽管近30年来,这种癌症的发病率和死亡率呈长期稳步下降的形势,但其目前仍位于世界上高致死率和高发病率肿瘤类型的前列[3,4]。虽然治疗手段和方案不断在改善,但胃癌的存活率仍然很低[5]。而随着癌症的基因分析和肿瘤标记物的发现,单克隆抗体和小分子抑制剂形式的靶向治疗已经成为可能,并且最近已经成为胃癌多模式治疗的重要方面[6]。但此前尚未发现特别有效的生物标志物作为胃癌的靶向指导[7]。因此,有必要寻找更多胃癌的潜在标志物,以实现更好的治疗效果、获得更高的总生存率。
微小RNA(microRNA, miRNA)作为一种非编码RNA,通常经两个连续的切割事件由新生的初级miRNA(pri-miRNA)转录本生成[8,9]。成熟的miRNA能够匹配并结合相应mRNA的3′UTR(untranslated region,非翻译区),促使下游基因在特定位点发生降解或翻译抑制[10]。事实上,许多miRNA可以在癌症中发挥或促进、或抑制的作用,调控肿瘤细胞的分化、血管生成、干细胞性、上皮-间质转化(epithelial-mesenchymal transition,EMT)、增殖、细胞周期等表型[11]。已有研究表明,miR-32-5p可参与乳腺癌的增殖、凋亡、侵袭等过程[12];可参与肺腺癌的EMT、转移等功能的调控[13];可调节结直肠癌内放射增敏、迁移和侵袭等表型[14]。此外,还有研究显示,miR-32-5p与卵巢癌[15]、宫颈癌[16]、食管癌[17]、肝癌[18]等发生发展有关,但miR-32-5p在胃癌中的研究仍然不多。本研究意在探讨miR-32-5p在胃癌中对细胞增殖、凋亡、Wnt信号通路的影响,并研究其与SOSTDC1之间的内在联系。
1 材料与方法
1.1 材料与细胞
胃癌细胞(BGC-823、MKN-45、MGC-803、SGC-7901)来自中科院上海细胞库,人胃上皮细胞(GES-1)由武汉普诺赛生命科技有限公司提供。miR-NC mimics、miR-32-5p mimics与miR-NC inhibitor、miR-32-5p inhibitor通过上海吉玛基因公司所生产。一抗(p-GSK3β)来自美国Affinity Biosciences公司,一抗(SOSTDC1)购自英国Abcam公司,二抗及其他一抗(β-catenin、Bcl-2、cleaved-Caspase-3、GSK3β、Bax、GAPDH)由武汉三鹰生物技术有限公司生产。EasyScript一步法去除gDNA和cDNA合成试剂盒与PerfectStart Green qPCR试剂盒从北京全式金生物公司购得;RPMI-1640培养基、opti-MEM由美国Gibco公司供给;CCK-8试剂盒、青-链霉素溶液、胰酶溶液来自中国Biosharp公司;凋亡试剂盒由中国贝博生物提供;BCA蛋白定量试剂盒、快速裂解液、PMSF、蛋白上样缓冲液由中国碧云天生物技术公司生产提供;ECL发光液于美国Abbkine公司购买;新生牛血清由浙江天杭生物科技有限公司提供;无血清冻存液由苏州新赛美生物科技有限公司生产;预染蛋白Marker购自美国Thermo Fisher公司。
1.2 生信分析及数据库在线分析
为了确定研究目标和方向,我们首先从公开数据库基因表达综合数据库(gene expression omnibus,GEO)(https://www.ncbi.nlm.nih.gov/geo/)中,获得了非编码RNA系列数据集GSE118915。随后利用R语言分析软件首先筛出GSE118915数据集中胃癌组织的所有差异表达miRNA,并据此绘制胃癌组织中所有差异表达miRNA的热图。在前面筛选的结果基础上,设置log2FC>1,且P<0.05的条件,进一步筛选出相比于正常胃组织,胃癌组织中差异表达2倍以上的miRNA,并通过R语言绘制火山图。同时结合TargetScan(https://www.targetscan.org/vert_80/)数据库,预测差异表达2倍以上miRNA的调控靶基因,并使用R语言绘制胃癌组织中差异表达2倍以上miRNA及其靶基因mRNA的调控网络图。随后通过查阅所有差异2倍以上miRNA及其靶基因的相关现存文献,排除在胃癌中已被研究过的miRNA,最终确定将miR-32-5p及其靶基因SOSTDC1作为研究对象。
基因表达谱交互分析网站(GEPIA, http://gepia.cancer-pku.cn/)用于探索SOSTDC1在多种肿瘤组织及正常组织中的表达水平,随后通过网站内匹配癌症基因组图谱(the cancer genome atlas,TCGA)和基因型和基因表达量关联数据库(genotype-tissue expression,GTEx),分析SOSTDC1在正常组织及配对癌组织中的表达水平。此外,SOSTDC1在正常胃组织与胃癌组织中的表达水平也是通过GEPIA网站获得。
miRNA靶基因数据库(TargetScan, https://www.targetscan.org/vert_80/)用于预测miR-32-5p的下游靶基因,探索miR-32-5p同SOSTDC1之间的调控关系及结合位点。
1.3 细胞培养
研究中所用的所有细胞,包括用于检测miR-32-5p表达情况的MKN-45、SGC-7901、GES-1、BGC-823、MGC-803细胞,以及转染后的MKN-45细胞(分为miR-NC mimics组、miR-32-5p mimics组、miR-NC inhibitor组、miR-32-5p inhibitor组),皆使用的是RPMI-1640培养基,使用前需向其内补充体积比1%的青-链霉素及体积比10%的新生牛血清。细胞培养瓶平放于培养箱内进行培育,维持培养条件为5%CO2、37 ℃、湿润环境。培养期间视具体的细胞状态进行换液、传代,培养的细胞用于后续实验。
1.4 细胞转染
根据qRT-PCR实验所检测的不同细胞系GES-1、MGC-803、BGC-823、SGC-7901、MKN-45内miR-32-5p的表达情况,选取MKN-45细胞进行转染,使后续实验都按1.3所述的细胞分为miR-NC mimics组、miR-32-5p mimics组、miR-NC inhibitor组、miR-32-5p inhibitor组。将选取的原始胃癌细胞MKN-45培养至占据6孔板单孔的50%~70%时,按说明书分别将Lipofectamine 2000、miR-NC mimics共转染为miR-NC mimics组;Lipofectamine 2000、miR-32-5p mimics共转染为miR-32-5p mimics组;Lipofectamine 2000、miR-NC inhibitor共转染为miR-NC inhibitor组;Lipofectamine 2000、miR-32-5p inhibitor共转染为miR-32-5p inhibitor组。再分别与适量基本培养基(未添加血清和双抗)混合并转入细胞培养孔内,持续转染6~8 h后将旧液移入废液桶,重新补充完全培养基,培养后用于后续qRT-PCR、增殖、凋亡、Western blot等实验。
1.5 RNA抽提和qRT-PCR检测miR-32-5p的表达水平和转染效率
qRT-PCR实验用于检测miR-32-5p的表达水平以及转染效率。其中培养胃癌细胞(MGC-803、BGC-823、SGC-7901、MKN-45)、胃上皮细胞(GES-1)以检测miR-32-5p的表达水平;培养MKN-45细胞转染的miR-NC mimics组、miR-32-5p mimics组细胞以检测MKN-45细胞的过表达转染效率;培养miR-NC inhibitor组、miR-32-5p inhibitor组细胞以检测MKN-45细胞的敲除转染效率。使用TransZol Up、异丙醇、三氯甲烷、75%无RNA酶乙醇(无水乙醇 ∶DEPC水=3 ∶1)等试剂对培养好的细胞进行处理,以抽提总RNA。经分光光度计检测总RNA,剔除不符合纯度和浓度标准的RNA,符合标准的RNA用于后续操作。即根据检测结果对符合标准的RNA进行稀释,调整其浓度后,使用EasyScript一步法去除gDNA和cDNA合成试剂盒与PerfectStart Green qPCR试剂盒,分别对RNA进行逆转录和扩增。将U6设为内源参照,根据所获得的Ct值使用2-ΔΔCt法计算最终值以进行相对性分析。其中,分析miR-32-5p的表达水平时,将MGC-803、BGC-823、SGC-7901、MKN-45细胞计算的最终值与GES-1细胞计算的最终值进行比较。检测转染效率时,将miR-NC mimics组与miR-32-5p mimics组计算的最终值进行比较,即可判断过表达转染是否有效;将miR-NC inhibitor组与miR-32-5p inhibitor组计算的最终值进行比较,即可判断敲除转染是否有效。
过程中使用的引物序列如下:miR-32-5p上游引物:5′-CGCGCGTATTGCACATTACTAA-3′;miR-32-5p下游引物:5′-AGTGCAGGGTCCGAGGTATT-3′;miR-32-5p反转录引物:5′-GTCGTATCCAGTGCAG GGTCCGAGGTATTCGCACTGGATACGACTGCAAC-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′;U6下游引物:5′-AACGCTTCACGAATTTGCGT-3′。
1.6 CCK-8实验检测细胞增殖能力
采用CCK-8实验检测miR-32-5p对胃癌细胞增殖能力的影响。对上述MKN-45细胞转染后的不同分组细胞进行培养,分别收集细胞后重新接种到96孔板内,接种浓度为每孔5×103。随后在适宜培养环境对96孔板内细胞进行培养。培养至24,48,72,96 h时分别取出96孔板,避光环境下以10 μl/孔的体积进行CCK-8试剂的添加。随后再次将96孔板移入适宜培养环境内,维持2 h。然后使用酶标仪对孔板进行吸光度(OD值)测定,并将波长设定为450 nm。分别比较miR-NC mimics组与miR-32-5p mimics组的吸光度值,以及miR-NC inhibitor组与miR-32-5p inhibitor组的吸光度值。
1.7 集落克隆实验检测细胞增殖能力
集落克隆实验同样用于检测miR-32-5p对胃癌细胞增殖能力的影响。对上述转染后的不同组别细胞分别进行培养,收集、重悬细胞后,进行计数并按照要求进行稀释,然后以2×103/孔的浓度接种到6孔板内。随后将6孔板移入设置好培养条件的培养箱内,对其进行集落培养。培养时间为12 d,期间可进行换液操作。待培养至大部分集落内细胞超过50个时,对其进行后续操作。即取出6孔板,将废液吸入废液桶,取PBS进行2次轻微吹洗,再取适量4%多聚甲醛浸泡细胞15 min以完成细胞固定操作。随后再次完成2次轻微冲洗,取适量结晶紫染液浸泡细胞15 min,以完成细胞染色操作。染色后再次清洗2次,并晾干、拍照、统计集落数量。分别比较miR-NC mimics组与miR-32-5p mimics组的集落数量,以及miR-NC inhibitor组与miR-32-5p inhibitor组的集落数量。
1.8 流式细胞术检测细胞凋亡情况
流式细胞术双染实验用于研究细胞凋亡变化。首先培养上述转染后的各组细胞,24 h后对各组细胞进行消化、收集,然后对细胞进行2次洗涤、离心。在避光条件下分别对不同组的细胞进行FITC、PI染色处理,经尼龙网过滤至流式细胞管内,随后通过流式细胞仪对不同分组细胞进行凋亡测定。将检测结果导入FlowJo软件内并对其进行分析处理,即可知道不同分组细胞的凋亡比例。分别比较miR-NC mimics组与miR-32-5p mimics组的凋亡比例,以及miR-NC inhibitor组与miR-32-5p inhibitor组的凋亡比例。
1.9 Western blot检测凋亡相关蛋白、Wnt/β-catenin通路相关蛋白和SOSTDC1蛋白表达
Western blot实验分别用于研究miR-32-5p与凋亡相关蛋白的关系、miR-32-5p与Wnt/β-catenin通路相关蛋白的关系、miR-32-5p与SOSTDC1蛋白表达的关系。对上述转染后的不同分组细胞进行培养,用离心管收集培养好的各组细胞,进行离心、沉淀,吸取多余水分。然后补充适量RIPA裂解液,吹散沉淀后将其吸入1.5 ml离心管,并将离心管插入冰块持续裂解30 min,随后存放于-20 ℃冰箱裂解过夜。次日移出并完成化冻及离心操作,取上清且保存于新的1.5 ml离心管内,并用BCA定量法对其进行蛋白质定量。根据定量结果调整不同组别的浓度、体积、上样量。按照调整后的上样量对配制的凝胶进行样品加注,随后电泳分离蛋白质。然后进行转膜使蛋白质从凝胶转至PVDF膜,经30 min封闭后将膜浸入相应的一抗(Bcl-2、Bax以1 ∶2 000的比例稀释,cleaved-Caspase-3、p-GSK3β以1 ∶500的比例稀释,β-catenin以1 ∶5 000的比例稀释,GSK3β、SOSTDC1以1 ∶1 000的比例稀释,GAPDH以1 ∶50 000的比例稀释)内,维持此状态放入4 ℃环境内持续一夜。次日取出并清洗3次后,浸入二抗(山羊抗兔、山羊抗鼠均以1 ∶5 000的比例稀释)中进行孵育,持续2 h。随后进行ECL曝光显影,对最终的成像条带进行ImageJ灰度扫描。分别对miR-NC mimics组与miR-32-5p mimics组的条带灰度值进行比较,以及对miR-NC inhibitor组与miR-32-5p inhibitor组的条带灰度值进行比较。
1.10 统计学分析
利用GraphPad Prism 7软件分析所有的数据,并以均数±标准差的形式表示。其中,采用t检验分析两组间的差异,采用单因素方差分析比较多组间的差异。P<0.05时认为差异有统计学意义。
2 结果
2.1 miR-32-5p在胃癌组织中高表达
根据R语言生信分析的筛选及制图,最终绘制了胃癌组织中所有差异表达miRNA的热图、火山图。热图可见色彩变化尺,其中红色代表高表达、正相关,绿色代表低表达、负相关;此外,类型图标中,蓝色和N代表正常胃组织,粉色和T代表胃癌组织。热图中即可见相对于正常胃组织,胃癌组织中高表达和低表达的所有miRNA所代表的色块(见图1A)。火山图可见红色点,代表相较于正常胃组织,胃癌组织中差异2倍以上且高表达的miRNA;绿色点代表相较于正常胃组织,差异2倍以上且低表达的miRNA;黑色点代表相较于正常胃组织,表达差异在2倍以内的miRNA(见图1B)。此外,R语言结合TargetScan数据库还绘制了胃癌组织中表达差异2倍以上的miRNA与其靶基因mRNA间的调控网络图。此图中红色表示相对于正常胃组织,胃癌组织中高表达的miRNA与mRNA;绿色表示相对于正常胃组织,胃癌组织中低表达的miRNA与mRNA。在调控网络图中最终确定miR-32-5p及其靶基因SOSTDC1为研究目标,其中显示miR-32-5p在胃癌组织中高表达,SOSTDC1在胃癌组织中低表达(见图1C)。
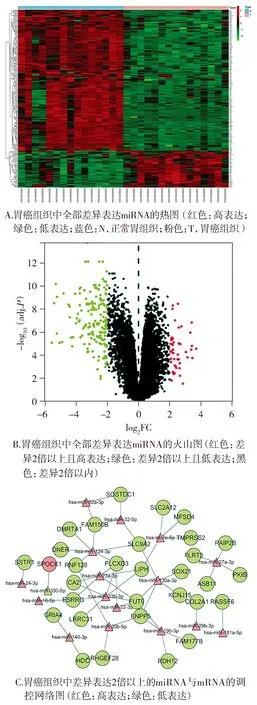
图1 胃癌组织中差异表达miRNA及其靶基因Figure 1 Differentially expressed miRNAs and their target genes in gastric cancer
2.2 胃癌细胞内的miR-32-5p呈高表达状态
qRT-PCR分析结果揭示了,相较于人胃上皮细胞(GES-1),miR-32-5p在胃癌细胞MKN-45、MGC-803、SGC-7901、BGC-823内表达水平明显上升(P<0.05,见图2)。
对MKN-45细胞进行转染后,qRT-PCR分析表明miR-32-5p mimics组细胞中miR-32-5p的表达量较miR-NC mimics组增高(P<0.05,见图2);miR-32-5p inhibitor组细胞中miR-32-5p的表达量则较miR-NC inhibitor组降低(P<0.05,见图2)。可见miR-32-5p的过表达及敲除转染有效。

图2 miR-32-5p在胃癌细胞内的表达水平及转染效率Figure 2 Expression level and transfection efficiency of miR-32-5p in gastric cancer cells
2.3 胃癌细胞内miR-32-5p可促进细胞增殖表型
CCK-8实验结果表明,相较于miR-NC mimics组,miR-32-5p mimics组细胞的增殖能力增强(P<0.05);相比于miR-NC inhibitor组,miR-32-5p inhibitor组细胞增殖能力则减弱(P<0.05,见图3)。
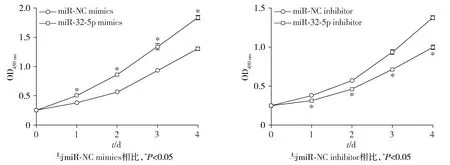
图3 miR-32-5p对MKN-45细胞增殖能力的影响Figure 3 Effect of miR-32-5p on proliferation of MKN-45 cells
同时,集落克隆实验也表明,miR-32-5p mimics组的集落数量较miR-NC mimics组有所增加(P<0.05);miR-32-5p inhibitor组的集落数量则较miR-NC inhibitor组减少(P<0.05,见图4)。
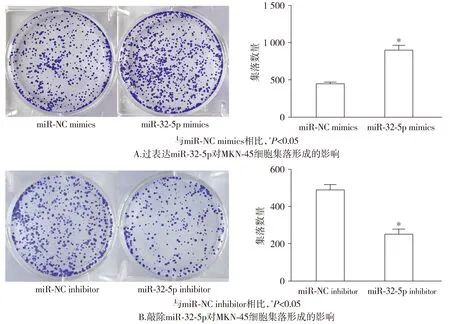
图4 miR-32-5p对MKN-45细胞集落形成能力的影响Figure 4 Effect of miR-32-5p on colony formation ability of MKN-45 cells
综合两个实验结果可见,miR-32-5p的表达上调对胃癌细胞增殖有促进作用。
2.4 胃癌细胞内miR-32-5p会抑制细胞凋亡
Annexin Ⅴ-FITC/PI双染的流式细胞检测结果显示,miR-32-5p mimics组细胞凋亡率较miR-NC mimics组下降(P<0.05);miR-32-5p inhibitor组细胞凋亡率则较miR-NC inhibitor组增加(P<0.05,见图5)。

图5 miR-32-5p对MKN-45细胞凋亡的影响Figure 5 Effect of miR-32-5p on apoptosis of MKN-45 cells
此外,Western blot分析结果表明,相比于miR-NC mimics组,miR-32-5p mimics组细胞内Bax、cleaved-Caspase-3表达量下降,而Bcl-2表达水平增高(P<0.05,见图6)。相比于miR-NC inhibitor组,miR-32-5p inhibitor组细胞内Bax、cleaved-Caspase-3表达量增加,而Bcl-2表达水平下降(P<0.05,见图6)。根据以上两个实验的结果,可证明上调miR-32-5p的表达会抑制胃癌细胞凋亡。

图6 miR-32-5p对MKN-45细胞凋亡相关蛋白的影响Figure 6 Effect of miR-32-5p on apoptosis-related proteins in MKN-45 cells
2.5 miR-32-5p促进Wnt/β-catenin通路的激活
Western blot实验结果表明,miR-32-5p mimics组细胞内β-catenin、p-GSK3β蛋白的相对表达量较miR-NC mimics组提高(P<0.05,见图7)。miR-32-5p inhibitor组细胞内β-catenin、p-GSK3β蛋白的相对表达量较miR-NC inhibitor组降低(P<0.05,见图7)。这表明上调miR-32-5p可诱导Wnt/β-catenin通路的激活。
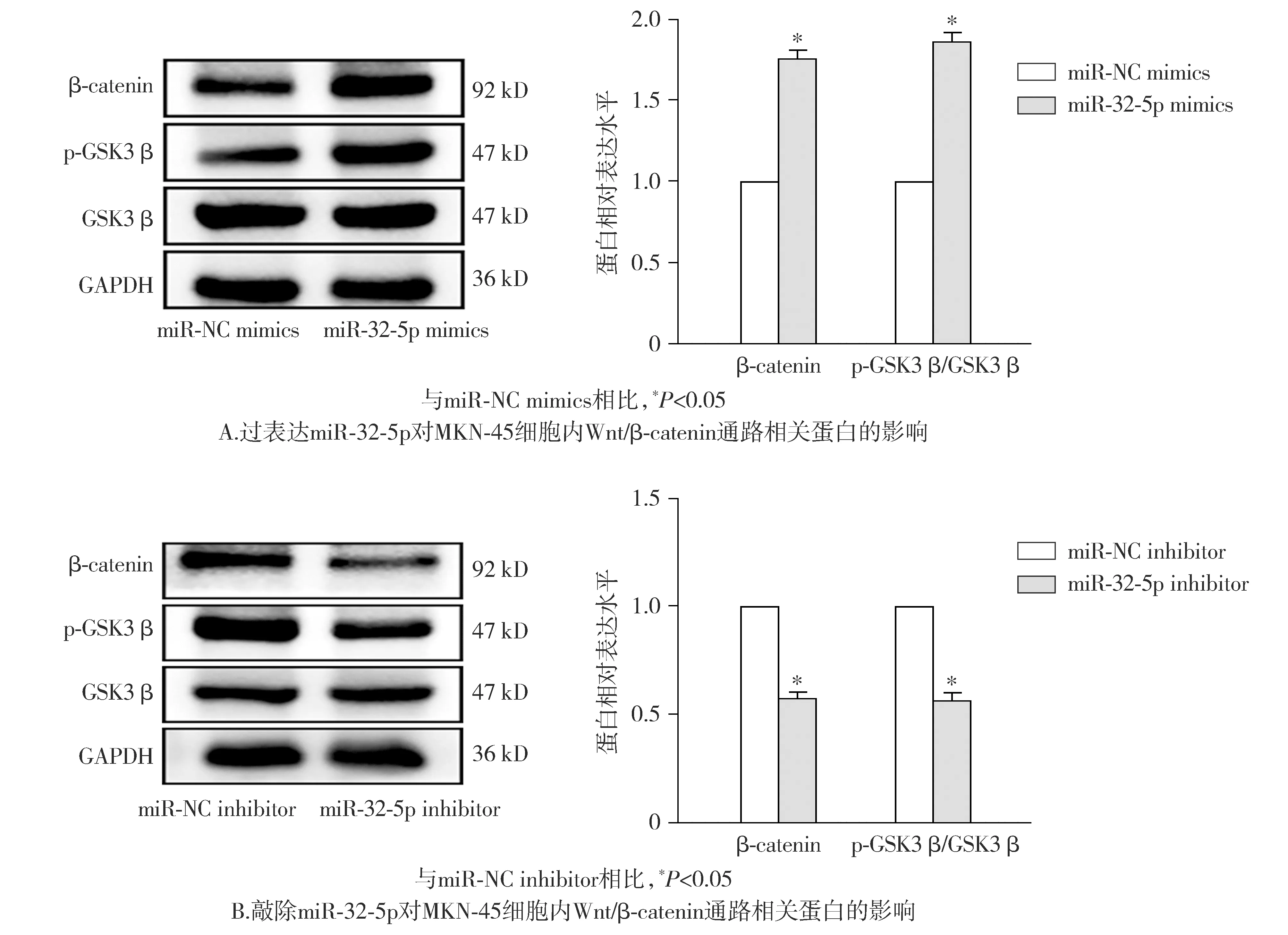
图7 MKN-45细胞内miR-32-5p与Wnt/β-catenin信号通路的关系Figure 7 Relationship between miR-32-5p and Wnt/β-catenin signaling pathway in MKN-45 cells
2.6 SOSTDC1在胃癌中低表达
根据GEPIA网站进行在线分析的结果,可获得SOSTDC1的表达谱及箱型图,红色代表肿瘤组织,黑色代表正常组织。其中SOSTDC1在所有配对正常组织和肿瘤组织中的基因表达谱显示,相比于正常胃组织,SOSTDC1在配对胃癌(stomach adenocarcinoma,STAD)组织中处于低表达水平(见图8)。此外,箱型图结果也表明,相较于正常胃组织,SOSTDC1在胃癌组织中低表达(P<0.05,见图8)。

图8 SOSTDC1在胃癌组织(STAD)中的表达水平Figure 8 Expression level of SOSTDC1 in gastric cancer tissue
2.7 miR-32-5p在胃癌细胞内靶向抑制SOSTDC1
通过TargetScan网站的预测,结果显示SOSTDC1是miR-32-5p的下游靶基因,并显示了二者的结合位点(见图9)。此外,通过Western blot实验,证明了miR-32-5p mimics组细胞内SOSTDC1蛋白表达量较miR-NC mimics组减低(P<0.05);miR-32-5p inhibitor组细胞内SOSTDC1蛋白水平较miR-NC inhibitor组增高(P<0.05,见图9)。由此可见,在胃癌细胞中,miR-32-5p靶向抑制SOSTDC1。
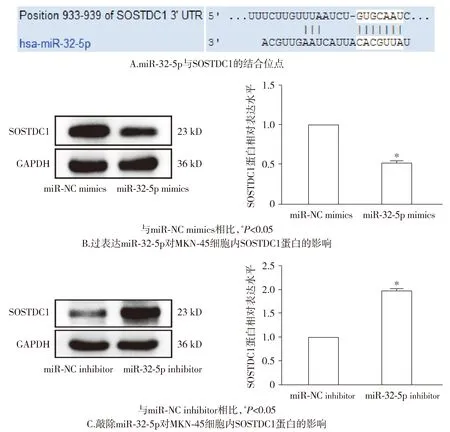
图9 miR-32-5p在MKN-45细胞内与SOSTDC1的关系Figure 9 The relationship between miR-32-5p and SOSTDC1 in MKN-45 cells
3 讨论
胃癌的发生已被证明与幽门螺杆菌的慢性感染具有密切联系,这导致了其在全球各地区的高发生率[19]。在这之中,尤以东亚、中亚和拉丁美洲为最[20]。根治性手术仍是其首选治疗对策,但大多数患者的确诊时期都处于晚期[21]。虽然手术与放、化疗等相结合的多模式治疗对延长生存期具有一定效果,但晚期胃癌的5年生存率却仍然很低,世界上大多数国家仍处于20%~30%水平,故晚期胃癌的治疗仍是一个挑战[22,23]。目前靶向治疗已被纳入晚期胃癌常规治疗的选择之一,以提高治疗效果,然而胃癌现有的靶向药物有效率仍低于50%[24]。因此,有必要探寻更多、更新、更敏感的标志物以实现胃癌的早期诊断和有效治疗。
相关研究表明,异常表达的miRNA同癌症的发病机制之间存在紧密联系,且可以通过体外介导的细胞间通讯在癌症中发挥生物标记作用,表明其具有成为生物标记物的可能性[25,26]。如今关于各种miRNA与癌症的相关性研究也与日俱增。因此,本研究首先使用R语言分析,筛选出胃癌中一系列与正常胃组织相比,具有2倍以上差异表达的miRNA,并预测了下游基因,在此基础上选择拟进行实验的目标。
其中,miR-32-5p已被证明会影响肿瘤的生物学恶性进展。如姚嘉等[12]报道,miR-32-5p通过抑制乳腺癌细胞的凋亡而促进细胞增殖和侵袭;Zhang等[13]证明,miR-32-5p在非小细胞肺癌细胞中抑制细胞的迁移、侵袭能力;Liu等[16]发现,miR-32-5p会导致HOXB8表达下降,可减弱宫颈癌细胞的增殖、侵袭和迁移能力。此外,miR-32-5p与消化系肿瘤恶性行为的发生也有密切联系,并在其过程中发挥重要作用。Liang等[14]报道,结直肠癌中,下调miR-32-5p可通过促进TOB1表达增强放射敏感性,抑制迁移和侵袭;徐汉桥等[17]发现,miR-32-5p在食管癌中通过调控KLF4,抑制细胞的增殖、迁移和侵袭,并且抑制炎症因子IL-6的产生;Yuan等[27]证实,mir-32-5p通过调控Tldc1而抑制胰腺癌细胞的增殖、迁移和侵袭;此外,Fu等[18]报道,miR-32-5p通过抑制PTEN激活PI3K/Akt通路,并通过促进血管生成和EMT通过外泌体诱导多药耐药。可见,miR-32-5p在多种肿瘤包括消化系肿瘤中起重要作用,有成为标志物的可能性。而目前关于miR-32-5p在胃癌中的研究仍较少,有必要对其进行相关研究,为胃癌寻找更多潜在标志物。
SOSTDC1则是一种骨形态发生蛋白(BMP)拮抗剂,位于17号染色体,主要参与牙齿和肾脏发育[28]。SOSTDC1的功能是直接与配体结合,如BMP2、BMP4和BMP7,使其活性受到抑制[29]。有研究证实了SOSTDC1与肿瘤的发生发展有一定相关性。Clausen等[30]发现,高水平的SOSTDC1与乳腺癌患者生存率的提升密切相关,且SOSTDC1选择性阻断BMP7诱导的Smad磷酸化,而不减少BMP2或Wnt3a诱导的信号;Liu等[31]证明,SOSTDC1在非小细胞肺癌中,可能通过调节p21Cip和p27Kip抑制细胞增殖,进而影响Rb-E2F信号传导;Bartolomé等[32]发现,结直肠癌中,SOSTDC1通过克服BMP4特异性抗转移信号,并诱导ALCAM介导的Src和PI3K/AKT激活,促进细胞侵袭和肝转移。同时,SOSTDC1在胃癌中也进行了相关研究,Cui等[33]报道,SOSTDC1通过使c-Jun信号失活,而抑制胃癌生长及肺转移的形成;Gopal等[34]也证明,SOSTDC1可提高胃癌患者总体生存率,过表达SOSTDC1可抑制胃癌的致瘤性。可见SOSTDC1在胃癌的发生、发展中发挥重要作用,有必要对其进行更加广泛、深入的研究。而miR-32-5p与SOSTDC1二者之间的相互关系尚未被报道过,此二者在胃癌中的内在联系和机制也尚未被研究过,因此最终选定miR-32-5p与SOSTDC1作为研究目标,为胃癌提供新的研究思路和潜在靶点。
本研究实验结果表明,胃癌细胞内的miR-32-5p相比于胃上皮细胞呈高水平状态。根据表达情况,在高表达的胃癌细胞中选取MKN-45,对其进行过表达及敲除。qRT-PCR结果表明,在MKN-45细胞中所进行的miR-32-5p过表达转染及敲除转染皆有效,由此进行后续实验。通过进一步研究证明,在胃癌细胞MKN-45中,上调miR-32-5p的表达时细胞增殖能力增强、细胞凋亡受到抑制;而抑制miR-32-5p的表达时细胞增殖能力减弱、细胞凋亡受到促进。综合以上结果可知,miR-32-5p可促进胃癌细胞增殖、抑制细胞凋亡。
同时,通过数据库的分析,其结果显示SOSTDC1在胃癌组织中处于低水平状态。Cui等[33]和Gopal等[34]也通过研究证实SOSTDC1在胃癌中低表达。而根据前面研究结果显示的miR-32-5p在胃癌中呈高水平状态,可初步判断miR-32-5p与SOSTDC1可能呈负相关。随后通过TargetScan数据库分析发现miR-32-5p靶向结合SOSTDC1,也可间接印证miR-32-5p与SOSTDC1呈负相关的判断。此外,Western blot实验揭示了,miR-32-5p在胃癌细胞内抑制SOSTDC1的表达,可再次验证上述判断。综合以上结果,可发现miR-32-5p在胃癌细胞内可靶向结合SOSTDC1并抑制其表达。
Wnt/β-catenin信号通路作为癌症进展中的一条基本调控途径,已被证明与癌症的转移、血管新生、增殖、凋亡、糖酵解等恶性行为密切相关[35,36]。在该信号通路中,当Wnt被激活时,可导致β-catenin在细胞质中发生积累,然后转移到细胞核中。本研究通过相关实验证明,过表达miR-32-5p时胃癌细胞内β-catenin、p-GSK3β蛋白的相对表达量升高;而敲低miR-32-5p时细胞内β-catenin、p-GSK3β蛋白的相对表达量下降。可见miR-32-5p在胃癌细胞中促进Wnt/β-catenin通路的异常激活,且可能是通过此种异常激活进而促进胃癌细胞增殖、抑制细胞凋亡。此外,SOSTDC1也被报道显示出抑制Wnt/β-catenin信号通路及增殖的特性[33,34,37]。由此可知,在胃癌中miR-32-5p可能是通过靶向抑制SOSTDC1而诱导Wnt/β-catenin通路的激活,从而促进细胞增殖、抑制细胞凋亡。但胃癌中miR-32-5p对SOSTDC1的靶向调控缺乏直接性的实验证据,此外miR-32-5p是如何通过SOSTDC1调控胃癌的增殖、凋亡表型,仍需更直接的证据以及更深入的研究探讨,这也是后续的研究重点。
综上所述,胃癌细胞中的miR-32-5p处于高表达状态。且miR-32-5p通过负向调控SOSTDC1的表达促进Wnt/β-catenin通路的激活,进而促进胃癌细胞增殖、抑制细胞凋亡。miR-32-5p/SOSTDC1轴有可能为胃癌的靶向治疗研究提供新的依据,但miR-32-5p对SOSTDC1的靶向调控及具体作用机制仍需进行深入验证。

