鱿鱼皮胶原蛋白肽的脱色及其对风味影响的研究
王佳圆 马佳雯 蔡金秀 曹少谦 戚向阳,*
(1上海海洋大学食品学院,上海 201306;2浙江万里学院生物与环境学院,浙江 宁波 315100)
鱿鱼年产量高,分布广泛[1]。鱿鱼在加工过程中会产生包括头、足、内脏及表皮等废弃物,其中鱿鱼皮占副产物加工量的8%~13%[2],但大部分鱼皮都被掩埋或丢弃,不仅造成资源的浪费,还会对环境产生污染[3]。现有研究表明,水产源胶原蛋白比陆生动物源胶原蛋白具有更高的安全性[4],且水产源胶原蛋白具有抗氧化[5]、降血压[6]、抑制恶性肿瘤细胞活性[7]等生理活性。
目前开发的许多鱿鱼皮胶原蛋白制品,如助消化药物、添加剂等,风味色泽较差,需进一步进行脱色等处理才能被广泛应用[8]。常用的脱色方法有双氧水法、大孔树脂吸附法和活性炭法等。双氧水法操作简单,脱色效果好,但因较强的氧化作用,对样品理化性质影响大,如残留物将会影响产品的品质[9]。大孔树脂具有吸附量大、机械强度高、安全可靠、可再生使用等优点。郑金娃等[10]利用不同树脂对海参多肽酶解液脱色脱腥,发现树脂D380 脱色效果良好,且具有一定的脱腥能力。活性炭吸附能力强,微孔数量多,不仅能高效地吸附酶解液的色素[11],还可以通过去除水中的有机物从而达到除嗅、除味的效果[12],已被广泛用于水产品的脱色去腥[13],但再生困难且蛋白损失率较高。因此,有必要筛选出最佳脱色剂,进一步探究样品脱色脱腥效果。
本研究以鱿鱼皮胶原蛋白肽为原料,探讨不同颗粒活性炭及不同树脂对鱿鱼皮酶解液的脱色效果,并采用电子鼻、电子舌、氨基酸分析、感官评价等对脱色前后的胶原蛋白肽风味进行分析,以期为鱿鱼皮高附加值产品的开发及胶原蛋白肽的应用提供一定的理论依据。
1 材料与方法
1.1 材料与主要试剂
鱿鱼皮,宁波水产批发市场;碱性蛋白酶(2×106U·g-1)、BCA 蛋白浓度测定试剂盒,北京索莱宝生物科技有限公司;粉状活性炭(粒径200 目)、颗粒状活性炭(粒径20 目),上海国药化学试剂集团;D4006(非极性)、D152(弱酸性阳离子)、AB-8(弱碱性阴离子)、D3520(非极性)、D380(弱碱性阴离子),郑州和成新材料科技有限公司;细胞色素C(MW12400)、抑酞菌(MW6500)、杆菌酶(MW1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451)、乙氨酸-乙氨酸-乙氨酸(MW189),上海源叶生物科技有限公司;谷氨酸钠、柠檬酸、盐酸-奎宁、氯化钠、盐酸、氢氧化钠、无水乙醇(分析纯),上海国药化学试剂集团。
1.2 主要仪器与设备
101-2 -BS 电热恒温鼓风干燥箱,上海跃进医疗器械厂;UV-1750紫外可见分光光度计,日本岛津仪器有限公司;Multiskan FC 酶标仪,美国赛默飞公司;SCIENTZ-10N 冷冻干燥机,宁波新芝生物科技股份有限公司;L-8900 全自动氨基酸分析仪,日本日立公司;Waters e2695 型高效液相色谱仪,美国Waters 公司;PEN3便携式电子鼻,德国Airsense 公司;ASTREE 电子舌,法国Alpha MOS公司。
1.3 试验方法
1.3.1 鱿鱼皮胶原蛋白肽的制备 将10 g 鱿鱼皮与蒸馏水按1∶5 的料液比混合均匀,加入碱性蛋白酶2 555 U·g-1(0.012 8 g),在pH 值9.0、50 ℃条件下水浴酶解4.6 h,沸水钝酶10 min 后,冰浴冷却,8 000 r·min-1离心15 min,取上清液并定容至100 mL,得到鱿鱼皮胶原蛋白酶解液。
1.3.2 脱色工艺优化
1.3.2.1 脱色材料筛选 树脂静态脱色试验:取20 mL鱿鱼皮酶解液倒入烧杯中,加入5%(w/v)经预处理的5种树脂D4006、D152、AB-8、D3520、D380,室温下脱色1 h后,过滤,滤液用蒸馏水定容至25 mL,测定脱色率及蛋白损失率。
活性炭静态脱色试验:将20 mL 鱿鱼皮酶解液置于50 mL 烧杯中,加入0.5%(w/v)的粉状活性炭及颗粒状活性炭,室温下脱色30 min,过滤,滤液用蒸馏水定容至25 mL,测定脱色率及蛋白损失率。
1.3.2.2 活性炭脱色单因素试验 取20 mL 鱿鱼皮酶解液于烧杯中,加入粉状活性炭脱色后,过滤,滤液用蒸馏水定容至25 mL,测定脱色率及蛋白损失率。分别考察粉状活性炭添加量(0.05%~0.30%)、脱色时间(10~60 min)、脱色温度(10~60 ℃)和溶液pH 值(1~6)对鱿鱼皮酶解液脱色效果的影响。
1.3.2.3 脱色正交试验 在单因素试验的基础上,选取溶液pH值(A)、添加量(B)、脱色温度(C)、脱色时间(D)进行三因素四水平的正交试验L9(34),以脱色率和蛋白损失率综合评定脱色效果。试验因素水平设计见表1。
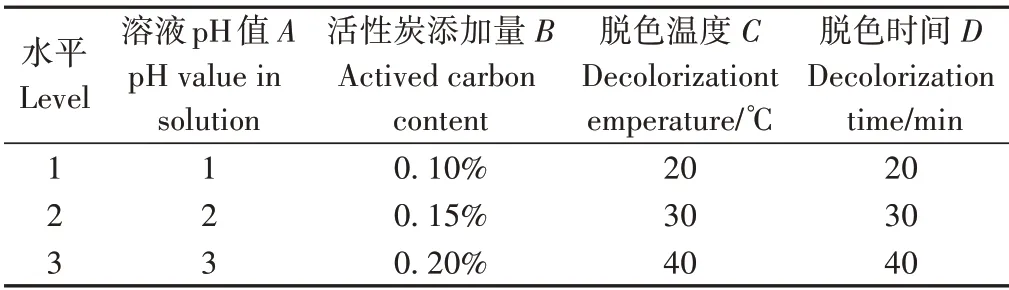
表1 正交试验因素与水平表Table 1 Orthogonal test factor and level table
1.3.3 脱色率的测定 将制得的鱿鱼皮胶原蛋白酶解液用不同脱色剂进行脱色,采用分光光度法测定脱色前后溶液在362 nm 波长处的吸光度值。按公式(1)计算胶原蛋白肽脱色率[14]:

式中,A:脱色率,%;A1:脱色前酶解液在362 nm波长处的吸光度值;A2:脱色后上清液在362 nm 波长处的吸光度值。
1.3.4 蛋白损失率的测定 利用BCA试剂盒测定胶原蛋白酶解液脱色前后蛋白含量的变化。按照公式(2)计算蛋白损失率:

式中,W:蛋白损失率,%;W1:脱色前酶解液中蛋白含量,mg·mL-1;W2:脱色后酶解液中蛋白含量,mg·mL-1。
1.3.5 胶原蛋白肽分子量分布测定 利用高效液相色谱仪测定胶原蛋白肽分子量分布,并用GPC 软件对其分子量分布进行分析。色谱柱为TSKgel 2000 SWXL 300 mm×7.8 mm;流动相∶乙腈∶水∶三氟乙酸=45∶55∶0.1(V/V/V);检测波长:UV220 nm;流速:0.5 mL·min-1;柱温:30 ℃。称取细胞色素C(MW12400)、杆菌酶(MW1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW451)、乙氨酸-乙氨酸-乙氨酸(MW189)标准品,用流动相溶解配制成0.2 mg·mL-1左右的标准分子量溶液。
1.3.6 游离氨基酸组成分析 根据文献[15]进行样品前处理,取最佳制备条件下鱿鱼皮酶解液冻干粉1 g,用50 mL 0.04 mol·L-1盐酸浸提30 min,摇匀后过滤。取2 mL上清液于离心管中,加入8%磺基水杨酸2 mL,混匀,静置15 min,10 000 r·min-1离心10 min,取上清液,过0.22µm膜后用全自动氨基酸分析仪进行分析。
1.3.7 电子鼻分析 准确吸取最佳制备条件下的鱿鱼皮酶解液5 mL,置于20 mL顶空瓶中,密封后于50 ℃水浴锅中加热15 min,取出后将针头插入顶空瓶上端进行检测,信号采集时间为120 s,每采样1 次,通过跑空瓶的形式对进样通道进行清洗,降低对下一样品的影响。每个样品重复3次。不同传感器对应了不同的物质类别[16],组成电子鼻传感器阵列的10 个金属氧化物传感器的敏感物质及其检测限见表2。
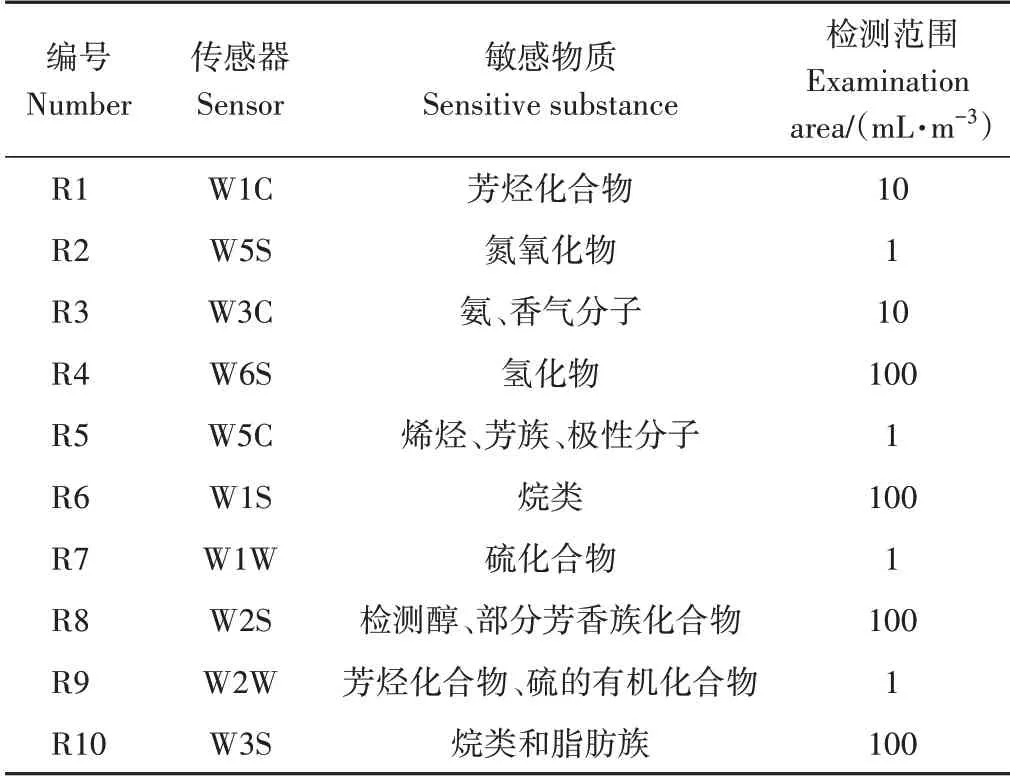
表2 PEN2电子鼻传感器阵列及其性能特点Table 2 Electronic nose sensor array and its performance characteristics
1.3.8 鱿鱼皮胶原蛋白肽酶解液脱苦前后滋味感官分析 选取谷氨酸钠、柠檬酸、盐酸-奎宁、NaCl、蔗糖分别作为鲜、酸、苦、咸、甜的标准品[17],对应的浓度及分值如表3所示。选取10名经过专业培训的感官品评员进行感官评价。感官评价之前无辛辣刺激食品摄入,且不能使用香水化妆品等物品。每种味道由低浓度标准品至高浓度标准品顺序进行感官评定,每次评定后均用水漱口,口中无异味后再品尝下一个样品。根据标准品浓度对应的分值对样品进行对照打分,得到样品的分值。
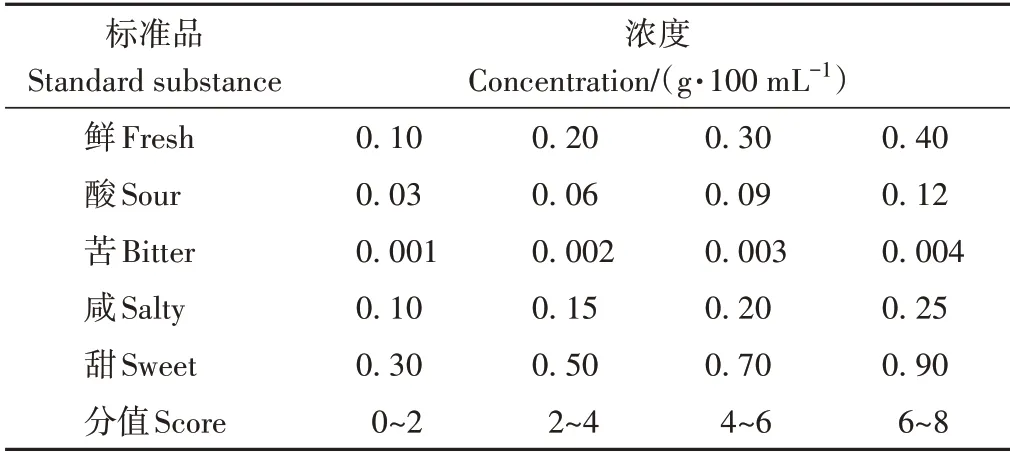
表3 不同浓度滋味标准品评分值Table 3 Standard taste evaluation scores of different concentrations
1.3.9 电子舌分析 本试验所用电子舌能直接检出鲜、酸、苦、咸的响应值,以谷氨酸钠、柠檬酸、盐酸奎宁、NaCl为标准品用蒸馏水配置成不同浓度梯度[18]。取脱色前后的鱿鱼皮酶解液和不同浓度的标准品15 mL于样品杯中,室温下进行电子舌检测,每个样品测定4个平行值,取后3次测定数值进行分析,检测期间设定采样时间为120 s,清洗时间10 s,每次检测完毕后均进行清洗。测定前仪器需经活化、自检和校准等程序,确保数据的稳定性。
1.4 数据分析
电子鼻数据采用PEN3-Win Muster 数据处理软件进行主成分分析(principal compcnent analysis,PCA);采用SPSS 17.0 软件对所得数据进行方差分析(analysis of variance,ANOVA),显著性检验方法为Duncan 多重检验,显著水平为P<0.05,使用GraphPad Prism及Origin 2021软件作图。
2 结果与分析
2.1 脱色材料筛选结果
由图1可知,以脱色率为指标,粉状活性炭脱色效果最佳,脱色率达到81.20%。根据蛋白损失率,树脂D152蛋白损失率最低,为1.27%,但脱色率仅达到8.34%。所测试的树脂中,脱色效果最好的为树脂D380,脱色率为32.17%。D380、AB-8 为阴离子交换树脂,脱色率高于其余阳离子交换树脂和非极性树脂,可能是因为酶解液中阴离子型色素占比较高。极性树脂AB-8与D380 的脱色率大于非极性树脂D4006 和D3520,可能是因为酶解液中的色素多为极性分子。综合考虑脱色率及蛋白损失率,最后选用粉状活性炭作为鱿鱼皮酶解液的脱色剂。
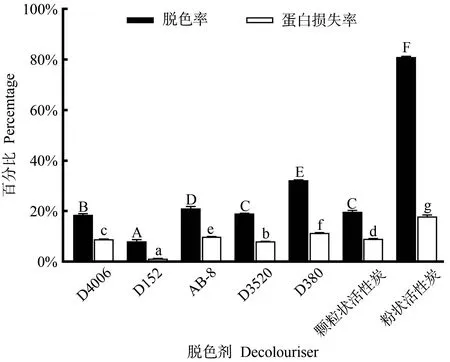
图1 脱色剂对胶原肽脱色率和蛋白损失率的影响Fig.1 Effect of decolorant on decolorization rate and protein loss rate of collagen peptide
2.2 活性炭脱色工艺的优化
2.2.1 pH值的影响 由图2可知,随着pH值的升高,鱿鱼皮酶解液的脱色率与蛋白损失率均呈现先上升后下降的趋势,在酸性较高的条件下脱色率较高,当pH值在2以下时脱色率达到87.17%,之后随pH值上升,脱色率呈下降趋势,表明脱色率与H+浓度有关[19]。为了避免pH值过低导致胶原蛋白肽的损失,选择pH值为2。

图2 pH值对胶原肽脱色率和蛋白损失率的影响Fig.2 Effect of pH value on decolorization rate and protein loss rate of collagen peptide
2.2.2 活性炭添加量的影响 由图3可知,当活性炭添加量由0.05%增加到0.30%时,鱿鱼皮酶解液的脱色率由56.91%提高到82.32%,蛋白损失率也由25.93%上升至36.22%,该结果与李秉润等[20]利用活性炭对水蛭酶解液脱腥脱色的研究结果一致,随着活性炭添加量的增加,蛋白损失率逐渐增加。为了减少多肽损失,选择活性炭添加量为0.15%。
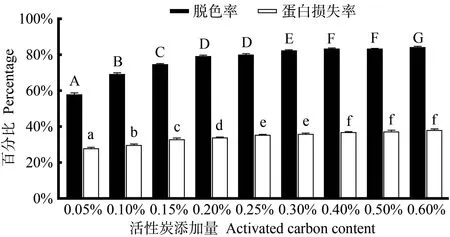
图3 活性炭添加量对胶原肽脱色率和蛋白损失率的影响Fig.3 Effect of activated carbon content on decolorization rate and protein loss rate of collagen peptide
2.2.3 脱色时间的影响 由图4可知,胶原蛋白肽脱色率与蛋白损失率均随脱色时间的延长而增加,当脱色时间大于30 min时,脱色率趋于稳定,蛋白损失率略有上升。
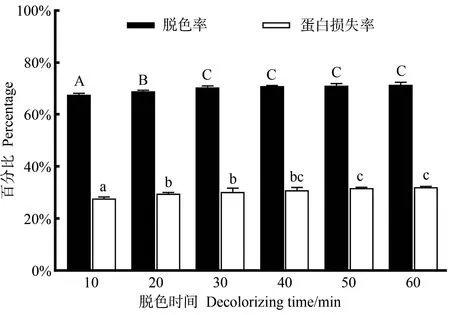
图4 脱色时间对胶原肽脱色率和蛋白损失率的影响Fig.4 Effect of decolorizing time on decolorization rate and protein loss rate of collagen peptide
2.2.4 脱色温度的影响 由图5可知,当温度从10 ℃上升到60 ℃时,鱿鱼皮胶原蛋白肽的脱色率由62.12%上升至77.57%。综合考虑脱色率及蛋白损失率,选择温度为30 ℃。
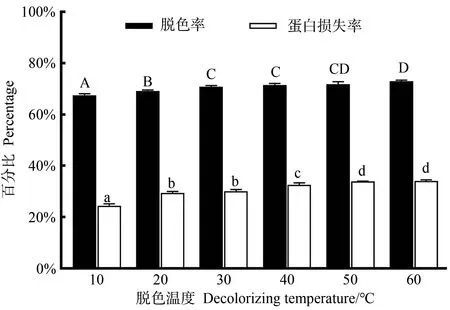
图5 脱色温度对胶原肽脱色率和蛋白损失率的影响Fig.5 Effects of decolorizing temperature on decolorization rate and protein loss rate of collagen peptide
2.2.5 正交试验结果 粉状活性炭脱色效果优化正交试验结果见表4~6。通过极差分析可知,各因素对脱色率及蛋白质损失率的影响大小次序为B>A>C>D,即活性炭添加量>pH值>脱色温度>脱色时间。以脱色率为依据,脱色效果最佳的组合是A1B3C3D3,即pH 值1、活性炭添加量0.2%、脱色温度40 ℃、脱色时间40 min。以蛋白损失率为依据,脱色效果最佳的组合是A1B1C1D1,即pH 值1、活性炭添加量0.1%、脱色温度20 ℃、脱色时间20 min。综合分析脱色率及蛋白损失率,活性炭最佳脱色工艺为A2B1C2D2,即pH 值2、活性炭添加量0.1%、脱色温度30 ℃、脱色时间30 min。进一步验证试验表明,在该条件下,活性炭的脱色率达到82.91%±0.05%,蛋白回收率达到75.82%±0.17%,样品得率为72.32%±0.16%。

表4 活性炭脱色正交试验结果与分析Table 4 Results and analysis of orthogonal test for decolorization of activated carbon

表5 脱色率方差分析Table 5 Variance analysis of decolorization rate

表6 蛋白质损失率方差分析Table 6 Analysis of variance of protein loss rate
2.3 脱色前后胶原蛋白肽的分子量分布
由图6和表7可知,鱿鱼皮胶原蛋白肽经粉状活性炭脱色后分子量分布与脱色前相比差异不大。脱色后分子量小于180 Da 的肽占比下降幅度最大,下降了3.14 个百分点,分子量小于500 Da 的肽占比共下降4.79 个百分点,可能是因为粉状活性炭在吸附色素的同时,溶液中的氨基酸类、二肽及三肽也部分被吸附[21]。此外,脱色后分子量大于2 000 Da的肽占比也有所下降,而分子量在500~1 000 Da的肽占比增幅较大,达到了4.69个百分点,分子量在500~2 000 Da的肽占比共增加了6.14个百分点。脱色前后分子量小于1 000 Da的胶原蛋白肽所占比例分别为79.47%、79.37%,无显著差异(P>0.05)。表示脱色过程中主要损失了分子量小于500 Da 及大于2 000 Da 的鱿鱼皮胶原蛋白肽,Ajibola等[22]研究发现分子量小于1 000 Da肽的抗氧化活性高于分子量大于1 000 Da的肽;也有文献报道,相对于氨基酸及大分子多肽,寡肽(>四肽)对维持肠道健康和功能具有重要作用,且可以作为生理活性物质被直接吸收[23]。因此,可推测脱色工艺对于活性较高的胶原蛋白肽影响较少。
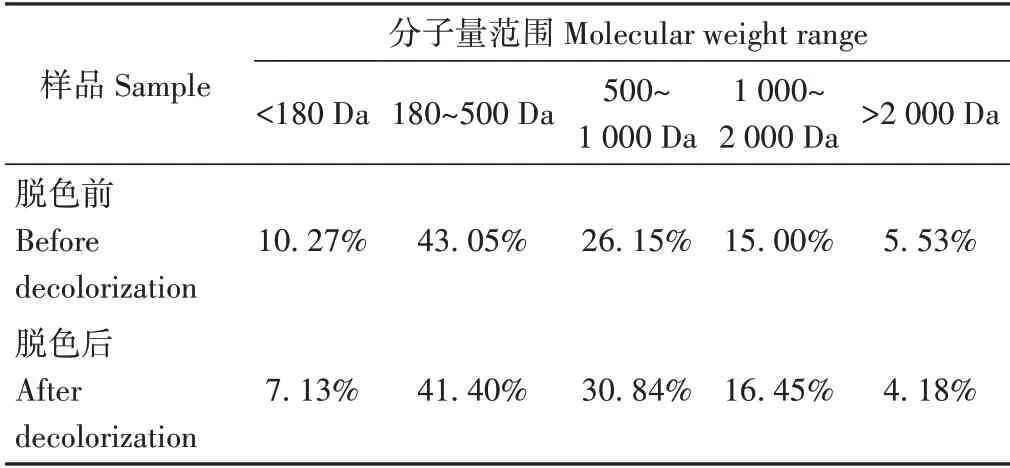
表7 脱色前后胶原蛋白肽分子质量分布Table 7 Molecular weight distribution of the decolorized and non-decolorized squid skin collagen peptides
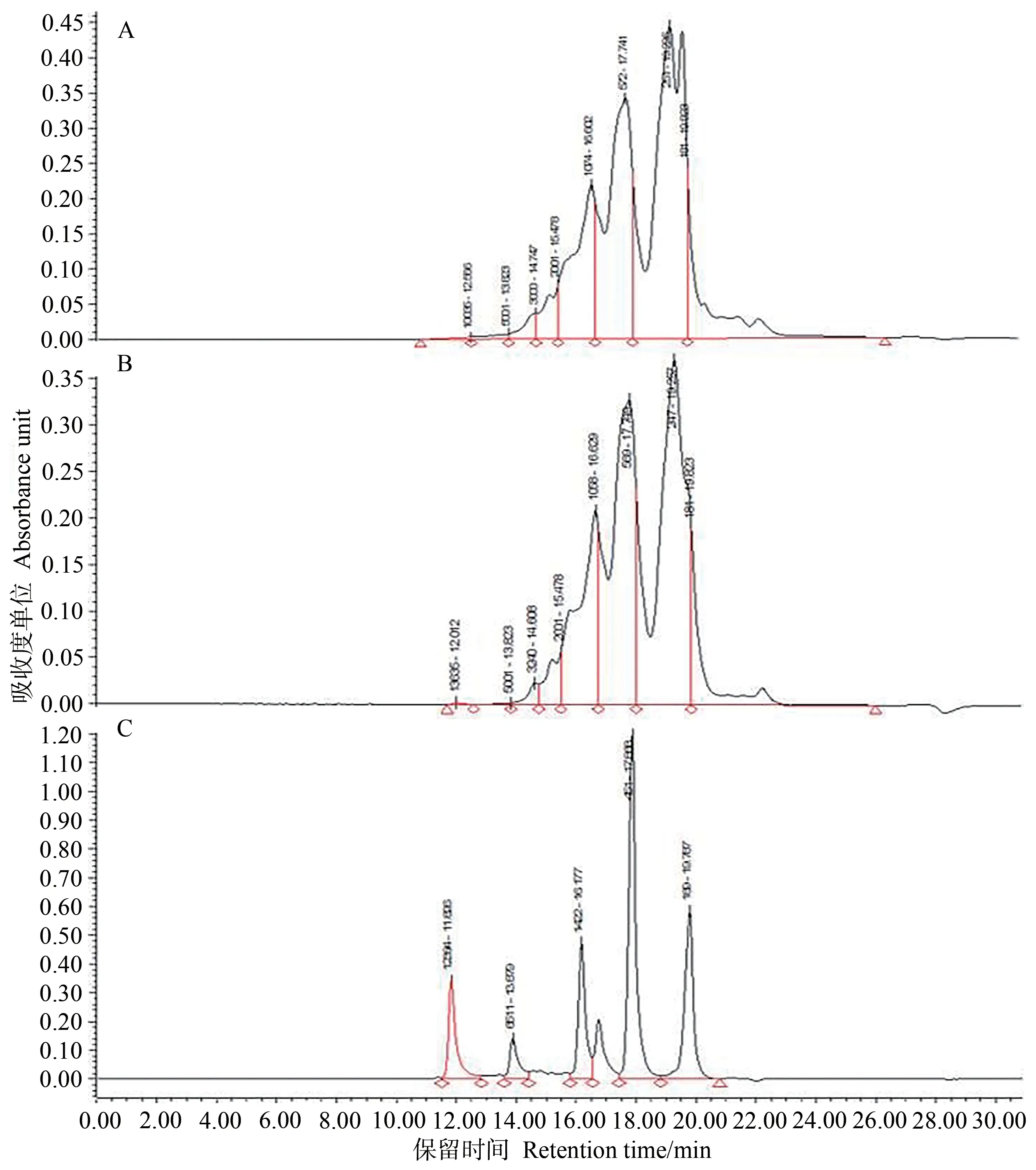
图6 鱿鱼皮胶原蛋白肽凝胶色谱图Fig.6 Gel chromatogram of collogen peptide of squid skin
2.4 脱色前后胶原蛋白肽的氨基酸组成
由表8可知,鱿鱼皮胶原蛋白肽共检出20 种游离氨基酸,其中鲜味2种、甜味5种、苦味9种以及无味氨基酸4种[24]。脱色后鱿鱼皮酶解液中的游离氨基酸含量降低了2.02 mg·g-1,呈味氨基酸含量降低了0.89 mg·g-1,但呈味氨基酸(delicious amino acid,DAA)占总游离氨基酸(total free amino acid,TFAA)的比例上升了1.75 个百分点。谷氨酸(Glu)是酶解液的主要鲜味氨基酸,脱色后样品的鲜味氨基酸占比由10.21%上升至13.12%;此外,脱色前后甜味氨基酸占比无明显差异,分别为12.99%和13.73%,其中丙氨酸(Ala)占比最高。脱色后酶解液的苦味氨基酸占比由71.50%下降至67.72%,其中酪氨酸(Tyr)是主要的苦味氨基酸,脱色后由16.81%降至14.24%。表明脱色可有效改善酶解液的风味,具有一定的脱苦作用,并提升鲜味。
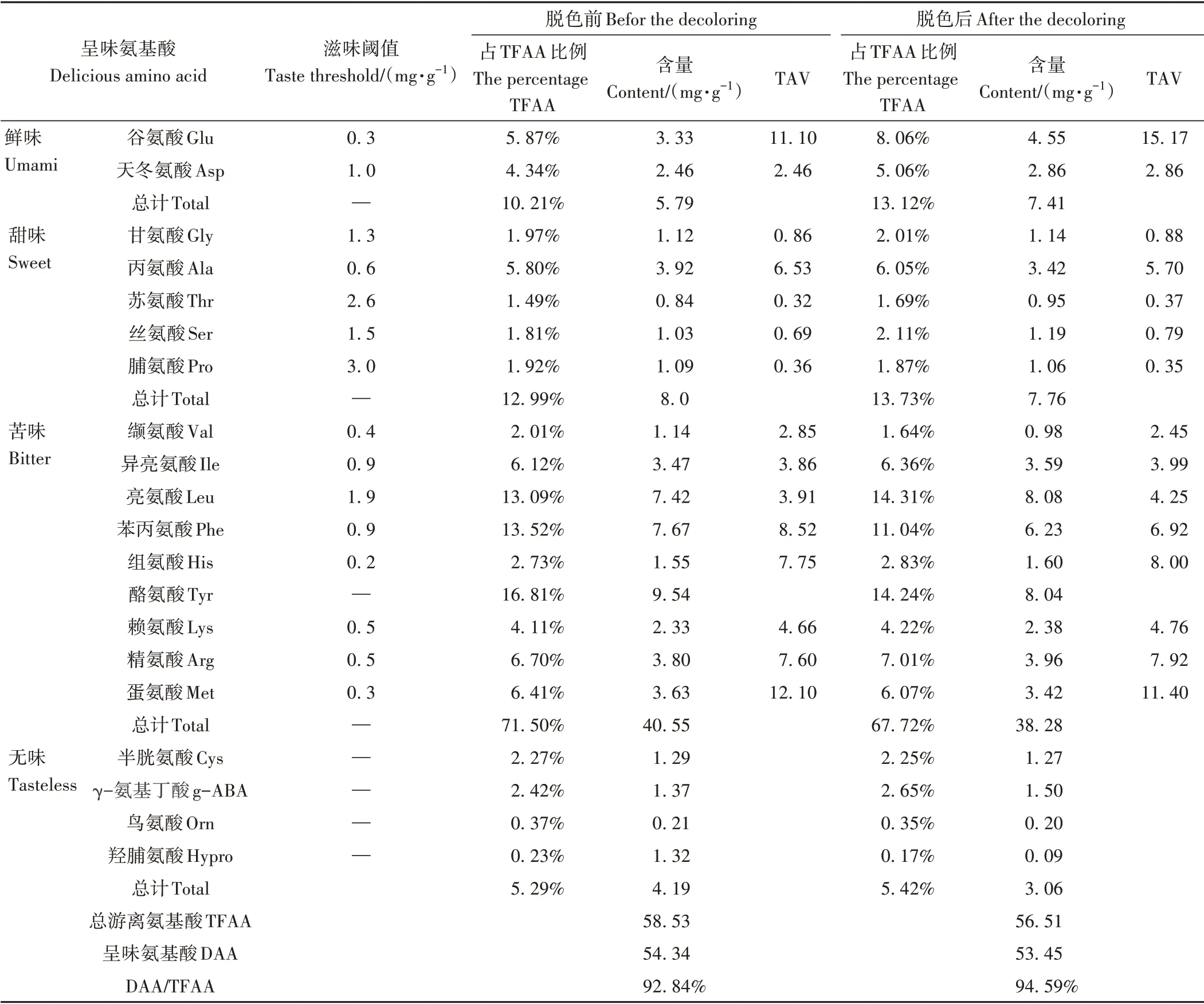
表8 脱色工艺对胶原肽游离氨基酸含量的影响Table 8 Effect of decolorization process on free amino acid content of collagen peptide
味道强度值(taste active value,TAV)表示各个呈味物质的含量与其阈值的比。当TAV>1时,表明该物质对样品呈味贡献大;当TAV<1时,表明该物质对样品几乎没有呈味贡献[25]。酶解液脱色前TAV最大的为蛋氨酸(Met),为12.10,其次为Glu,其TAV为11.10,表明苦味氨基酸和鲜味氨基酸对样品整体滋味呈味具有重要贡献。脱色后,Glu的TAV上升至15.17,成为最主要呈味氨基酸,而Met的TAV由12.10下降至11.40,进一步表明脱色可使主要的苦味氨基酸呈味贡献下降,鲜味氨基酸呈味贡献上升,酶解液风味得到一定程度的提升。
2.5 脱色前后胶原蛋白肽的电子鼻分析
PCA分析是将提取的传感器响应信号进行数据转换和降维,并对降维后的特征向量进行线性分类处理,其总贡献率越大(>75%),检测数据的信息反映越好[26]。图7为脱色前后酶解液电子鼻响应信号的PCA 分析结果,酶解液脱色前后的响应值没有重叠区域,区分度较好,PC1和PC2的贡献率分别为96.38%和3.44%,累计贡献率达99.82%,各组样品的数据点按其类别对应聚类,且两两之间能实现较好地区分,说明这两个主成分几乎包含了样品的所有信息,可用来代表鱿鱼皮酶解液中挥发性物质的整体信息,该结果表明脱色前后鱿鱼皮酶解液的气味相互独立。
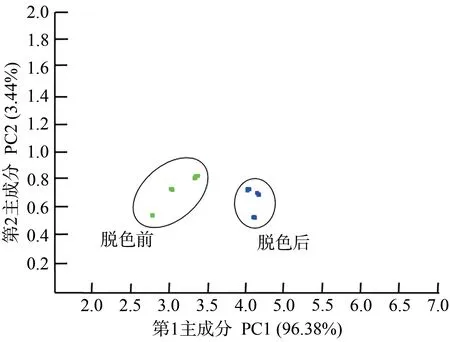
图7 鱿鱼皮酶解液电子鼻响应值的PCA分析Fig.7 PCA analysis of electronic nose response of enzymatic hydrolysate of squid skin
图8为鱿鱼皮酶解液挥发性成分的电子鼻载荷分析。脱色前后累计贡献率达到了99.99%,基本涵盖了样品的所有信息。鱿鱼皮酶解液脱色后,第1 主成分(PC1)贡献率最大的成分由R7(硫)变成了R2(氮氧化物);第2 主成分(PC2)贡献率最大的成分由R2(氮氧化物)变成了R7(硫),表明脱色后氮氧化物类挥发性成分对气味的贡献最大,硫化类(硫化氢等)挥发性成分对气味的贡献率变小。综上所述,鱿鱼皮酶解液脱色前后气味发生了明显变化,且脱色后风味得到一定程度的改善。

图8 鱿鱼皮酶解液风味LOADINGS分析Fig.8 Aroma LOADINGS analysis of squid skin enzymatic hydrolysate
2.6 脱色前后胶原蛋白肽的感官评价分析
以鲜、酸、苦、咸、甜标准品为标准对脱色前后的鱿鱼皮酶解液进行感官评价,结果如图9所示。鱿鱼皮胶原蛋白肽酶解液以苦咸味为主,经活性炭脱色处理后,鱿鱼皮胶原蛋白肽酶解液的苦味显著下降(P<0.05),鲜、酸及咸味显著上升(P<0.05),甜味无显著变化,表明活性炭处理对鱿鱼皮胶原蛋白肽酶解液有一定的脱苦效果。

图9 鱿鱼皮胶原蛋白肽酶解液滋味感官评分Fig.9 Sensory taste score of squid skin enzymatic hydrolysate
2.7 脱色前后胶原蛋白肽的电子舌分析
由图10可知,脱色前后PC1 和PC2 贡献率分别为70.26%和13.30%,累计贡献率为83.56%,表明PC1、PC2 包含了大量样品原始数据,可以整体反应样品信息[27]。判别指数(discrimination index,DI)是区分样品之间差异的表征值[28]。本试验DI为95.95,表明样品之间区分度大。不同样品之间滋味差异可以通过样品在主成分分析图中的距离远近来表征[29]。鱿鱼皮胶原蛋白肽酶解液脱色前后样品位于主成分分析图中不同区域,不重叠,且距离较远,表明脱色前后样品滋味差异较大。

图10 鱿鱼皮酶解液滋味主成分分析Fig.10 Principal component analysis of taste of enzymatic hydrolysate of squid skin
主成分分析中,可根据样品落点的区域及样品间的距离来判断样品之间的相似性,本研究样品所在区域表明该标准品滋味属性,样品之间距离越近表明滋味属性越相似。图11为鱿鱼皮酶解液脱色前后不同滋味的主成分分析图。鲜、酸、苦、咸不同滋味的主成分累计贡献率分别为81.76%、80.26%、88.56%、81.99%,表明第1和第2主成分能够代表大部分的原始数据信息。DI 值分别为99.83、99.78、98.59、99.83,表明电子舌能较好地区分脱色前后鱿鱼皮酶解液的滋味。脱色前后样品整体风味无交叠,区分效果好。根据每种滋味对应的标准品浓度梯度[30],可见鲜味、酸味、咸味有不同程度的提升,苦味下降。表明鱿鱼皮酶解液经脱色工艺优化后风味有明显提升,主要表现为鲜味、酸味、咸味加强,苦味减弱。综合电子鼻和感官评定分析可知,鱿鱼皮酶解液脱色前后风味有明显差别,脱色的同时明显改善了酶解液的风味,有助于鱿鱼皮酶解液后续的加工及应用。
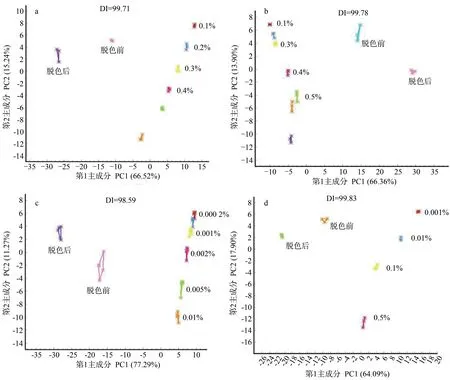
图11 鱿鱼皮酶解液不同滋味的主成分分析Fig.11 Principal component analysis of different tastes of enzymatic hydrolysate of squid skin
3 讨论
胶原蛋白肽是以胶原蛋白为原料,利用化学、物理方法或者生物酶法降解得到的产物,具有广泛的生物活性[31]。早期有研究者发现蛋白酶解液具有苦味,且水产源蛋白酶解液依旧存在腥味[32],为掩盖不良气味,可以通过选择分离法[33]、掩盖法[34]、酶解法[35]等方法脱腥脱苦提升产品品质,而活性炭法作为选择分离法是较为常见的脱色方式[36]。本研究比较不同脱色剂效果,发现粉状活性炭脱色率最佳,与前人研究结果类似[37-38],可能是由于粉状活性炭微孔数量多,比表面积大,从而能够快速且高效地吸附蛋白酶解液色素分子[39]。
本研究通过高效液相色谱分析样品脱色前后的分子量分布,发现样品脱色前后分子量分布差异不大,可能是由于活性炭脱色是通过范德华力和静电作用吸附色素[40],未破坏化学键,从而较好地保持了样品中多肽的结构[41]。此外,脱色后样品分子量小于500 Da和大于2 000 Da 的肽占比有所减少,这可能是由于粉状活性炭是疏水性吸附剂,易吸附分子量偏小的芳香族氨基酸、色素和其他分子量偏大的小肽[42]。氨基酸作为重要的呈味物质,有助于滋味的形成。本研究发现,脱色前后甜味氨基酸占比几乎无差异,苦味氨基酸占比降低,这可能是由于添加活性炭不影响含羟基和烷基的中性氨基酸(Thr、Ser 和Gly、Ala)和部分碱性氨基酸(Lys),易吸附芳香基氨基酸(Tyr 和Phe)、含硫氨基酸(Met)和碱性氨基酸(His 和Arg)[43]。电子鼻试验结果表明样品脱色前后气味完全不同,且脱色后氮氧化物类挥发性成分代替硫化类(硫化氢等)挥发性成分对气味的贡献最大,这与常钰菲[44]、钱琴莲等[45]的研究结果一致。感官评价试验结果表明样品脱色处理后苦味下降,甜味基本无变化,而其余风味有不同程度提升。电子舌分析也表明脱色前后胶原蛋白肽风味差异明显,脱色后的胶原蛋白肽苦味明显下降,鲜味、酸味、咸味都有不同程度提升。表明活性炭能有效改善酶解液的风味,主要归因于粉末状活性炭具有有效面积大、微孔数量多、吸附性能好等特点,能够在一定程度上减少色素以及鱼腥味等挥发性物质,从而有效改善产品风味[46]。
4 结论
本研究结果表明,粉状活性炭对鱿鱼皮酶解液脱色脱苦效果最好,最佳工艺条件为:pH 值2.0,活性炭添加量0.1%,脱色温度30 ℃,脱色时间30 min,在该工艺条件下的脱色率为82.91%,蛋白回收率达到75.82%。通过凝胶色谱、游离氨基酸、电子鼻、电子舌及感官评定分析表明,脱色前后胶原蛋白肽的分子量分布差异不大,但脱色前后鱿鱼皮酶解液的风味明显不同,苦味得以改善。综上所述,粉状活性炭脱色工艺可有效改善鱿鱼皮酶解液的风味,提高鱼胶原蛋白肽产品品质。而脱色处理对其生物活性及功能特性的影响还有待进一步研究。

