基于PPAR-α/PGC-1α途径探讨低氧减重对肥胖大鼠能量代谢的影响
郜 琨, 杨历新
(青海省人民医院, 青海 西宁 810000)
由于现代人们高脂高糖的饮食习惯,肥胖已经成为一种普遍高发的营养代谢性疾病,给现代人们的健康带来极大的隐患。有研究报道:居住于高海拔地区的人群体内脂肪比例低于平原地区居住的人群,因此,低氧疗法逐渐成为一种预防、治疗肥胖疾病的方法。可通过抑制食欲,增加基础代谢率和脂肪氧化,并尽量减少副作用[1]。运动可有效降低血脂、血糖,对于肥胖疾病作用极佳,有学者发现低氧环境因素可有效增强运动提高能量消耗的作用效果[2]。因此,低氧结合运动在减肥降脂方面效果显著。骨骼肌是机体能量代谢的重要场所,也是主要的耗能组织之一。PGC-1α在骨骼肌分布广泛,有研究显示:活化的PGC-1α可增强线粒体活动,促进脂肪酸的氧化[3,4]。PPAR-α是一种脂质调节因子,可以促进脂肪细胞分解、参与脂质能量代谢,对于肥胖、高血压等疾病的发生具有重要作用[5]。在本研究中,通过高脂膳食建立肥胖大鼠模型,观察低氧配合耐力运动对肥胖大鼠能量代谢以及PPAR-α、PGC-1α蛋白表达的影响,探讨低氧运动在肥胖大鼠能量代谢中的作用机制。
1 材料与方法
1.1试验动物:SD大鼠80只,SPF级,雄性,体重220~250g,购于湖南斯莱克动物实验公司,生产许可证号:SCXK(湘)2019-0005,饲养环境:温度22~24℃,湿度40%~55%,5只/笼,自由饮食。
1.2试剂及仪器:JM-A20001电子称(北京金科利达电子科技有限公司);低氧分压系统(美国Hypoxico公司),TSE动物代谢测量分析系统(德国PROCESS CONTROL公司),半自动生化仪(南京建成科技有限公司),PGC-1α 、PPAR-α、GAPDH抗体(英国 Abcam 公司)。
1.3营养性肥胖大鼠模型复制:大鼠随机分为普通膳食对照组(10只)、高脂膳食模型组(70只),普通膳食为国家标准啮齿类动物干燥饲料;高脂膳食:基础饲料52.2%,猪油15%,蔗糖20%,酪蛋白10%,胆固醇1.2%,胆酸钠0.2%,石粉0.4%,磷酸氢钙0.6%,预混料0.4%,高脂膳食供能比:碳水化物45.5%,脂肪37%,蛋白质17.5%。持续性喂养7周后,取对照组及模型组大鼠各10只,称量体重,测定血糖、血脂,评价造模效果。根据肥胖易感模型筛选规律,高脂膳食组大鼠的体重超过普通膳食组大鼠体重的20%作为营养性肥胖大鼠[6,7]。
1.4动物分组及低氧运动干预:随机取建模成功的肥胖大鼠60只,分为常氧安静组(A)、常氧运动组(AE)、16.3%低氧安静组(B)、16.3%低氧运动组(BE)、13.3%低氧安静组(C)、13.3%低氧运动组(CE),每组10只;继续进行高脂膳食饲养,运动组适应1周后,进行跑台耐力训练,20m/min、40min/d、5d/周、跑台坡度为0;低氧组采用低氧分压系统构建人工常压低氧环境,持续干预8周。
1.5称量大鼠体重:在相同的时间点(每周3下午)称量大鼠体重并记录。
1.6采用大鼠代谢系统测大鼠运动后即刻状态吸氧量和能量消耗:采用TSE动物代谢测量分析系统测定大鼠干预后即刻吸氧量和能量消耗,实验前测试系统稳定性,测试方法:每日大鼠运动结束后,立即将其放回呼吸室内,固定仪将大鼠固定后进行测定,采集9、18、27、36、45、54min数据,选择第2个9min为运动即刻吸氧量。仪器主要参数为:FlowSamp 0.72mL/L,Ref O2:20.92%~20.93%,Ref CO2:0.054%~0.055%。代谢实验室条件:温度:20℃±2℃、湿度:50%~70%,保持安静状态。
1.7检测血糖(BG)浓度和血脂(TC、LDL-C、TG):京都血糖仪测定血糖含量;半自动生化仪测定血脂四项。
1.8Western blotting 法PPAR-α、PGC-1α的表达:取腓肠肌100mg,加入适量RIPA裂解液,使用玻璃匀浆器充分研磨裂解;4℃,12000r/min离心10min,取上清液,BCA蛋白试剂盒测定蛋白质浓度,取少量蛋白质,配制成上样缓冲液,电泳、转膜、封闭、加入一抗PGC-1α(1∶1000)、PPAR-α(1∶1000)、GAPDH(1∶1000);4℃孵育过夜,TBST洗涤,加入HRP标记二抗(山羊抗兔IgG/HRP:1∶3000),室温孵育2h,TBST洗涤,用ECL化学发光试剂显色后,化学发光仪成像。以相应的GAPDH作为内参,计算各目标条带的灰度值。
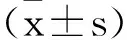
2 结 果
2.1高脂诱导营养性肥胖模型构建成功:7周高脂膳食饲养后,模型组大鼠体重、体长、Lee's指数均显著增加(P<0.01,P<0.05);BG、TG、TC、LDL-C含量均显著增加(P<0.01),差异具有显著性统计学意义,说明高脂膳食诱导的营养性肥胖大鼠模型建立成功。见表1、表2。

表1 两组大鼠体重体长Lee's指数比较
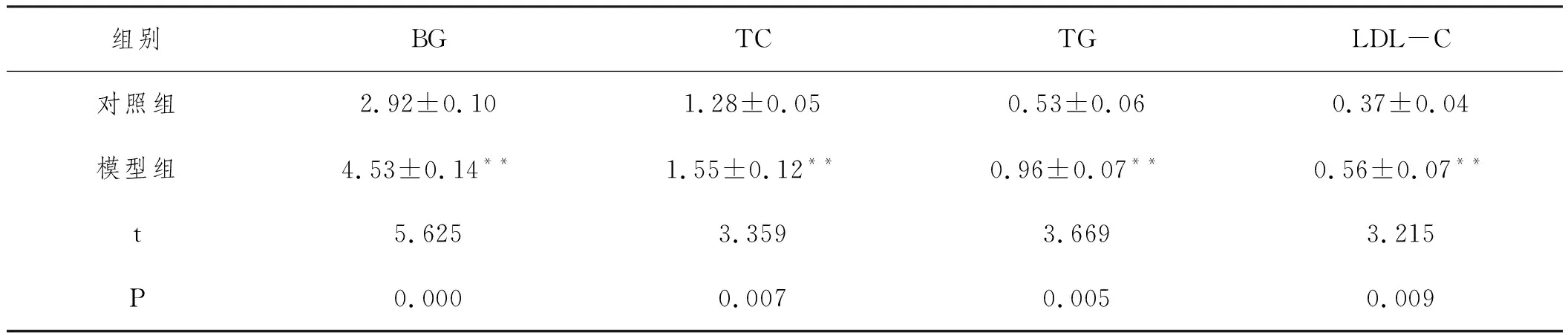
表2 两组大鼠血脂及血糖比较(mmoL/L)
2.2低氧运动干预对肥胖大鼠体重的影响:与A组比较,AE、BE、C、CE组大鼠的体重增长明显受到抑制,差异具有统计学意义(P<0.05,P<0.01);与AE组比较,BE、CE组大鼠体重增长明显受到抑制,差异具有统计学意义(P<0.05,<0.01)。见表3、图1。

图1 低氧运动对肥胖大鼠体重的影响
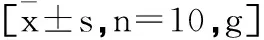
表3 低氧运动对肥胖大鼠体重的影响
2.3低氧运动干预对肥胖大鼠运动即刻状态总耗氧量的影响:与A组比较,AE、B、BE、C、CE组大鼠的运动即刻状态总耗氧量均出现增加趋势,差异具有统计学意义(P<0.05,P<0.01);与AE组比较,B、BE、C、CE组大鼠运动即刻状态总耗氧量出现增加趋势,差异具有统计学意义(P<0.05,P<0.01)。在8周的干预过程中,每个组别肥胖大鼠伴随周龄的增加,运动即刻状态总耗氧量表现为下降趋势,但干预各组均能提高运动后即刻耗氧量水平从而抑制其降低。见表4、图2。

表4 低氧运动干预对肥胖大鼠运动即刻状态总耗氧量的影响

图2 低氧运动干预对肥胖大鼠运动即刻状态总耗氧量的影响
2.4低氧运动干预对肥胖大鼠运动即刻状态肌肉耗氧量的影响:与A组比较,AE、B、BE、C、CE组大鼠的运动即刻状态肌肉耗氧量均出现增加趋势,差异具有统计学意义(P<0.05,P<0.01);与AE组比较,BE、C、CE组大鼠运动即刻状态总耗氧量出现增加趋势,差异具有统计学意义(P<0.05,P<0.01),在8周的干预过程中,每个组别的肥胖大鼠伴随周龄的增加,运动即刻状态肌肉耗氧量表现为下降趋势,但干预各组均能提高运动后即刻耗氧量的水平从而抑制其降低。见表5、图3。

图3 低氧运动干预对肥胖大鼠运动即刻状态肌肉耗氧量的影响

表5 低氧运动干预对肥胖大鼠运动即刻状态肌肉耗氧量的影响
2.5低氧运动干预对肥胖大鼠运动即刻状态总耗能的影响:与A组比较,AE、BE、C、CE组大鼠的运动即刻状态总耗能出现增加趋势,差异具有统计学意义(P<0.05,P<0.01);与AE组比较,CE组大鼠运动即刻状态总耗能出现增加趋势,差异具有统计学意义(P<0.05,P<0.01)。在8周的干预过程中,每个组别的肥胖大鼠伴随周龄的增加,运动即刻状态总耗能表现为下降趋势,但干预各组均能提高运动后即刻耗能量的水平从而抑制其降低。见表6、图4。

表6 低氧运动干预对肥胖大鼠运动即刻状态总耗能的影响

图4 低氧运动干预对肥胖大鼠运动即刻状态总耗能的影响
2.6低氧运动干预对肥胖大鼠运动即刻状态肌肉耗能的影响:与A组比较,B、BE、C、CE组大鼠的运动即刻状态肌肉耗能出现增加趋势,差异具有统计学意义(P<0.05,P<0.01);与AE组比较,CE组大鼠运动即刻状态总耗能出现增加趋势,差异具有统计学意义(P<0.05,P<0.01)。B、BE、C组运动即刻状态总耗能在6W、7W出现下降,1W、2W、3W、4W、5W、8W为增加趋势,差异具有统计学意义(P<0.05,P<0.01);在8周的干预过程中,每个组别的肥胖大鼠伴随周龄的增加,运动即刻状态总耗能表现为下降趋势,但干预各组均能提高运动后即刻耗能量的水平从而抑制其降低。见表7、图5。

表7 低氧运动干预对肥胖大鼠运动即刻状态肌肉耗能的影响

图5 低氧运动干预对肥胖大鼠运动即刻状态肌肉耗能的影响
2.7低氧运动干预对肥胖大鼠血脂血糖的影响:与A组大鼠比较,AE、BE、C、CE组大鼠TC、TG、LDL-C、血糖明显降低(P<0.05或P<0.01),BE、CE组大鼠HDL-C明显升高(P<0.01);与AE组大鼠比较,BE、CE组大鼠TC、TG、LDL-C、血糖明显降低(P<0.01);BE、CE组大鼠HDL-C明显升高(P<0.01)。见表8。

表8 低氧运动干预对肥胖大鼠血脂血糖的影响
2.8低氧运动干预对肥胖大鼠对大鼠骨骼肌PPAR-α、PGC-1α蛋白表达的影响:与A组相比,BE组、C组和CE组大鼠PPAR-α、PGC-1α蛋白表达明显升高(P<0.05,P<0.01);与AE组相比,BE组、C组、CE大鼠PPAR-α、PGC-1α蛋白表达明显增加(P<0.05,P<0.01)。见表9、图6。

图6 低氧运动干预对肥胖大鼠对大鼠骨骼肌PPAR-α、PGC-1α蛋白表达的影响

表9 低氧运动干预对肥胖大鼠对大鼠骨骼肌PPAR-α PGC-1α蛋白表达的影响
3 讨 论
氧是人体维持生命活动必不可少的物质,持续的低氧环境会让机体产生不适反应,但是适当的低氧刺激反而能促进机体的脂肪酸代谢。当机体受到无氧刺激时,组织中的无氧代谢会加强,此时糖代谢无法满足正常的能量代谢,脂肪便会分解供给能力,当配合耐力运动时,则可以加快脂肪的分解代谢,从而有效控制体重,降低血脂[8]。此外,诸多研究表明低氧运动还可通过调控PGC-1α通路极其下游因子,增强脂肪酸氧化能力,加剧骨骼肌能量代谢等[9]。
能量代谢是一个复杂的过程,诸如运动强度、机体的生理状态、精神状态等都会对其产生影响。机体进行生理活动时需要持续地从外界获取氧气,排出CO2,因此,能量消耗、耗氧量等可以作为评价能量代谢的关键指标[10]。本实验结表明示:低氧运动干预8周后,肥胖大鼠血糖、血脂均明显降低,与常氧安静组相比,低氧安静组大鼠能量代谢增加,与低氧安静组比较,低氧运动组大鼠能量代谢明显增加,且13.3%低氧运动组能量代谢较16.3%低氧运动组增加,说明低氧结合运动可协同提高机体的能量代谢,且低氧浓度也是影响能量代谢的重要因素。骨骼肌是机体重要的氧耗器官,其形态结构或是功能异常可影响机体能量代谢的平衡[11]。PGC-1α是人体能量代谢“分子开关”,骨骼肌作为机体能量代谢最活跃的组织之一,富含PGC-1,而PGC-1α在骨骼肌线粒体发生、糖代谢、脂肪酸氧化等能量代谢网络中均具有重要调控作用。低氧状态下,PGC-1α可通过低氧诱导因子1(HIF-1)调节机体骨骼肌线粒体生成和糖、脂代谢等[12]。Greene等研究报道:耐力运动可促进骨骼肌中PGC-1α的表达,提高能量代谢水平[13]。PPARs属于核受体超家族成员,在细胞的信号转导过程中具有重要作用,PPRAα是脂类供给的总感受器,能够与饱和、不饱和脂肪酸结合,增加脂肪酸向肌肉的输送,从而促进脂类的氧化利用[14]。本实验结表明示:低氧运动干预8周后,与常氧安静组相比,13.3%低氧安静组大鼠PGC-1α、PPAR-α蛋白表达增加,与低氧安静组比较,低氧运动组大鼠PGC-1α、PPAR-α蛋白表达增加,其中13.3%低氧运动组大鼠PGC-1α、PPAR-α蛋白表达高于16.3%低氧运动组,说明低氧结合运动干预可协同增强骨骼肌PGC-1α、PPAR-α蛋白的表达,且低氧浓度也可影响PGC-1α、PPAR-α蛋白表达。由此可见,运动过程中增加低氧干预手段可有效增强骨骼肌PGC-1α/PPAR-α蛋白的表达,进而影响骨骼肌能量代谢稳态。
综上可知:长期高脂膳食可诱导营养性肥胖的发生,导致机体代谢紊乱,低氧和运动客有效控制营养性肥胖大鼠的体重,其机制可能是低氧运动可增强骨骼肌PGC-1α、PPAR-α蛋白的表达,进而改善肥胖大鼠能量代谢水平。

