22个烤烟品种苗期对增强UV-B辐射的耐性分析及鉴定指标筛选
顾浩,张锦韬,陈颐,李嘉亮,蔡虓,杨志新,王力,何承刚
22个烤烟品种苗期对增强UV-B辐射的耐性分析及鉴定指标筛选
顾浩1,张锦韬2,陈颐3,李嘉亮1,蔡虓1,杨志新1,王力1,何承刚1*
1 云南农业大学烟草学院,昆明市盘龙区金黑公路95号 650201;2 湖南中烟工业有限责任公司,长沙市雨花区万家丽中路三段188号 410007;3 云南省烟草农业科学研究院,昆明市五华区圆通街33号 650021
【目的】对22个烤烟品种苗期耐UV-B辐射能力进行综合评价,并筛选耐性鉴定指标。【方法】测定22个烤烟品种苗期在自然UV-B辐射(对照)和4.60 kJ/m2·d增强UV-B辐射下的7项生长指标和9项生理指标,依据各单项指标对增强UV-B辐射的响应指数进行主成分分析,并通过隶属函数和系统聚类等分析方法,对22个烤烟品种苗期耐UV-B辐射能力进行综合评价,再结合逐步回归分析筛选烤烟苗期耐UV-B辐射鉴定指标。【结果】将16个单项指标进行主成分分析,得到5个相互独立的综合指标,通过隶属函数法计算得出各品种对增强UV-B辐射耐性评价值(),利用聚类分析,筛选出7个对UV-B辐射耐性较强、4个对UV-B辐射耐性中等、7个对UV-B辐射耐性弱、4个对UV-B辐射较敏感的烤烟品种,采用逐步回归分析建立烤烟苗期对UV-B辐射耐性预测方程:=0.510+0.233SFW+0.135SOD+0.114UV-AS+0.113LDM-0.068W-SS+0.073RDM(2=0.974,<0.05),其平均预测精度为95.24%。【结论】NC102、云烟87、云烟85、NC82、中烟201、NC297和中烟100对UV-B辐射耐性较强,中烟103、云烟201、云烟97和云烟203对UV-B辐射较敏感;筛选出幼苗鲜质量(SFW)、超氧化物歧化酶(SOD)活性、紫外吸收物质(UV-AS)含量、叶干质量(LDM)、水溶性糖(W-SS)含量和根干质量(RDM)作为烤烟苗期耐UV-B辐射鉴定指标。
UV-B辐射;烤烟品种;苗期;综合评价
紫外辐射按波长可分为短波紫外辐射UV-A(200~280 nm)、中波紫外辐射UV-B(280~320 nm)和长波紫外辐射UV-C(320~400 nm)[1]。臭氧层作为抵御紫外辐射的天然屏障,UV-A虽能大量透过臭氧层,但对生物体产生的影响较小,UV-C被臭氧吸收殆尽,而UV-B由于其具有极高的能量,虽能被臭氧大量吸收,但残余的UV-B辐射仍能对植物的生长发育产生显著影响[2]。前人研究表明:UV-B辐射增强可以降低马铃薯[3]、水稻[4]、大豆[5]和大麦[6]等作物的株高、叶面积和干质量,抑制其光合作用,导致作物减产,造成严重经济损失。UV-B辐射对植物生长的抑制和生理损伤,一方面是由于DNA受损[7],导致DNA复制和转录过程不能正常进行,另一方面是由于自由基和活性氧的积累[8],对细胞形成氧化胁迫所致。UV-B辐射对植物的损伤程度与DNA的修复能力[9]、次生代谢产物含量[10]、抗氧化酶系统活性[11]以及UVR8光受体蛋白的响应[12]有关。在农业生产中,不同作物甚至同一作物不同品种对UV-B辐射的响应均有差异[13-14]。根据GISS模型结果显示,相对于1979—1992年, 2010—2020年期间南北半球UV-B辐射强度增幅分别达到40%和14%[15]。因此,面对日益增强的UV-B辐射,筛选和培育耐UV-B辐射种植资源具有重要意义。
云南位于低纬高原地区,UV-B辐射较强,且其辐射强度随海拔高度的变化呈规律性递增[16]。UV-B辐射增强不仅会影响烤烟的次生代谢产物及致香物质含量,还会降低烤烟的中上等烟比例,对烤烟的经济价值产生负面影响[17]。目前,关于UV-B辐射对烤烟生长发育及生理进程的影响已有较多报道,但仅有少数研究针对个别烤烟品种分析了其对UV-B辐射的种间响应差异[18-19]。本研究选取22个来自不同地区的烤烟品种作为试验材料,以各烤烟品种苗期的生长及生理指标对UV-B辐射的响应指数为基础,采用多元分析方法,对不同烤烟品种苗期耐UV-B辐射能力进行综合评价,并筛选鉴定指标,旨在为耐UV-B辐射烤烟品种的筛选及品种区划提供参考。
1 材料与方法
1.1 试验地点与材料
试验于云南农业大学后山农场(N25°04¢,E102°73¢)拱棚内进行,海拔1950 m。供试22个烤烟品种分别来源于国内外不同地区,中烟90、中烟98、中烟100、中烟103和中烟201来源于中国烟草总公司青州烟草研究所,云烟85、云烟87、云烟97、云烟201和云烟203来源于云南省烟草农业科学研究院,红花大金元来源于云南省路南(石林)县,贵烟4号来源于贵州大学和贵州省烟叶公司,湘烟1号来源于湖南省郴州市农业科学研究所和郴州市烟草公司,翠碧1号来源于福建省宁化县,净叶黄来源于河南省农业科学院烟草研究所,K326来源于美国诺斯朴金种子公司,G80来源于美国斯佩特种子公司,NC82、NC102和NC297来源于美国北卡罗来纳州烟草试验站,KRK23和KRK26来源于津巴布韦烟草研究院。
1.2 试验设计
采用漂浮育苗的方式进行育苗,每品种育苗2盘,其中一盘为自然UV-B辐射处理(对照),另一盘进行增强UV-B辐射处理,共设2×22个处理。
于试验拱棚内设置可升降紫外灯架,并垂直于试验烟苗,通过调节紫外灯与烟苗顶部的距离控制辐射强度,并利用紫外辐射测定仪(北京师范大学生产)测定烟苗顶端的辐射强度。增强UV-B辐射处理采用北京电光源研究所生产的UV-B灯管(40 W,光谱为275~380 nm)进行模拟并用0.13 mm醋酸纤维膜紧贴以过滤290 nm以下的紫外线,除阴雨天外,自小“十”字期开始至成苗,每天10:00~17:00辐照7 h,紫外灯至烟株顶部的距离为0.55 m,以提供4.60 kJ/m2·d的增强UV-B辐射。自然UV-B辐射处理(对照)上方同样悬挂UV-B灯管,但通过0.075 mm聚酯膜紧贴以去除UV-B辐射降低试验误差。
通过Caldwell[20]模拟公式计算紫外光生物有效辐射强度。昆明地区夏至(晴天)时大气紫外光生物有效辐射强度为10.00 kJ/m2·d,按照Madronich等[21]的模型和LI等[22]的模型计算,本试验模拟增强UV-B辐射处理相当于昆明地区夏至(晴天)时18.31%的臭氧衰减。
1.3 主要测定指标及方法
1.3.1 生长指标的测定
于各品种烟苗处理45 d时,选取长势均匀一致的5株烟苗参照行业标准《烟草农艺性状调查测量方法》(YC/T142—1998)测定各处理幼苗鲜质量(SFW)、幼苗叶干质量(LDM)、幼苗根干质量(RDM)、最大叶长(LL)、最大叶宽(LW)、株高(PH)和茎围(SG)。
1.2.1 生理指标的测定
于增强UV-B辐射和对照处理30 d时取长势均匀一致的20株幼苗叶片(从上到下第2、第3完全展开叶) 40片,测定抗氧化酶活性和部分生理指标,方法如下:过氧化物酶(POD)活性采用愈创木酚氧化法[23];超氧化物岐化酶(SOD)活性采用氮蓝四唑(NBT)光还原法[23];多酚氧化酶(PPO)活性采用邻苯二酚氧化法[24];相对电导率(EC)的测定采用电导仪法[24];脯氨酸(Pro)含量采用茚三酮显色法[25];丙二醛(MDA)含量采用硫代巴比妥酸反应法[25];水溶性总糖(W-SS)含量的测定采用蒽酮比色法[25];水溶性蛋白质(SP)采用考马斯亮蓝G-250法[25]测定;紫外吸收物质(UV-AS)采用酸化甲醇(甲醇:蒸馏水:盐酸=79:20:1)提取法[26]。
1.4 数据处理与统计分析
通过Microsoft Excel 2010进行常规数据处理,运用SPSS26.0软件进行多元分析。数据处理及分析方法如下[27-28]。
(1)对22个烤烟品种的各项测定指标进行单变量分析确定其UV-B效应
C= (UV-B-CK)/CK(1)
式中,C:各单项指标对增强UV-B辐射的响应指数;UV-B:增强UV-B辐射处理下各指标的测定值,CK:自然UV-B辐射(对照)下各指标的测定值。
(2)对C值进行相关性分析,并通过主成分分析后计算各综合指标的隶属函数值。
U(X)=(X-min)/(max-min),=1,2,3…(2)
式中,U(X):表示第个综合指标的隶属函数值;X:表示第个综合指标值;max和min分别表示第个综合指标值的最大值和最小值。
(3)各综合指标的权重(W)

式中,W:表示第个综合指标的权重;P:为第个综合指标的贡献率。
(4)不同烤烟品种苗期对UV-B辐射耐性综合评价值()

(5)对值进行系统聚类分析,同时以值为因变量,C值作为自变量进行逐步回归分析,建立烤烟苗期对UV-B辐射耐性预测模型。
2 结果与分析
2.1 各烤烟品种苗期对增强UV-B辐射的响应指数分析
由表1可知,各单项指标对增强UV-B辐射的响应指数在22个烤烟品种间变化显著。除云烟87和云烟85的生长指标对增强UV-B辐射的响应呈正相关外,其余品种的绝大部分生长指标对增强UV-B辐射的响应呈负相关。在生理指标方面,不同品种的不同指标对增强UV-B辐射的响应指数各不相同。说明各单项指标对增强UV-B辐射的响应指数只能反映烤烟幼苗对UV-B辐射耐性的片面数据,难以直接决定各品种对UV-B辐射的耐性强弱。
2.2 各烤烟品种苗期对增强UV-B辐射响应指数的相关性分析
由表2可知,PH与LW、LL、SG、SFW和LDM相关性极显著;LW与LL、SG、SFW和RDM相关性极显著,与LDM相关性显著;LL与SG、SFW和LDM相关性极显著,与RDM和MDA相关性显著;SG与SFW、RDM和LDM相关性极显著,与SP相关性显著;SFW与RDM、LDM和SP相关性极显著;RDM与LDM和SP相关性极显著;LDM与SP相关性显著;SOD与SP相关性极显著;Pro与MDA相关性显著。可以看出,各生长指标间的相关性较强,且各单项指标所提供的评价信息相互关联并存在重叠,即烤烟苗期对增强UV-B辐射的响应不是单一性状的表现,各指标在烤烟苗期耐UV-B辐射能力评价体系构建中的作用各不相同。因此,评价烤烟苗期对增强UV-B辐射的耐性指标,需要进一步鉴定。
2.3 各烤烟品种苗期对UV-B辐射耐性评价指标的主成分分析
将16个单项指标对增强UV-B辐射的响应指数进行主成分分析,通过表3可以看出:前5个综合指标(CI)的贡献率分别为36.10%、14.51%、11.27%、9.04%和6.91%,累计贡献率为77.83%。因此,分析出的这5个新的相互独立的综合指标能代表原来16个具有相互关联的单项指标的绝大部分信息,分别定义为第1(CI1)~第5(CI5)主成分,可用来综合评价烤烟苗期对UV-B辐射的耐受性。通过各综合指标对应特征向量可以看出,CI1中主要与各项生长指标相关;CI2中主要与PPO、SOD、MDA和SP指标相关;CI3中主要与Pro、MDA和W-SS指标相关;CI4主要与EC和UV-AS指标相关;CI5主要与POD指标相关。
表1 22个烤烟品种各单项指标对增强UV-B辐射的响应指数(C)

Tab.1 Response index (TC) of individual indices of 22 flue-cured tobacco varieties to enhanced UV-B radiation
续表1

品种varitiesPHLWLLSGSFWRDMLDMPODSODPPOECProMDAW-SSSPUV-AS 云烟203-0.48*-0.09*-0.21*-0.14*-0.40*-0.23*-0.69*-0.04-0.46*2.62*-0.27*-0.15*-0.19*0.64*-0.31*-0.26* 红花大金元-0.15*-0.34*-0.30*-0.27*-0.45*-0.20*-0.82*-0.34*-0.020.23*-0.30*-0.28*-0.13*-0.33*-0.20*0.59* 贵烟4号-0.01-0.11*-0.08-0.12*-0.26*-0.02-0.58*-0.030.21*0.51*-0.22*0.23*-0.16*0.040.000.28* 湘烟1号-0.13*-0.14*-0.14*-0.22*-0.18*-0.48*-0.15*-0.32*0.78*-0.31*-0.050.02-0.14*0.10*0.25*-0.01 翠碧1号-0.31*-0.24*-0.18*-0.22*-0.38*-0.27*-0.49*0.18*0.28*-0.32*0.050.04-0.30*0.68*-0.30*-0.07 净叶黄-0.24*-0.30*-0.28*-0.16*-0.58*-0.55*-0.42*0.09*0.23*0.10*-0.23*0.19*0.00-0.29*-0.31*0.42* K326-0.27*-0.12*-0.23*0.00-0.21*0.33*-0.17*-0.25*0.46*0.17*-0.10*0.22*-0.24*-0.13*0.08-0.26* G80-0.11*-0.17*-0.18*-0.19*-0.37*-0.45*-0.72*0.07*0.081.13*-0.13*0.35*-0.23*0.34*0.020.45* NC82-0.09*-0.19*-0.050.05-0.20*-0.25*0.06-0.12*0.67*0.31*-0.17*0.78*-0.25*-0.27*-0.060.21* NC102-0.21*0.02-0.10*-0.04-0.040.96*0.11*0.25*0.59*-0.28*-0.12*-0.070.090.16*0.19*0.23* NC2970.15*0.14*0.16*-0.09*0.20*0.30*-0.61*-0.18*0.29*2.18*-0.09*0.32*-0.37*-0.16*-0.010.09* KRK23-0.34*-0.35*-0.40*-0.21*-0.54*-0.31*-0.95*0.050.33*1.85*-0.27*-0.29*0.04-0.090.010.12* KRK26-0.40*-0.38*-0.32*-0.29*-0.56*-0.49*-0.72*0.16*0.23*0.21*-0.080.04-0.15*0.03-0.010.03
注:*表示差异显著(<0.05);PH. 株高;LW. 叶宽;LL. 叶长;SG. 茎围;SFW. 幼苗鲜质量;RDM. 根干质量;LDM. 叶干质量;POD. 过氧化物酶活性;SOD. 超氧化物歧化酶活性;PPO. 多酚氧化酶活性;EC. 相对电导率;Pro. 脯氨酸含量;MDA. 丙二醛含量;W-SS. 水溶性糖含量;SP. 可溶性蛋白质含量;UV-AS. 紫外吸收物质含量;以下表格缩写与此表相同。
Note: * indicates significant difference (<0.05); PH. plant height; LW. leaf width; LL. leaf length; SG. stem girth; SFW. seedling fresh weight; RDM. leaf dry mass; LDM. leaf dry mass; POD. peroxidase; SOD. superoxide dismutase; PPO. polyphenol oxidase activity; EC. electrical conductivity; Pro. proline content; MDA. malondialdehyde content; W-SS. water-soluble sugar content; SP. soluble protein content; UV-AS. UV absorbing substance content; Abbreviations in the following table are the same.
表2 增强UV-B辐射处理下各单项指标响应指数(C)的相关系数矩阵

Tab.2 Correlation coefficient matrix of response index (TC) of each single index under enhanced UV-B radiation treatment
注:*表示差异显著(<0.05);**表示差异极显著(<0.01)
Note:* indicates significant difference (<0.05); ** indicates extremely significant difference(<0.01).
表3 UV-B胁迫下各综合指标的系数及贡献率

Tab.3 Coefficient and contribution rate of each comprehensive index under UV-B stress
注:*表示该指标在对应主成分中的绝对值最大。
Note:* indicates that the absolute value of the indicator in the corresponding principal component is the largest.
2.4 各烤烟品种苗期对增强UV-B辐射耐性综合评价
通过公式(2)计算22个烤烟品种各项测定指标的隶属函数值;通过公式(3)得出5个综合指标的权重分别为0.46、0.19、0.14、0.12和0.09;通过公式(4)计算22个烤烟品种对增强UV-B辐射的综合耐性评价值()(表4)。依据值对22个烤烟品种苗期对增强UV-B辐射的耐性强弱进行排序,值最高的为NC102(0.66),表明其对UV-B辐射的耐性最强;值最低的为云烟203(0.18),表明其对UV-B辐射的耐性最弱。采用组间连接法对值进行系统聚类分析,建立了聚类谱系图(图1),将22个烤烟品种划分为4类。其中,NC102、云烟87、云烟85、NC82、中烟201、NC297和中烟100为第Ⅰ类,对UV-B辐射的耐性强;第Ⅱ类包括K326、湘烟1号、贵烟4号和中烟98,对UV-B辐射耐性中等;第Ⅲ类包括净叶黄、G80、中烟90、红花大金元、KRK23、KRK26和翠碧1号,对UV-B辐射耐性弱;第Ⅳ类包括中烟103、云烟201、云烟97和云烟203,对UV-B辐射较敏感。

表4 22个烤烟品种苗期对增强UV-B辐射耐性的综合评价
续表4
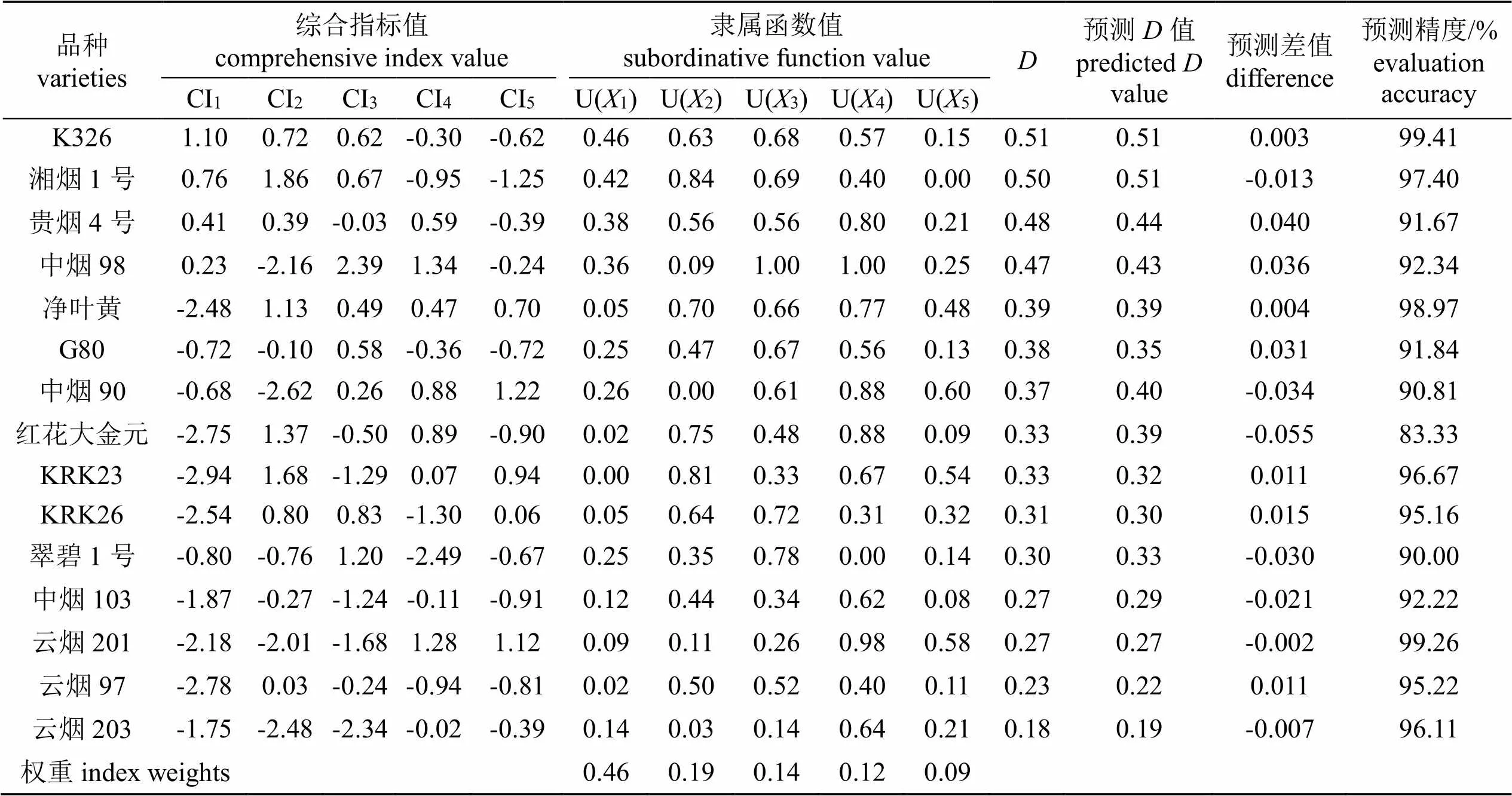
品种varieties综合指标值comprehensive index value隶属函数值subordinative function valueD预测D值predicted D value预测差值difference预测精度/%evaluation accuracy CI1CI2CI3CI4CI5U(X1)U(X2)U(X3)U(X4)U(X5) K3261.100.720.62-0.30-0.620.460.630.680.570.150.510.510.00399.41 湘烟1号0.761.860.67-0.95-1.250.420.840.690.400.000.500.51-0.01397.40 贵烟4号0.410.39-0.030.59-0.390.380.560.560.800.210.480.440.04091.67 中烟980.23-2.162.391.34-0.240.360.091.001.000.250.470.430.03692.34 净叶黄-2.481.130.490.470.700.050.700.660.770.480.390.390.00498.97 G80-0.72-0.100.58-0.36-0.720.250.470.670.560.130.380.350.03191.84 中烟90-0.68-2.620.260.881.220.260.000.610.880.600.370.40-0.03490.81 红花大金元-2.751.37-0.500.89-0.900.020.750.480.880.090.330.39-0.05583.33 KRK23-2.941.68-1.290.070.940.000.810.330.670.540.330.320.01196.67 KRK26-2.540.800.83-1.300.060.050.640.720.310.320.310.300.01595.16 翠碧1号-0.80-0.761.20-2.49-0.670.250.350.780.000.140.300.33-0.03090.00 中烟103-1.87-0.27-1.24-0.11-0.910.120.440.340.620.080.270.29-0.02192.22 云烟201-2.18-2.01-1.681.281.120.090.110.260.980.580.270.27-0.00299.26 云烟97-2.780.03-0.24-0.94-0.810.020.500.520.400.110.230.220.01195.22 云烟203-1.75-2.48-2.34-0.02-0.390.140.030.140.640.210.180.19-0.00796.11 权重index weights 0.460.190.140.120.09
2.5 回归分析及烤烟对UV-B辐射耐性指标的选择
以值为因变量,16个指标对增强UV-B辐射的响应指数为自变量进行逐步线性回归分析,由表5建立回归方程:=0.510+0.233SFW+0.135SOD+0.114UV- AS+0.113LDM-0.068W-SS+0.073RDM(<0.05,2=0.974),表明在增强UV-B辐射条件下,对UV-B辐射耐性较强的品种,其幼苗鲜质量(SFW)、超氧化物歧化酶(SOD)、紫外吸收物质(UV-AS)、叶干质量(LDM)和根干质量(RDM)这5项指标表现出增加趋势,水溶性糖(W-SS)含量表现出降低趋势,表明这6项指标可用于预测相同条件下不同烤烟品种对UV-B辐射的耐性强弱。
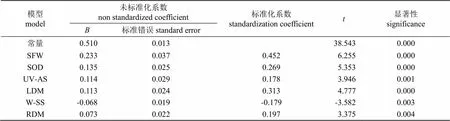
表5 逐步回归系数及显著性
3 讨论
3.1 烤烟耐UV-B辐射鉴定指标响应差异
烟株为应对UV-B辐射增强,会诱发自身一系列适应性或防御性机制。欧阳磊等[29]认为烟株为适应UV-B胁迫,会通过减小叶面积的方式以降低所受辐射量,而叶面积的缩小降低了烟株的光合效率,导致有机物合成减少,从而抑制烟株的生长。在本研究中,除云烟85和云烟87的生长指标与增强UV-B辐射呈正相关外,增强UV-B辐射对其余20个烤烟品种的绝大部分生长指标均表现出抑制作用,这与李大肥等[30]、涂云等[31]的研究结果一致。此外,李俊等[13]研究发现:UV-B辐射增强在抑制植株地上部分生长的同时,还会影响地下根系的发育。因此,本研究通过逐步回归分析筛选出SFW、LDM和RDM作为鉴定烤烟耐UV-B辐射能力的3个生长指标,也进一步说明了UV-B胁迫对植物干物质积累及分配的影响。对于云烟85和云烟87的生长指标在本试验条件下有所增加,可能是由于该UV-B辐射强度未能达到抑制其生长的阈值,反而促进了烟株的生长,这一点在何承刚等[18]、朱罡 等[32]的研究中均有所体现,即烟株生长对UV-B辐射强度表现出“低促高抑”的现象。
UV-B辐射胁迫对植物造成伤害其中重要的一条途径就是活性氧(ROS)的产生,积累过多的O2-、OH-等自由基[33]。Tossi等[34]研究表明ROS积累与UVR8、COP1和HY5/HYP转录因子信号传导途径有关,植物为了防御ROS伤害就会激活自身保护措施,而SOD作为植物抵御氧化胁迫伤害的第1道防线,也是植物体内清除O2-的主要酶[35],就会通过SOD的大量表达来平衡体内的活性氧,降低伤害[36]。糖类不仅是重要的光合产物,还是植物主要的碳源和能量物 质[37]。在本研究中,W-SS指标在不同烤烟品种间的响应差异显著,对UV-B辐射较敏感的品种其W-SS指标均有所增加,而耐性强的部分品种其W-SS指标反而有所降低,作为预测模型中唯一一个表现出下降趋势的鉴定指标,体现出预测模型的准确性。紫外吸收物质是植物应对UV-B辐射增强的一类重要次生代谢产物,其主要成分为黄酮类和花青素苷等[26],其不仅能有效猝灭羟自由基和过氧化氢自由基[38],还能通过黄酮类化合物吸收紫外光,减少UV-B透过量,以保护叶片内的光合机构等敏感部位,增强自身对UV-B的防御能力[39]。在本试验条件下SOD与UV-AS指标均仅有两个品种烟苗显著下降,与韩雯等[40]、李大肥等[30]的研究结果基本一致。综上所述,以SOD、W-SS和UV-AS三个生理指标来鉴定烤烟耐UV-B辐射能力具有一定的科学依据和理论支撑。
3.2 各烤烟品种对增强UV-B辐射的耐性
通过主成分分析、隶属函数法、聚类分析和逐步回归等多元分析方法,结合多指标综合评价作物对逆境胁迫的耐性强弱,该分析方法已被应用于芸豆[27]和小白菜[28]等作物的耐性评价及鉴定指标的筛选。因此,对多指标进行多元分析是综合评价不同烤烟品种耐UV-B辐射能力的有效方法之一。
响应指数已被用于马铃薯[13]和冬小麦[41]等作物对UV-B辐射的敏感性评价。本研究以16个单项指标对增强UV-B辐射的响应指数为基础,利用多元分析方法,综合评价了22个烤烟品种对UV-B辐射的耐性强弱。得到NC102、云烟87、云烟85、NC82、中烟201、NC297和中烟100耐性较好的结果。周平等[15]研究发现紫外辐射强度表现出随海拔高度的升高而增加的趋势。王育军等[42]研究表明:NC102和NC297在昆明烟区适种海拔区间为1700~1900 m,且在此海拔区间NC102所表现出的适应性强于NC297,与本研究结果一致,同时也从侧面说明了该品种对于UV-B辐射耐性较好的结果。云烟85和云烟87对UV-B辐射耐性强一方面可能是由于两个品种均是以K326为父本、云烟2号为母本杂交选育而来,而K326又是以Mcnair30和NC95杂交选育而成,且K326对UV-B辐射的耐性评价仅次于中烟100,两个品种兼具了NC系烤烟品种和K326的优良耐性基因,另一方面可能是由于两个品种自云南省烟草农业科学研究院选育以来,作为云南主栽烤烟品种,与其长期以来在高海拔地区种植形成的适应性有关。中烟100是以烤烟新品系9201与优质品种NC82杂交选育而来,中烟201是以K326为母本与中烟98为父本选育而来。以上7个品种均存在一定的亲缘关系,在本研究中通过聚类分析将其归为一类,具有一定科学性和合理性,但基于不同品种对UV-B的响应差异机理亟需进一步研究。
本研究将22个烤烟品种对UV-B辐射的耐性强弱分为耐性强(NC102、云烟87、云烟85、NC82、中烟201、NC297和中烟100)、耐性中等(K326、湘烟1号、贵烟4号和中烟98)、耐性弱(净叶黄、G80、中烟90、红花大金元、KRK23、KRK26和翠碧1号)和敏感型(中烟103、云烟201、云烟97和云烟203)4个类型。目前,中国有东北、东南、黄淮、西南和长江中上游5个主产烟区,由于各产区地理坐标及海拔高度的不同,导致各产区间UV-B辐射强度差异明显。而UV-B辐射对烤烟的香气风格及烟叶品质形成有至关重要的作用[43]。因此,本研究可针对各烟区UV-B辐射强度的不同,为不同烤烟品种的种植区划及推广提供参考。
总的来说,UV-B辐射对烤烟的影响是一种综合性状的表现,且各品种对UV-B辐射的响应不同。本研究首次通过多元分析方法综合评价了22个烤烟品种对UV-B辐射的耐性强弱,并建立了烤烟苗期耐UV-B辐射预测模型,该模型平均预测精度为95.24%,可用于鉴定烤烟对UV-B辐射的耐性强弱。
4 结论
(1)本研究将供试的22个烤烟品种对UV-B辐射的耐性分为耐性强(7个)、耐性中等(4个)、耐性弱(7个)和敏感型(4个)4个类型,其中NC102、云烟87、云烟85、NC82、中烟201、NC297和中烟100耐性较强,中烟103、云烟201、云烟97和云烟203对UV-B辐射较敏感。
(2)建立了烤烟苗期对UV-B辐射的耐性预测模型,=0.510+0.233SFW+0.135SOD+0.114UV-AS+ 0.113LDM-0.068W-SS+0.073RDM。
[1] 石新新,李佐同,杨克军,等. 增强的UV-B辐射对高粱幼苗光合和抗氧化系统的影响[J]. 光谱学与光谱分析,2016,36(5): 1389-1395.
SHI Xinxin, LI Zuotong, YANG Kejun, et al. Effects of enhanced ultraviolet B irradiation on photosynthetic and antioxidant system of sorghum seedlings[J]. Spectroscopy and Spectral Analysis, 2016, 36(5):1389-1395.
[2] Ahmad P, Prasad M. UV-B Radiation, its effects and defense mechanisms in terrestrial plants[J]. Environmental Adaptations and Stress Tolerance of Plants in the Era of Climate Change,2012(3): 57-83.
[3] 李俊,杨玉皎,王文丽,等. UV-B辐射增强对马铃薯叶片结构及光合参数的影响[J]. 生态学报,2017, 37(16): 5368-5381.
LI Jun, YANG Yujiao, WANG Wenli, et al. Effects of enhanced UV-B radiation on potato leaf structure and photosynthetic parameters[J]. Acta Ecologica Sinica, 2017, 37(16): 5368-5381.
[4] 包龙丽,何永美,祖艳群,等. 大田条件下增强UV-B辐射对元阳梯田2个地方水稻品种叶片形态解剖结构的影响[J]. 生态学杂志,2013, 32(4): 882-889.
BAO Longli, HE Yongmei, ZU Yanqun, et al. Effects of enhanced UV-B radiation on the leaf morphology and anatomical structure of two local rice varieties in Yuanyang terraced fields, Yunnan Province of Southwest China[J]. Chinese Journal of Ecology, 2013, 32(4): 882-889.
[5] 吴荣军,姚娟,郑有飞,等. 地表臭氧含量增加和UV-B辐射增强对大豆生物量和产量的影响[J]. 中国农业气象,2012, 33(2): 207-214.
WU Rongjun, YAO Juan, ZHENG Youfei, et al. Combination effects of elevated O3and enhanced UV-B radiation on biomass and yield of soybean[J]. Chinese Journal of Agrometeorology, 2012, 33(2): 207-214.
[6] 朱婷婷,娄运生,黄岩. UV-B辐射增强及种植密度对大麦生长发育的影响[J]. 江苏农业学报,2013, 29(2): 254-260.
ZHU Tingting, LOU Yunsheng, HUANG Yan. Effects of planting density and enhanced UV-B radiation on growth and development of barley[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(2): 254-260.
[7] HARGREAVES A, TAIWO FA, DUGGAN O, et al. Near- ultraviolet photolysis of ß-phenylpyruvic acid generates free radicals and results in DNA damage[J]. Journal of Photochemistry and Photobiology B: Biology, 2007, 89 (2/3) : 110-116.
[8] Latifi A, Ruiz M, Zhang C C. Oxidative stress in cyanobacterial[J]. FEMS Microbialogy Reviews, 2009, 33(2): 258-278.
[9] Taylor R M, Tobin A K, Bray C M. DNA damage and repair in plants[M]. Cambridge: Cambridge University Press, 1997.
[10] 刘佳钰,王蓉,张弛,等. UV-B辐射与植物次级代谢产物变化的研究进展[J]. 基因组学与应用生物学,2017, 36(8): 3157-3166.
LIU Jiayu, WANG Rong, ZHANG Chi, et al. Research progress on the influence of UV-B radiation on changes of secondary metabolites in plant[J]. Genomics and Applied Biology, 2017, 36(8): 3157-3166.
[11] 吕杰,王超,刘璐,等. UV-B胁迫对植物抗氧化酶活性的影 响[J]. 吉林师范大学学报(自然科学版),2019, 40(4): 113-117.
LV Jie, WANG Chao, LIU Lu, et al. Advance in response of antioxidant enzyme system in plant to UV-B stress[J]. Jilin Normal University Journal(Natural Science Edition), 2019, 40(4): 113-117.
[12] 陈慧泽,韩榕. 植物响应UV-B辐射的研究进展[J]. 植物学报,2015, 50(6): 790-801.
CHEN Huize, HAN Rong. Plants respond to UV-B radiation: a review[J]. Chinese Bulletin of Botany, 2015, 50(6): 790-801.
[13] 李俊,牛金文,杨芳,等. 不同马铃薯品种(系)对增强UV-B辐射的形态响应[J]. 中国生态农业学报,2016, 24(6): 770-779.
LI Jun, NIU Jinwen, YANG Fang, et al. Morphological responses of potato varieties(lines) to enhanced UV-B radiation[J]. Chinese Journal of Eco-Agriculture, 2016, 24(6): 770-779.
[14] 陈建军,祖艳群,陈海燕,等. UV-B辐射增强对20个大豆品种生长与生物量分配的影响[J]. 农业环境科学学报,2004, 23(1): 29-33.
CHEN Jianjun, ZU Yanqun, CHEN Haiyan, et al. Influence of enhanced UV-B radiation on growth and biomass allocation of twenty soybean cultivars[J]. Journal of Agro-environmental Science, 2004, 23(1): 29-33.
[15] Taalas P, Kaurola J, Kylling A, et al. The impact of greenhouse gases and halogenated species on future solar UV radiation doses[J]. Geophysical Research Letters, 2000, 27(8):1127-1130.
[16] 周平,陈宗瑜. 云南高原紫外辐射强度变化时空特征分析[J]. 自然资源学报,2008, 23(3): 487-493.
ZHOU Ping, CHEN Zongyu. Analysis of the spatio-temporal characteristics of UV-B strength change over the Yunnan plateau[J]. Journal of Natural Resources, 2008, 23(3): 487-493.
[17] 李大肥. 增强紫外线-B辐射对烤烟叶片生理及品质的影响[D]. 南京:南京农业大学,2010.
LI Dafei. Effects of enhanced uv-b on the phosiology and quality of flue-cured tobacco leaves[D]. Nanjing: Nanjing Agricultural University, 2010.
[18] 何承刚,綦世飞,邵建平,等. 增强UV-B辐射对两个烤烟品种生长和叶片解剖结构的影响[J]. 中国烟草学报,2012, 18(5): 34-38.
HE Chenggang, QI Shifei, SHAO Jianping, et al. Effects of intensified UV-B radiation on growth and anatomical structure of two flue-cured tobacco cultivars[J]. Acta Tabacaria Sinica, 2012, 18(5): 34-38.
[19] 何承刚,杨志新,邵建平,等. 增强UV-B辐射对两个烤烟品种主要化学成分的影响[J]. 中国生态农业学报,2012, 20(6): 767-771.
HE Chenggang, YANG Zhixin, SHAO Jianping, et al. Effects of enhanced UV-B radiation on basic chemical compositions of two flue-cured tobacco cultivars[J]. Chinese Journal of Eco-Agriculture, 2012, 20(6): 767-771.
[20] Caldwell M M. Chapter 4 – Solar uv irradiation and the growth and development of higher plants[J]. Photophysiology, 1971, 66(36): 131-177.
[21] Madronich Sasha, Martyn M, Caldwell, et al. Changes in ultraviolet radiation reaching the earth’s surface[J]. Ambio, 1995, 24(3): 143-152.
[22] LI Yuan, ZU Yanqun, CHEN Jianjun, et al. Intraspecific responses in crop growth and yield of 20 soybean cultivars to enhanced ultraviolet-B radiation under field conditions[J]. Field Crops Research, 2000, 78(1):1-8.
[23] 陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社,2015.
CHEN Jianxun, WANG Xiaofeng. Experimental guidance on plant physiology[M]. Guangzhou: South China University of Technology Press, 2015.
[24] 郑炳松. 现代植物生理生化研究技术[M]. 北京:气象出版社,2006.
ZHENG Bingsong. Modern plant physiological and biochemical research technology[M]. Beijing: China Meteorological Press, 2006.
[25] 叶尚红,张志明,陈疏影. 植物生理生化实验教程(第2版)[M]. 昆明:云南科技出版社,2007.
YE Shanghong, ZHANG Zhiming, CHEN Shuying. Plant physiology and biochemistry experiment course ( 2nd edition )[M]. Kunming: Yunnan Science and Technology Press, 2007.
[26] 王颖,吴彤彤,赵纪萍,等. 针叶中紫外吸收物质含量的测定[J]. 林业科技,2014, 39(1): 32-34.
WANG Ying, WU Tongtong, ZHAO Jiping, et al.Measurement of UV-B absorbing compounds in conifer[J]. Forestry Science & Technology, 2014, 39(1): 32-34.
[27] 李琳,于崧,蒋永超,等. 芸豆苗期耐盐碱性鉴定及品种筛选研究[J]. 植物生理学报,2016, 52(1): 62-72.
LI Lin, YU Song, JIANG Yongchao, et al. Identification and screening of different kidney bean cultivars for saline–alkaline tolerance during seedling stage[J]. Plant Physiology Journal, 2016, 52(1): 62-72.
[28] 余如刚,张迪,余心悦,等. 13种小白菜苗期耐盐比较分析及耐性指标筛选[J]. 云南农业大学学报(自然科学), 2022, 37(1): 24-31.
YU Rugang, ZHANG Di, YU Xinyue, et al. Comparison analysis of salinity tolerance and screening of salinity tolerance indicators in 13L. ssp.varieties at seedling stage[J]. Journal of Yunnan Agricultural University (Natural Science), 2022, 37(1): 24-31.
[29] 欧阳磊,周冀衡,陈习羽,等. UV-B辐射对烟草形态、光合色素和抗氧化酶活性的影响[J]. 湖南农业科学,2012(5): 21-23.
OUYANG Lei, ZHOU Jiheng, CHEN Xiyu, et al. Effects of UV-B radiation on tobacco morphology and photosynthetic pigments and activity of antioxidant enzyme in tobacco[J]. Hunan Agricultural Sciences, 2012(5): 21-23.
[30] 李大肥,李军营,邓建华,等. 增强UV-B辐射对烤烟幼苗生长及生理特性的影响[J]. 中国烟草学报,2011, 17(4): 47-50.
LI Dafei, LI Junying, DENG Jianhua, et al. Effects of intensified ultraviolet-b radiation on growth and physiological characteristics of flue-cured tobacco[J]. Acta Tabacaria Sinica, 2011, 17(4): 47-50.
[31] 涂云,杨正聪,权佳锋,等. UV-B辐射强度对烟苗生长及抗氧化酶的影响[J]. 贵州农业科学,2019,47(4):13-18.
TU Yun, YANG Zhengcong, QUAN Jiafeng, et al. Effects of enhanced UV-B radiation on growth and antioxidant enzyme of flue-cured tobacco[J]. Guizhou Agricultural Sciences, 2019, 47(4):13-18.
[32] 朱罡,邵建平,赵晓绕,等. 增强UV-B辐射对烤烟花期和植株性状的影响[J]. 湖南农业科学,2014(14): 5-6+11.
ZHU Gang, SHAO Jianping, ZAHO Xiaorao, et al. Effect of enhanced ultraviolet-b on agronomic traits of flue-cured tobacco[J].Hunan Agricultural Sciences, 2014(14):5-6+11.
[33] 陈宗瑜,毕婷,吴潇潇. 滤减UV-B辐射对烤烟蛋白质组变化的影响[J]. 生态学杂志,2012, 31(5):1129-1135.
CHEN Zongyu, BI Ting, WU Xiaoxiao. Effects of reduced UV-B radiation on the variation of flue-cured tobacco proteome[J]. Chinese Journal of Ecology, 2012, 31(5):1129-1135.
[34] TOSSI V, LAMATTINA L, JENKINS G I et al. Ultraviolet- B-induced stomatal closure in Arabidopsis is regulated by the UV resistance LOCUS8 photoreceptor in a nitric oxide-dependent mechanism[J]. Plant Physiology, 2014, 164(4):2220-2230.
[35] 钟楚,王毅,丁金玲,等. 减弱UV-B辐射对烟草(L.)叶片SOD、POD和CAT活性动态变化影响初探[J]. 中国烟草学报,2010, 16(3): 49-52.
ZHONG Chu, WANG Yi, DING Jinling, et al. Effects of UV-B radiation on SOD, POD and CAT activity in tobacco (L.) leaves[J]. Acta Tabacaria Sinica, 2010, 16(3): 49-52.
[36] 赵凤霞,高相彬,王正平,等. 蛋白质组学技术在烟草研究中的应用进展[J]. 中国烟草学报,2014, 20(1): 103-110.
ZHAO Fengxia, GAO Xiangbin, WANG Zhengping, et al. Application of proteomics in current researches on tobacco[J]. Acta Tabacaria Sinica, 2014, 20(1): 103-110.
[37] ZHEN Qiaoling, FANG Ting, PENG Qian, et al. Developing gene- tagged molecular markers for evaluation of genetic assoclation of apple SWEET genes with fruit sugar accumulation[J]. Horticulture Researeh, 2018, 5:14.
[38] 李冬梅,李少旋,徐功勋,等. 设施作物响应UV-B辐射的研究进展[J]. 植物生理学报,2018, 54(1): 36-44.
LI Dongmei, LI Shaoxuan, XU Gongxun, et al. Research advances of plant response to UV-B radiation in greenhouse[J]. Plant Physiology Journal, 2018, 54(1): 36-44.
[39] 孙金伟,任斐鹏,任亮,等. UV-B辐射对植物生理生态特征的影响研究进展[J]. 长江科学院院报,2015, 32(3): 107-111.
SUN Jinwei, REN Feipeng, REN Liang, et al. Research progresses of the impact of UV-B radiation on plant’s ecophysiology characteristics[J]. Journal of Yangtze River Scientific Research Institute, 2015, 32(3): 107-111.
[40] 韩雯,韩榕. 不同时间的UV-B辐射对拟南芥幼苗生长的影响[J]. 植物学报,2015, 50(1): 40-46.
HAN Wen, HAN Rong. Effect of different times of UV-B radiation on seedling growth of Arabidopsis thaliana[J]. Chinese Bulletin of Botany, 2015, 50(1): 40-46.
[41] 吕志伟,冯青,吕艳伟,等. 140个冬小麦品种(系)对UV-B辐射的响应[J]. 麦类作物学报,2017, 37(6): 841-845.
LV Zhiwei, FENG Qing, LV Yanwei, et al. Responses of 140 winter wheat varieties to UV-B radiation[J]. Journal of Triticeae Crops, 2017, 37(6): 841-845.
[42] 王育军,周冀衡,张一扬,等. 海拔对烤烟品种NC102和NC297物理特性和化学成分的影响[J]. 中国烟草科学,2015, 36(1): 42-47.
WANG Yujun, ZHOU Jiheng, ZHANG Yiyang, et al. Effect of latitude on physical properties and chemical component of flue-cured tobacco varieties NC102 and NC297 in Kunming[J]. Chinese Tobacco Science, 2015,36(1):42-47.
[43] 李鹏飞,周冀衡,罗华元,等. 增强UV-B辐射对烤烟主要香气前体物及化学成分的影响[J]. 烟草科技,2011(7): 69-75.
LI Pengfei, ZHOU Jiheng, LUO Huayuan, et al. Effects of intensified UV-B radiation on main aroma precursors and chemical components in flue-cured tobacco[J]. Tobacco Science & Technology, 2011(7): 69-75.
Analysis of the tolerance of 22 flue-cured tobacco varieties to enhanced UV-B radiation at seedling stage and screening of identification indices
GU Hao1, ZHANG Jintao2, CHEN Yi3, LI Jialiang1, CAI Xiao1, YANG Zhixin1, WANG Li1, HE Chenggang1*
1 College of Tobacco Science, Yunnan Agricultural University, Kunming 650201, China;2 China Tobacco Hunan Industrial Co., Ltd., Changsha 410007, China;3 Yunnan Academy of Tobacco Agricultural Sciences, Kunming 650021, China
This study aims to evaluate the tolerance of 22 flue-cured tobacco varieties to UV-B radiation at seedling stage and screen the identification indices.Seven growth indices and nine physiological indices of 22 flue-cured tobacco cultivars were measured under natural UV-B radiation (control) and enhanced UV-B radiation (4.60 kJ/m2·d) at seedling stage. Principal component analysis was carried out according to the response indices of each single index to enhanced UV-B radiation, the UV-B radiation tolerance of 22 flue-cured tobacco varieties at seedling stage was comprehensively evaluated by means of membership letter and systematic cluster analysis, and the identification indices of UV-B radiation tolerance of flue-cured tobacco at seedling stage were selected by stepwise regression analysis.Through principal component analysis of 16 single indices, five independent comprehensive indices were obtained. The evaluation value () of enhanced UV-B radiation tolerance of each variety was calculated by membership function method. Using cluster analysis, seven flue-cured tobacco varieties with strong UV-B radiation tolerance, four with medium UV-B radiation tolerance, seven with weak UV-B radiation tolerance and four with relatively weak UV-B radiation tolerance were selected, and the prediction equation of flue-cured tobacco’s tolerance to UV-B radiation at seedling was established by stepwise regression analysis:'=0.510+0.233SFW+0.135SOD+0.114UV-AS+0.113LDM-0.068W-SS+0.073RDM(R=0.974,<0.05). The average predicted accuracy was 95.24%.NC102, Yunyan 87, Yunyan 85, NC82, Zhongyan 201, NC297 and Zhongyan 100 high higher tolerance to UV-B radiation, while Zhongyan 103, Yunyan 201, Yunyan 97 and Yunyan 203 are more sensitive to UV-B radiation. Seedling fresh weight (SFW), sup eroxide dismutase (SOD) activity, UV absorbing substance (UV-AS), leaf dry mass (LDM), water-soluble sugar (W-SS) content and root dry mass (RDM) were selected as the evaluation indices of UV-B radiation resistance of flue-cured tobacco at seedlings.
UV-B radiation; flue-cured tobacco varieties; seedling stage; comprehensive assessment
. Email:chengganghe63@163.com
顾浩,张锦韬,陈颐,等. 22个烤烟品种苗期对增强UV-B辐射的耐性分析及鉴定指标筛选[J]. 中国烟草学报,2022,28(6).GU Hao,ZHANG Jintao,CHEN Yi, et al. Analysis of the tolerance of 22 flue-cured tobacco varieties to enhanced UV-B radiation at seedling stage and screening of identification indices[J]. Acta Tabacaria Sinica, 2022,28(6).doi:10.16472/j.chinatobacco.2022.T0052
湖南中烟工业有限责任公司烟草农业示范与推广科技项目(No.202143000934114);云南省烟草公司科技计划重点项目(No.202053000 0241025)
顾浩(1998—),硕士研究生,烟草生理生化,Tel:0871-65227711,Email:1335527954@qq.com
何承刚(1972—),博士,副教授,烟草化学与烟叶质量评价研究,Tel:0871-65227711,Email:chengganghe63@163.com
2022-03-11;
2022-08-02

