马铃薯块茎末端糖化适应性、稳定性及薯条加工型品种(系)筛选
段惠敏 王 郁 程李香 撒 刚 夏露露 张 峰,,*
马铃薯块茎末端糖化适应性、稳定性及薯条加工型品种(系)筛选
段惠敏1王 郁2程李香3撒 刚3夏露露2张 峰1,3,*
1甘肃农业大学农学院, 甘肃兰州 730070;2甘肃农业大学生命科学技术学院, 甘肃兰州 730070;3甘肃农业大学 / 省部共建干旱生境作物学国家重点实验室/ 甘肃省遗传改良与种质创新重点实验室, 甘肃兰州 730070
油炸薯条需要具有明亮均匀的色泽, 马铃薯生育期内块茎基部或顶部发生的末端糖化会使油炸薯条呈现出褐色末端。分析块茎中与末端糖化相关的成分含量和色泽参数, 结合基因型和基因型与环境互作(genotype + genotype and environment interactions, GGE)模型筛选抗末端糖化薯条加工型品种, 为薯条加工型品种的选育和种植提供理论依据。选择综合农艺性状优良的8个品种(系)分别种植于2个不同生态类型区: 河西灌区(永昌)和高寒阴湿区(渭源)。收获后分别储藏于常温(20℃)、低温(4℃), 分别于15 d和60 d测定块茎基部与顶部的淀粉、果糖、葡萄糖、蔗糖和游离氨基酸含量。炸条后检测薯条基部和顶部色泽, 评价块茎糖化末端类型。分析试点、品种、储藏条件及其互作效应对块茎末端糖化的影响, 结合GGE模型分析参试品种(系)末端糖化的适应性和稳定性。结果表明, 永昌试点中有6个品种(系)块茎出现基部和顶部末端糖化现象, 其中5个基部糖化, 1个顶部糖化。渭源试点中, 9个品种(系)块茎出现基部和顶部末端糖化现象, 其中4个基部糖化, 5个顶部糖化。永昌试点品种(系)基部和顶部色差平均值低, 末端糖化程度较低。方差分析表明, 环境与互作效应是决定块茎顶部和基部末端糖化的首要因素, 而在互作效应中, 环境与基因型互作效应对末端糖化起决定作用。GGE模型表明, 块茎基部成分含量具有比顶部更高的适应性, 块茎蔗糖和游离氨基酸含量稳定性高于淀粉和还原糖。永昌试点适宜种植薯条加工型马铃薯, 渭源试点对末端糖化的鉴别力更精确, 常温储藏能更好鉴别块茎末端糖化, 材料H0940具有末端糖化抗性, 品种甘农薯7号是抗末端糖化的加工型品种。
末端糖化; 块茎成分; 薯条色泽; GGE分析
薯条是马铃薯重要的加工产品之一, 薯条色泽是影响消费者选择的最直观因素。马铃薯块茎发育过程中遭遇环境胁迫或生长受阻时, 部分品种块茎基部或顶部还原糖含量升高导致块茎末端(基部或顶部)糖化, 这种类型的块茎在炸条加工中呈现出明显的褐色末端。分析品种(系)在不同生态类型区和储藏条件(温度和时间)下块茎末端糖化适应性和稳定性, 可以为抗末端糖化的加工型品种选育和薯条加工型品种适宜种植区域选择提供准确的参考依据。前人研究表明引起块茎末端糖化的主要原因有水分亏缺、高温和氮磷肥不足或过量。水分亏缺强度与块茎末端糖化发生率直接相关, 短暂水分亏缺更容易引起块茎末端糖化[1-2], 保水性差的土壤类型容易引起块茎末端糖化的根本原因也是水分亏缺[3]。高温通常是通过引起块茎短暂水分亏缺或土壤干旱胁迫导致末端糖化发生[4-5]。氮磷肥用量不足或过量导致的匍匐茎衰老会导致块茎末端糖化发生率升高[6-10]。末端糖化产生的生理机制主要包括以下4种: (1) 短暂水分亏缺导致植株光合同化物合成和向地下块茎运输减少, 表现为块茎基部还原糖含量增高[11]; (2) 长期水分亏缺导致块茎中淀粉分解回流至匍匐茎和地面植株, 同样表现为块茎基部还原糖含量增高[12-13]; (3) 当水分亏缺解除, 块茎恢复生长时, 碳水化合物从块茎基部向顶部转移也造成块茎基部还原糖含量增高[14]; (4) 高温或水肥不均时, 块茎正常生理功能被破坏, 输入块茎的蔗糖无法合成淀粉, 同时块茎基部淀粉水解增加造成块茎基部还原糖含量增高[13,15-16]。块茎的糖化末端可表现为3种类型: I型糖化末端表现为块茎基部低淀粉高糖, 顶部高淀粉低糖[17]。II型糖化末端表现为基部高淀粉低糖, 顶部低淀粉高糖[17]; III型糖化末端表现为基部高淀粉高糖, 顶部低淀粉低糖[10]。块茎末端糖化产生3种类型主要与胁迫发生的时间和程度有关, 而与胁迫类型无关[3]。研究表明马铃薯末端糖化抗性的广义遗传力约为0.76, 可能以多基因、加性方式遗传[18]。国内外对马铃薯块茎末端糖化的研究主要集中在分析影响其发生的环境因素, 以及应对各种环境胁迫的农艺措施研究方面, 缺少对不同末端糖化基因型与环境互作分析。本研究在对现有薯条加工型品种和高代品系进行田间农艺性状选择基础上, 分析试点、品种、储藏条件及其相互作用对块茎末端糖化及加工色泽造成的影响, 筛选出抗末端糖化的加工型马铃薯品种。
1 材料与方法
1.1 试验材料
本研究的试验材料为引进的国外品种以及研究团队选育品种(系)。供试材料分别于2019—2020年种植在甘肃省定西市渭源县和甘肃省金昌市永昌县。渭源试验点: 平均海拔2450 m、年均降水量680 mm、>10℃年积温2100~2650℃、7月平均日温13~25℃。永昌试验点: 平均海拔1950 m、年均降水量185.1 mm、>10℃年积温2650~2850℃、7月平均日温14~27℃。田间试验采用随机区组设计, 播种50 g切块种薯, 每个品种设3个重复小区, 小区面积为0.7 m × 2.5 m, 行距1 m, 株距0.25 m, 单垄双行, 每行10株。苗期进行覆土固苗, 其余栽培和田间管理措施均按当地统一方法进行, 各地块保持一致。收获时根据薯形、商品率、干物质含量、薯肉颜色、抗病性强弱等田间农艺性状筛选出8份符合炸条品种农艺性状要求的材料, 材料名称及遗传背景见表1。每个重复取10~15个左右大小均匀, 无病斑、无机械损伤的商品薯块茎, 混合均匀后均分储藏。对材料进行3种储藏处理后分析块茎成分, 3种储藏条件分别为15 d常温(15 d, 20℃)、60 d常温(60 d, 20℃)和60 d低温(60 d, 4℃)。

表1 各参试品种(系)系谱及材料来源
1.2 测定指标及方法
1.2.1 农艺性状 块茎洗净晾干, 游标卡尺纵向测定块茎基部至顶部最长处为长度, 记为L; 横向测定块茎最宽处为宽度, 记为W。块茎长宽比=L/W。采用称重法[19]测定商品率, 马铃薯小区块茎重量大于75 g的块茎总重量/小区产量×100%。收获时自然光下评价薯肉颜色, 按最大相似性原则, 将薯肉颜色分为2个类别, 白色和黄色。参照赵艳群等[20]方法鉴定晚疫病抗性。
1.2.2 干物质含量 采用烘干称重法测量。将收获的块茎洗净晾干, 取基部和顶部块茎各50 g, 共100 g, 记为W1, 105℃杀青30 min, 转80℃烘至恒重,称重记为W2。块茎干物质含量=W2/W1×100%。
1.2.3 淀粉含量 参照《马铃薯试验研究方法》[21]测定淀粉含量。取块茎大小均匀的3~5个块茎, 洗净晾干后, 切条机(7 mm × 7 mm)切条。取长度相近的切条, 分离基部和顶部后液氮速冻并用研钵研磨。将研磨至粉状的块茎置于自封袋中, 保存于-80℃冰箱中待测。称取马铃薯块茎基部和顶部冻存粉末各0.5 g, 加入2.0 mL蒸馏水研磨至匀浆, 加入3.2 mL 60%高氯酸酸解, 定容至100 mL。取上清液0.5 mL, 依次加入3.0 mL蒸馏水、2.0 mL碘试剂, 反应后采用紫外分光光度计(T6新世纪, 北京普析通用)测定660 nm波长吸光度。
1.2.4 可溶性糖含量 参照Ohara-Takada等[22]方法测定可溶性糖含量, 称取块茎基部和顶部冻存粉末各2 g, 溶于20 mL 80%乙醇中, 80℃水浴提取1 h, 3400´离心20 min。取上清液真空干燥并溶解于5 mL蒸馏水中, 经0.2 µm滤膜过滤后, 使用高效液相色谱仪(Agilent 1100 series, UV检测器, Amide-80色谱柱)测定滤液中果糖、葡萄糖和蔗糖含量。
1.2.5 游离氨基酸含量 参照Lee等[23]方法测定游离氨基酸含量。取块茎基部和顶部冻存材料各1 g, 加入25 mL 2%乙酸研磨匀浆、过滤备用。将1 mL样品提取液、1 mL蒸馏水、3 mL 0.5%水合茚三酮、0.1 mL 0.1%抗坏血酸加入试管混匀, 沸水浴15 min。迅速流水冷却, 反应液呈蓝紫色时, 用60%乙醇定容至20 mL, 测定570 nm波长下吸光度。
1.2.6 薯条加工及色泽测定 随机取3个大小相近的马铃薯块茎清洗去皮, 切条机(7 mm × 7 mm方盘)切条。每块茎取最长的切条3~5根, 滤纸吸取表面水分, 恒温180℃菜籽油(金龙鱼调和油)油炸4 min, 室温冷却20 min, 每品种取具代表性的6根薯条测定薯条色泽。色泽测定采用美国Hunter Lab D25LT标准色差仪在D65光源下测定亨特指数()。、、值中,值表示明暗(0~100), 0表示最暗, 100表示最亮, 正负值分别代表红和绿, 正负值分别代表黄和蓝[24]。总色差Δ可由公式得出:
Δhunter=[–0)2+–0)2+(–0)2]1/2
0、0和0代表薯条顶部测定值,、、代表薯条基部测定值。



1.2.8 数据统计与分析 每次试验技术性重复3~5次, 数据以平均值±标准误(Mean±SE)表示。利用SPSS 19.0软件进行单因素方差分析, 采用SPSS皮尔逊(Pearson)相关系数进行数据相关性分析, Duncan’s法进行试点和储藏条件内多重比较(<0.05)。Genstat 21.0软件对数据进行GGE适应性和稳定性分析。Origin 2018绘制图表。
2 结果与分析
2.1 不同品种(系)块茎农艺性状
不同品种(系)的长、宽、长宽比、商品率和干物质含量存在显著差异(表2)。各参试材料的块茎长在7.94~12.76 cm之间, 块茎宽在4.93~7.60 cm之间, 除荷混18 (永昌)、H0942 (永昌, 渭源)和H0953 (渭源)以外的其他材料块茎长宽比均大于1.5。各品种(系)商品率均高于80%。除H0951 (渭源)和H0953 (永昌, 渭源)外, 其余材料干物质含量均高于20%。H0953、甘农薯7号和0730-217, 种植在永昌时的块茎长大于渭源种植块茎长; 荷混18、H0953、甘农薯7号和0730-217种植在永昌的块茎宽大于种植在渭源; 除荷混18和H0951外, 其他材料种植在永昌的长宽比均大于种植在渭源。荷混18和0730-217种植在永昌时的商品率高于种植在渭源。除H0942和0730-217外, 其他6份材料种植在永昌时的干物质含量均高于种植在渭源。Shepody、H0953、甘农薯7号和0730-217的薯肉颜色为白色; 荷混18、H0940、H0942和H0951的薯肉颜色表现为黄色。所有材料在2个地点均表现出晚疫病抗性。
2.2 试点、品种及储藏条件对块茎基部和顶部成分含量的影响
2.2.1 试点、品种及储藏条件对块茎基部和顶部淀粉含量的影响 同一试点, 各品种马铃薯块茎基部和顶部的淀粉含量表现差异(图1)。渭源材料在常温储藏15 d后, 0730-217的基部淀粉含量显著高于除荷混18外的其他材料基部淀粉含量(显著水平<0.05, 下同); 荷混18和0730-217的顶部淀粉含量显著高于除Shepody、H0940和甘农薯7号外的其他材料顶部淀粉含量。常温储藏60 d后, 荷混18、H0942、甘农薯7号和0730-217的基部淀粉含量显著高于其他材料; 荷混18和0730-217的顶部淀粉含量显著高于H0942和H0951的顶部淀粉含量。低温储藏60 d后, 荷混18、H0942和0730-217的基部淀粉含量显著高于除H0953和甘农薯7号外的其他材料; 荷混18、H0940、甘农薯7号和0730-217的顶部淀粉含量显著高于除Shepody外的其他材料。永昌材料在常温储藏15 d后, Shepody、H0940、H0942、甘农薯7号和0730-217的基部淀粉含量显著高于其他材料; H0940和H0942的顶部淀粉含量显著高于其他材料。常温储藏60 d后, Shepody、H0940、H0942、甘农薯7号和0730-217的基部淀粉含量高于其他材料; H0940、H0942、H0951和H0953的顶部淀粉含量显著高于其他材料。低温储藏60 d后, Shepody、H0940、H0942、甘农薯7号和0730-217的基部淀粉含量均显著高于其他材料; Shepody、荷混18和0730-217的顶部淀粉含量显著低于其他材料。
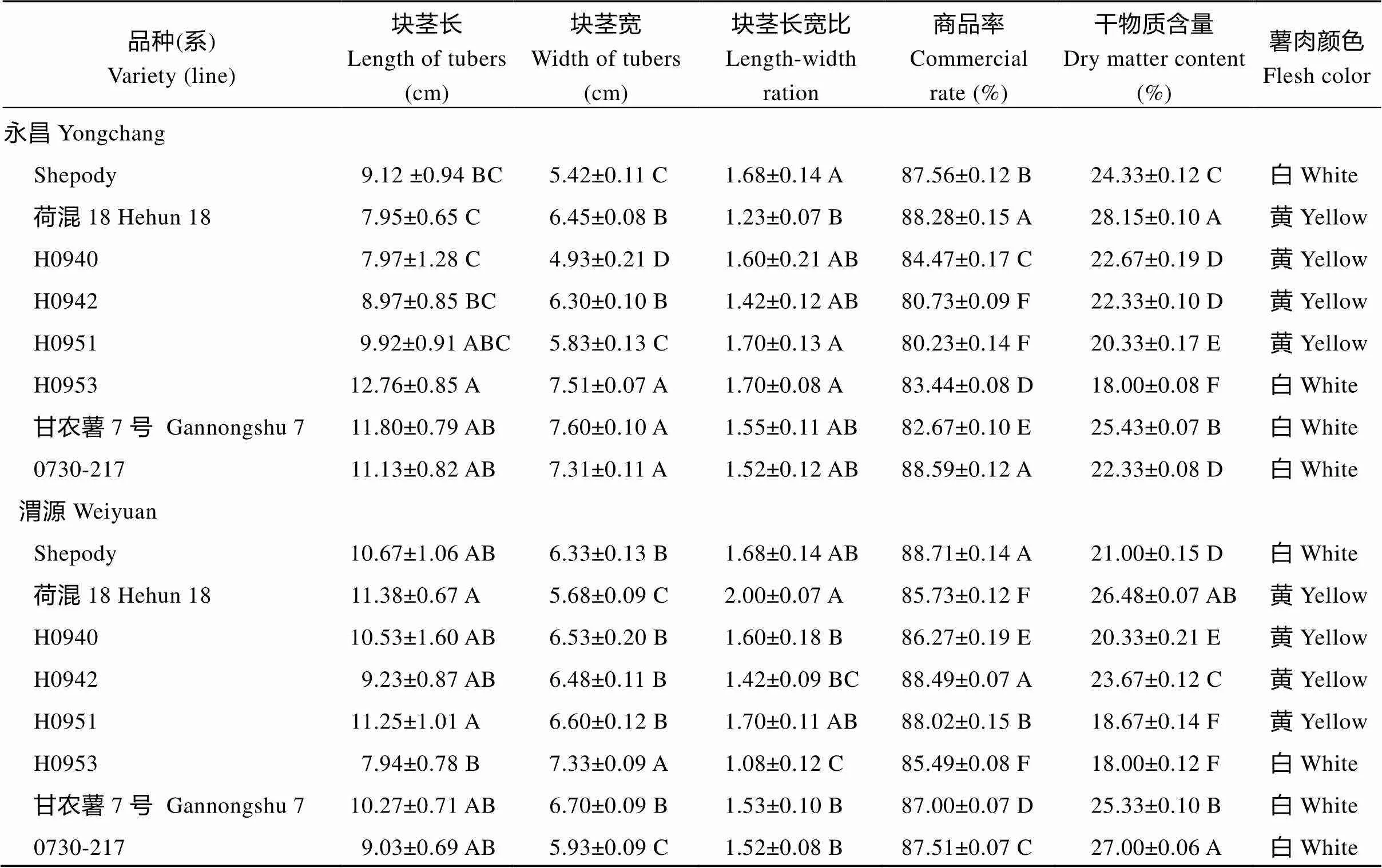
表2 马铃薯品种(系)田间农艺性状
表中不同大写字母表示试点内各品种(系)间存在显著差异(≤ 0.05)。
Different uppercase letters in the table show that there are significant differences between varieties or lines in the location at≤ 0.05.

图1 两试点各品种(系)马铃薯块茎基部与顶部淀粉含量
不同大写字母表示品种(系)间差异显著, 不同小写字母表示品种(系)内块茎部位在不同种植和储藏条件下差异显著(≤ 0.05)。
The Different uppercase letters indicate significant differences among varieties or lines, and lowercase letters indicate significant differences under different planting and storage conditions of tuber parts within varieties or lines at≤ 0.05.
同一品种淀粉含量在不同试点间表现出差异(图1)。常温储藏15 d时, 种植在永昌的Shepody、H0940、H0942和甘农薯7号其基部和顶部淀粉含量均高于渭源种植的同品种材料; 常温储藏60 d时, 永昌种植的Shepody、H0940和甘农薯7号其基部和顶部淀粉含量均高于渭源同品种材料; 低温储藏60 d时, Shepody、H0940和甘农薯7号其基部和顶部淀粉含量均高于渭源同品种材料。
2.2.2 试点、品种及储藏条件对块茎基部和顶部果糖含量的影响 同一试点, 各品种马铃薯块茎基部和顶部的果糖含量表现差异(图2)。渭源材料在常温储藏15 d后, H0942的基部果糖含量显著低于其他材料基部果糖含量; H0942、H0953和甘农薯7号的顶部果糖含量显著低于除H0940外的其他材料顶部果糖含量。常温储藏60 d后, H0942、H0953、甘农薯7号和0730-217的基部果糖含量显著低于除H0951外的其他材料; H0940和甘农薯7号的顶部果糖含量低于除H0942和H0951外的其他材料。低温储藏60 d后, H0942和甘农薯7号的基部果糖含量显著低于除H0951和H0953外的其他材料; H0940和甘农薯7号的顶部果糖含量显著低于除H0942和H0951之外的其他材料。永昌材料在常温储藏15 d后, H0940、H0953和甘农薯7号的基部果糖含量低于其他材料; H0951和甘农薯7号的顶部果糖含量低于其他材料。常温储藏60 d后, H0940和甘农薯7号的基部果糖含量显著低于除H0953外的其他材料; H0951和甘农薯7号的顶部果糖含量低于其他材料。低温储藏60 d后, H0940的基部果糖含量低于其他材料; H0953和甘农薯7号的顶部果糖含量低于其他材料。
同一品种果糖含量在不同试点间表现出差异(图2)。常温储藏15 d时, 种植在永昌的H0942和H0953其基部和顶部果糖含量均高于渭源种植的同品种材料; 常温储藏60 d时, 种植在永昌的H0942其基部和顶部果糖含量均高于渭源种植的同品种材料; 低温储藏60 d时, 种植在永昌的H0942和甘农薯7号其基部和顶部果糖含量均高于渭源种植的同品种材料。
2.2.3 试点、品种及储藏条件对块茎基部和顶部葡萄糖含量的影响 同一试点, 各品种马铃薯块茎基部和顶部的葡萄糖含量表现差异(图3)。渭源材料在常温储藏15 d后, 荷混18、甘农薯7号和0730-217的基部葡萄糖含量低于其他材料; H0953和甘农薯7号的顶部葡萄糖含量低于其他材料。常温储藏60 d后, 甘农薯7号和0730-217的基部葡萄糖含量显著低于除H0942和H0953外的其他材料; H0940的顶部葡萄糖含量低于其他材料。低温储藏60 d后, H0953的基部葡萄糖含量显著低于除H0942和甘农薯7号外的其他材料; H0940的顶部葡萄糖含量低于其他材料。永昌材料在常温储藏15 d后, 荷混18和H0953的基部葡萄糖含量显著低于除甘农薯7号外的其他材料; 甘农薯7号的顶部葡萄糖含量显著低于其他材料。常温储藏60 d后, 荷混18的基部葡萄糖含量显著低于除H0953外其他材料; 甘农薯7号的顶部葡萄糖含量低于其他材料。低温储藏60 d后, 甘农薯7号和H0953的基部葡萄糖含量显著低于除荷混18外的其他材料; 甘农薯7号的顶部葡萄糖含量低于其他材料。
同一品种葡萄糖含量在不同试点间表现差异(图3)。常温储藏15 d时, 种植在永昌的荷混18和H0942基部和顶部葡萄糖含量均高于渭源种植的同品种材料; 常温储藏60 d时, 种植在永昌的H0942和0730-217基部和顶部葡萄糖含量均高于渭源种植的同品种材料; 低温储藏60 d时, 种植在永昌的H0942和H0953基部和顶部葡萄糖含量均高于渭源永昌种植的同品种材料。
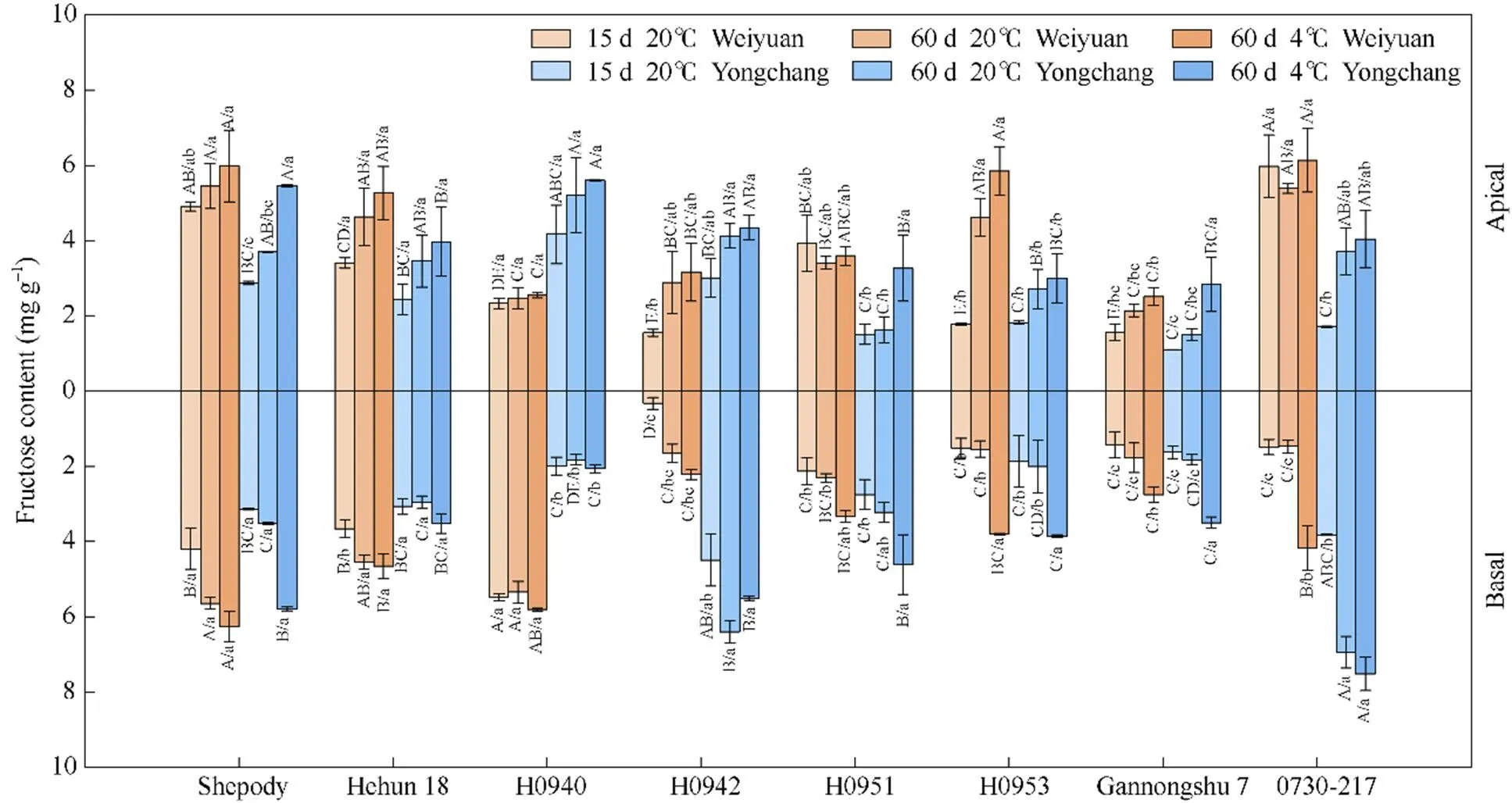
图2 两试点不同品种(系)马铃薯块茎基部与顶部果糖含量
不同大写字母表示品种(系)间差异显著, 不同小写字母表示品种(系)内块茎部位在不同种植和储藏条件下差异显著(≤ 0.05)。
Different uppercase letters indicate significant differences among varieties or lines, and lowercase letters indicate significant differences under different planting and storage conditions of tuber parts within the varieties or lines at≤ 0.05.

图3 两试点不同品种(系)马铃薯块茎基部与顶部葡萄糖含量
不同大写字母表示品种(系)间差异显著, 不同小写字母表示品种(系)内块茎部位在不同种植和储藏条件下差异显著(≤ 0.05)。
Different uppercase letters indicate significant differences among varieties or lines, and lowercase letters indicate significant differences under different planting and storage conditions of tuber parts within the varieties or lines at≤ 0.05.
2.2.4 试点、储藏条件和品种对块茎基部和顶部蔗糖含量的影响 同一试点, 各品种马铃薯块茎基部和顶部的蔗糖含量表现差异(图4)。渭源材料在常温储藏15 d后, H0942的基部蔗糖含量低于其他材料的基部蔗糖含量; 甘农薯7号顶部蔗糖含量显著低于除H0953外的其他材料顶部蔗糖含量。常温储藏60 d后, H0953基部蔗糖含量显著低于其他材料; H0951顶部蔗糖含量显著低于其他材料。低温储藏60 d后, H0953基部蔗糖含量低于其他材料; H0942、H0951和甘农薯7号顶部蔗糖含量低于其他材料。永昌材料在常温储藏15 d后, H0953基部蔗糖含量显著低于其他材料; 甘农薯7号顶部蔗糖含量低于其他材料。常温储藏60 d后, 荷混18基部蔗糖含量显著低于除H0940、H0953和甘农薯7号外的其他材料; 甘农薯7号顶部蔗糖含量低于其他材料。低温储藏60 d后, 荷混18和H0953基部蔗糖含量低于其他材料; 甘农薯7号和0730-217顶部蔗糖含量低于其他材料。
同一品种蔗糖含量在不同试点间表现差异(图4)。常温储藏15 d时, 永昌种植的H0951基部和顶部蔗糖含量均高于渭源种植的同品种材料; 常温储藏60 d时, 永昌种植的H0942和H0951基部和顶部蔗糖含量均高于渭源的同品种材料; 低温储藏60 d时, 永昌种植的H0942和H0951基部和顶部蔗糖含量均高于渭源的同品种材料。
2.2.5 试点、储藏条件和品种对块茎基部和顶部游离氨基酸含量的影响 试点和品种显著影响马铃薯块茎中游离氨基酸的含量及分布(图5)。渭源材料在常温储藏15 d后, H0940基部游离氨基酸含量显著低于其他材料的基部游离氨基酸含量; H0940和0730-217顶部游离氨基酸含量显著低于其他材料的顶部游离氨基酸含量。常温储藏60 d后, 0730-217基部游离氨基酸含量显著低于其他材料; H0940、甘农薯7号和0730-217顶部游离氨基酸含量显著低于其他材料。低温储藏60 d后, 0730-217的基部和顶部游离氨基酸含量均显著低于其他材料。永昌材料常温储藏15 d后, 荷混18基部游离氨基酸含量显著低于其他材料; 荷混18顶部游离氨基酸含量显著低于除H0953和0730-217外的其他材料。常温储藏60 d后, 荷混18的基部和顶部游离氨基酸含量均显著低于其他材料。低温储藏60 d后, 荷混18的基部游离氨基酸含量显著低于其他材料; 荷混18的顶部游离氨基酸含量显著低于除H0951外的其他材料。
同一品种游离氨基酸含量在不同试点间表现差异(图5)。常温储藏15 d后, 种植在永昌的H0940和0730-217基部和顶部游离氨基酸含量均高于渭源种植的同品种材料; 常温储藏60 d后, 种植在永昌的H0940和0730-217基部和顶部游离氨基酸含量均高于渭源种植的同品种材料; 低温储藏60 d后,种植在永昌的Shepody、甘农薯7号和0730-217基部和顶部游离氨基酸含量均高于渭源种植的同品种材料。

图4 两试点不同品种(系)马铃薯块茎基部与顶部蔗糖含量
不同大写字母表示品种(系)间差异显著, 不同小写字母表示品种(系)内块茎部位在不同种植和储藏条件下差异显著(≤ 0.05)。
Different uppercase letters indicate significant differences among varieties or lines, and lowercase letters indicate significant differences under different planting and storage conditions of tuber parts within the varieties or lines at≤ 0.05.
不同大写字母表示品种(系)间差异显著, 不同小写字母表示品种(系)内块茎部位在不同种植和储藏条件下差异显著(≤ 0.05)。
Different uppercase letters indicate significant differences among varieties or lines, and lowercase letters indicate significant differences under different planting and storage conditions of tuber parts within the varieties or lines at≤ 0.05.
2.2.6 不同品种(系)马铃薯经储藏后炸条色泽分析
参试材料炸后薯条色泽分析表明, 试点、储藏条件以及品种(系)对薯条色泽造成明显影响(图6和图7)。常温储藏15 d, 渭源材料基部与顶部色差平均值为5.09, 甘农薯7号基部与顶部色差值最小, 仅有1.19, 0730-217最大, 为9.15; 永昌材料色差平均值为5.71, 色差值最小的材料是甘农薯7号, 为2.44, 0730-217最大, 为10.71。常温储藏60 d, 渭源材料的色差平均值为5.08, 甘农薯7号最小, 为2.44, 荷混18最大, 为7.08; 永昌材料色差平均值为4.58, 甘农薯7号最小, 为2.31, H0951最大, 为6.17。低温储藏60 d后, 渭源材料平均值为5.02, 甘农薯7号最小, 为3.68, Shepody最大, 为7.61; 永昌材料平均值为4.28, 甘农薯7号最小, 为2.16, H0953最大, 为6.86。
2.2.7 马铃薯品种(系)薯条炸后色泽与块茎成分的相关性分析 综合8份材料在2个试点3种储藏条件下基部和顶部的成分含量及材料炸后色泽亨特指数的相关性分析(表3)表明, 代表明和暗的与果糖、蔗糖分别呈显著正相关和显著负相关, 与葡萄糖和游离氨基酸无显著相关。代表红和绿的值与蔗糖呈显著负相关, 与果糖、葡萄糖和游离氨基酸无显著相关。代表黄和蓝的值与葡萄糖和蔗糖分别呈显著正相关和极显著负相关, 与果糖和游离氨基酸含量无显著相关性。色差值与果糖含量呈极显著负相关, 与蔗糖呈显著负相关, 与葡萄糖和游离氨基酸含量无显著相关性。
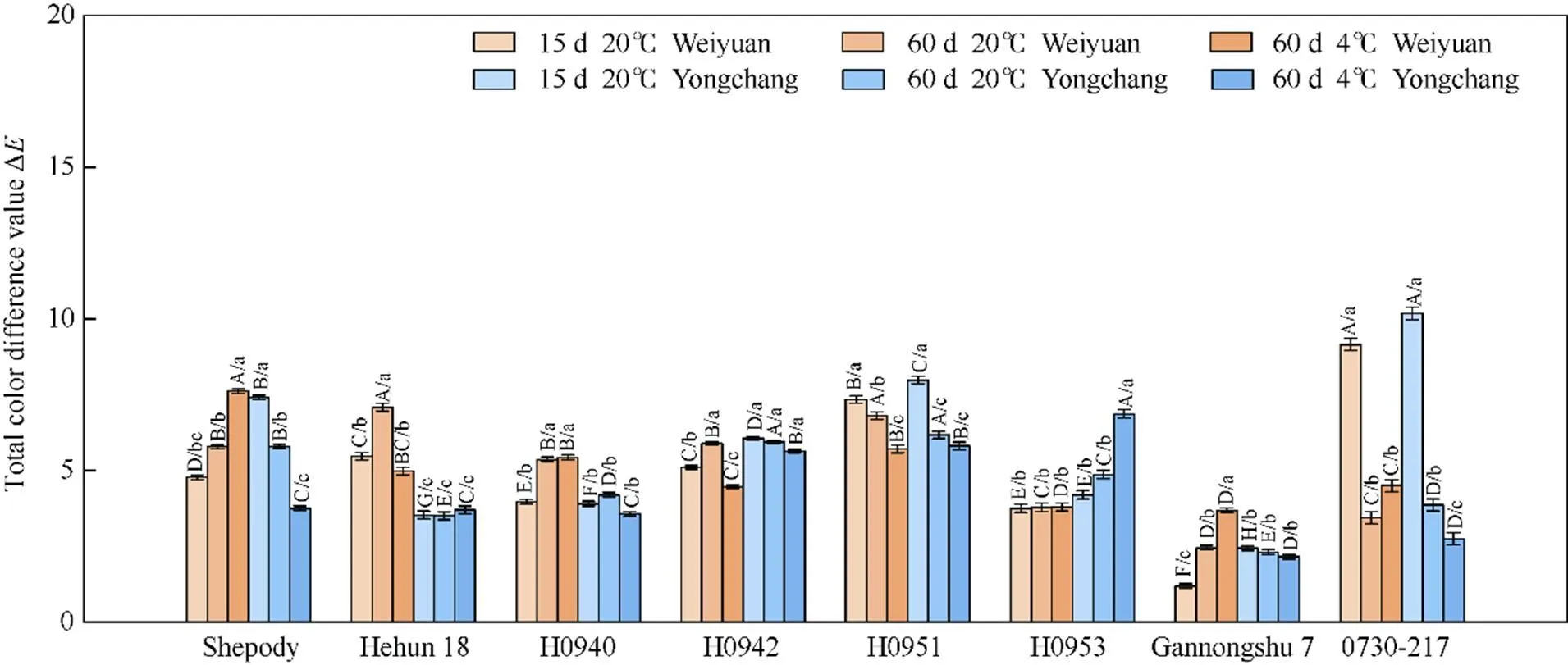
图6 两试点不同品种(系)马铃薯经储藏炸后基部和顶部色泽差异
不同大写字母表示品种(系)间差异显著, 不同小写字母表示品种(系)在不同种植和储藏条件下差异显著(≤ 0.05)。
Different uppercase letters indicate significant differences among varieties or lines, and lowercase letters indicate significant differences under different planting and storage conditions of varieties or lines planted in two locations at≤ 0.05.

图7 马铃薯品种(系)炸后色泽

表3 炸后马铃薯色泽亨特指数与块茎成分的相关性分析
**:≤ 0.01;*:≤ 0.05.
2.2.8 方差分析 试点、品种、储藏条件及其互作效应对马铃薯块茎中不同部位的成分含量造成显著影响(表4)。基部淀粉和顶部淀粉的互作效应方差平方和占总方差平方和的比例分别为64.65%和43.66%, 其中基因型与试点互作分别占比19.84%和11.31%、基因型与储藏互作分别占比26.70%和22.07%、三者互作效应分别占比17.52%和10.27%; 基部和顶部还原糖(葡萄糖、果糖)的互作效应方差平方和占总方差平方和的比例分别为50.75%和39.94%, 其中基因型与试点互作分别占比19.62%和19.61%、基因型与储藏互作分别占比7.49%和13.22%、三者互作效应分别占比23.55%和6.84%; 基部蔗糖和顶部蔗糖的互作效应方差平方和占总方差平方和的比例分别为53.25%和60.92%, 其中基因型与试点互作分别占比22.15%和27.01%、基因型与储藏互作分别占比11.41%和19.45%、三者互作效应分别占比19.55%和13.89%; 基部游离氨基酸和顶部游离氨基酸的互作效应方差平方和占总方差平方和的比例分别为57.55%和59.89%, 其中基因型与试点互作分别占比37.08%和27.06%、基因型与储藏互作分别占比10.17%和26.15%、三者互作效应分别占比9.18%和6.45%。

表4 马铃薯块茎成分方差分析

(续表4)
2.2.9 块茎成分含量适应性GGE双标图分析 根据基因型-环境的互作效应对试点分组构成GGE适应性双标图的多边形图(图8-A~D), 同一方向上距离原点最远的基因型连接成多边形, 可将所有基因型都包括在内。通过从原点到多边形各边垂线将双标图分成若干扇区, 试点落在扇区中不同区域, 越多试点落在某一扇区内则代表该扇区包含的基因型具有越强的适应性, “角顶”基因型则代表具有该扇区内最高的含量, 扇区中无试点表示该扇区内各基因型在所有试点中表现均不是最佳(图8-A~D)。淀粉GGE适应性双标图中(图8-A), 2、7、1、3、10和5连接成多边形, 甘农薯7号基部淀粉含量在3种条件下最高, 适应性最好; Shepody和荷混18分别在2个条件和1个条件下基部淀粉含量最高, 适应性次之; 0730-217的基部淀粉含量落在多边形边线上, 属于4种条件下均高适应性材料。还原糖GGE适应性双标图中(图8-B), 1、9、2、6和8构成多边形, Shepody基部还原糖含量在渭源3种条件下最高; 0730-217基部还原糖含量永昌3种条件下最高; Shepody和0730-217适应性无显著差异。蔗糖GGE适应性双标图中(图8-C), 11、1、8、4、6和15构成多边形, 0730-217基部蔗糖含量在3种条件下最高, 适应性最好; H0940顶部蔗糖含量在2种条件下最高, 适应性次之。游离氨基酸GGE适应性双标图中(图8-D), 5、4、2、10、16和8构成多边形, H0951基部游离氨基酸含量在3种条件下最高, 适应性最好; 荷混18基部游离氨基酸含量在1种条件下最高, 适应性次之。
2.2.10 块茎成分含量稳定性GGE双标图分析
抗末端糖化的理想品种(系)应保证基部和顶部均高淀粉低还原糖, 并具有高稳定性。以单向箭头从原点指向平均环境作为平均环境轴(average environment axis, AEA), 箭头所指方向代表具有高的物质含量, 以与AEA轴垂直方向的双向箭头为纵轴, 箭头所指方向代表不稳定性, 越接近AEA轴, 基因型稳定性越高, AEA轴与纵轴共同构成平均环境坐标(average environment coordination, AEC) (图9-A~D)。淀粉GGE稳定性双标图(图9-A)中, 甘农薯7号和H0942的基部淀粉含量稳定性较高, 荷混18、H0942和甘农薯7号的顶部淀粉含量稳定性较高; 还原糖GGE稳定性双标图(图9-B)中, H0953和甘农薯7号的基部还原糖含量稳定性较高, H0951和甘农薯7号的顶部还原糖含量稳定性较高; 蔗糖GGE稳定性双标图(图9-C)中, 荷混18、H0953和甘农薯7号的基部蔗糖含量稳定性较高, 荷混18和0730-217的顶部蔗糖含量稳定性较高; 游离氨基酸GGE稳定性双标图(图9-D)中, Shepody、H0940和甘农薯7号的基部游离氨基酸含量稳定性较高, Shepody、H0940和甘农薯7号的顶部游离氨基酸含量稳定性较高。

图8 马铃薯块茎各成分含量适应性GGE双标图分析
A: 淀粉; B: 还原糖; C: 蔗糖; D: 游离氨基酸。
A: starch; B: reducing sugar; C: sucrose; D: free amino acids.

图9 马铃薯块茎各成分含量稳定性GGE双标图分析
A: 淀粉; B: 还原糖; C: 蔗糖; D: 游离氨基酸。
A: starch; B: reducing sugar; C: sucrose; D: free amino acids.
3 讨论
薯条加工型品种缺乏是限制国内马铃薯加工业发展的关键因素。薯条加工型品种是各类加工品种中需要聚合最多优异农艺性状的类型, 需要对各农艺性状进行详细分解并在品种(系)选择中进行性状的适应性和稳定性筛选。而目前国内审定和登记的薯条加工型品种在生产实践中因为薯形、还原糖含量、色泽、风味、质地等因素的不稳定均没有在加工企业中得到大规模应用。薯条加工型品种色泽适应性和稳定性中重要的一个分解性状就是抗末端糖化[26-27], 其表现为炸条后薯条两端呈现出不同的色泽, 实质是块茎两端的还原糖含量存在差异, 这类块茎两端还原糖含量差异显著并超过加工标准的品种(系)应在品种选育中淘汰。分析薯条加工型品种(系)在不同试点、储藏条件下块茎两端的还原糖含量、色泽等末端糖化形成因子的适应性和稳定性是选育薯条加工型品种(系)的重要环节。
马铃薯块茎基部和顶部末端糖化类型受试点和储藏条件影响。2个试点生态类型不同, 参试品种(系)块茎基部和顶部末端糖化程度的适应性和稳定性不同。8份材料3种储藏条件下, 渭源试点中共9个材料出现基部和顶部末端糖化现象, 其中4个材料块茎基部糖化, 5个材料顶部糖化。永昌试点中有6个材料出现基部和顶部末端糖化现象, 其中5个材料块茎基部糖化, 1个材料顶部糖化。参试材料的淀粉和还原糖含量的基因型效应分别占总变异的11.38%和15.72%; 环境和互作效应之和分别占总变异的24.14%和25.17%; 互作效应中, 环境与基因型互作分别占总变异的10.45%和14.80%, 基因型和环境与基因型互作是影响块茎淀粉和还原糖含量的主要因素。顶部和基部还原糖含量的基因型效应分别占总变异的14.47%和23.12%; 环境和互作效应之和分别占总变异的27.13%和43.78%, 其中环境与基因型互作占总变异的19.61%和19.62%; 环境与互作效应是决定块茎顶部和基部末端糖化的首要因素, 而在互作效应中, 环境与基因型互作效应对末端糖化起决定作用。参试材料的基部或顶部末端糖化, 根本原因是参试材料块茎末端对试点生态类型适应性不强, 而在2个试点均未发生末端糖化的参试材料则具有较好的稳定性。
低温储藏后品种(系)发生低温糖化, 参试材料基部和顶部在低温储藏下的适应性差异造成块茎末端糖化。常温储藏的糖化末端主要发生在储藏15~60 d, 常温储藏15 d后, 6个材料出现基部或顶部末端糖化现象; 常温储藏60 d后, 7个材料出现末端糖化现象; 低温4℃储藏60 d后, 只有2个材料分别发生基部和顶部糖化。参试材料还原糖含量除受基因型效应影响较大外, 储藏及互作效应同样影响还原糖含量, 储藏及互作效应占总变异的17.82%; 储藏、基因型与试点三者互作效应占总变异的9.78%; 储藏、基因型与试点三者互作效应是影响还原糖含量的重要因素。顶部还原糖含量中, 储藏与互作效应占总变异的27.10%; 基部还原糖含量中, 储藏与互作效应占总变异的33.78%; 储藏条件是决定块茎基部糖化的主要因素, 而顶部受储藏影响相比基部较小。相比常温储藏, 低温储藏下各品种基部与顶部色差平均值显著下降, 末端糖化现象在色差数据上表现减轻的原因主要是低温储藏过程中已发生末端糖化的块茎更易受低温影响[28-29], 使未发生末端糖化的块茎一端发生低温糖化增加该部位还原糖含量[30], 引起基部与顶部色差值减小。相关性分析表明还原糖中果糖与薯条基部和顶部的色差值相关性更高。马铃薯品种块茎末端糖化的实质是块茎淀粉和还原糖含量及分布受试点、储藏及其互作效应影响。马铃薯块茎成份含量适应性和稳定性受基因型以及块茎不同部位影响显著, 不同品种块茎基部淀粉、还原糖、蔗糖和游离氨基酸含量具有广泛适应性, 顶部和基部蔗糖和游离氨基酸含量具有稳定性。评价试点和储藏条件是有效提高筛选品种抗末端糖化效率的重要方法。经过3种储藏处理后, 渭源试点的材料同时存在I和II型糖化末端, 而永昌试点仅在常温储藏后存在I和II型糖化末端。III型糖化末端在2个试点3种储藏条件下均能观察到。渭源试点材料储藏后糖化末端类型多样化, 永昌试点材料末端糖化程度更低。低温储藏时, 末端糖化的表现程度及类型受到低温糖化影响, 常温储藏鉴定末端糖化抗性可以避免低温糖化的影响。
4 结论
马铃薯块茎末端糖化发生率和表现程度受到基因型、试点、储藏条件及其互作效应的影响, 渭源试点对末端糖化的鉴别力更精确, 永昌试点的生态类型更适合薯条加工品种的种植, 常温储藏能更好鉴别块茎末端糖化。甘农薯7号和H0940是具有末端糖化抗性的薯条加工品种(系)。
[1] Djaman K, Irmak S, Koudahe K, Allen S. Irrigation management in potato (L.) production: a review., 2021, 13: 1504.
[2] Wagg C, Hann S, Kupriyanovich Y, Li S. Timing of short period water stress determines potato plant growth, yield and tuber quality., 2021, 247: 106731.
[3] Thompson A L, Love S L, Sowokinos J R, Thornton M K, Shock C C. Review of the sugar end disorder in potato (L.)., 2008, 85: 375–386.
[4] Zommick D H, Knowles L O, Pavek M J, Knowles N R. In-season heat stress compromises postharvest quality and low-temperature sweetening resistance in potato (L.)., 2014, 239: 1243–1263.
[5] Busse J S, Wiberley-Bradford A E, Bethke P C. Transient heat stress during tuber development alters post-harvest carbohydrate composition and decreases processing quality of chipping potatoes., 2019, 99: 2579–2588.
[6] Muleta H D, Aga M C. Role of nitrogen on potato production: a review., 2019, 7: 36–42.
[7] Naumann M, Koch M, Thiel H, Gransee A, Pawelzik E. The importance of nutrient management for potato production part II: Plant nutrition and tuber quality., 2020, 63: 121–137.
[8] Kumar P, Pandey S, Singh S, Kumar D, Singh B, Singh S, Rawal S, Meena R. Influence of N and K rates on yield and quality of chipping variety Kufri Chipsona-3., 2012, 39: 191–196.
[9] Gawish R A, Ali F A, Midan S A, Taha M A. CO2evolution and chemical constituents of leaves and tubers of potato plants as influenced by organic compost and mineral N-fertilizers applied individually or in different combination rates along with seaweed extract., 2012, 8: 1993–2009.
[10] Sabba R P, Bussan A J, Michaelis B A, Hughes R, Drilias M J, Glynn M T. Effect of planting and vine-kill timing on sugars, specific gravity and skin set in processing potato cultivars., 2007, 84: 205–215.
[11] Rosen C, Sun N, Olsen N, Thornton M, Pavek M, Knowles L, Knowles N R. Impact of agronomic and storage practices on acrylamide in processed potatoes., 2018, 95: 319–327.
[12] Grudzińska M, Boguszewska-Mańkowska D, Zarzyńska K. Drought stress during the growing season: changes in reducing sugars, starch content and respiration rate during storage of two potato cultivars differing in drought sensitivity., 2021, 207: 12498.
[13] Wang Y, Bethke P C, Drilias M J, Schmitt W G, Bussan A J. A multi-year survey of stem-end chip defect in chipping potatoes (L.)., 2015, 92: 79–90.
[14] 乔焕焕, 李红兵, 郑太波, 邓西平. 干旱与复水对马铃薯块茎膨大期碳氮转运的影响. 干旱地区农业研究, 2019, 37(4): 154–162.
Qiao H H, Li H B, Zheng T B, Deng X P. Effects of drought stress and rehydration on carbon and nitrogen translocation in potato tuber swelling stage., 2019, 37(4): 154–162 (in Chinese with English abstract).
[15] Rykaczewska K. The effect of high temperature occurring in subsequent stages of plant development on potato yield and tuber physiological defects., 2015, 92: 339–349.
[16] Abbas H, Ranjan R S. Effect of soil moisture deficit on marketable yield and quality of potatoes., 2015, 57: 25–37.
[17] Bandana, Sharma V, Kaushik S K, Singh B, Raigond P. Variation in biochemical parameters in different parts of potato tubers for processing purposes., 2016, 53: 2040–2046.
[18] Sowokinos J R. Potato Biology and Biotechnology. Amsterdam: Elsevier Science BV, 2007. pp 501–523.
[19] 余斌. 引进马铃薯种质资源表型多样性分析及块茎品质的综合评价. 甘肃农业大学博士学位论文, 甘肃兰州, 2018.
Yu B. Genetic Diversity Analysis of Phenotypic Traits and Comprehensive Assessment of Tuber Quality in Introduced Potato Germplasm Resources. PhD Dissertation of Gansu Agricultural University, Lanzhou, Gansu, China, 2018 (in Chinese with English abstract).
[20] 赵艳群, 武奇伟, 任飞娥, 赵金瑞, 赵文忠. 马铃薯品种对早疫病、晚疫病和疮痂病的田间抗性评价. 中国马铃薯, 2021, 35(2): 164–169.
Zhao Y Q, Wu Q W, Ren F E, Zhao J R, Zhao W Z. Evaluation on field resistance of potato varieties to early blight, late blight and scab., 2021, 35(2): 164–169 (in Chinese with English abstract).
[21] 张永成, 田丰. 马铃薯试验研究方法. 北京: 中国农业科学技术出版社, 2007. pp 166–169.
Zhang Y C, Tian F. Potato Experimental Research Method. Beijing: China Agricultural Science and Technology Press, 2007. pp 166–169 (in Chinese).
[22] Ohara-Takada A, Matsuura-Endo C, Chuda Y, Ono H, Yada H, Yoshida M, Kobayashi A, Tsuda S, Takigawa S, Noda T. Change in content of sugars and free amino acids in potato tubers under short-term storage at low temperature and the effect on acrylamide level after frying., 2005, 69: 1232–1238.
[23] Lee Y P, Takahashi T. An improved colorimetric determination of amino acids with the use of ninhydrin., 1966, 14: 71–77.
[24] 刘娟, 梁延超, 余斌, 李成, 王玉萍, 程李香, 张峰. 马铃薯薯条色泽和质地特性及薯条加工型品系筛选. 中国农业科学, 2017, 50: 4247–4265.
Liu J, Liang Y C, Yu B, Li C, Wang Y P, Cheng L X, Zhang F. Screening for French fries processing potato lines according to colour qualities and texture properties., 2017, 50: 4247–4265 (in Chinese with English abstract).
[25] 叶夕苗, 程鑫, 安聪聪, 袁剑龙, 余斌, 文国宏, 李高峰, 程李香, 王玉萍, 张峰. 马铃薯产量组分的基因型与环境互作及稳定性. 作物学报, 2020, 46: 354–364.
Ye X M, Cheng X, An C C, Yuan J L, Yu B, Wen G H, Li G F, Cheng L X, Wang Y P, Zhang F. Genotype × environment interaction and stability of yield components for potato lines., 2020, 46: 354–364 (in Chinese with English abstract).
[26] Tajner-Czopek A, Kita A, Rytel E. Characteristics of French fries and potato chips in aspect of acrylamide content-methods of reducing the toxic compound content in ready potato snacks., 2021, 11: 3943.
[27] 王郁, 程鑫, 叶夕苗, 程李香, 李高峰, 文国宏, 王玉萍, 张峰. 不同品系马铃薯块茎末端糖化差异分析.中国粮油学报, 2020, 35(7): 22–27.
Wang Y, Cheng X, Ye X M, Cheng L X, Li G F, Wen G H, Wang Y P, Zhang F. Analysis of sugar-end differences of potato tubers in different lines., 2020, 35(7): 22–27 (in Chinese with English abstract).
[28] Herman D J, Knowles L O, Knowles N R. Heat stress affects carbohydrate metabolism during cold-induced sweetening of potato (L.)., 2017, 245: 563–582.
[29] Herman D J, Knowles L O, Knowles N R. Low oxygen storage modulates invertase activity to attenuate cold-induced sweetening and loss of process quality in potato (L.)., 2016, 121: 106–117.
[30] Liu X, Chen L, Shi W, Xu X, Li Z, Liu T, He Q, Xie C, Nie B, Song B. Comparative transcriptome reveals distinct starch- sugar interconversion patterns in potato genotypes contrasting for cold-induced sweetening capacity., 2021, 334: 127550.
Tuber sugar-end adaptability, stability, and screening of French fries processing varieties in potato
DUAN Hui-Min1, WANG Yu2, CHENG Li-Xiang3, SA Gang3, XIA Lu-Lu2, and ZHANG Feng1,3,*
1College of Agriculture, Gansu Agricultural University, Lanzhou 730070, Gansu, China;2College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, Gansu, China;3State Key Laboratory of Aridland Crop Science / Gansu Key Laboratory of Crop Improvement & Germplasm Enhancement, Gansu Agricultural University, Lanzhou 730070, Gansu, China
French fries need to have a bright and uniform color in the process of potato processing. Potato tuber sugar-end would make the fried fries brown ends. Screening the French fries processing varieties with sugar-end resistance by analyzing component content and color parameters related to sugar-end in the tuber and combining the genotype + genotype and environment interactions (GGE) model would provide a theoretical basis for the selection and planting of French fries processing varieties. Eight varieties (lines) with excellent comprehensive agronomic traits were selected and planted in two different ecological areas of Hexi irrigation area (Yongchang) and Alpine humid area (Weiyuan). After harvest, the tubers were stored at room temperature (20℃) and low temperature (4℃), respectively. Then, the contents of starch, fructose, glucose, sucrose, and free amino acids at the basal and apical tubers were measured after 15 days and 60 days storage. The color of basal and apical ends of French fries was measured for evaluating tuber sugar-end type. Meanwhile, the effects of locations, varieties, storage conditions, and their interactions on tuber sugar-end were analyzed. Combining with the GGE model, the adaptability and stability of the tested varieties showed that six varieties had tuber sugar-end in Yongchang, among which five varieties were basal sugar-end and one variety was apical sugar-end. In Weiyuan, nine varieties had tuber sugar-end, among which four varieties were basal sugar-end and five varieties were apical sugar-end. The low color difference at the basal and apical ends of potato varieties indicated that the sugar-end degree was low in Yongchang location. The variance analysis indicated that the environment and interaction effects were the primary factors that determined tuber sugar-end. Among the interaction effects, the interaction between environment and genotype played a role in determining sugar-end. The GGE model revealed that the composition of basal ends was higher adaptability than the apical end of tubers. Moreover, the sucrose and free amino acids of tubers were higher stability than starch and reducing sugar in each location. The suitable location for planting fries processing potatoes was Yongchang, and more accurately discriminability location for the tuber sugar-end was Weiyuan. The sugar-end varieties can be better identified under room temperature storage. In conclusion, H0940 was a material with sugar-end resistance and Gannongshu 7 was a processing variety with sugar-end resistance.
sugar-end; tuber components; French fries color; GGE analysis
10.3724/SP.J.1006.2023.24024
本研究由甘肃省科技重大专项计划项目(21ZD11NA002)甘肃省抗病优质高效系列专用马铃薯品种创新与示范推广(GNKJ-2020-1)和甘肃省中央引导地方科技发展专项资金资助。
This study was supported by the Gansu Province Science and Technology Key Project (21ZD11NA002), the Gansu Province Disease Resistance, Quality and Efficiency Special Potato Varieties Innovation and Demonstration Expansion Project (GNKJ-2020-1), and the Gansu Province Central Government Guides Local Science and Technology Development Special Fund Project.
通信作者(Corresponding author):张峰, E-mail: zhangf@gsau.edu.cn
E-mail: 1273475789@qq.com
2022-01-19;
2022-05-05;
2022-05-27.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220526.1159.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

