老芒麦、加拿大披碱草及其杂交一代根际土壤细菌群落结构和多样性
王伶瑞,红 雨,2,李慧玲,李景环
(1.内蒙古师范大学生命科学与技术学院,内蒙古 呼和浩特 010022;2.内蒙古自治区高等学校生物多样性保护与可持续利用重点实验室,内蒙古 呼和浩特 010022)
土壤微生物在提高土壤养分转化与循环、系统稳定性、抗干扰的能力水平以及资源可持续利用中都发挥着重要作用[1]。土壤微生物一方面可以预测土壤环境的变化,另一方面也可作为评估土壤质量和土壤恢复性能的一项关键指标[2-8]。加拿大披碱草(Elymus canadensis L.)与老芒麦(Elymus sibiricus Linn.)均为披碱草属植物,是我国生态建设和畜牧业发展中具有耐寒、耐旱能力的高产优质牧草品种[9-12],在云锦凤教授的指导下,已获得一批具有重要育种价值的加拿大披碱草与老芒麦杂交后代[13-16],其抗逆性和适应性均有所提高。不同的植物种类会导致根际土壤微生物群落及养分发生变化,从而对植物生物量产生较大影响。因此,研究不同种类植物的土壤微生物群落及养分变化,对于牧草的种植和改良具有一定意义。
本试验以老芒麦、加拿大披碱草及老芒麦(父本)×加拿大披碱草(母本)杂交一代的根际土壤为研究对象,采用Illumina MiSeq测序平台,对3种类型土壤16S rRNA基因进行测序分析,并对内蒙古地区沙壤质暗栗钙土中种植老芒麦、加拿大披碱草及老芒麦×加拿大披碱草杂交一代的根际土壤细菌分布进行分析,旨在揭示环境因子对根际土壤细菌的影响,从而为提升土壤品质及推动生态系统的可持续发展提供理论依据。
1 材料和方法
1.1 试验方法
1.1.1 样品的采集
于2014年在内蒙古农业大学南校区种植了老芒麦、加拿大披碱草和老芒麦(父本)×加拿大披碱草(母本)杂交一代(用分蘖苗移栽)。种植方式为播种,每种植物种植面积为30 m2(3 m×10 m),株距为40 cm。2021年9月下旬在种植老芒麦、加拿大披碱草和老芒麦×加拿大披碱草杂交一代的试验地中采用随机取样法各选取6个采样点,用取土钻采集结皮下层5 cm土壤装入样品袋,以备测定土壤化学指标。将地表植物落叶除去,沿根系生长的方向将其全部挖出,轻轻抖动根系,再挑选粘有土壤的根放入灭菌的离心管中,此时根附着的土壤为根际土[17]。将得到的根及根际土置于-80℃保存备用[18]。将老芒麦、加拿大披碱草和老芒麦×加拿大披碱草杂交一代的结皮下层土壤分别标记为L、J、F,试验重复6次(每个采样点为1次重复),各重复土样依次命名为L1~L6、J1~J6、F1~F6。
1.1.2 土壤化学指标测定
将采集的结皮下层5 cm土样晾干,按液土比2.5 mL/g(25 mL溶液中加入10 g土)的比例用0.01 mol/L氯化钙溶液浸提,充分搅拌后静置30 min,用pH计测定pH值[19]。速效磷含量测定方法为0.5 mol/L NaHCO3法,速效氮含量测定方法为碱解扩散法,有机质含量测定方法为外加热法[20]。
1.1.3 样品总DNA的提取及高通量测序
称取不同采样点的植物根际土壤各0.5 g,依照土壤DNA提取试剂盒说明书提取样品总DNA,每个样品3次重复,将每次所得的DNA分别混匀,置于-80℃冰箱保存备用[21-25]。
以得到的DNA溶液为模板,采用16S rRNA基因V3~V4区域通用引物338F和806R进行PCR扩增,以反应体系1(表1)配制反应溶液[26-27]。PCR反应条件:94℃3 min;94℃30 s,55℃45 s,72℃2 min,30个循环;72℃10 min。扩增的PCR产物经1%琼脂糖(加核酸染料0.01%)电泳检测后,送至上海美吉生物医药科技有限公司,基于Illumina MiSeq测序平台进行高通量测序和分析[21,26]。MiSeq流程包括:环境基因组DNA提取及检测、PCR扩增、MiSeq文库构建和MiSeq测序[22]。

表1 反应体系1
1.2 多样性分析、相关性分析及稀释性曲线
Alpha多样性分析与相关性分析均通过美吉生物云信息平台进行分析。物种Venn图分析通过R语言(version 3.3.1)工具统计和作图。稀释性曲线选择97%相似度的OTU或其他分类学水平,利用mothur软件在随机抽样下进行Alpha多样性指数的计算,利用R语言工具制作曲线图[23]。
多样性指数的计算方法
Chao1:常用来估计物种总数,本试验分析使用计算公式如下

式中,SChao1为估计的OTU数;Sobs为实际观测到的OTU数;n1为只含有一条序列的OTU数目;n2为只含有两条序列的OTU数目。
ACE:用来估计群落中OTU数目的指数,常用来估计物种总数,本试验分析使用计算公式如下
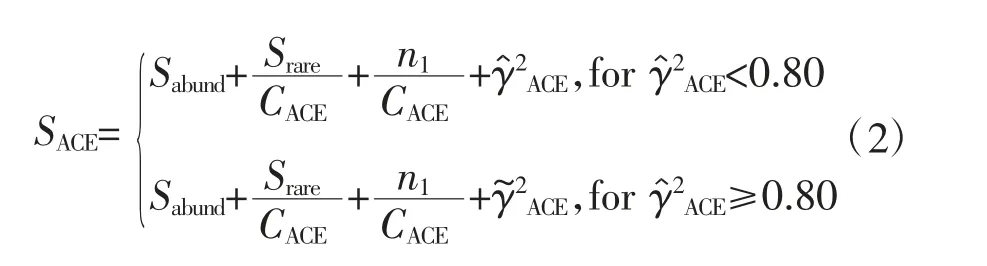
其中,

式中,Srare为含有“abund”条序列或者少于“abund”的OTU数目;Sabund为多于“abund”条序列的OTU数目;abund为“优势”OTU的阈值(默认为10)。
Simpson:常用来定量描述一个区域的生物多样性。计算公式如下

Shannon-Wiener:常用来估算样本中微生物多样性。计算公式如下

式中,ni为含有i条序列的OTU数目;N为所有的序列数。
1.3 数据处理与分析
基于Illumina MiSeq测序平台得到PE reads,根据overlap关系进行拼接,在对序列质量质控和过滤的同时区分样本,进行物种分类学分析,基于分类学分析结果,在不同分类水平上进行群落结构的统计分析,并对OTU进行多样性指数分析和测序深度的检测,从而实现对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等一系列深入的统计学和可视化分析[27-29]。
2 结果与分析
2.1 稀释性曲线
从所采集的土样中随机抽取若干个体,对这些个体所代表的物种数目进行统计,并以个体数与物种数来构成的曲线作稀释性曲线[22,29]。通过对3种植物的根际土壤高通量数据统计可知,L1~L6、J1~J6、F1~F6 18个样品的基因测序分别得到47 688、47 069、48 476、44 715、51 468、51 759、48 366、51 306、53 104、57 743、53 071、46 561、44 743、51 194、48 737、52 769、47 297、47 683条序列。OTU数目随序列数增加而增加,但增幅逐渐变小,稀释性曲线(图1)趋于平缓,表明测序结果能较好地反映环境中的土壤细菌群落结构[23]。

图1 样品稀释曲线
2.2 土壤细菌群落的结构与组成分析
对样品中的物种组成进行分析后,根据细菌OTU数目构建Venn图(图2)。由图2可知,3种根际土壤样品细菌群落中共有OTU数目为3 603个、L和F共有的OTU数目为3 937个、J和F共有的OTU数目为4 113个、J和L共有的OTU数目为4 121个;L中特有OTU数目为512个、J中特有OTU数目为211个、F中特有OTU数目为161个。

图2 细菌OTU的Venn图
在门水平上(图3),检测到的植物根际土壤细菌群落结构大致相同,主要由放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、黏球菌门(Myxococcota)、芽单胞菌门(Gemmatimonadetes)、髌骨细菌门(Patescibacteria)等组成。

图3 门水平上的土壤样品细菌群落柱形图
在所有土样中,3种植物根际土壤细菌群落的共同优势门为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria);老芒麦根际土壤细菌群落的单独优势门为拟杆菌门(Bacteroidete),占比为6.08%;杂交一代根际土壤细菌群落的单独优势门也为拟杆菌门(Bacteroidete),但占比为5.96%。
在属水平上(图4),所有土样的细菌群落中共检测到26个属,其中,3种植物根际土壤的共同优势属为节细菌属(Arthrobacter),占比为6.16%,其余属的占比都低于5%。老芒麦根际土壤细菌群落的单独优势属为希瓦氏菌属(Shewanella),占比为3.14%;加拿大披碱草根际土壤细菌群落的单独优势属为类诺卡氏菌属(Nocardioides),占比为3.14%;杂交一代根际土壤细菌群落的单独优势属为norank-f-JG30-KF-CM45,占比为2.78%。
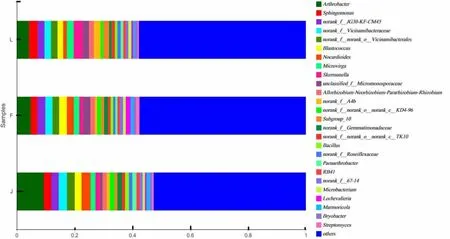
图4 属水平上的土壤样品细菌群落柱形图
2.3 多样性指数分析
由表2可知,老芒麦根际土壤中细菌的Shannon-Wiener指数、ACE指数和Chao1指数都是最高的,分别为6.714 289、4 382.526 453、4 320.070 064;加拿大披碱草根际土壤中细菌的Simpson指数最高,为0.017 916;老芒麦与老芒麦×加拿大披碱草杂交一代的多样性指数相近。这说明老芒麦根际土壤细菌群落的物种多样性和物种丰富度较加拿大披碱草和老芒麦×加拿大披碱草杂交一代更高。

表2 Alpha多样性指数
2.4 土壤化学指标分析
由图5可知,加拿大披碱草根际土壤的pH值低于老芒麦和老芒麦×加拿大披碱草杂交一代的根际土壤。由图6可知,老芒麦根际土壤的有机质含量最高,加拿大披碱草根际土壤的有机质含量最低;老芒麦根际土壤的速效磷含量显著高于其他两种植物根际土壤,分别是加拿大披碱草根际土壤的1.52倍和杂交一代根际土壤的1.23倍;加拿大披碱草根际土壤的速效氮含量最低,为54.25 mg/kg,老芒麦与杂交一代根际土壤的速效氮含量较接近,只相差2.92 mg/kg。

图5 样品土壤pH值柱形图

图6 样品土壤化学指标箱型图
2.5 细菌组成与土壤化学指标的相关性分析
Spearman相关性分析表明(图7),土壤有机质与Pseudomonas、norank-f-norank-o-Subgroup-7和Subgroup-10呈极显著正相关,相关系数分别为0.723 430、0.760 580、0.799 790;与norank-f-norank-o-Gaiellales、Gaiella和norank-f-Gemmatimonadaceae呈极显著负相关,相关系数分别为-0.771 300、-0.831 610、-0.781 220。速效氮与Mycobacterium呈极显著正相关,相关系数为0.791 090;与Agromyces、norank-f-Gemmatimonadaceae和Arthrobacter呈显著负相关,相关系数分别为-0.665 290、-0.694 310、-0.666 330。速效磷与norank-f-norank-o-SBR1031、norank-fnorank-o-Subgroup-7、Subgroup-10和norank-f-A4b呈极显著正相关,相关系数分别为0.736 430、0.717 980、0.708 680、0.714 880;与norank-f-norank-o-Gaiellales、Gaiella和norank-f-Ilumatobacteraceae呈极显著负相关,相关系数分别为-0.743 150、-0.751 810、-0.727 650。pH值 与Agromyces和norank-f-Xantobacteraceae呈显著负相关,相关系数分别为-0.604 870、-0.651 450。

图7 细菌组成与土壤化学指标的Spearman相关性分析
3 结论与讨论
植物根际土壤生态系统由土壤微生物与植物根系构成,它们之间会产生相互作用[30]。由于土壤生态系统的复杂性、土壤生物的多样性和技术手段的不足等因素,严重制约了人们对土壤微生物的深入研究。随着高通量测序等分子技术的迅速发展,对生态系统中土壤微生物的基础研究逐渐丰富。研究表明,土壤化学指标与植物根际土壤的微生物群落结构和多样性有密切关系[31-32]。张永亮等[33]研究发现,牧草的生长对土壤中的速效磷含量有很大影响,不同植物的生长所消耗的磷含量不同,所以种植不同植物的土壤速效磷含量也不同,这与本试验中种植老芒麦的土壤速效磷含量与加拿大披碱草和杂交一代的含量有显著差异的结果相一致。
在OTU水平上,杂交一代与加拿大披碱草样品相距更近,土壤细菌群落结构更相似;而杂交一代与老芒麦的样品较远,它们之间的土壤细菌群落结构差异较大。有研究表明,老芒麦与加拿大披碱草的杂种后代与双亲的亲缘关系表现为与加拿大披碱草较近,而与老芒麦的亲缘关系相对较远[9],本试验也进一步证明了该结论。测序结果表明,在门水平上,老芒麦、加拿大披碱草和杂交一代根际土壤的优势门为 放 线 菌 门(Actinobacteria)、变 形 菌 门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria),这与刘艳君等[25]的研究结果基本一致。而在属水平上,节细菌属(Arthrobacter)和希瓦氏菌属(Shewanella)是老芒麦根际的优势属,但刘艳君等[25]研究得出的优势菌群依次为Norank-c-Subgroup-6、鞘脂单胞菌属(Sphingomonas)、Norankf-Gemmatimonadaceae、芽球菌属(Blastococcus)和RB41,这些属在本试验中也被检测出,但含量不占优势,说明优势属的组成与土壤环境有关系。
Alpha多样性指数可以较好地反映生物群落的多样性和丰富度。Shannon-Wiener指数和Simpson指数都可以反映生物群落多样性,Shannon-Wiener指数数值越大,表示该群落的物种多样性越高,Simpson指数则与之相反[24,27]。ACE和Chao1指数都可以反映物种丰富度,其数值越高,表示该群落的物种丰富度越高[30]。此外,多样性指数分析表明,老芒麦根际土壤的细菌物种丰富度和群落多样性都是最高的,而加拿大披碱草则最低。研究表明,植物根际土壤的细菌群落多样性会随种植年限的增加而逐渐降低[25],本试验暂未针对种植年限因素进行研究,后续试验将会进行该因素的相关研究。
土壤微生物与环境因子间存在复杂多样的相互作用[34-35]。在本试验中,对土壤细菌群落结构和多样性影响最大的是有机质和速效磷,速效氮也有一定的影响。付莉娇等[36]研究指出,土壤pH值、有机质含量、速效氮含量、速效钾含量、速效磷含量的变化,都会导致植物根际微生态环境发生改变,进而影响植物根际土壤微生物群落结构多样性。苏贝贝等[34]研究表明,高寒地区不同豆科牧草根际土壤细菌群落结构多样性与土壤化学指标存在显著相关关系,并提出其中土壤主要的驱动因子可能是速效磷和有机质。陈孟立等[37]的研究中也提到可以通过改善土壤肥力和环境状况,改变土壤细菌群落结构,而有机质是影响其研究区域土壤细菌分布的主要环境因素之一。这些研究结果都与本试验的研究结果相一致。
本试验通过高通量测序技术,分析了老芒麦、加拿大披碱草及其杂交一代根际土壤中细菌群落结构和多样性,为了解生物多样性与生态系统功能之间的关系,提供了一定的理论基础。此外,有学者对不同种植年限、不同种植方式[38]的植物根际土壤细菌群落结构和多样性影响,以及植物分泌物对土壤根际微生物的影响[39-40]也进行了研究,未来也会把这些影响因素加入老芒麦、加拿大披碱草及杂交后代根际土壤细菌群落结构和多样性的试验中进行更深入的研究。

