氢氧化亚铁制备中灰绿色物质成分探究
贾佩霖 张丹丹 赵丽娜
(吉林省四平市吉林师范大学化学学院 136000)
氢氧化亚铁的制备实验是学生在高中必修阶段学习铁及其化合物时教材安排的实验,通过实验中产生的沉淀颜色变化,即由白色絮状沉淀迅速变成灰绿色,最后变为红褐色,让学生认识到铁的氢氧化物的性质和Fe2+与Fe3+的之间的转化关系,构建认知模型.但是,依据教材中的步骤进行实验时,并不会得到白色的氢氧化亚铁沉淀,而是直接生成絮状灰绿色沉淀.针对教材实验所出现的实验现象,本文分别通过实验设计和理论分析的方式对氢氧化亚铁制备中产生的灰绿色物质进行了探究.
1 氢氧化亚铁制备实验的教学地位及教学情况分析
铁及其化合物是高中化学必修阶段元素化学部分的主要学习内容,通过铁及其化合物的学习,学生不仅要掌握单质铁、铁的氧化物、铁的氢氧化物和不同价态铁离子的盐等知识内容,同时在学习过程中复习与应用氧化还原反应和离子反应等基本化学原理.在讲授铁的氢氧化物的性质时,教材中指出:在严格无氧的条件下,Fe2+与OH-反应生成Fe(OH)2,如果反应体系中有O2,则Fe(OH)2会被氧化生成Fe(OH)3.为了让学生掌握这一知识,强化对Fe2+还原性的认识,教材设置了氢氧化亚铁制备实验.以人教版化学必修第一册实验3-1为例,在试管中加入少量的FeSO4溶液,然后滴入NaOH溶液,观察现象.理论上来说,当NaOH溶液加入后会先生成白色絮状沉淀,之后迅速变成灰绿色,最后有红褐色沉淀生成.但长期以来,无论是学生还是教师在进行实验时,按照教材所写的步骤进行实验,得不到白色的氢氧化亚铁,而是直接生成灰绿色产物.为此,不少教师围绕这一问题进行研究.本文从实验中制取的灰绿色沉淀入手,用实验方法对灰绿色沉淀中所含有的离子进行检验,再从理论上分析了灰绿色沉淀可能的结构.
2 氢氧化亚铁中灰绿色物质的制备与检验
2.1 氢氧化亚铁中灰绿色物质的制备
2.1.1 实验药品与仪器
1 mol/L FeSO4溶液、5 mol/L NaOH溶液、试管、胶头滴管
2.1.2 实验操作与现象
在试管中先加入5 mol/L NaOH溶液5mL,用胶头滴管吸取3mL 1 mol/L FeSO4溶液,将胶头滴管深入至试管液面下方,硫酸亚铁被挤入氢氧化钠溶液内,在加入后会发现试管中有灰绿色的絮状沉淀生成.发生了反应:
2.2 氢氧化亚铁中灰绿色物质的检验
2.2.1 实验猜想

2.2.2 实验药品与仪器
酸性KMnO4溶液、KSCN溶液、稀H2SO4、BaCl2溶液、稀HCl、试管、胶头滴管
2.2.3 实验流程
根据实验猜想和实验药品与仪器的选择,设计了如图1所示的检验流程.

图1
实验现象和反应的离子方程式见表1.

表1
实验制取的灰绿色物质和离子检验实验的图片如图2所示.

图2
3 氢氧化亚铁中灰绿色物质的分析

在查阅大量关于铁氧化物的文献后可知,在制备氢氧化亚铁过程中产生的灰绿色物质可能是“绿锈”(Green Rust,GR),因其呈现墨绿色而得名.本文将从绿锈的组成、结构出发解释沉淀呈现灰绿色的原因.
3.1 绿锈的组成
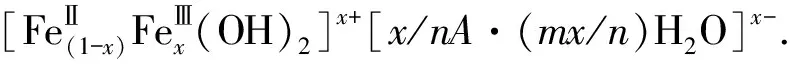
3.2 绿锈的结构

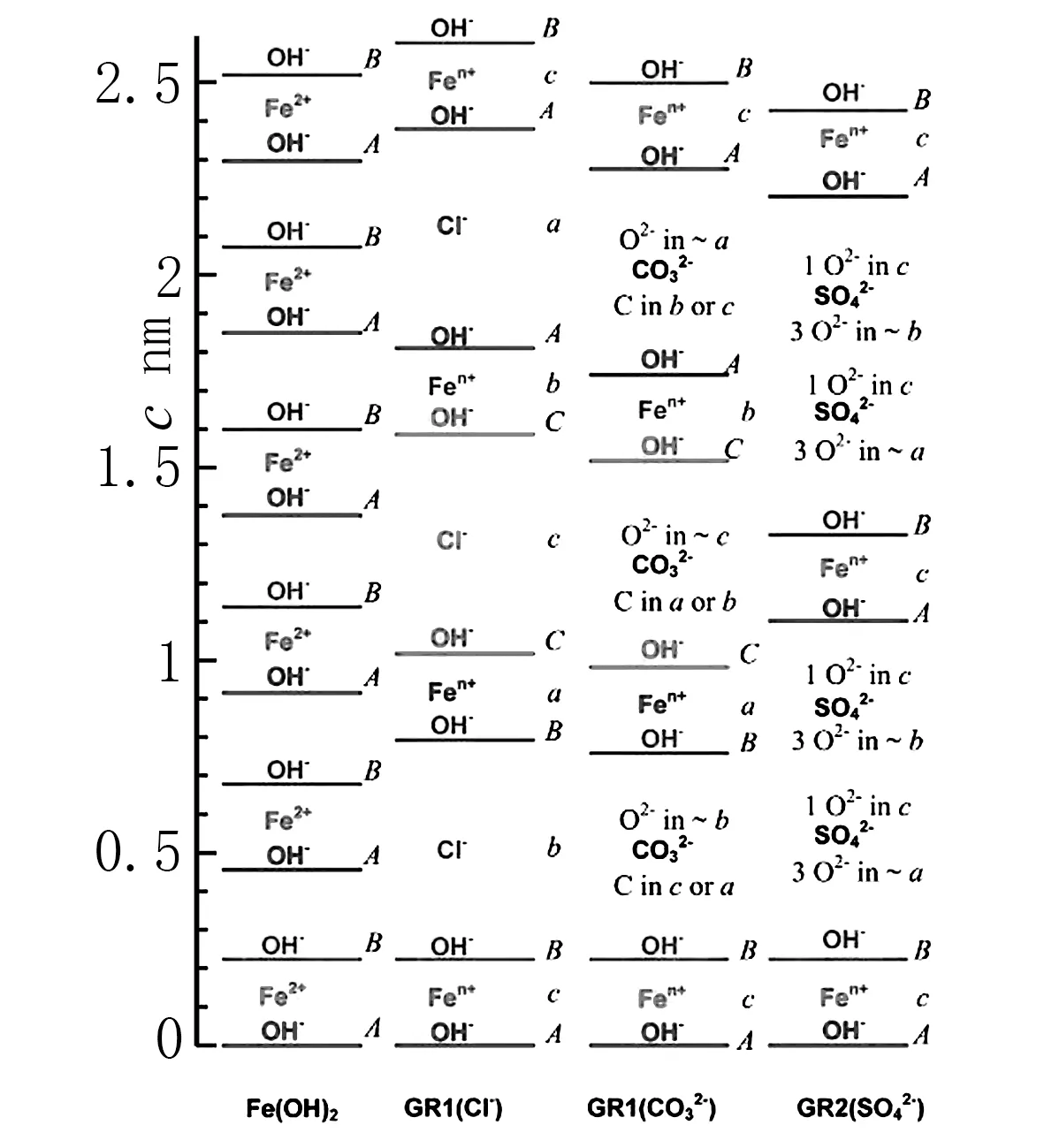
图3
3.3 实验中绿锈产生的原因分析


