油莎豆丙酮酸激酶基因的鉴定及其在块茎发芽和幼苗形态建成时期的表达分析
史先飞,高 宇,黄旭升,周雅莉,刘宝玲,李润植,薛金爱
(山西农业大学农学院/分子农业与生物能源研究所,晋中 030801)
光合作用是植物生命周期中有机物质碳骨架和大部分生物量的最初来源[1]。光合作用所固定的碳大多分配在可溶性糖和淀粉中,其参与植物体内的代谢,在光暗周期的循环中被消耗的同时也可以重新合成积累。植物油脂作为重要的储能物质,其生物合成通常会消耗光合作用产生的糖和积累的淀粉[2]。淀粉/糖类和油脂生物合成途径之间的碳源竞争和平衡制约着植物器官形态的建成和生长发育,以及贮藏物的积累[3]。生物有机体普遍存在的糖酵解(glycolysis)能将葡萄糖分解成丙酮酸,并伴随着能量的产生[4],在整体代谢网络中处于核心位置,通过底物、产物和中间物与其他代谢途径相联系。例如,糖酵解途径的终产物丙酮酸就可参与三羧酸循环、氨基酸代谢和脂质代谢等数百个生化反应[5]。
丙酮酸激酶(pyruvate kinase,PK)不可逆地催化磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)生成丙酮酸(pyruvate,Pyr),同时产生ATP[5],是调控糖酵解途径中生成丙酮酸的关键性限速酶。高等植物PK生化特性复杂,不同PK的基因表达模式和酶活性调控机制不同,所参与的物质代谢等生物学过程亦有差异。依据亚细胞定位,PK可分为细胞质丙酮酸激酶(cytosolic pyruvate kinase,PKc)和质体丙酮酸激酶(plastidial pyruvate kinase,PKp)两类[6]。这两类同工酶在物理特性、免疫学和动力学以及调控上有明显差异,分别行使不同的功能[6]。PKc主要参与植物线粒体的呼吸代谢,对碳源流向和源库关系有重要的影响和作用。PKp则参与营养器官或种子质体中油脂等储藏物质的生物合成[7]。拟南芥(Arabidopsisthaliana)中已鉴定出10个AtPKc和3个AtPKp。拟南芥Atpkp1突变体种子中油脂含量减少,种子发芽延迟[8]。外源添加蔗糖可部分恢复Atpkp1突变体幼苗的发育[9],PKp可将糖源转化为不同代谢途径的前体物质。马铃薯块茎中鉴定出5个StPKc和4个StPKp基因。在马铃薯块茎中,StPKc沉默导致PKc酶活性降低,进而引起丙酮酸和三羧酸循环中一些有机酸含量降低,碳源从糖酵解转向淀粉合成[10]。枇杷(Eriobotryajaponica)PKc的基因EjPK在枇杷发育果实糖积累阶段高表达,此阶段的丙酮酸含量增加,烯醇式丙酮酸的含量降低[11]。水稻(OryzasativaL.)细胞质Ospk1突变体的穗中蔗糖含量降低了84%,OsPK1的缺失严重影响了单糖的代谢和糖转运[12]。定位于叶绿体的Ospk2缺失突变体水稻的胚乳中淀粉含量显著下降,酶活性的降低导致多种代谢途径紊乱,发芽过程中油脂的含量增加导致了发芽率降低[13]。
油莎豆(CyperusesculentusL.)主要以块茎繁殖,块茎组织可积累大量的碳水化合物和蛋白质,淀粉含量占干重的40%,糖含量为20%,蛋白质含量为9%[14-15]。与马铃薯(SolanumtuberosumL.)、甘薯(Dioscoreaesculenta)等的块茎、块根的储能作物不同,油莎豆块茎可积累大量油脂,高达块茎干重的30%,油莎豆油的脂肪酸组成与橄榄(Canarium album)、牛油果(Perseaamericana)、榛果(Corylus heterophylla)类似,油酸含量高达60%~75%[16],是现在唯一已知的地下块茎组织储藏大量油脂的植物。因此,油莎豆被认为是研究非种子器官或营养器官中碳代谢及调控机制的一个理想模型。块茎发芽和幼苗形态建成是一个复杂的生理过程,包括碳水化合物的代谢,核酸、蛋白质的合成及各种信号转导[17]。在该生物学过程中,糖酵解、三羧酸循环和戊糖磷酸途径可消耗块茎贮藏的营养物质并提供能量[18]。然而,在油莎豆块茎发芽和幼苗建成的过程中,这些代谢途径及其碳通量的协同调控机制还不清楚。为此,本研究以PK为靶标,基于油莎豆块茎转录组数据鉴定油莎豆CePK基因,使用生物信息学工具分析这些CePK的蛋白特征和进化关系,定量检测油莎豆CePK基因在块茎发芽及幼苗建成过程的时空表达谱,以期获得解析油莎豆块茎发芽及幼苗建成过程中碳源消耗及再利用分子机制的新知识。
1 材料与方法
1.1 试验材料
种质材料油莎豆由山西农业大学分子农业与生物能源研究所提供。挑选饱满、发芽点完整的油莎豆块茎做发芽预处理后,使用Hoagland营养液于人工气候箱中培养,温度为28℃,光暗周期为16 h/8 h。取油莎豆发芽和幼苗建成阶段4个时期的块茎样品:吸胀后的油莎豆块茎为T0阶段;吸胀3 d后,块茎萌发白色幼芽为T1阶段;吸胀9 d后,白色幼芽转变为绿色,长出白色的幼根和根状茎,为T2阶段;吸胀23 d后,茎和叶伸长,根系发达,为T3阶段。液氮速冻后-80℃下储存。使用TransZol Plant(TRANS)试剂盒提取RNA,使用GenStarStarScriptII cDNA试剂盒反转录获得cDNA,于-20℃下保存。
1.2 油莎豆CePK基因序列的鉴定
基于本研究组的油莎豆发育块茎的转录组数据,以拟南芥AtPK蛋白序列为索引,检索获得油莎豆CePK蛋白序列。所有AtPK蛋白序列均下载自TAIR(https://www.arabidopsis.org/)网站。于Phytozome(https://phytozome-next.jgi.doe.gov/)和 NCBI(https://www.ncbi.nlm.nih.gov/)网站获取水稻、高粱(Sorghumbicolor)、马铃薯、烟草(Nicotianataba-cumL.)和大豆(Glycinemax)的PK蛋白序列,并对其重新命名和编号。使用MEGA_11.0软件的Phylogeny工具,选择邻接法(neighbor-joining,N-J)构建系统发育树,设置自举检验值为1 000。使用Xfam(http://pfam.xfam.org/)在线工具分析CePK蛋白序列的保守结构域,通过GeneDoc软件进行蛋白多序列比对分析。利用TBtools软件和MEME(https://meme-suite.org/meme/)在线工具,分析CePK家族的保守基序(Motif)。
1.3 油莎豆CePK蛋白的理化性质及高级结构分析
通过ExPASy(https://www.expasy.org/)在线工具预测CePK蛋白的相对分子质量、等电点(isoelectric point,pI)和亲水系数等理化性质。使用TMHMM_2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)在线工具预测CePK蛋白的跨膜结构。使用Cell-PLoc_2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)在线工具预测CePK蛋白的亚细胞定位。使用SOPMA(http://www.prabi.fr/)和SWISS-MODLE(https://swissmodel.expasy.org/interactive)在线工具预测CePK蛋白的高级结构。
1.4 油莎豆CePK基因在块茎发芽和幼苗建成不同时期的表达谱分析
使用Premier 6软件设计CePK基因的特异性定量引物,以18S rRNA作为内参基因(表1)。应用实时荧光定量PCR检测CePK基因的相对表达量,试剂盒使用TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus),反应程序为95℃ 2 min、95℃15 s、60℃ 30 s,40个循环。使用SPSS和GraphPad 9软件处理相对表达量并绘制柱形图。
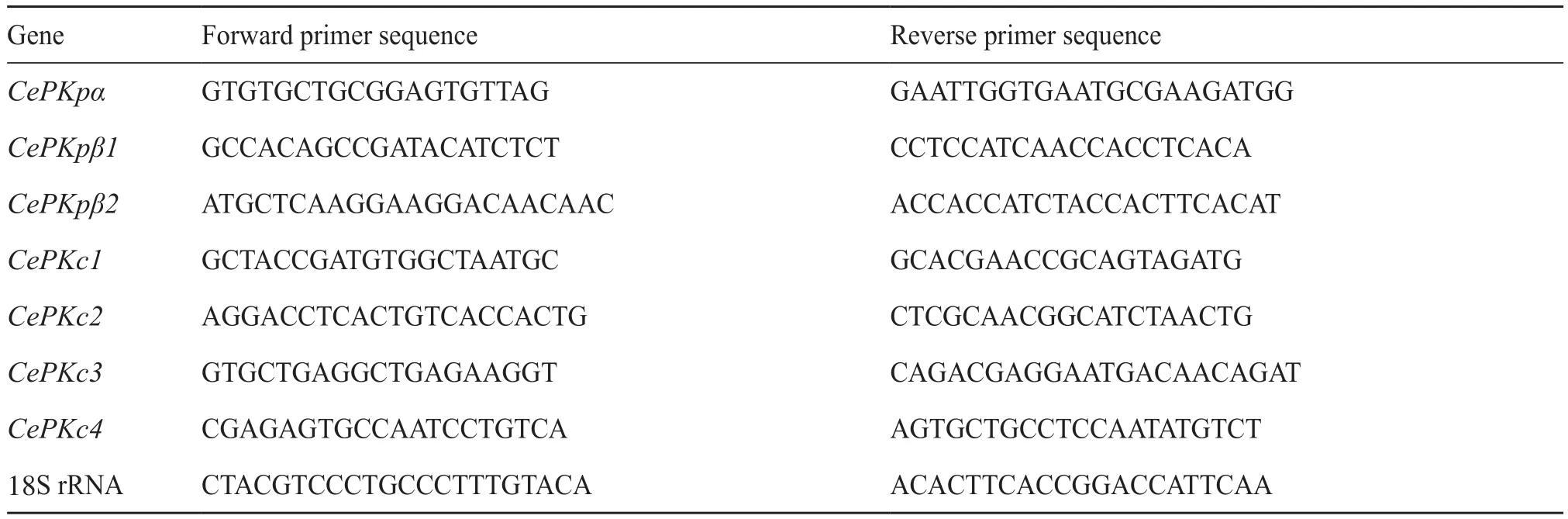
表1 引物序列Tab.1 Primer sequences
2 结果与分析
2.1 油莎豆CePK基因的筛选及鉴定
基于油莎豆发育块茎的转录组数据,以AtPK蛋白序列为索引进行本地BLAST,结果共筛选鉴定出7条油莎豆CePK蛋白序列。与已鉴定和注释的PK蛋白序列构建系统进化树(图1),结果显示,来自油莎豆的7个CePK蛋白包含3个质体型和4个细胞质型。依据同源进化关系可知,3个质体型又分别属于Plastidial-α I、Plastidial-β I、Plastidial-β II,4个细胞质型分别属于Cytosolic-I和Cytosolic-II。将这7条油莎豆CePK蛋白序列分别命名为CePKpα、CePKpβ1~2和CePKc1~4。所有CePK蛋白均具有PK蛋白典型的PK和PK_C结构域(图2),CePKp和CePKc蛋白的保守结构域之间不完全相同。同类型的CePK蛋白结构域之间无明显差异。
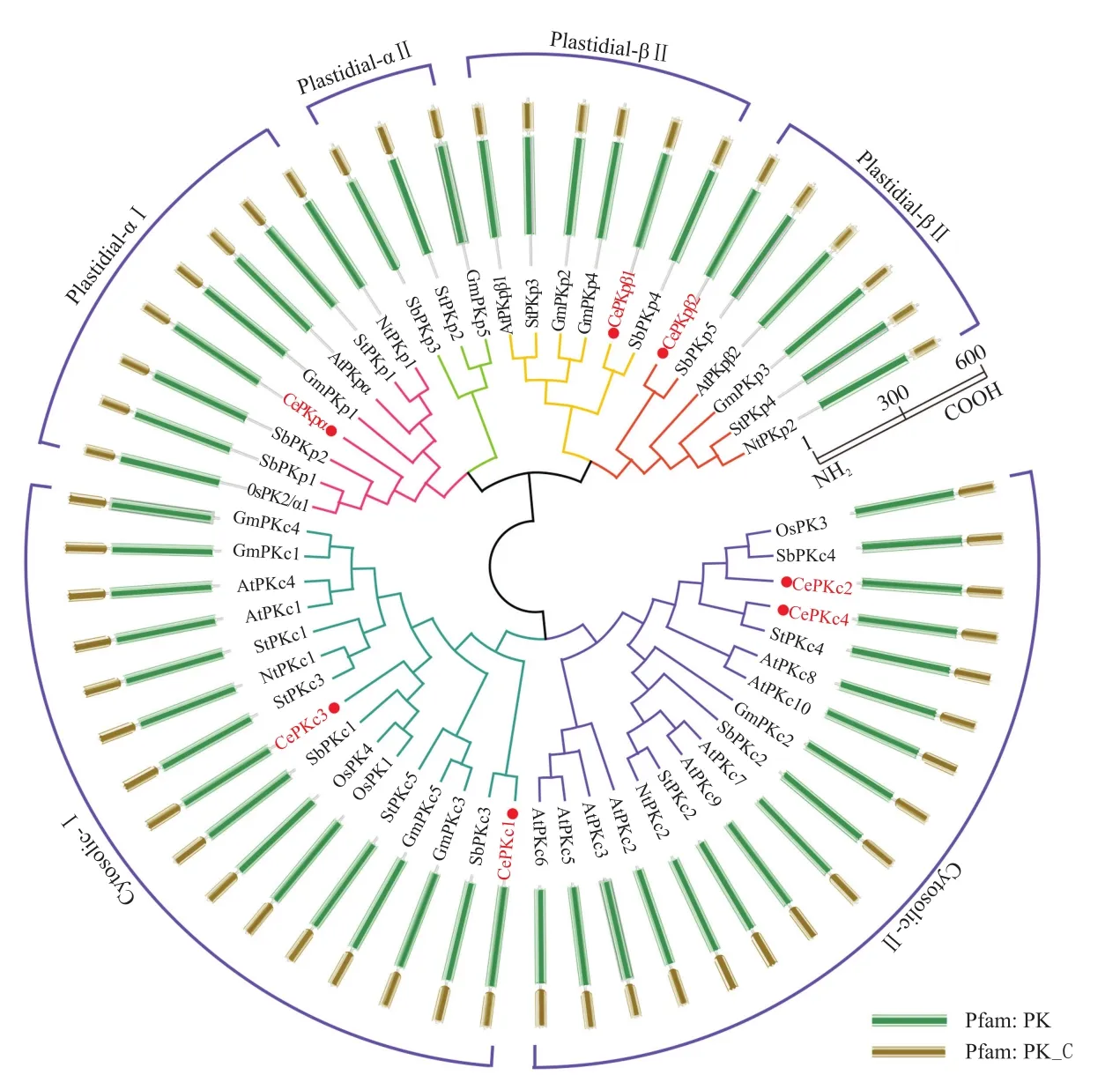
图1 油莎豆CePK蛋白的系统进化树和保守结构域Fig.1 Phylogenetic and conserved domains of CePK proteins in C. esculentus
2.2 CePK蛋白的基序组成
基于蛋白序列的保守基序分析,这7条CePK蛋白序列共鉴定出15个保守Motif,分别以不同颜色表示(图3)。质体型和细胞质型的CePK之间的差别较大,同类型CePK蛋白保守基序的数量和种类更相似。Motif 14和Motif 15只出现在质体型CePK蛋白序列中,β型中出现的Motif 13和Motif 15在α型中并未出现。Motif 9和Motif 12仅出现在细胞质型的CePK蛋白序列中,CePKc3较其他细胞质型序列缺少Motif 13。这些蛋白序列保守结构上的差异,预示着CePK基因可能在块茎中响应不同的代谢途径。
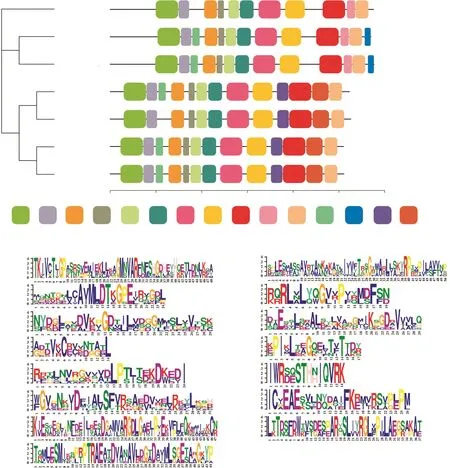
图3 CePK蛋白的保守基序Fig.3 The conserved motifs in CePK proteins
2.3 CePK蛋白的理化性质
基于以上序列的鉴定分析,本研究进一步解析了这些蛋白的性质和功能(表2)。油莎豆质体型和细胞质型CePK蛋白之间的理化性质差异较大,同类型间性质接近。3个CePKp预测的亚细胞定位均位于叶绿体,4个CePKc预测的亚细胞定位均位于细胞质,这与之前的预测一致。CePKp编码的蛋白的序列长度较CePKc长,相对分子质量大。CePKc均为稳定的疏水蛋白;CePKp中β2为稳定型蛋白,α和β1为不稳定蛋白,3个CePKp均为亲水性蛋白。7个CePK蛋白均不含跨膜结构。pI差异较大,最小值为4.99,最大值为8.47,均属PKc型。CePKp和CePKc蛋白理化性质上的差异预示着这些蛋白可能发挥不同的功能,参与不同的代谢途径。
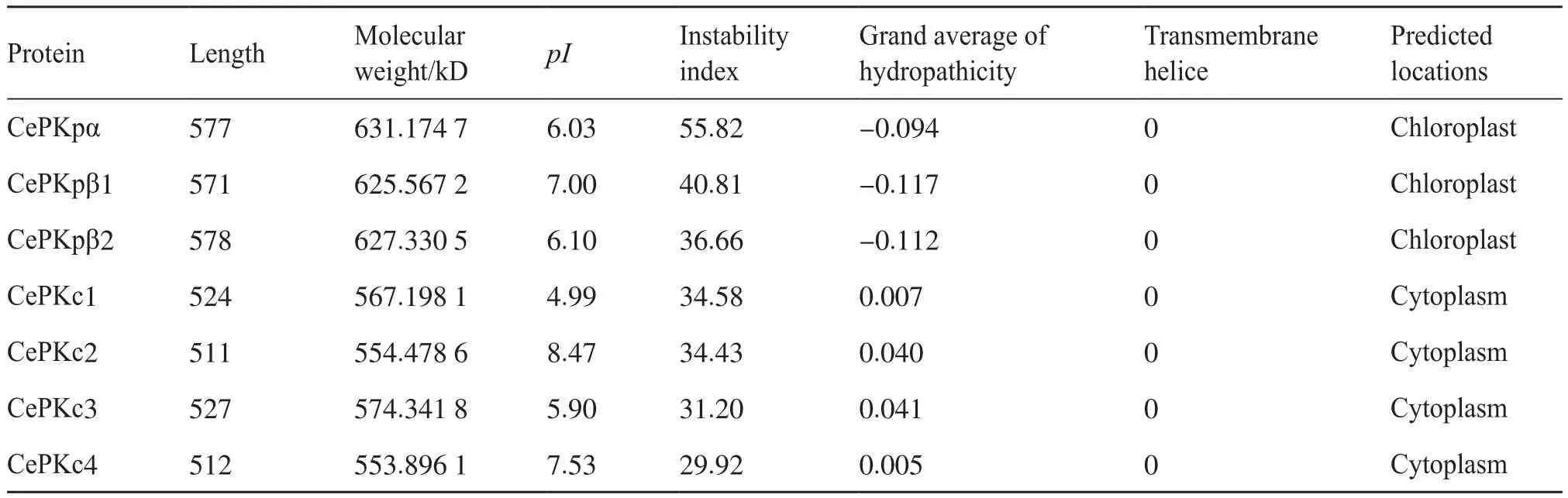
表2 油莎豆CePK蛋白理化性质分析Tab.2 Prediction of physical and chemical properties of CePK proteins in C.esculentus
2.4 CePK蛋白的高级结构
为进一步解析CePK蛋白的结构,本研究对CePK的高级结构进行了建模。CePK蛋白的二级结构预测均包含α-螺旋、β-转角、无规则卷曲和延伸链(表3)。这7个CePK蛋白的二级结构相似,其中β-转角所占比重最低,为7.11%~8.79%;α-螺旋和无规则卷曲分别为33.79%~39.28%和32.62%~41.42%,两者所占比重较为接近;延伸链所占比重为16.26%~20.12%。分别以1pkm.1和6ksh.1蛋白为模板,对3个CePKp和4个CePKc蛋白进行三级结构建模(图4)。CePKpα、CePKpβ1、CePKpβ2与模板1pkm.1的相似性分别为33.40%、36.42%、37.68%;CePKc1、CePKc3、CePKc2、CePKc4与模板6ksh.1的相似性分别为 34.29%、35.77%、49.59%、48.15%。三级结构预测结果显示,CePK均以复合体同源四聚体的形式存在。

图4 CePK蛋白的三级结构Fig.4 The tertiary structure of CePK proteins
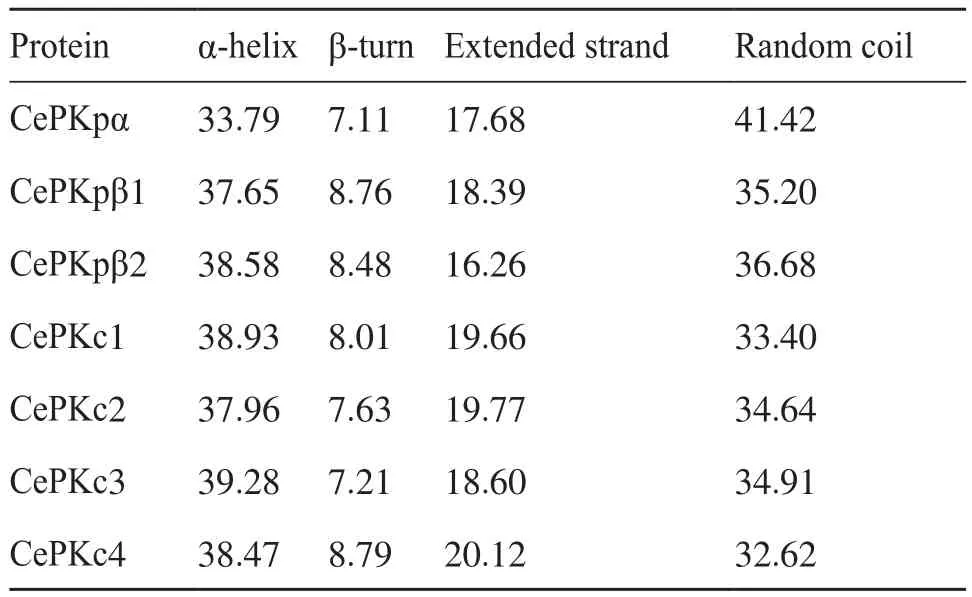
表3 CePK蛋白的二级结构Tab.3 Secondary structure of CePK proteins Unit: %
2.5 CePK基因在油莎豆块茎发芽和幼苗建成时期的表达模式
油莎豆块茎发芽和幼苗建成时期伴随有大量的生理代谢活动。为了鉴定CePK基因在建苗过程中的功能和作用,本研究检测了不同时期块茎中CePK基因的表达谱。取油莎豆发芽和幼苗建成阶段这4个时期的块茎,在这4个阶段中共检测到5条CePK基因的表达变化(图5)。CePK基因存在3种不同的表达变化趋势:CePKpα、CePKc3和CePKc4基因先降低后升高再降低;CePKpβ1基因持续降低;CePKc2先降低后升高。2种质体型的CePKp基因在T3阶段都不表达,但是这两个基因的变化趋势不同,CePKpα基因的表达水平变化更加显著。3种细胞质型的CePKc基因存在2种表达模式,总体表达水平都是降低的。CePKc2基因与CePKc3和CePKc4基因的表达模式不同,表达水平降低程度更大。不同的CePK基因表达模式具有一定的时空特异性,预示着其可能差异化调控块茎发芽和幼苗建成期营养物质的代谢途径。
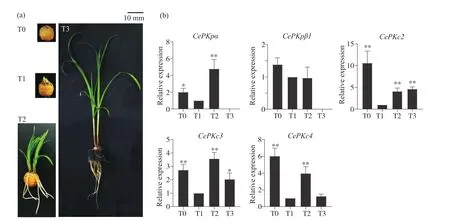
图5 CePK基因在油莎豆发芽和幼苗期块茎的表达模式Fig.5 Expression profiles of CePK genes at germination period and seedling stages in C.esculentus tuber
3 讨论
PK是糖酵解途径的关键性限速酶之一,不可逆地催化磷酸烯醇式丙酮酸生成丙酮酸,参与调控生长发育和物质代谢等重要生理过程[5]。PK的基因在多种动物中已经被鉴定和克隆,其生物学功能也得到了广泛的研究[19]。然而,高等植物PK的基因数量更多,具有更加复杂的生化特性,而有关植物PK的基因的研究尚不全面。油莎豆的块茎可以积累大量的碳水化合物,尤其是其营养器官中积累了大量的油脂,且富含油酸,可作为一种新型的粮油作物。解析其碳流通和再分配具有重要的研究意义。
本文基于转录组测序数据,首次对油莎豆CePK基因进行挖掘,共鉴定出7个编码CePK蛋白的CePK基因。以拟南芥AtPK[20]、水稻OsPK[13]、高粱 SbPK、马铃薯StPK[10]、烟草NtPK[7]和大豆GmPK[21]为模板序列,依据系统进化树以及PK和PK_C保守结构域的差异对油莎豆CePK蛋白进行命名和分类,分为3种质体型的PK(CePKpα、CePKpβ1~2)和4种细胞质型的PK(CePKc1~4)(图1、2)。所有类型的CePK蛋白均具有典型的PK和PK_C保守结构域,PKp和PKc保守Motif之间存在差异(图3),且同类型CePK蛋白的理化性质和高级结构更为相似。在几乎所有的生物体内PK都可以同源四聚体的形式存在,然而不同植物或不同组织的PK复合体具有相当大的多样性[22]。三级结构预测油莎豆PK均以同源四聚体的形式存在(图4),与之前在水稻[23]、马铃薯[10]、枇杷[11]中的报道一致,与蓖麻(RicinuscommunisL.)中分离的异源四聚体和异源六聚体存在差异[24-25]。物种进化上的差异可能预示着这些酶功能上存在差异。
成熟块茎中碳水化合物和蛋白质等贮藏物质的降解及再利用决定着块茎的正常发芽,以及幼苗的形态建成和生长发育。然而,油莎豆块茎发芽过程中贮藏物质降解及调控分子机制还未见详尽报道。PK是调控糖酵解途径的关键性限速酶,其催化底物磷酸烯醇式丙酮酸和产物丙酮酸是细胞内物质合成及代谢的重要前体,参与植物体的多种代谢途径,如乙醛酸循环[26]、三羧酸循环[27]过程和蛋白、脂肪酸[5]的合成等。PK在块茎发芽和幼苗建成代谢过程中有着重要的调节作用。本研究检测到5个CePK基因在块茎发芽和幼苗建成阶段(T0~T3)的油莎豆块茎中表达,不同的CePK基因呈现了不同的表达模式(图5)。3个CePKc基因在幼苗阶段(T3)的块茎中表达,2个CePKp基因均不在T3阶段表达,预示着这两种类型的CePK基因可能参与不同营养物质的代谢途径。在种子萌发和块茎发芽的过程中,淀粉、脂肪酸降解,可溶性糖的含量会随之增加,提供必要的能量以供种子萌发和幼苗的形成[28-29]。马铃薯块茎发芽变绿过程中淀粉大量水解,可溶性糖含量增加以供应块茎萌芽以及芽的初期生长[30]。油莎豆CePKc基因的表达水平较高,T0阶段均呈现出高的表达水平,之后大幅降低后又增加,这与油料作物萌发中可溶性糖含量变化的趋势一致[31],可推测这种细胞质型的PK极有可能参与淀粉与糖的生物合成途径。CePKp基因的表达水平较低,CePKpβ1基因呈现持续降低的趋势且在T3阶段不表达,CePKpα基因在T2幼苗变绿的阶段暂时升高且在T3阶段不表达。在淀粉和油脂等储藏物质分解的过程中,CePKp基因呈现出较低的表达水平,质体型PK的基因已被证实与这些储藏物质的合成相关,可推测这些来自于油莎豆的CePKp极有可能也与油脂和淀粉的生物合成相关。这些CePK基因可以应用于后续的功能分析,以期精准解析油莎豆块茎贮藏营养物质的降解和再利用及其调控碳流通和再分配的分子机制,拓展有关营养器官繁育作物发芽和幼苗形态建成阶段生物学过程精准调控网络的认知。

