转录因子AP-2α调控SOX9基因的表达
黄桂香,李志伟,丁小凤
(湖南师范大学生命科学学院基因功能与调控研究室,长沙 410081)
肝癌是肝脏最常见的原发性恶性肿瘤,占原发性肝癌的90%,是2020年全球癌症相关死亡的第三大主要原因[1-3]。目前治疗肝癌的主要方法包括手术切除、肝移植、放射线或化学药物局部治疗及综合治疗[4]。肝癌的典型特征是具有高度的细胞异质性,易复发和转移,这是导致治疗反应和预后不佳的主要原因。肝癌的异质性特征主要归因于干细胞特征的干细胞亚群的存在。肿瘤组织中干细胞具有自我更新和分化的能力,进而形成新的肿瘤[5-6]。由于肝癌发病隐秘,缺少特异性早期标志物且进展迅速,大多数患者发现时即被诊断为进展期肝癌,即使采用最积极的治疗,患者的生存率依然较低[7]。因此,进一步研究肝癌肿瘤发生和转移特性的分子机制对于寻找更好的治疗策略来提高患者存活期具有重要的临床意义。
转录因子是一类维持细胞生命活动的关键调控因子,在肿瘤的发生发展中扮演着非常重要的角色。AP-2转录因子家族由AP-2α、AP-2β、AP-2γ、AP-2δ和AP-2ε 5个成员组成,其表达具有组织和细胞特异性。在AP-2家族中,转录因子激活蛋白2α(AP-2α)是最早被鉴定和研究的,是转录过程中的重要调控因子,参与脊椎动物的细胞黏附、细胞生长、细胞凋亡、组织分化、胚胎发育、肿瘤发生等多种生理病理过程[8-9]。转录因子AP-2的N端区域由一个激活域组成,C端包含一个约200个氨基酸的区域,负责DNA结合和二聚化[10]。其二聚化结构域位于DNA结合位点内,包括富含脯氨酸/谷氨酰胺的结构域以及碱性α-螺旋和碱性螺旋-跨度-螺旋(basic Helix-Span-Helix,bHSH)[11]。研究表明,AP-2α在多种肿瘤组织中存在异常表达,其表达程度与肿瘤类型、临床分期、病理分化程度等有着密切的关系,并且AP-2α蛋白具有抑癌和促癌双重作用。如AP-2α在黑色素瘤、乳腺癌、前列腺癌和结直肠癌等多种类型的实体瘤中作为肿瘤抑制因子发挥作用,其表达的缺失与癌症的进展相关,并可预测不良预后[12-14]。但也有研究表明,AP-2α可以通过促进可溶性因子的分泌和MMP-2的表达来增强肿瘤、神经嵴和内皮细胞的迁移,引起肿瘤的发生[15-17]。
我们以前的研究发现:在肝癌细胞系中,AP-2α低表达或不表达;AP-2α过表达可降低肝癌细胞的迁移和侵袭,并且增加肝癌细胞对顺铂的敏感性[18]。研究发现,SOX9在肝癌组织和肝癌细胞系中表达上调,并且可促进肝癌的增殖、迁移和侵袭[19]。虽然有文献报道了AP-2α和SOX9在肝癌中的作用,但两者之间的调控关系仍不清楚。本文主要探究AP-2α与SOX9之间的调控机制,以期为肝癌的临床诊治提供指导和新方向。
1 材料与方法
1.1 材料
人类肝癌细胞系SMMC7721、人胚肾细胞HEK293均为实验室保存。pGL3-basic、pCMV-myc载体为实验室保存。限制性内切酶购自Thermo公司;T4连接酶、EX taq聚合酶购自Vazyme公司。胎牛血清和Dulbecco改良的Eagle培养基(Dulbecco’s modification of Eagle’s medium Dulbecco,DMEM)购自Cellmax公司。DNA marker、蛋白marker购自Thermo公司;转染试剂lipofectamine2000、青霉素/链霉素双抗购自Invitrogen公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自Milipore公司。AP-2α(3B5)单抗购自Santa Cruz公司;SOX9抗体购自ABclonal公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多抗购自bioworld公司;羊抗鼠、羊抗兔二抗购自正能生物技术有限公司。生物素标记试剂盒、化学发光法凝胶迁移试验(electrophoretic mobility shift assay,EMSA)检测试剂盒均购自Beyotim公司;谷胱甘肽巯基转移酶(glutathione-S-transferases,GST)纯化凝珠购自GE医疗公司;萤光试剂盒购自Promega公司;实时荧光定量PCR和反转录试剂盒购自Vazyme公司;质粒小量制备试剂盒、DNA胶回收试剂盒和组织细胞DNA/RNA提取试剂盒均购自Magen公司;去内毒质粒提取试剂盒购自Omega公司。
1.2 细胞培养
从液氮罐中取出冻存的细胞,在37℃水浴锅中快速冻融。所有细胞均在DMEM中培养,并添加10%胎牛血清、1%青霉素和1%链霉素。将细胞置于37℃、5% CO2的细胞培养箱中培养。
1.3 慢病毒稳定表达细胞系的建立
在慢病毒试验操作中,将大约5×105个SMMC7721细胞接种于3.5 cm培养皿中,待细胞密度约至50%时进行慢病毒感染。感染前将完全培养基换成无血清培养基,加入AP-2α过表达慢病毒或阴性对照慢病毒感染细胞,添加感染增强试剂HiTransG A以提高感染效率。感染12~16 h,待细胞长满培养皿后,通过倒置荧光显微镜检测感染效果,随后对稳定细胞系进行嘌呤霉素阳性细胞筛选。
1.4 蛋白质免疫印迹试验
收集的细胞用补充有蛋白酶抑制剂的细胞裂解缓冲液提取蛋白质。利用适当浓度的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),上样后进行恒压电泳,转膜前先将聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜在甲醇中浸泡5 min左右,然后依次将海绵、滤纸、胶、PVDF膜、滤纸海绵夹在转膜夹中恒压转膜,转完膜后取出PVDF膜,用5%脱脂牛奶进行室温封闭1 h左右,然后孵育一抗,置于4℃的旋转转子上旋转过夜。洗膜后根据一抗来源孵育相应的二抗,通过化学发光检测蛋白质的表达。
1.5 EMSA试验
构建目的基因AP-2α的原核表达质粒,将质粒转入BL21细菌进行异丙基硫代半乳糖苷(isopropyl β-D-Thiogalactoside,IPTG)诱导表达。配制适量的蛋白裂解液、清洗液和洗脱液,纯化重组GST-AP-2α蛋白。合成覆盖SOX9启动子区域AP-2α结合位点的特异性探针,参考碧云天试剂盒使用说明书进行探针标记。按照EMSA/凝胶转移试剂盒的制造商说明书,在含有GST-AP-2α和生物素标记的野生型或突变序列的混合物中进行结合反应,在结合缓冲液中加入未标记探针做为冷竞争反应,室温下孵育30 min。反应混合物在4%非变性凝胶上电泳,并转移到尼龙膜上进行显色反应。
1.6 萤光素酶试验
构建目的基因SOX9启动子的萤光素酶报告载体pGL3-basic-SOX9,所用引物序列为:SOX9promoter F(CGCCCCCACTTTTGCTCTT)、SOX9promoter R(CCAGTCGTAGCCTTTGAGCA)。将HEK293细胞铺于12孔板上,待细胞密度长至80%左右后,分别将pGL3-basic-SOX9、pCMV-Myc-AP-2α、pCMVMyc以及pCMV-LacZ共转染至细胞,4~6 h后更换成完全培养基继续培养24 h。收集细胞,按照Promega公司的萤光素酶检测试剂盒使用说明书测量荧光值。
1.7 实时定量PCR
利用细胞RNA提取试剂盒提取细胞总RNA,利用细胞总RNA逆转录制备cDNA,SOX9和AP-2α的mRNA表达水平通过β-actin标准化,所用引物序列如下。SOX9F:AGCGAACGCACATCAAGAC;SOX9R :CTGTAGGCGATCTGTTGGGG ;AP-2αF :AGGTCAATCTCCCTACACGAG ;AP-2αR :GGAGTAAGGATCTTGCGACTGG ;β-actinF :CACCATTGGCAATGAGCGGTTC ;β-actinR :AGGTCTTTGCGGATGTCCACGT。
1.8 统计学分析
使用GraphPad、Image J软件录入数据并进行统计分析。数据来自至少3个独立试验的平均值±标准差(±s)。当P<0.05时,结果被认为具有统计学意义。
2 结果与分析
2.1 AP-2α抑制SOX9的转录活性
为了研究AP-2α对SOX9的调控作用,我们使用转录因子结合谱数据库JASPAR预测了SOX9基因上游区域含有潜在的AP-2的结合位点,AP-2在进化上保守的结合位点序列为GCCN3/4GGC。SOX9启动子区域含有2个AP-2的结合位点(图1a)。一个潜在的AP-2结合位点(GCCCCGGGC)大约位于SOX9启动子区域中距离转录起始位-15~-7 bp的位置,另一个结合位点是GCCCCAGGA,位于+141~+149 bp的位置。
根据JASPAR预测结果,我们猜想AP-2α可能通过调控SOX9转录来影响其表达水平。接着,将包含预测的AP-2结合位点的SOX9启动子区域片段克隆到萤光素酶报告基因pGL3-basic中,分析AP-2α对SOX9转录活性的影响。萤光素酶结果显示,在HEK293细胞中,随着pCMV-Myc-AP-2α质粒转入量的增加,pGL3-basic-SOX9的报告基因的转录活性相比对照组越来越低(图1b)。说明AP-2α抑制了SOX9的转录活性,并且呈剂量依赖性。
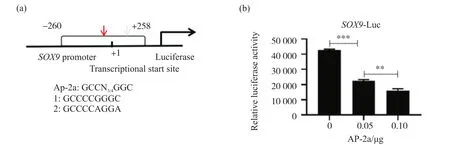
图1 AP-2α抑制SOX9的转录活性Fig.1 AP-2α inhibition of SOX9 transcriptional activity
2.2 AP-2α与SOX9的启动子区域相互结合
为了进一步探究AP-2α对SOX9的转录调控方式是直接结合还是间接结合,我们构建了原核表达质粒GST-AP-2α,纯化出GST-AP-2α蛋白(图2a)。接着,利用EMSA试验来检测SOX9启动子调控区域与纯化后的GST-AP-2α蛋白在体外的结合能力。EMSA结果显示,生物素标记的SOX9第一位点探针序列(F1:CCCCCTGCCCCGGGCCCGCGTAT ;R1 :ATACGCGGGCCCGGGGCAGGGGG)与GST-AP-2α蛋白结合,在非变性SDS-PAGE中检测到滞留的生物素信号,而第二个位点探针序列(F2:ACACGCGGCCCCAGGAGAACAC;R2:GTGTTCTCCTGGGGCCGCGTGT)未检测到滞留的生物素信号,且突变位点探针序列(mut1 F:CCCCCTAATCCGGTACCGCGTAT ;mut1 R :ATACGCGGTACCGGATTAGGGGG ;mut2 F :ACACGCGAATCCATAAGAACAC ;mut2 R :GTGTTCTTATGGATTCGCGTGT)均未检测到滞留的生物素信号(图2b)。以上结果说明,AP-2α可以直接特异性地结合至SOX9的启动子区域。
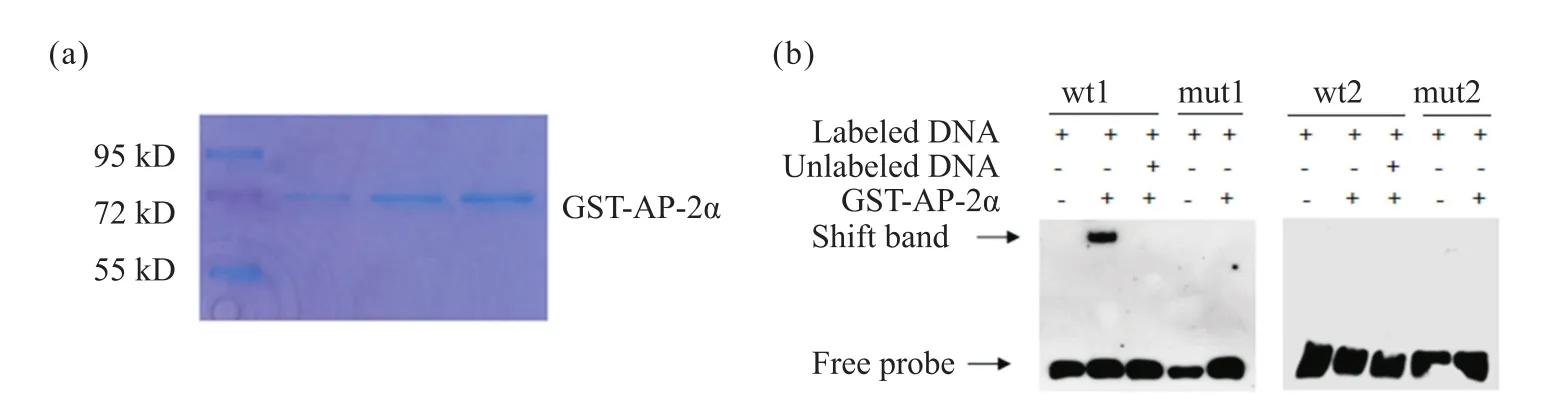
图2 AP-2α与SOX9的启动子区域直接结合Fig.2 AP-2α can directly bind to the promoter region of the SOX9 gene
2.3 在肝癌细胞中AP-2α下调SOX9的表达
前面的试验结果已经证实了AP-2α可以直接调控SOX9,抑制SOX9的转录活性。为了检测AP-2α对SOX9mRNA水平的影响,我们采用实时定量PCR技术检测了SOX9的表达情况。结果显示,在AP-2α过表达的肝癌细胞中,SOX9的mRNA水平有显著降低(图3a)。为进一步检测AP-2α是否可以在蛋白水平上抑制SOX9的表达,用过表达AP-2α的慢病毒感染SMMC7721细胞,并筛选过表达AP-2α的阳性细胞,用蛋白免疫印迹试验检测肝癌细胞内SOX9的表达,发现在肝癌细胞中过表达AP-2α可下调SOX9的表达(图3b)。这些结果说明,不管是在mRNA水平还是在蛋白水平上,AP-2α都抑制了SOX9的表达。
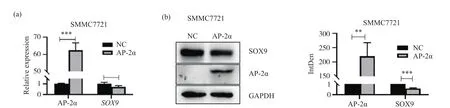
图3 在SMMC7721肝癌细胞中AP-2α下调SOX9的表达Fig.3 AP-2α inhibits the expression of SOX9 in SMMC7721 hepatoma cell
3 讨论
SOX9是SRY盒基因超家族的成员,属于SOXE基因的一个亚组,是调节高迁移率族盒DNA结合和反式激活域的重要转录因子[20-21]。SOX9的失调已成为各种癌症的驱动因素,其表达被认为是不同条件下的恶性生长。SOX9既可以作为肿瘤抑制基因,也可以作为癌基因在癌症中发挥作用。如其在宫颈癌、膀胱癌和黑色素瘤中起抑癌作用[22-24],而在胃癌、乳腺癌和胶质瘤等多种癌症中是作为癌基因发挥作用的[25-27]。肿瘤抑制因子SOX9可调节肿瘤中的Wnt/β-catenin信号[28];作为原癌基因,其可激活不同的信号通路,引起肿瘤的发生,增加癌细胞的转移能力,导致癌症的预后不良[26-29]。
在肿瘤发生过程中,SOX9在包括肝癌的多种类型肿瘤中上调,并作为癌基因在肿瘤进展中发挥重要作用[30-31]。其可调节细胞增殖、衰老和自我更新。研究发现,SOX9在肝癌组织和细胞系中表达上调,并可促进肝癌的增殖、迁移和侵袭[19]。此外,SOX9还参与了包括肝癌在内的多种肿瘤干细胞特异性基因网络的调控,包括自我更新、分化和细胞外基质重塑[32]。在肝癌中,SOX9作为癌基因发挥着促癌的作用,而AP-2α作为抑癌基因发挥着抑癌的作用。本文主要在体外研究肝癌中AP-2α与SOX9之间的调控机制,发现AP-2α可以与SOX9启动子区域直接结合,并且呈剂量依赖性抑制SOX9的转录活性。在肝癌细胞中过表达AP-2α可以在mRNA水平和蛋白水平上抑制SOX9的表达。
有报道称,SOX9可促进肝癌细胞的迁移,它在高转移细胞系中的表达水平高于低转移细胞系[33]。SOX9在侵袭和迁移期间也促进上皮间质转化(epithelial-mesenchymal transition,EMT),并赋予干细胞表型,导致化疗药物治疗肿瘤的耐药性。此外,肝癌中SOX9的高表达与降低无病生存率和降低总体生存率显著相关[34]。基于前面的报道以及我们的研究结果,我们推测肝癌的进展与SOX9的上调和AP-2α的下调相关。一方面,肝癌中因缺少AP-2α对SOX9的负调控,导致SOX9表达异常增加,从而促进肝癌细胞的增殖、侵袭和迁移,导致肿瘤向正常组织扩散;另一方面,SOX9表达增加可赋予肝癌细胞干细胞特性,最终导致患者预后不良。提高肝癌中AP-2α的表达可能会逆转这些结果,延长患者的存活期。因此,针对SOX9及其上游AP-2α的治疗策略可能有助于肝癌的临床治疗和患者预后。我们将继续研究SOX9与AP-2α在肝细胞癌中的作用及调控信号通路。
总之,本文阐明了肝癌中转录因子AP-2α对SOX9的调控机制,对进一步探讨肝癌临床治疗方案提供了理论依据和新思想。

