苦参碱对LPS激活的小胶质细胞炎症因子释放和CX3CR1蛋白表达的影响
王业丰,姚 遥,杨欣河,邹 彬,李 佳,李 娟,4
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏医科大学基础医学院,银川 750004;3.宁夏医科大学药学院,银川 750004;4.宁夏少数民族医药现代化教育部重点实验室,银川 750004)
阿尔茨海默病(Alzheimer disease,AD)是由老化、遗传和环境多因素共同导致的一种神经退行性疾病,是痴呆最常见的病因[1],其核心病理特征是脑内β 淀粉样蛋白(amyloid-β protein,Aβ)沉积、神经原纤维缠结(neurofibrillary tangles,NFTs)以及大脑中持续的神经炎性反应[2]。小胶质细胞是驻留在中枢神经系统(CNS)中的一种天然免疫细胞[3]。全基因组关联研究发现,与AD 中的炎症过程相关的基因(TREM2、CD33、CR1、PLCG2和INPP5D)在中枢神经系统中主要由小胶质细胞表达,这表明小胶质细胞是AD 的神经炎症发病机制的关键参与者[4]。动物研究和临床前研究[5]显示,使用抗炎药物可以有效抑制小胶质细胞的活化,降低脑内炎症因子水平,减轻神经元损伤,改善认知功能;苦参碱是中药苦参中的代表性生物碱和主要有效成分,其抗炎作用尤为显著[6]。有研究[7-8]显示,苦参碱可以降低AD 大鼠和小鼠脑内的炎症因子水平,减弱对海马神经元线粒体超微结构的损伤,从而抑制神经炎症,改善AD 大鼠的认知功能,但机制并不明确。CX3CR1(CX3C chemokine receptor 1)是一种趋化因子受体,可以与多种功能性配体结合,参与调节小胶质细胞的活化和炎症因子的释放[9]。本研究拟通过检测苦参碱对小胶质细胞活化、炎症因子的释放以及CX3CR1 蛋白的表达情况,为苦参碱治疗神经炎症的机制研究提供实验依据。
1 材料与方法
1.1 试剂与仪器
小鼠小胶质细胞株(N9)购于通派(上海)生物科技有限公司;苦参碱购于宁夏紫荆花药业股份有限公司盐池药厂(纯度>98%,批号180905);MTT、米诺环素(minocycline,MINO)、脂多糖(lipopolysaccharide,LPS)及含DAPI 的抗荧光衰减封片剂购于北京索莱宝科技有限公司;高糖DMEM、胎牛血清(FBS)、PBS 缓冲液、胰蛋白酶、青霉素-链霉素混合液(100×)购于美国Gibco 公司;RAPA 裂解液(强)、PMSF、蛋白酶抑制剂、磷酸酶抑制剂、TBST 购于武汉塞维尔生物科技有限公司;BCA蛋白含量检测试剂盒购于江苏凯基生物技术股份有限公司;山羊血清购于北京中杉金桥生物技术有限公司;山羊抗兔HRP 偶联二抗、山羊抗兔红色Alexa Fluor 偶联二抗(594)、山羊抗鼠绿色Alexa Fluor 偶联二抗(488)购于亚科因(武汉)生物技术有限公司;CX3CR1、β-actin 抗体购于江苏亲科生物研究中心有限公司;分化抗原簇-32(cluster of differentiation-32,CD32)与分化抗原簇-206(cluster of differentiation-206,CD206)抗体购于美国Santa Cruz 公司;白细胞介素-6(interleukin-6,IL-6)、前列腺素E2(prostaglandin E2,PGE2)、活性氧(reactive oxygen species,ROS)检测试剂盒购于南京建成生物工程研究所。
细胞培养箱、冷冻离心机、全波长酶标仪及iBright 成像系统购于美国赛默飞世尔科技公司,荧光显微镜购于美国ECHO 公司。
1.2 方法
1.2.1 细胞培养 N9 细胞置于37 ℃、5% CO2的培养箱中用含10% FBS、100 U 青霉素和100 U链霉素及50 μmol·L-12-巯基乙醇的DMEM 培养基培养。当细胞融合度达到70%~80%时,以胰酶消化细胞,调整细胞浓度至4×105个/mL 传代。取3~7 代细胞进行实验。
1.2.2 实验分组及处理 所有药物均以无血清的DMEM 基础培养基稀释配制。将细胞分为Control 组(DMEM 基础培养基)、苦参碱(10 μmol·L-1)组、LPS(300 ng·mL-1)组、LPS+苦参碱(0.1、0.3、1.0、3.0 和10.0 μmol·L-1)组以及LPS+MINO(30 μmol·L-1)组。
1.2.3 MTT 法检测苦参碱与LPS 对N9 小胶质细胞活力的影响 将细胞浓度调整至4×104个/mL,接种于96 孔板中,每孔200 μL,培养过夜。第2 天,更换含有LPS(0、0.1、0.3、1.0、3.0、10.0 μg·mL-1)、苦参碱(0、0.1、0.3、1.0、3.0、10.0、30.0、100.0 μmol·L-1),以及LPS+苦参碱(0.1、0.3、1.0、3.0、10.0 μmol·L-1)的新鲜培养基,孵育24 h。第3 天,每孔中加入20 μL 的MTT 溶液(5 mg·mL-1),孵育4 h 后弃去培养液,每孔中加入150 μL 的DMSO,振荡10 min使黄色结晶完全溶解后,置于酶标仪中,选择490 nm 波长检测各孔的吸光度(A)值。细胞存活率=[(As-Ab)/(Ac-Ab)]×100%。As:实验孔A值(含DMSO、MTT、细胞以及药物);Ac:对照孔A 值(含DMSO、MTT、细胞,不含药物);Ab:空白孔A值(仅含DMSO、MTT)。
1.2.4 ELISA 法检测上清液中IL-6、PGE2 及ROS的含量 药物处理24 h 后收集培养液,4 ℃下1 000 ×g 离心20 min,取上清液保存;按照说明书,提前从检测盒中取出铝箔,室温平衡60 min,取出所需的包被好抗体的板条,分别在空白孔、标准品孔和样本孔加入对应的试剂或样品,37 ℃孵育60 min;洗板5 次后依次加入底物A、B,37 ℃避光孵育15 min,最后加入终止液混匀;用酶标仪在450 nm 波长下检测各孔的光密度(OD)值,做标准曲线,计算IL-6、PGE2 和ROS 浓度。
1.2.5 免疫荧光法检测CD32、CD206 以及CX3CR1蛋白水平 将细胞浓度调整至2×104个/mL,接种于置有爬片的24 孔板中,每孔500 μL,给药处理24 h 后开始实验。以常温PBS 润洗细胞2次,加4%多聚甲醛固定15 min 后,PBS 漂洗3 次,每次5 min。每孔加300 μL 山羊血清覆盖爬片,封闭1 h 后加入CD32(1∶200)、CD206(1∶200)、CX3CR1(1∶200),4 ℃孵育过夜。PBS 漂洗3次后,用相应的荧光二抗(1∶100)室温下孵育1 h。PBS 漂洗3 次,取出爬片,吸干残留液体后用含DAPI 的封片剂封片,并在荧光显微镜下采集图像,后续使用Image J 对荧光强度进行半定量分析。
1.2.6 Western blot 检测CX3CR1 蛋白表达量 以BCA 法测定总蛋白含量后,将样品与4×上样缓冲液按4∶1 混合后煮沸10 min。将变性的样品加到10%的SDS-PAGE 凝胶中,80 V 电泳30 min后转120 V 电泳1 h,300 mA 转膜30 min,将蛋白从凝胶转移到PVDF 膜上。将PVDF 膜置于5%脱脂奶粉封闭1 h,然后在特异性一抗(1∶1 000)中4 ℃孵育过夜。TBST 漂洗3 次后,用HRP 偶联二抗(1∶20 000)室温下孵育1 h,随后使用ECL 化学发光试剂盒对蛋白条带进行显色。采用iBright 成像系统对蛋白条带进行成像,并使用Image J 对条带的灰度值进行半定量分析。
1.3 统计学方法
所有实验重复3 次,数据采用SPSS 19.0 统计学软件进行分析,采用Shapiro-Wilk 检验和Levene检验判断数据的正态性和方差齐性,当数据服从正态分布且方差齐时,数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用Dunnett-t 检验;当数据不服从正态分布或方差不齐时,数据以中位数(四分位数)表示,组间比较采用非参数检验,两两比较采用Kruskal-Wallis 检验。采用双侧检验,检验水准α 取0.05。绘图使用GraphPad Prism 8 完成。
2 结果
2.1 苦参碱对小胶质细胞活力的影响
为评估苦参碱对N9 细胞活力的影响,采用MTT 法测定了不同浓度苦参碱(0、0.1、0.3、1、3、10、30、100 μmol·L-1)处理后N9 细胞的存活率。苦参碱的毒性较低,在0~100 μmol·L-1的剂量范围内,苦参碱对N9 细胞活力无影响(P=0.9828)。LPS 对细胞活力的影响,结果显示,在0~10 μg·mL-1的剂量范围内,LPS 对N9 细胞无明显的细胞毒性(P=0.7107)。LPS 与苦参碱共同作用于N9 细胞,结果显示,LPS 刺激也对经苦参碱预处理的N9 细胞存活率无影响(P=0.7445),见图1。
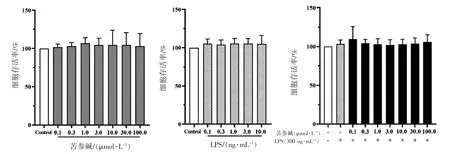
图1 苦参碱及LPS 对N9 细胞存活率的影响
2.2 苦参碱对小胶质细胞炎症因子释放的影响
ELISA 实验结果如图2所示,与Control 组相比,LPS 组的ROS、IL-6、PGE2 的释放水平均升高;与LPS 组相比,LPS+苦参碱组的ROS、IL-6、PGE2 的释放水平均下降(P 均<0.01)。
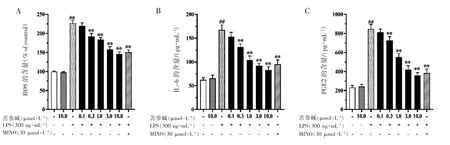
图2 苦参碱对LPS 活化的N9 细胞的ROS、IL-6、PGE2 表达的影响
2.3 苦参碱对小胶质细胞M1/M2 型极化标记物的影响
为探究苦参碱对LPS 刺激的小胶质细胞的保护作用是否与极化有关,本研究采用免疫荧光法检测小胶质细胞M1/M2 型极化的标记物CD32 与CD206。在300 ng·mL-1的LPS 刺激后,小胶质细胞CD32 的相对荧光强度增强(P<0.01);苦参碱(10 μmol·L-1)预处理组的CD32 相对荧光强度下降(P<0.01)。CD206 检测结果显示,在300 ng·mL-1的LPS 刺激后,小胶质细胞CD206 的相对荧光强度降低(P<0.01);苦参碱(10 μmol·L-1)预处理组的CD206 的相对荧光强度增强(P <0.01),见图3。
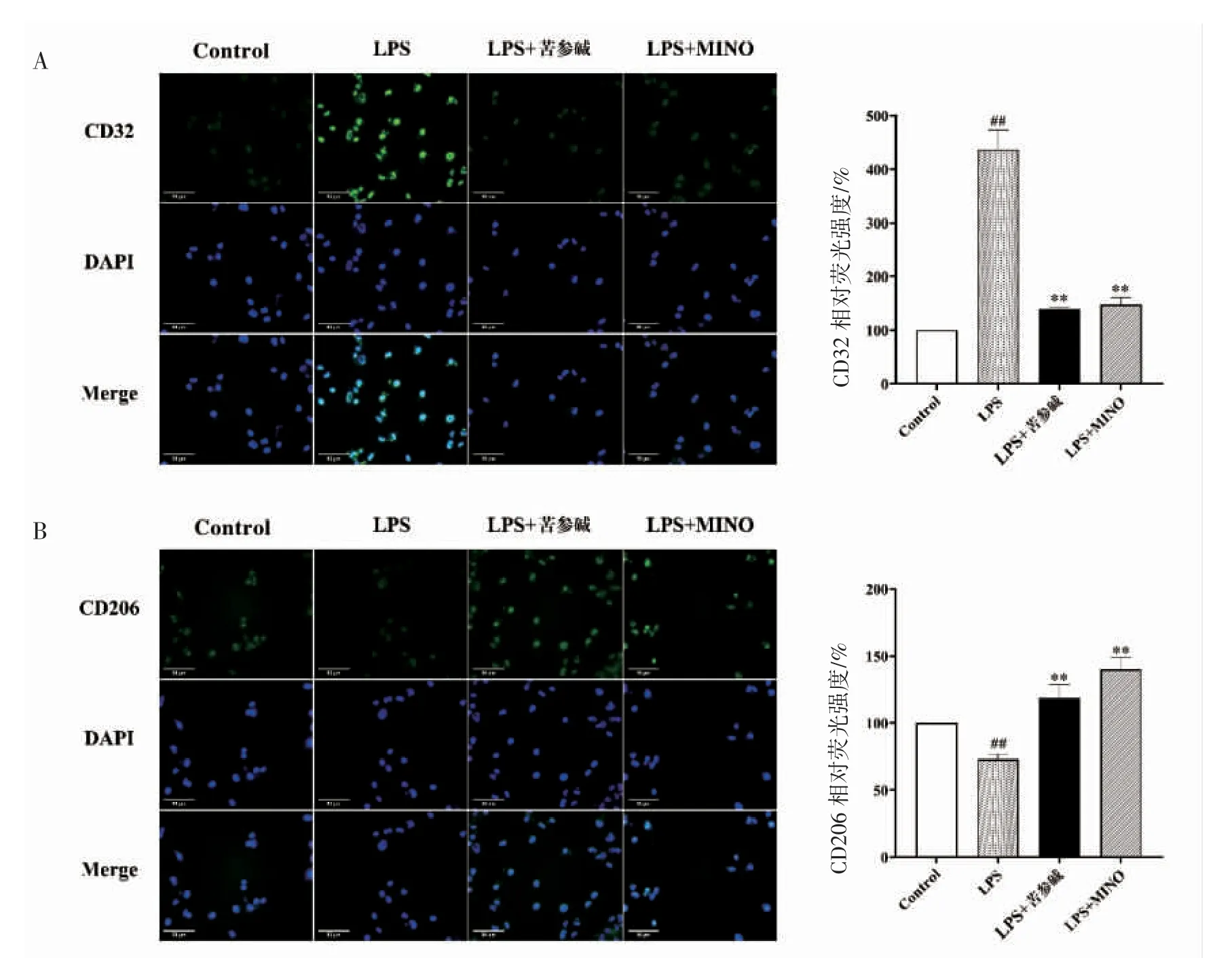
图3 苦参碱对LPS 活化的N9 细胞M1/M2 型极化标记物的影响
2.4 苦参碱对小胶质细胞CX3CR1 蛋白表达的影响
免疫荧光检测结果如图4A所示,与Control 组相比,在300 ng·mL-1的LPS 作用24 h 后,LPS 组CX3CR1 的平均荧光强度降低(P<0.01);与LPS组相比,3 μmol·L-1与10 μmol·L-1的苦参碱预处理能够增加CX3CR1 的平均荧光强度(P<0.01)。
Western blot 检测也呈现出与免疫荧光相似的结果,如图4B 所示,与Control 组相比,小胶质细胞在300 ng·mL-1的LPS 作用24 h 后,CX3CR1蛋白的相对表达水平降低(P<0.05);与LPS 组相比,1、3、10 μmol·L-1的苦参碱均能使CX3CR1的相对表达量上调。
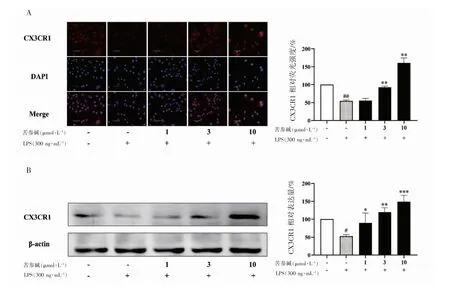
图4 苦参碱对LPS 活化的小胶质细胞CX3CR1 蛋白表达水平的影响
3 讨论
在神经炎症中,小胶质细胞反应具有双重性。在发生认知缺陷之前的早期阶段,活化的小胶质细胞可以促进Aβ 的清除和Tau 蛋白的内化,被认为是有益的影响[10];但在其后期,持续活化的小胶质细胞则通过分泌消化酶、ROS、炎症因子及减少营养和神经保护因子等直接或间接引起神经元的凋亡或坏死,加重神经毒性[11]。在正常状态下,小胶质细胞可以通过CX3CR1、TREM2 等免疫检查点或颗粒蛋白前体途径来防止它们对外界刺激的过度反应[12]。但当这些通路失调时则会引发或加剧神经退行性变。
CX3CR1 属于视紫红质样G 蛋白偶联受体,由355 个氨基酸组成,其细胞外环与胞外的n 端结构域构成的结合位点可以和其配体CX3CL1结合[13]。CX3CL1 又称Fractalkine,是趋化因子CX3C 家族的唯一成员,由373 个氨基酸组成,在中枢神经系统中主要表达于神经元,有膜结合和可溶性两种形式。膜结合形式的CX3CL1 是一种跨膜蛋白,其作为黏附物,与其唯一受体CX3CR1结合后,维持小胶质细胞处于静默状态;而当其由膜结合形式被ADAM0、ADAM17 等蛋白酶水解形成可溶性CX3CL1 时,则作为一种趋化因子,激活小胶质细胞的替代激活途径,促进小胶质细胞向M2 型转化并向感染或炎症部位迁移[14-16]。研究[12]显示,CX3CL1/CX3CR1 信号通路受损会导致小胶质细胞的过度活化(M1 型极化),并诱导IL-1β、IL-6、肿瘤坏死因子(TNF-α)、ROS、一氧化氮(NO)等炎症因子的表达,引起神经元损伤。例如,在hAPP 小鼠中敲除CX3CR1 后,小鼠脑内的炎症因子TNF-α 和IL-6 的水平升高,齿状回中钙结合蛋白的消耗增强,并加剧了与AD相关的功能障碍和认知缺陷[10]。此外,有研究[17]显示,在hTau 小鼠中敲除CX3CR1 后,Tau 蛋白的过度磷酸化会进一步增强,并且出现与Tau 磷酸化增多相关的行为障碍,提示CX3CR1 也参与了小胶质细胞对Tau 蛋白的清除过程[18-19]。因而,通过CX3CL1/CX3CR1 信号通路调节小胶质细胞的活性,可能成为阿尔茨海默病治疗研究的一个有价值的靶点。
本研究首先筛选了苦参碱与LPS 的给药剂量,MTT 检测结果显示,0~100 μmol·L-1的苦参碱以及0~10 μg·mL-1的LPS 对N9 细胞活力均无影响,这与Jiang 等[20]的研究结果相似。而Cunha 等[21]使用300 ng·mL-1的LPS 诱导N9 细胞发生极化,并升高了炎症因子的水平,降低了CX3CR1 蛋白的表达;因而本文也选用此浓度作为LPS 的给药剂量,采用ELISA 法测定N9 细胞ROS 和IL-6、PGE2 的表达结果显示,0.3、1、3及10 μmol·L-1的苦参碱可抑制LPS 诱导的小胶质细胞活性氧ROS 的产生以及炎症因子IL-6、PGE2 的释放,明确了苦参碱在小胶质细胞中的抗炎作用。苦参碱能够抑制小胶质细胞的M1型极化,促进小胶质细胞向M2 表型转化,而这些功能与上述的CX3CR1 的功能相似。因此,本课题组后续通过Western blot 与免疫荧光检测CX3CR1 蛋白含量的变化,结果发现,LPS组的CX3CR1 相对表达量下降,与Panek 等[22]的研究一致。另外,本文也观察到苦参碱能够有效上调小胶质细胞中CX3CR1 蛋白的表达。
综上,苦参碱能够抑制LPS 诱导的小胶质细胞炎症因子释放,抑制小胶质细胞的M1 型极化,促进小胶质细胞向M2 表型转化,并上调CX3CR1的表达。后续,本研究将重点关注苦参碱与CX3CR1 之间的作用模式以及CX3CR1 与小胶质细胞极化之间的联系,从而为苦参碱治疗神经炎症的机制研究提供更为有力的实验依据。

