利用肝脏类器官探究CEBPD和HMGA2对胆管细胞向肝细胞转分化的作用
金 丹,魏劲松,赵 冰
(复旦大学 生命科学学院,上海 200438)
肝脏是人体内最大的实质器官,主要由肝实质细胞及胆管上皮细胞构成,发挥着营养物质代谢、解毒及免疫等重要生理功能。肝脏具有强大的再生能力,能够在损伤后快速完成自我修复,这对于肝脏解毒功能的实现非常关键。损伤发生后,成熟的肝实质细胞能够快速启动自我复制以补充损伤的组织[1],是损伤修复的主要细胞来源[2]。酒精及毒素等成分的长期接触,会导致肝实质细胞再生能力受损,门静脉周的胆管细胞可转分化形成肝实质细胞[3-4],对损伤修复也有着重要贡献。然而,胆管细胞向肝实质细胞转化的分子机制仍有待探索。胆管类器官,能够保持胆管细胞特征并在体外长期扩增,同时具备向成熟肝实质样细胞分化的潜能[5],为体外探究肝脏发育及谱系转化提供了新的途径。腺相关病毒(Adeno-Associated Virus, AAV)可高效便捷地实现胆管类器官感染与基因操控[6],进一步拓宽肝脏类器官的应用前景。
CCAAT/增强子结合蛋白δ(CCAAT/Enhancer Binding Protein Delta, CEBPD)通过亮氨酸拉链结构域结合DNA,在多种细胞类型中调控基因表达[7]。CEBPD的表达受到促炎细胞因子、皮质类固醇、低氧低糖等多种因素的诱导[7-8],对于细胞应激、炎症发生及细胞周期的调节至关重要[9-10]。例如,CEBPD可响应促炎因子白细胞介素IL-1β,促进培养成骨细胞及血管平滑肌细胞的增殖[11-12];营养和空间的限制可诱导CEBPD的表达,促进乳腺上皮细胞和成纤维细胞的接触抑制[13]。肝脏具有解毒功能,如果长期接触内源毒素、药物、尼古丁等物质,那么快速地响应损伤信号、启动细胞更新及谱系转化的能力对于它来说就至关重要,而作为协助多类组织细胞应激的CEBPD在肝脏细胞命运决定中的功能还未有过报道。
高迁移率蛋白A2(High Mobility Group A2, HMGA2),可与基因上AT富集区结合,改变染色质构象进而调控基因表达,是一种结构性转录因子[14]。人与小鼠胚胎发育早期的肝脏组织高表达HMGA2蛋白,随着发育进行,在妊娠晚期该蛋白表达逐渐下调,出生后健康肝脏组织中检测不到其表达[15]。此类表达模式提示HMGA2可能参与肝祖细胞的谱系维持。此外,HMGA2还是重要的原癌基因,参与调控TGF-β/Smad2/ERK、Notch等多条信号通路[16]。在慢性肝脏代谢疾病、原发性肝癌及肝内胆管癌组织中,HMGA2表达水平均异常上调,与炎症加重、上皮间质转化、细胞周期异常及不良预后高度相关[17-19]。然而HMGA2在肝脏发育及干性维持中的功能尚未见报道。
本文以胆管类器官体外分化系统为实验模型,通过AAV-DJ实现基因操控,初步探究CEBPD与HMGA2这两个转录因子在肝细胞干性维持、谱系转化过程中的功能,提示了肝脏损伤后胆管细胞激活并形成肝实质细胞的机制,为类器官在再生医学中的应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
C57BL/6小鼠购自上海模式生物研究中心,饲养于SPF级鼠房。所有涉及动物的操作均得到复旦大学动物保护与使用委员会的许可(SYXK(沪)2020-0032)。
1.1.2 主要试剂
Advanced DMEM/F12、DMEM、磷酸盐缓冲液(Phosphate Buffered Saline, PBS。含NaCl 137 mmol/L,KCl 2.7 mmol/L,Na2HPO44.3 mmol/L,KH2PO41.4 mmol/L的水溶液)、青霉素-链霉素(P/S,含10 000 U/mL青霉素和10 000 U/mL链霉素)、谷丙氨酸二肽(GlutaMAX-Ⅰ)、B27细胞无血清培养添加剂均购自Gibco公司,乙酰半胱氨酸(N-acetylcysteine)、烟酰胺(Nicotinamide)、胃泌素([Leu15]-gastrin)、DAPT、地塞米松(Dexamethasone)、胶原酶、中性蛋白酶Ⅱ均购自Sigma公司,TrypLE购自Life Technologies公司,Matrigel Matrix、Cell Recovery Solution均购自Corning公司,表皮生长因子(Epidermal Growth Factor, EGF)购自Invitrogen公司,成纤维细胞生长因子10(Fibroblast Growth Factor, FGF10)、R-spondin-1购自Kactus公司,肝细胞生长因子(Hepatocyte Growth Factor, HGF)购自北京义翘神州科技股份有限公司,A83-01购自Torcris Bioscience公司,无蛋白快速封闭液购自雅酶公司。
1.2 方法
1.2.1 小鼠胆管类器官分离培养及传代
分离培养: 取6~8周龄小鼠肝脏左叶,弃掉门管区域的肝脏组织,在预冷的PBS中清洗3次;在(含1%胎牛血清、0.5%P/S的DMEM)中将组织剪碎为0.5 mm3的小块,转移至15 mL管内,加入10 mL预冷的Wash buffer,轻轻吹打后,通过静置1 min或低速800 r/min离心10 s,弃掉上清以达到清洗的目的,重复3次;加入5 mL预置于37 ℃的消化液(含胶原酶与中性蛋白酶Ⅱ的Wash Buffer),水平放置在37 ℃摇床内,消化30~60 min;静置1~2 min或低速离心800 r/min 10 s,收集上清,转移至50 mL离心管;加入Wash Buffer至50 mL清洗,摇晃均匀后4 ℃ 200 g离心5 min,弃掉上清,重复两次;收集沉淀中胆管加入Matrigel,轻柔混匀后接种于24孔板,置于37 ℃培养箱10 min使Matrigel凝固,加入400 μL扩增培养基(Expansion Medium, EM)。每3天更换一次培养基。小鼠胆管类器官扩增培养基EM的成分: 添加10 mmol/L Nicotinamide、0.5 μg/mL R-Spondin-1、50 ng/mL EGF、100 ng/mL FGF10、50 ng/mL HGF、10 nmol/L[Leu15]-gastrin的Advanced DMEM/F12(含工作浓度的P/S、B27、GlutaMax-I、N-acetylcysteine)。
类器官传代: 用移液枪将包被在Matrigel的类器官轻轻刮下,转移至Eppendorf管内,加入预冷的PBS轻轻吹打,1 000 r/min离心1 min,弃上清;加入400 μL TrypLE,置于37 ℃培养箱进行消化,每隔1 min轻轻吹打,共消化5~6 min;加入1 mL预冷的PBS终止消化,吹打均匀,800 r/min离心3 min;弃上清,包被在Matrigel内接种入24孔培养板中。
1.2.2 细胞转染与重组AAV-DJ病毒包装
选用威格拉斯生物技术有限公司的VigoFect高效真核转染试剂,进行293T细胞转染。细胞密度为50%~70%时进行转染;转染前1 h更换新鲜预置于37 ℃培养箱的培养基;按照产品说明书的指示配制DNA与VigoFect混合的转染工作液,滴入细胞培养皿,轻轻混匀;24~48 h后收取细胞样品。
本课题用到的AAV-DJ病毒[6]为三质粒转染法包装获得。将AAV-DJ核心表达质粒、包装质粒、辅助质粒按照比例混合后,用VigoFect转染293T细胞。48 h后,弃培养上清,轻轻加入预冷的PBS清洗残余培养基,弃PBS;加入适当体积预冷的PBS,利用细胞刮刮下所有细胞,与PBS一同转移至Eppendorf管中,冻于-80 ℃冰箱15 min,转入37 ℃水浴锅15 min,每3 min涡旋振荡;重复以上冻存复温步骤2次,充分裂解细胞后,4 ℃ 14 000 r/min离心15 min,取上清即为病毒粗提液,按需求分装存于-80 ℃冰箱。
1.2.3 平面化AAV-DJ转导类器官及分化[6]
“平面化感染法”: 对48孔板进行预处理,每孔滴入5 μL 50%浓度的Matrigel(PBS稀释),用枪头将其摊开铺满孔底,将孔板置于37 ℃培养箱10 min使其凝固;用枪头将类器官和Matrigel一同轻轻挂下,转移至Eppendorf管内,加入预冷的PBS,轻轻吹打分离基质胶;1 000 r/min离心1 min,弃上清,利用含有10%~25%体积AAV-DJ病毒提取液的培养基重悬类器官,转移至预处理后的孔内。置于37 ℃培养箱感染12 h;将类器官及培养基转移至Eppendorf管,离心弃病毒上清;加1 mL预冷PBS轻柔吹打清洗病毒液,离心弃病毒上清,将沉淀包被在Matrigel内种入培养板中,置于37 ℃培养箱内培养。
AAV-DJ感染后的类器官在EM中培养48 h,弃培养基,PBS洗净残余培养基。加入第1阶段分化培养基(Differentiation Medium-1, DM-1),每天更换一次DM-1,持续4 d;第5天更换第2阶段分化培养基DM-2,每天更换一次DM-2,持续3 d。小鼠胆管类器官第1阶段分化培养基DM-1的成分: 添加了50 ng/mL EGF、100 ng/mL FGF10、10 nmol/L[Leu15]-gastrin Ⅰ、50 nmol/L A83-01、10 μmol/L DAPT的Advanced DMEM/F12(含工作浓度的P/S、B27、GlutaMax-I、N-acetylcysteine);第2阶段分化培养基DM-2的成分: 在DM-1的基础上添加3 μmol/L dexamethasone。
1.2.4 类器官染色
弃去孔板内的培养基,用预冷PBS冲洗;加入预冷的Cell Recovery Solution,置于4 ℃水平摇床1~2 h温和溶解Matrigel,转移至Eppendorf管中,低温离心去上清;预冷PBS清洗后,加入预冷4%多聚甲醛置于4 ℃摇床固定30 min;预冷PBS清洗3次,加入含有0.25% Triton X-100的PBS,透化处理15 min,离心弃上清;加入PBST(含0.1%Tween 20的PBS)清洗3次;利用PBST稀释的无蛋白快速封闭液,室温封闭30 min,离心弃上清;加入一抗4 ℃孵育过夜,PBST清洗3次;加入二抗室温孵育1 h,PBST清洗3次;离心后保留约100 μL上清,重悬类器官并转移至载玻片上,避免类器官聚集在一起,吸干多余水分,滴加抗淬灭封片剂,封片。
1.2.5 类器官RNA的提取及Realtime Quantitative PCR(RT-qPCR)
用移液枪将包被在Matrigel的类器官轻轻刮下,转移至Eppendorf管内,加入预冷的PBS轻轻吹打,离心弃上清;使用RNA提取试剂盒(Tiangen, Cat.DP420)进行RNA提取;使用NanoDrop进行RNA浓度及纯度测定。利用GoScriptTM(Promega, Cat.A5000)反转录试剂盒,按照说明反转1 μg RNA;使用2×SYBR Green Master Mix(Bimake, Cat.B21202)进行荧光定量PCR实验,每个样品设置3个技术重复。实验所用引物序列见表1。
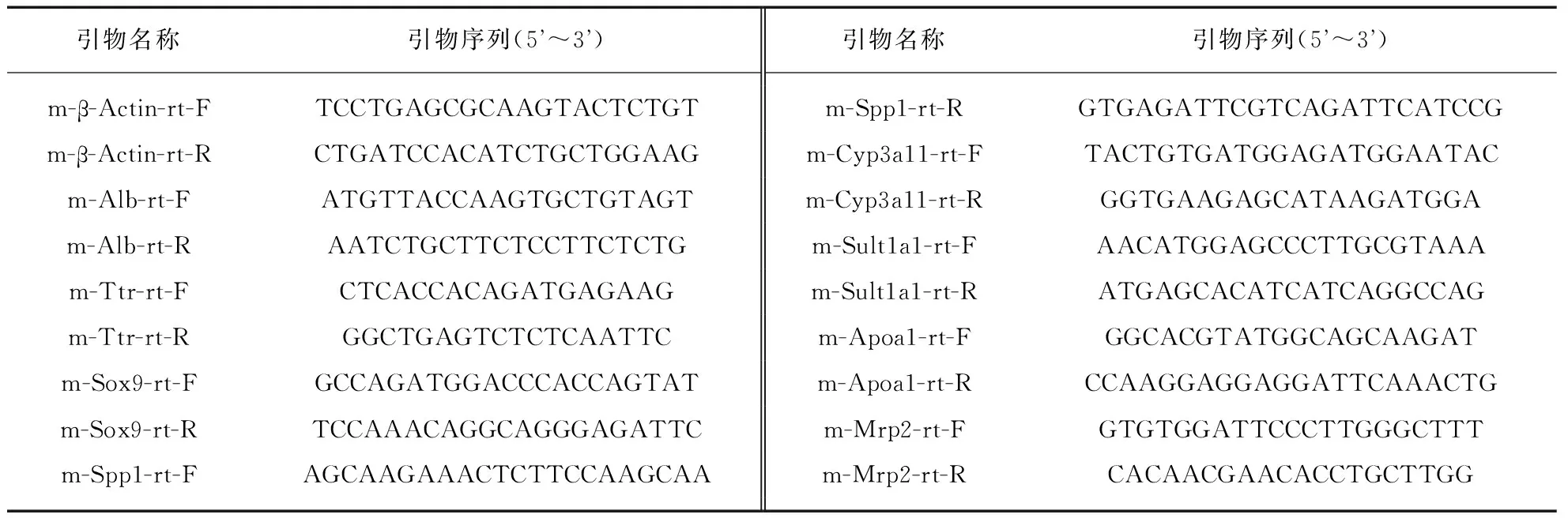
表1 实验所用引物
1.2.6 数据分析
所有值均表示为平均值±标准差形式。采用GraphPad软件进行统计分析。采用t检验和双向ANOVA检验比较两组间的差异,*P<0.05,**P<0.01,***P<0.001。每个实验独立重复至少3次。
2 结果与分析
2.1 构建AAV-DJ过表达质粒并验证病毒感染效率
我们首先在AAV-DJ的核心表达质粒中插入N端带有Flag标签蛋白的人源CEBPD、HMGA2编码序列,分别命名为AAV-Flag-CEBPD、AAV-Flag-HMGA2,质粒表达框架示意图如图1(a)所示;同时以带有GFP序列的质粒AAV-GFP作为对照。通过将核心质粒与包装质粒、辅助质粒一同转染293T细胞,48 h后裂解细胞获得AAV-DJ病毒粗提液。
为评估包装提取的病毒在体外感染细胞并表达目的基因的能力,分别利用AAV-Flag-HMGA2、AAV-Flag-CEBPD病毒感染293T细胞,24 h后收取细胞制成蛋白样品,进行Western blot试验,通过孵育Flag抗体检测目的蛋白的表达。如图1(b)所示,可检测到感染AAV-DJ组的293T细胞中目的基因CEBPD、HMGA2有显著表达,证实构建表达质粒成功,包装的AAV-DJ病毒具有转导细胞的能力。

图1 构建表达CEBPD、HMGA2的AAV质粒并验证病毒转导效率Fig.1 Construction of AAV vectors expressing CEBPD,HMGA2 and verification of the transduction efficiency(a) 为表达人源CEBPD、HMGA2基因的AAV核心质粒,目的基因N端为Flag标签序列;(b) 表达CEBPD、HMGA2基因的AAV-DJ感染293T细胞后,收取蛋白样品,Western blot试验检测带有Flag标签目的蛋白的表达。
2.2 表达CEBPD、HMGA2的AAV-DJ对小鼠胆管类器官感染效率验证
为进一步观察包装的AAV-DJ病毒对于完整胆管类器官的感染能力,我们采用了如图2(a)(见第162页)平面化的感染方式,即通过轻轻吹打的方式将生长至合适大小的胆管类器官从Matrigel中分离,与病毒液混匀后,转移至50%Matrigel预处理的平面感染12 h,将其收集至管中通过离心去除病毒液,恢复3D培养。此种感染方式避免了3D培养体系对病毒感染的干扰,预处理后的培养板能提供介于3D与平面间的培养环境,支持完整类器官的感染,避免消化成单细胞后感染带来的损伤及较长培养时间。
再次恢复3D培养48 h后,将类器官从胶中剥离,孵育Flag抗体进行免疫荧光染色,在奥林巴斯FV3000荧光倒置显微镜下观察其感染效率。如图2(b)(见第162页)所示,感染AAV-Flag-CEBPD、AAV-Flag-HMGA2的类器官中,可见大部分细胞均为Flag阳性,即成功感染AAV并表达了目的蛋白。以上结果说明包装提取的AAV-DJ对完整的小鼠胆管类器官有较高的转导效率。
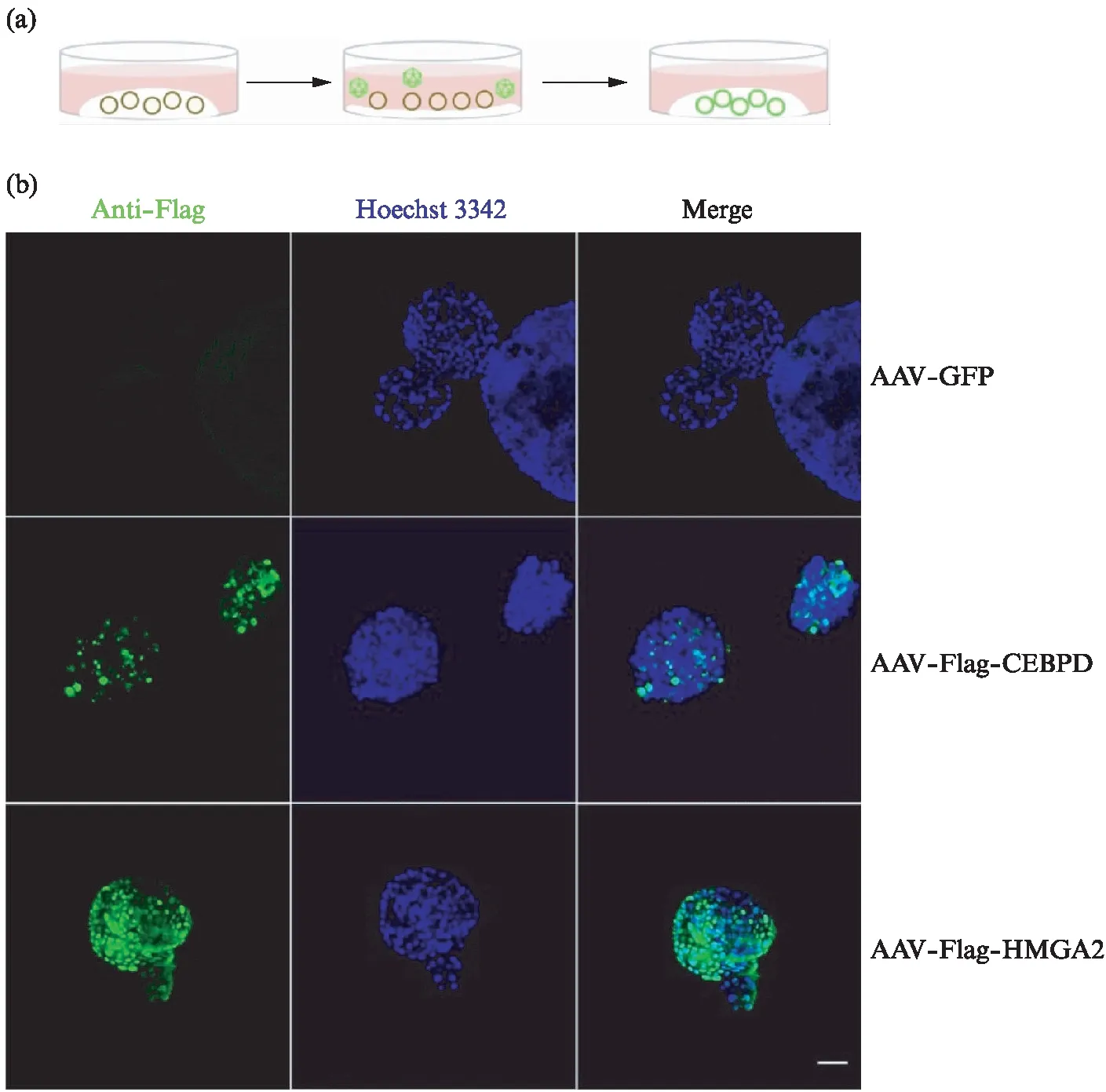
图2 过表达CEBPD、HMGA2的AAV-DJ高效感染小鼠胆管类器官Fig.2 Representative immunofluorescence images of mouse liver ductal organoids transduced with AAV-DJ expressing GFP, Flag-CEBPD or Flag-HMGA2(a) 为AAV-DJ平面化感染胆管类器官的实验流程示意图。将完整的胆管类器官从Matrigel中剥离后,与含病毒的培养基混合,转移至Matrigel预处理后的平面孵育12 h,PBS去除病毒后,将类器官恢复3D环境培养。(b) 为转导AAV-GFP(上)、AAV-Flag-CEBPD(中)、AAV-Flag-HMGA2(下)24 h的小鼠胆管类器官,在荧光倒置显微镜下成像。绿色: Flag(显示CEBPD或HMGA2的表达),蓝色: Hoechst3342(显示细胞核)。比例尺为50 μm。
2.3 过表达CEBPD可促进胆管类器官的分化
体外培养及诱导胆管类器官需要加入多种生长因子,从培养基中撤去Wnt信号通路激动剂R-spondin1,同时添加A83-01、DAPT分别阻断TGF-β、Notch信号通路。据文献报道TGF-β信号通路在胆管的形成和发育中具有重要作用,Notch信号通路对胆管细胞的分化十分关键[20]。借助类器官模型,我们研究了CEBPD、HMGA2在胆管向肝实质细胞分化过程的功能。
AAV-DJ感染类器官后,对类器官进行7 d分化处理,收集类器官提取RNA,荧光实时定量PCR检测胆管细胞及肝实质细胞相关标志基因表达水平。EM-GFP指感染AAV-GFP后培养在扩增培养基中的类器官,DM-GFP指感染AAV-GFP后培养在分化培养基中的类器官,感染AAV-CEBPD或AAV-HMGA2后培养在分化培养基中的类器官,分别记为DM-CEBPD或DM-HMGA2。
如图3所示,与EM-GFP组相比,DM-GFP组类器官中胆管标志基因Sox9、Spp1的表达显著下调,多个肝实质细胞标志性基因,如白蛋白基因Albumin、甲状腺素转运蛋白基因Ttr、细胞色素P450家族成员基因Cyp3a11、载脂蛋白基因Apoa1、尿蛋白编码基因Mup20等显著上调,表明该分化处理能显著诱导胆管类器官向肝实质细胞分化。
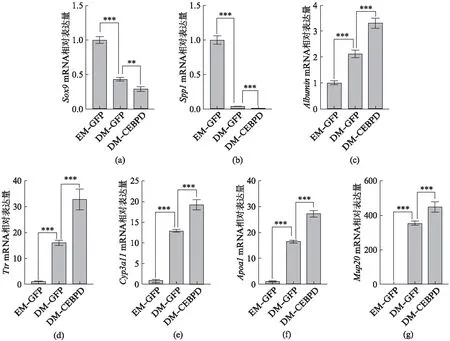
图3 过表达CEBPD促进胆管类器官向实质细胞分化Fig.3 Overexpression of CEBPD enhances the differentiation of cholangiocytes into hepatocytesqRT-PCR检测胆管上皮细胞标志基因: Sox9(a),Spp1(b),与肝实质细胞标志基因: Albumin(c),Ttr(d),Cyp3a11(e),Apoa1(f),Mup20(g)的相对表达量,内参基因为β-Actin。EM-GFP、DM-GFP为感染AAV-GFP后分别培养于扩增培养基和分化培养基的类器官,DM-CEBPD为感染AAV-Flag-CEBPD后于分化培养基培养同等时长的类器官。统计数据为平均值±标准差,n=3,**表示P<0.01,***表示P<0.001。
与DM-GFP组相比,胆管类器官中过表达CEBPD基因且经过诱导分化可进一步显著下调胆管标志基因Sox9、Spp1的mRNA水平;而Albumin、Ttr、Cyp3a11、Apoa1、Mup20等指示肝细胞成熟的基因mRNA水平均显著升高,指示该转录因子能够促进胆管上皮细胞向实质细胞分化。
2.4 过表达HMGA2对胆管类器官的分化起抑制影响
在胆管类器官中过表达HMGA2并诱导分化,谱系转化相关基因表达如图4(见第164页)所示。与DM-GFP组相比,在分化过程中下调的胆管细胞标志基因Spp1的mRNA水平显著升高,Sox9mRNA水平无显著差异。尽管肝实质细胞经典标志基因Albumin在HMGA2过表达组与DM-GFP组中无显著差异,但是多个肝实质细胞标志基因mRNA水平均显著下调,如Ttr、Cyp3a11、Mup20、Apoa1;值得注意的是,在胆汁排泌和葡糖苷酸修饰的胆红素转运过程中起重要作用的基因Mrp2,其mRNA水平也显著下调;此外,关键的磺基转移酶基因Sult1a1的mRNA水平在HMGA2过表达组也显著下调,磺基转移酶不仅能修饰胆汁酸、毒素以降低其细胞毒性,其加工对于药物、激素等物质的转运非常重要,其表达也是肝功能代谢实现的一个重要标志。可见在胆管类器官向实质细胞分化过程中,HMGA2能够多维度地抑制肝脏的蛋白合成、胆汁排泌、载脂等功能,对胆管细胞转分化过程起抑制作用。
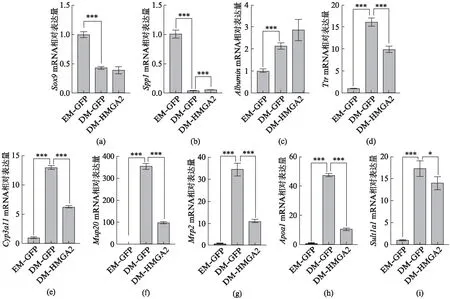
图4 过表达HMGA2抑制胆管类器官向实质细胞分化Fig.4 Overexpression of HMGA2 inhibits the differentiation of cholangiocytes into hepatocytesqRT-PCR检测胆管细胞标志基因: Sox9(a),Spp1(b),与肝实质细胞标志基因: Albumin(c),Ttr(d),Cyp3a11(e),Mup20(f),Mrp2(g),Apoa1(h),Sult1a1(i)的相对表达量,内参基因为β-Actin。EM-GFP、DM-GFP为感染AAV-GFP后分别培养于增殖培养基和分化培养基的类器官,DM-HMGA2为感染AAV-Flag-HMGA2后于分化培养基培养同等时长的类器官。统计数据为平均值±标准差,n=3,*表示P<0.05,***表示P<0.001。
3 讨 论
目前肝脏类器官培养材料多取于成体肝脏的胆管组织,可长期扩增,并具备向肝实质细胞分化的潜能[5],高度还原体内环境肝脏细胞转分化,可作为探究体内肝脏发育及细胞可塑性的理想模型。AAV对于类器官高效的基因操控效果,加速了类器官的广泛应用。本工作结合AAV的高效转导与胆管类器官体外分化系统,在体外首次揭示了CEBPD、HMGA2对肝实质细胞分化的重要影响。
在本文工作中我们发现,在胆管类器官中过表达CEBPD后进行分化处理,不仅可以进一步下调胆管的标志基因Sox9、Spp1,同时促进肝脏功能基因Albumin、细胞色素P450家族成员Cyp3a11、载脂蛋白编码基因Apoa1的表达。研究证实该蛋白可协助胆管类器官更强烈地响应分化相关信号分子,增强分化程度,加速胆管细胞向肝实质细胞的转化,这和过去工作揭示的CEBPD响应应激、参与细胞周期调节与命运决定的功能一致。类器官体外分化模型高度模拟体内谱系转化过程,因此CEBPD是否参与调控体内胆管细胞响应损伤信号、大量扩增并向肝实质细胞分化等过程,值得进一步探究。
在胆管类器官分化过程中,HMGA2蛋白的过表达能显著抑制肝脏功能相关多基因的表达,包括胆汁酸修饰相关的Sult1a1、解毒相关的细胞色素P450家族成员基因Cyp3a11、胆红素转运蛋白编码基因Mrp2、载脂蛋白编码基因Apoa1等。该蛋白抑制肝细胞功能基因的潜力可能对应其在胚胎肝脏中高表达的模式,其高表达可维持细胞干性,抑制细胞分化,该蛋白在发育晚期显著下调对于肝实质细胞成熟非常关键[21]。HMGA2可抑制分化过程中干性相关标志基因Spp1的下调,临床数据库的深度挖掘发现Spp1可能是肝细胞癌发生早期的敏感指标,与肿瘤的侵袭转移、凋亡抑制高度相关[22],HMGA2与Spp1表达的正相关性是否与其在非酒精性脂肪性肝炎、肝癌及肝内胆管癌中异常表达相关,也是值得深入探讨的生物学问题。
成体组织来源的肝类器官,不仅能够在体外还原不同类型肝脏疾病[23-25]及肝肿瘤[26]基因的表达与关键特征,作为移植材料还能在体内修复功能缺陷肝实质细胞[23],重建胆囊壁[27],展现了其在肝脏发育、疾病模拟、再生医学等领域中的巨大潜力。高脂食物、药物、酒精的长期摄入及精神压力会导致慢性肝损伤,肝脏再生能力受损,此时胆管细胞同时体现出胆管及肝实质细胞的表达谱,谱系追踪也发现胆管细胞具有双向分化潜能,对肝脏修复具有重要作用[3,28]。肝类器官的运用能够加速胆管细胞转分化过程中不同转录因子的功能解析,加深对胆管类器官命运调控的理解,这不仅助力肝脏疾病的体外建模及相关药物的研发,还能够更精准高效地调控细胞谱系转化,为再生医学的发展提供丰富的理论基础。

