南海东北部陆坡区浮游有孔虫壳体的原位微区Mg/Ca分析
张广璐,杨俊,龙海燕,赵彦彦,2,邹立,魏浩天,刘盛,杨丹丹,孙国静
1.深海圈层与地球系统教育部前沿科学中心,海底科学与探测技术教育部重点实验室,中国海洋大学海洋地球科学学院,青岛 266100
2.青岛海洋科学与技术试点国家实验室海洋矿产资源评价与探测技术功能实验室,青岛 266237
3.中国海洋大学环境科学与工程学院,青岛 266100
钙质有孔虫壳体的同位素和微量元素是反演古海洋环境和古气候的重要手段和获取现代海洋信息的重要方式[1]。浮游有孔虫壳体的碳氧同位素组成(δ18O和δ13C)能反映海平面变化、生产力水平,指示季风和洋流变化等[2-4];浮游有孔虫的δ18O值和Mg/Ca比能恢复晚第四纪以来的表层海水温度(SST)和盐度(SSS)[5-7];而底栖有孔虫的Mn/Ca比和B/Ca比能够对底层海水的化学环境作出指示[8-9]。
近些年来,随着测试技术的不断发展,电子探针(EPMA)、激光剥蚀电感耦合等离子体质谱(LAICP-MS)、离子探针(Nano SIMS)等原位测试技术已经在双壳类[10]、耳石[11]、珊瑚[12]、石笋[13]等碳酸盐样品上得到越来越广泛的应用。相较于传统的溶液法其复杂的前处理过程[14],原位分析方法仅需少量个体和简单的前处理步骤,便可获取高空间分辨率下不同生物壳体、壳体上不同位置的主微量元素含量的分布信息,进而反映出生物体在不同生长阶段中周围环境的变化,尤其为一些珍贵样品的测试提供新的思路方法。
有孔虫壳体在形成时,海水中的Mg会与壳体中的Ca发生置换,该过程为吸热过程,因此壳体中的Mg/Ca比能敏感地反映出海水的温度变化[15]。先前的研究显示有孔虫壳体的Mg/Ca与其周围海水温度呈指数相关,并且认为温度是控制有孔虫壳体Mg/Ca比的主要机制[16-17]。但有孔虫的微区测试则直观地表明,其壳壁上呈现出不均一的变化,并且往往超过了其栖息深度海水温度变化可以解释的范围[18-20],这些结果都指向了Mg/Ca比变化的影响因素可能不仅只是温度。一些有孔虫壳壁上存在高Mg/Ca比条带,如G.sacculifer、G.ruber和O.universa等,这些条带变化有着一定的形成时间和形成机制,但是对于另外一些属种如N.dutertrei等,Mg/Ca分布则相对比较均匀,且受到溶解的影响较大[21-23]。也可能由于都选择了同一结壳程度的个体,导致Mg/Ca比的整体测试结果明显偏高或偏低[24-26]。这些有孔虫壳体中的元素分布和变化情况,在传统测试中无法进行直接观测,因此利用有孔虫高空间分辨率原位测试方法,对研究和解释Mg/Ca比的影响因素、避免重建海水温度的误差有着重要意义。
南海作为西太平洋最大的边缘海,有着丰富的沉积物质来源以及较快的沉积速率,是古海洋学研究的重点场所,但以往南海的研究多选择水深较浅的陆架及陆坡区沉积物样品进行测试分析,站位水深均小于2 000 m,位于碳酸盐溶跃面(CCD)之上,有孔虫壳体中的地球化学信息保存较为完整[27-29]。为了研究南海深水环境下有孔虫壳体的地球化学指标变化,本研究选取南海东北部深水区的沉积物样品进行测试分析。在显微镜观察、扫描电镜图像(SEM)等基础上,通过EPMA和LA-ICP-MS方法,对不同属种浮游有孔虫的微观结构、壳体元素分布以及主微量元素含量变化情况进行分析,同时对影响壳体Mg/Ca比值变化的因素进行探讨,为今后南海东北部陆坡区较深水环境样品的测试提供数据和基础。
1 材料与方法
此次研究的样品DZ5为“向阳红18”于2020年在中国南海东北部陆坡区(20°23.5' N、119°30.1' E)所取得的重力柱状样品,取样水深3 071 m。本次研究所利用的浮游有孔虫取自岩芯顶部0~1 cm的表层沉积物中。该岩心样品在19 cm处的AMS14C 测年结果为1 162 a,因此认为本研究所选取的表层样属于现代沉积物样品(表1)。

表1 DZ5重力柱状样品19 cm处的AMS14C测年数据和校正年龄Table 1 AMS14C dating data and corrected age of the gravity core sample of DZ5 at 19 cm
浮游有孔虫G.ruber为共生种,其壳体易溶,表面发育针刺,广泛存在于热带和亚热带水域中,主要生活在表层海水中,P.obliquiloculata和N.dutertrei主要生活在次表层,G.inflata为无刺的深层种有孔虫 。 此 外 ,P.obliquiloculata、N.dutertrei、G.inflata通常均具有较厚的富低Mg方解石外壳[26]。了解有孔虫在生命周期不同阶段的变化,对这些地球化学指标更好地应用于整体测试具有很大意义。因此本研究重点选择对G.ruber、N.dutertrei、P.obliquiloculata和G.inflata4种有孔虫进行测试,借以探讨共生体和生长结构等因素对不同水深有孔虫壳体Mg/Ca比的影响。
在实验室中将低温、保存完好的沉积物湿样置于500 mL烧杯中,加入适量浓度为10 %的H2O2溶液超声清洗30 min至样品充分分散,再浸泡样品24 h以完全除去有机质。之后用240目(孔径0.063 mm)不锈钢筛在超纯水下冲洗样品,将分离出的粗粒组分放入冷冻干燥仪中进行干燥。用80目(孔径0.200 mm)不锈钢筛对干燥后的样品进行筛选。最后在体视显微镜下挑选出一定数量的浮游有孔虫壳备用。挑选时要保证所选的样品壳体完整且大小较一致,壳体表面干净无明显污染,以备下一步分析测试。
1.1 扫描电镜观察
为了更加清楚地观察样品的保存和受污染情况,以及不同属种有孔虫的壳体形态,首先在中国科学院壳幔物质与环境重点实验室对样品应用扫描电镜进行了观察。每个属种选取4~6枚完整壳体,并用胶固定在碳带上,之后用解剖针将每个属种其中的1~2枚壳体轻轻压碎。喷碳后,在Tescan Mira 3 LMH上进行观察。
1.2 电子探针测试
选取G.ruber、P.obliquiloculata、N.dutertrei、G.inflata4个属种的有孔虫壳各4~8枚并制作环氧树脂靶。测试在中国科学技术大学电子探针实验室进行,实验仪器为JOEL JXA-8530F plus。每个属种选取2个形态较好的个体进行打点测试,电子束加速电压为 10 kV,束流为 10 nA,束斑直径为5和10 μm。选点时尽量在壳壁厚度不同的位置上打点,以保证得到不同壳层的地球化学信息,每个有孔虫个体测试点数为10~15个。之后对有孔虫进行Mg、Ca、Mn、Sr含量的面扫描,实验过程中的电子束加速电压为15 kV,束流为20 nA,电子束驻留时间为30 ms。
1.3 LA-ICP-MS 测试
为了获得不同有孔虫属种、同属种不同腔室以及不同壳体深度上主微量元素含量的变化情况,在中国海洋大学海底科学与探测技术教育部重点实验室对G.ruber、P.obliquiloculata、N.dutertrei、G.inflata四个属种进行了LA-ICP-MS测试。为了验证实验结果,首先将有孔虫样品分为两部分,一部分样品未清洗,另一部分样品则用甲醇进行了清洗:在挑选的样品中加入10 %的H2O2溶液静置30 min,然后用去离子水清洗3次,再加入分析纯级甲醇溶液并进行温和的超声处理,该过程重复3次且每次超声时间<5 s,去离子水清洗4次后将样品在40 °C下烘24 h。同时测定已清洗和未清洗两部分的样品,以便比较不同处理方法对测试结果的影响。测试时,在每个壳体不同腔室上各选取1~3个分析位置,并由壳体外逐渐向内进行激光剥蚀。由于有孔虫壳壁较薄,激光能量和束斑直径太大易使壳壁碎裂,因此测试时选取的能量密度为4 J/cm2,激光束斑直径为32 μm,剥蚀频率4~7 Hz。剥蚀总时间为105 s,其中载气空白25 s,激光剥蚀时间40 s。如果剥蚀过后壳体没有出现明显的碎裂情况,表明所选仪器参数能够满足测试需求。测试过程中,选取电子探针获得的43Ca含量作为内标,选取美国国家标准技术研究院的NIST 610玻璃作为外标,每进行一个有孔虫个体的分析之后,即插入两个NIST 610标准进行校正。
由于有孔虫中Ca含量分布相对均匀,因此激光剥蚀开始时,在信号图上可明显观察到Ca信号均匀出现,而当激光穿透内壁时,激光剥蚀剖面中Ca的信号值会突然减少,并且还可能会伴随着Al和Mn信号的上升[30](图1)。因此,根据信号值的变化情况,我们主要选取了完整的剖面进行数据处理。

图1 有孔虫样品LA-ICP-MS测试的元素信号图Fig.1 Element signal diagram of foraminifera samples tested by LA-ICP-MS
2 结果
2.1 扫描电镜观察
利用扫描电镜(SEM)能够直观观察到有孔虫壳体的生长方式、表面形态以及保存情况。G.ruber中观察到较大的末腔室和较宽较高的口孔,而N.dutertrei可见5个腔室旋转排列,所挑选的有孔虫样品腔室均完整,没有明显破碎(图2a、f)。G.ruber和G.sacculifer表面孔隙较大且密集,但是没有出现明显的裂纹和变宽的迹象,G.ruber表面可观察到孔隙间分布的刺根未被剥落(图2b、c)。N.dutertrei表面存在不平整的凸起(图2e),G.inflata部分孔隙被覆盖或填充(图2g),P.obliquiloculata则较为光滑地呈现出瓷质光泽(图2d),这些有孔虫表面干净没有严重污染。壳体横截面可见有孔虫的层状生长结构(图2h、i)。

图2 有孔虫的SEM图像a, b.G.ruber的个体和表面形态,c.G.sacculier的孔隙,d.P.obliquiloculata的瓷状外壳,e, f.N.dutertrei个体和壳体粗糙的表面,g, h.G.inflata表面被覆盖了的孔隙及层状生长结构,i.G.truncatulinoide的层状生长结构,可见较厚的外部方解石层。Fig.2 SEM images of foraminiferaa, b.The individual of G.ruber and its outer surface morphology, c.pores of G.sacculier, d.porcelain like crust of P.obliquiloculata, e, f.the individual of N.dutertrei and its rough surface of crusts, g, h.covered pores on the surface and the layered growth structure of G.inflata, i.layered growth structure of G.truncatulinoide with thicker outer calcite crusts.
2.2 电子探针面扫
剖面的SEM图显示壳体外侧的高低起伏程度很大,且外部方解石层与壳体外侧的形状保持一致,而不与内侧腔室的弧形相平行(图3a黄色虚线)。电子探针面扫描图像显示,在有孔虫壳内Ca、Sr和 Mn元素含量分布均匀(图3b、c、e),但所有样品中Mg元素含量呈现条带状分布,由外到内,G.ruber壳体中发育多组窄的高Mg条带和较宽的低Mg条带(图3d)。
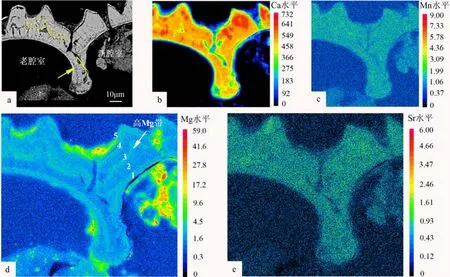
图3 G.ruber的电子探针面扫描图像黄色箭头标记处为新老两腔室交界。Fig.3 Electron microprobe elemental mappings of G.ruberThe yellow arrow marks the junction between old and new chambers.
相对而言,G.inflata、P.obliquiloculata和N.dutertrei发育更厚的低Mg外壳,其中G.inflata和P.obliquiloculata的中部壳层和最内层附近均发育高Mg带(图4a2、b2)。N.dutertrei的Mg元素分带不如其他属种明显,但仍可以清晰地观察到Mg元素含量的变化(图4c2)。不过,需要注意的是Mg元素含量在平面分布图上,一些边缘呈现的“高值”,也可能是测试时产生的“边缘效应”[31]。Mg/Ca比分布图也与Mg元素含量较一致,呈现带状分布(图4d、e)。此外,两个腔室交界处显示,新腔室形成的方解石层覆盖在先前形成的腔室上(图4a1、c1)。

图4 G.inflata、P.obliquiloculata和 N.dutertrei的电子探针面扫描图像a1, a2, d. G.inflata,b1, b2, e.P.obliquiloculata,c1, c2.N.dutertrei。黄色箭头标记处为新老两腔室交界。Fig.4 Electron microprobe elemental mappings of G.inflata, P.obliquiloculata and N.dutertreia1, a2, d.G.inflata, b1, b2, e.P.obliquiloculata, c1, c2.N.dutertrei.The yellow arrow marks the junction between old and new chambers.
2.3 LA-ICP-MS测试
2.3.1 Mg/Ca和Sr/Ca
LA-ICP-MS测试结果表明,G.ruber的不同个体、同一个体不同腔室以及同腔室的不同深度上,Mg/Ca和Sr/Ca比都具有不同的特征。为了描述方便,将未经甲醇清洗的两个G.ruber个体记为GR未1、GR未2,经甲醇清洗的样品记为GR已。同时,有孔虫的腔室是按时间先后依次生长形成的(即初腔室最早形成,末腔室最后形成),为了获得完整的生长序列的数据,对能测得的有孔虫腔室都进行了测试。用F表示最末一个腔室,F1表示倒数第二个腔室(图2a、f),f-a表示最末一个腔室的第一个激光剥蚀位置,f1-a表示倒数第二个腔室的第一个激光剥蚀位置,f1-b表示倒数第二个腔室的第二个激光剥蚀位置,依次类推。将同一个激光剥蚀位置上不同深度所有点的Mg/Ca比的平均值用来代表该位置上的Mg/Ca比;同一个体同一腔室上所有激光剥蚀位置的平均Mg/Ca比,代表此个体该腔室的Mg/Ca比;最后,用同一个体所有腔室的Mg/Ca平均值代表该个体的Mg/Ca比值。
测试结果表明,无论是已清洗的还是未清洗的样品,G.ruber个体的Mg/Ca比随测试深度的增加都存在较大变化。Mg/Ca高值均出现在距离腔室的外表面约1 μm的范围内,F腔室的Mg/Ca比较更早形成的腔室的Mg/Ca比低(图5a——c)。相对已清洗过的G.ruber个体,未清洗的个体具有更高的Mg/Ca比,且变化范围更大。其中未经甲醇清洗GR未1个体的 Mg/Ca 比为 5.16 mmol·mol-1,由早到晚形成的F2、F1和F三个腔室的Mg/Ca比分别为5.93、5.53和4.02 mmol·mol-1;在深度上,f2-a 和 f1-b 的 Mg/Ca比均呈现出两组先降低后升高的变化(图5a)。未经甲醇清洗的GR未2个体的Mg/Ca比为4.62 mmol·mol-1,由早到晚形成的F2、F1和F三个腔室的Mg/Ca比分别为 4.96、4.91 和 4.00 mmol·mol-1。Mg/Ca 比整体随测试深度增加而平缓降低,f2-a位置外表面的Mg/Ca 比可高达约 8 mmol·mol-1(图5b)。经甲醇清洗GR已个体的Mg/Ca比值较GR未1和GR未2都要低,为2.66 mmol·mol-1,F2、F1和 F三个腔室的 Mg/Ca比分别为 3.08、2.75 和 2.14 mmol·mol-1。GR已的 f2-a、f-a和f-b位置均可见一个明显的低Mg/Ca比值层(图5c)。此外,G.ruber壳体的Sr/Ca比变化较小(图5d——f),不同个体间、同一个体不同腔室间及同一位置的不同深度,Sr/Ca比值标准偏差均<0.15。

图5 G.ruber的Mg/Ca和Sr/Ca在壳体深度上的变化Fig.5 Variations of Mg/Ca and Sr/Ca ratios of G.ruber in shells depth
N.dutertrei,G.inflata,P.obliquiloculata三个属种的Sr/Ca变化幅度较小,个体间的变化范围为1.04~1.16 mmol·mol-1。而同属种中,已用甲醇清洗与未用甲醇清洗个体之间的Mg/Ca差异较大(图6)。
为了便于表述,我们将未清洗与已进行清洗的N.dutertrei分别记为ND未和ND已,其余两属种同上。结果表明,ND未和ND已所有腔室的Mg/Ca比均呈现出先降低后升高的趋势,其中F腔室的fa和 f-b 具有最高的 Mg/Ca 比(图6a、b),Mg/Ca 比分别为 4.65 和 2.23 mmol·mol-1。ND未外表面 1.5 μm处薄层的Mg/Ca比ND已更高,可高达9.74 mmol·mol-1(图6a中的 f-a)。
G.inflata壳体,不同腔室不同位置Mg/Ca比随测试深度的增加呈先降低后升高的变化趋势,GI未和 GI已个体的 Mg/Ca比分别为 1.69和1.50 mmol·mol-1。两个体中F腔室的Mg/Ca比均高于其他腔室,GI未个体的外表面发育高Mg/Ca比薄层(图6c中的f3-a、f3-b、f1-a、f-b)。
P.obliquiloculata不发育高Mg/Ca比的外表薄层。PO未中f3-a和f3-b的Mg/Ca比先降低后升高,其他位置的Mg/Ca比均随着测试深度的增加而升高(图6e、f)。

图6 N.dutertrei,G.inflata,P.obliquiloculata 的Mg/Ca在壳体深度上的变化Fig.6 Variations of Mg/Ca ratios of N.dutertrei, G.inflata, P.obliquiloculata in shells depth
2.3.2 Al/Ca和 Mn/Ca
测试结果还显示,在同一属种中,利用甲醇清洗过的个体比未进行甲醇清洗过的个体具有更低的平均Al/Ca比。所有个体中,未清洗的GR未1具有最高的 Al/Ca 比(4.12 mmol·mol-1),其 F2 腔室的Al/Ca比高达 7.50mmol·mol-1。而已清洗过的个体GR已、PO已、ND已和GI已的平均Al/Ca比分别为0.09、0.08、0.15、0.09 mmol·mol-1。
相比之下所有个体的平均Mn/Ca比则较低,除GR未1和PO未的平均Mn/Ca比稍高(分别为0.27和0.17 mmol·mol-1),其余各属种壳体的 Mn/Ca 平均值均低于 0.15 mmol·mol-1(表2)。
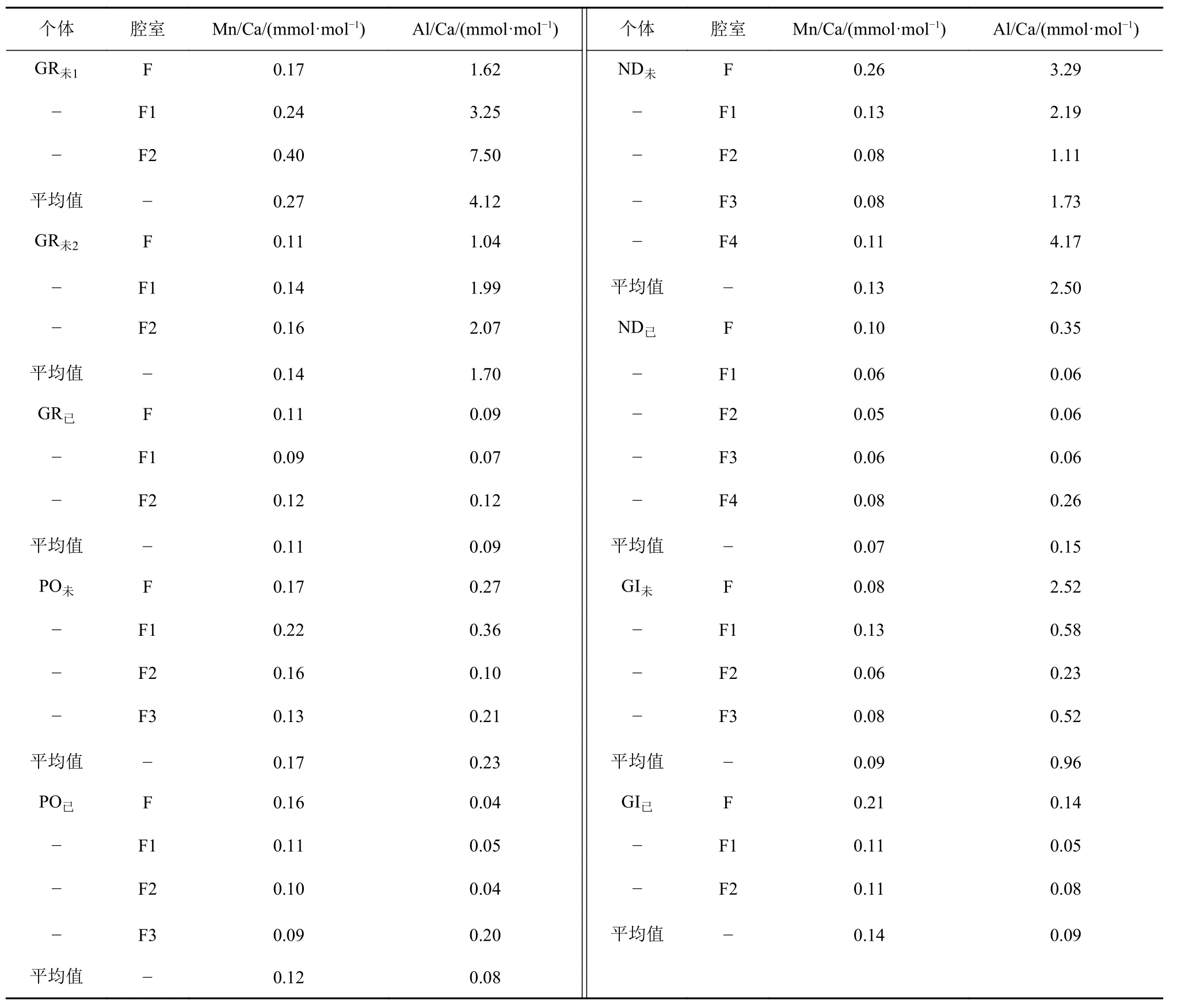
表2 各属种不同腔室的Mn/Ca、Al/Ca平均值Table 2 Average Mn/Ca and Al/Ca values in different chambers of each species
3 讨论
3.1 壳体溶解情况
有孔虫壳体中Mg元素含量分布不均,一般情况下,富Mg方解石溶解度相对较高,导致有孔虫壳体发生选择性溶解[32-33]。一般观点认为,随着水深的增加,如无针刺种G.tumida和深水种G.truncatuliboides等有孔虫中的高Mg/Ca比的方解石组分会优先溶解[34-35]。然而,先前也有实验表明,伴随高Mg/Ca比方解石组分优先损失的同时也可能有低Mg/Ca比方解石的均匀溶解[21]。此外,随着海水深度和压力的增加,碳酸盐组分的溶解度会增大,尤其在碳酸盐溶跃面附近溶解作用会突然增强,而在碳酸盐补偿深度界面(CCD)以下,钙质有孔虫壳体基本完全溶解。Sadekov等[22]对浮游有孔虫G.sacculifer的研究发现,溶跃面以下的样品存在明显的高Mg/Ca比方解石损失,并推测这很可能与富Mg腔室的优先溶解有关。Denkens等[36]通过对大西洋几个区域沉积物表层样的研究发现,位于溶跃面以下的有孔虫样品,其壳体Mg/Ca比也有明显的下降。因此,随着水深增加,钙质有孔虫的壳体会遭到不同程度的溶蚀和破坏[37]。南海的碳酸盐溶跃面和CCD约为3 000和3 500 m[38],而本研究中样品的水深为3 071 m,位于南海的碳酸盐溶跃面附近,有孔虫壳体很有可能发生部分溶解。张江勇等[39]研究发现,南海北部一些水深大于3 000 m的沉积物表层样品中也有着较高的有孔虫壳体丰度,说明在溶跃面附近也同样存在受溶解作用较小的有孔虫样品。但为了避免溶解作用对测试结果造成影响,我们首先通过观察超微结构,识别出有孔虫壳体是否已经发生部分溶解。已有研究表明,有孔虫的末腔较薄,最易遭受溶解破坏,并且随着溶蚀程度的增大,有孔虫的壳孔会变得更宽更深,孔间可能出现裂纹[40,41],而发育针刺的有孔虫,刺根会变小或被剥落[42]。本研究中,SEM图像显示有孔虫的每个腔室都保存完整,壳体表面刺根较为完好,壳孔呈现圆形,且孔间表面光滑未出现裂隙,孔间脊完整(图2),这表明各属种壳体没有被部分溶蚀,样品保存完好。
不同的清洗方法也会对有孔虫壳体的Mg/Ca比产生影响[43]。溶液法备样过程中的“还原清洗”步骤可能会导致有孔虫碳酸盐部分发生溶解,使得有孔虫整体的Mg/Ca比发生10 %~15 %的降低[14]。本研究选用LA-ICP-MS进行原位Mg/Ca比分析,避免了还原试剂对测试结果所造成的影响。
3.2 Mg/Ca比值的影响因素
3.2.1 壳体表面富Mg层
除P.obliquiloculata外,其余属种在最外层向内<2 μm的位置出现高Mg/Ca比层,其中N.dutertrei表面的Mg/Ca比值最高(图5——6)。张鹏等[44]通过对表层沉积样品研究发现,G.ruber壳体表面具有高Mg/Ca比值,并认为这可能是沉积后成岩作用的污染所致;而拖网所获取的活体G.ruber壳体表面的高Mg/Ca比可能是生物成因造成的[45]。但是在培养实验中,未经沉积作用的活体有孔虫G.sacculifer的壳体表面同样出现Mg元素的富集,这表明有孔虫自身的生理活动也可以沉淀出富Mg方解石成分[17]。Hathorne等[46]对沉积物捕获器中G.inflata和G.scitula有孔虫进行测试,也发现壳体表层Mg元素含量较高,他们认为这是在垂直沉降过程中,有孔虫吸附了黏土形成的。本研究结果表明,经甲醇超声清洗后的有孔虫壳体表面的Mg/Ca比虽然均有所下降但比值仍较高(图5c, 6b、 d)。因此,有孔虫壳体表面的高Mg/Ca比,可能主要与有孔虫的自身生命活动有关,但也可能是受到沉积之后污染的影响,这需要在后期的研究中进行验证。
3.2.2 Mg/Ca比值的海水温度重建
浮游有孔虫在生命周期中,会在一定的水深范围内垂向迁移[47]。有孔虫幼体自深部逐渐向上迁移并继续生长,后期会从浅部温暖的海水中再次向下迁移,并在深冷的海水中进行生殖[45,48-49]。前人研究认为浮游有孔虫幼体大小在200 μm以下[50],而本研究中的有孔虫个体均大于200 μm,因此,本研究中有孔虫属于成年个体,最后发育的腔室反映了其生命后期的生长过程。
深层种G.inflata的钙化范围为100~600 m[51],WOD数 据 库 (World Ocean Databases:www.nodc.noaa.gov)记录的研究区100~600 m水深的全年海水温度范围为7.2~22.5 °C。我们选取Groeneveld和Chiessi[26]利用G.inflata的Mg/Ca比建立的温度经验公式,恢复已清洗过的G.inflata个体GI已的F2 和 F 腔室的钙化温度分别为 9.1 °C 和 12.3 °C,分布在现代海水温度范围内。而F1腔室恢复的温度为7.0 °C,稍低于WOD的记录温度,指示了G.inflata可能在更深层水中发生了钙化。次表层有孔虫N.dutertrei和P.obliquiloculata分别主要生活在0~100 m和50~150 m的深度范围内[52],WOD记录的全年海水温度范围分别为 20.9 ~ 28.8 °C、 17.5~27.2 °C。根据Huang等[53]的经验公式,已清洗过的N.dutertrei个体ND已的F4至F腔室记录的温度分别为 13.9 °C、13.1 °C、11.1 °C、16.8 °C 和 21.6 °C;而已清洗过的P.obliquiloculata个体PO已的F3至F 腔室的钙化温度分别为 15 °C、14.2 °C、13.3 °C 和17.6 °C,几乎均低于实测的海水温度。导致这个结果的原因还未知,不过极有可能是由于N.dutertrei和P.obliquiloculata在生长发育过程中向更深的水中迁移导致的。但是,由于最后形成的F腔室是在温度最低、深度最大的海水中形成,如果壳体的Mg/Ca比仅是受温度的制约,那么F腔室的Mg/Ca比记录的海水温度应低于其余早形成的腔室所记录的温度。然而本研究的结果表明,3个属种有孔虫的F腔室的Mg/Ca比记录的温度均高于先形成的腔室。因此,有孔虫壳体的Mg/Ca比还可能受其他因素的制约。
浮游有孔虫G.ruber在其整个生命周期内主要生活在表层0~50 m水深范围内,在其生命末期会在稍深的水中钙化[54]。WOD数据库记录的研究区0~50 m水深范围内的年平均温度为25.4~26.7 °C,根据Dekens[36]等建立的温度公式,清洗后G.ruber壳体GR已的F2、F1和F腔室形成时的海水温度分别为 26.7 °C、25.5 °C 和 22.7 °C。这说明G.ruber个体可能首先在0~50 m的深度范围内进行了钙化,形成了F2和F1腔室,随着其生长发育的进行,逐渐向更深的水中迁移,导致最后形成的F腔室记录了更低的温度。利用f2-a位置的Mg/Ca比恢复的壳体不同深度的温度具有较大的变化范围,呈现先降低后升高,最后又降低的变化趋势,这一方面指示了周围水体温度并非均一稳定,而是不断变化的,另一方面也表明可能由其他因素影响了有孔虫壳体的Mg/Ca比。f2-a位置最外层Mg/Ca比恢复的温度为29.2 °C,稍高于研究区实测的夏季最高海水温度28.8 °C,可能是由于钙化过程中壳体表面富Mg层的影响(图7)。

图7 利用GR已个体f2-a位置的Mg/Ca比值恢复的温度(Mg/Ca=0.38 exp 0.09[SST-0.61h-1.6])[40]年平均温度范围和夏季最高温度数据来自于WOD数据库;阴影部分为本研究站位0~50 m的年平均温度范围。Fig.7 The temperature recovered by Mg/Ca of f2-a of GR已(Mg/Ca=0.38 exp 0.09[SST-0.61h-1.6]) [40]The annual average temperature range and summer maximum temperature data were obtained from the WOD; the shaded part is the annual mean temperature range from 0 to 50 m at this study station.
3.2.3 共生体的影响
有孔虫常与藻类共生,藻类可以为有孔虫提供能量来源,并帮助有孔虫清理代谢物等,如共生藻类可通过光合作用获取能量,供给宿主有孔虫蛋白质用于自身的生长和繁殖,并促使有孔虫壳体增强钙化[1]。这些共生藻类日间的光合作用和夜间的呼吸作用,可改变有孔虫周围微环境的pH:白天,共生藻的光合作用消耗CO2,使得微环境中的pH升高;相反,在夜间宿主有孔虫及共生藻的呼吸作用释放出CO2导致微环境中的pH降低,最终导致微环境中的pH产生较大的昼夜变化[55-56]。此外,有孔虫摄食或代谢等生命活动变化以及呼吸速率的不同也能导致微环境中pH值发生明显的波动[57]。共生种O.universa周围环境的pH每增加0.1个单位,Mg/Ca比就会降低约5%~7 %,这将导致O.universa的Mg/Ca比在白天比在夜间更低,从而导致O.universa壳体中出现多组窄的高Mg条带和宽的低 Mg 条带[58]。
此外,由于一些有孔虫在生命活动后期向更深更暗的海水中迁移,共生藻类接受到的光照水平会逐渐降低,藻类的活性也随之下降,从而导致有孔虫的Mg/Ca比发生变化[18]。一些浅水底栖有孔虫中也发现有共生体存在,含共生体的底栖有孔虫与不含共生体的底栖有孔虫相比,其Mg/Ca比值甚至可高一个数量级[59],如浅水底栖有孔虫O.umbonatus中Mg/Ca比的异常高值便可能是受到共生藻类的光合和呼吸作用的影响[60]。因此,有孔虫的共生藻类可间接地影响壳体的钙化,进而影响有孔虫壳体的Mg/Ca比。
本研究中,G.ruber表面存在的甲藻共生体[61],会引起昼夜间有孔虫周围微环境 pH 值的变化,从而导致G.ruber壳体中出现了高Mg和低Mg条带[62](图3d)。GR未1的 f2-a、f1-b和GR已的 f2-a、f-a、f-b的Mg/Ca比在深度上也出现高低的变化(图5a、c),这种变化与前人对G.ruber的研究是一致的,Sadekov等[63]同样认为这种变化不能仅归因于钙化温度的波动,也与G.ruber的共生藻类的活性有一定关系。N.dutertrei属于生活在温跃层的无刺种有孔虫,一般认为其属于非共生种,早前通过对N.dutertrei进行电子探针面扫描测试,认为其同一些非共生种有孔虫一样,往往缺乏周期性的窄高Mg条带,而出现更加宽厚的低高Mg分层[19]。但最近Fehrenbacher等[64]的研究认为,N.dutertrei存在着金藻共生体,通过纳米二次离子质谱测试(NanoSIMS)呈现出了清晰的高Mg条带。但在本研究的电子探针面扫描图像中,N.dutertrei的高Mg条带并不明显,并且Mg/Ca比在深度测试上也没有出现多组高低变化(图4c2, 图6a、 b),因此认为在本研究中,其可能受共生体的影响较小或者未受到共生体的影响。P.obliquiloculata和G.inflata属于非共生有孔虫,虽然偶尔可见共生体存在于G.inflata壳体表面,但这两种有孔虫的壳体均缺乏共生种特有的周期性Mg条带[19]。因此,共生体对P.obliquiloculata和G.inflata的影响不大。
3.2.4 外部方解石壳的影响
有孔虫在向深水中迁移或在生命末期释放配子体时,其外侧常会被包裹一层方解石壳[65](图2i,图4)。这种方解石壳较厚且在整个壳体中占很大比例,如G.sacculifer的方解石外壳可达到整体质量的约28 %,而在某些有孔虫中,这种外壳甚至可达整体的70 %[1]。通常,内部层状方解石晶体细小,但这种外壳中的方解石晶形较为粗大[46],壳体表面孔隙会被覆盖(图2e——g)。此外,由于有孔虫的这种方解石外壳具有较低的Mg/Ca比,因此会影响整个有孔虫Mg/Ca比的测定结果[66]。例如,Bolton和Marr[24]发现具有外部方解石壳的G.inflata样品的Mg/Ca比明显低于不发育方解石壳的Mg/Ca比。在本研究中,这种低Mg外壳的存在导致N.dutertrei、G.inflata和P.obliquiloculata等有孔虫的Mg/Ca比由外而内均呈升高的趋势(图6)。
本研究中G.inflata和N.dutertrei有孔虫个体末腔(F腔室)的Mg/Ca比明显高于先前腔室(F1和F2)的值,van Raden等[67]通过对浮游生物拖网和岩芯沉积物中的G.inflata样品的研究也发现,其F腔室的Mg/Ca比较F2和F1腔室的Mg/Ca比更高,并且这种差异可以达35 %。已有的研究表明,随着腔室由老到新,G.inflata和N.dutertrei的方解石外壳厚度逐渐变薄,末腔甚至不再发育方解石外壳[24,68],这可能是导致G.inflata和N.dutertrei中F腔室的Mg/Ca比较高的原因(图6a——d)。与G.inflata和N.dutertrei不同的是,P.obliquiloculata光滑的外部方解石壳可能是在末腔形成之后形成的,同时覆盖在了所有腔室的表面[66],因此随着深度增加,P.obliquiloculata各腔室均出现一段低Mg/Ca比(图6e、 f)。而G.ruber一般不发育典型的方解石外壳[65,69],随着G.ruber向更深的水中迁移并伴随着共生体的消失,F腔室的Mg/Ca比较F1和F2更低(图5a——c)。
3.2.5 有孔虫自身生理过程和个体发育的影响
有孔虫的不同属种、同一属种不同个体、同一个体不同生长阶段的生理过程不同,导致壳体形成过程中对海水中元素的吸收也存在差异,这种差异被称作“生命效应”[70]。生命效应主要包括有孔虫自身生理过程、个体发育、共生体影响等方面,会导致有孔虫壳体的微量元素和同位素组成发生变化[71-72]。除共生体的影响外,有孔虫自身生理过程和个体发育对有孔虫壳体内的Mg/Ca比也有重要影响。非共生种G.bulloides的实验室恒温培养结果表明,在25 °C的条件下其壳体的Mg/Ca比存在约2.3 mmol·mol-1的变化,很可能与有孔虫自身的内部调节有关[73]。在钙化的过程中,有孔虫自身生理过程参与始终,而不同矿化机制决定了钙化液的来源[74]。海水中的Mg2+和Ca2+离子通过跨膜运输或海水液化泡的方式进入有孔虫体内,并通过控制离子的泵出对钙化液中各离子浓度进行严格控制,进而调控着壳体钙化的开启和关闭,使有孔虫壳体的Mg/Ca比远低于海水中的Mg/Ca比[75]。有孔虫腔室壁呈双层结构,在一个新的腔室形成时,方解石在有机膜两侧开始沉淀,并且附近往往有较高的Mg/Ca比,Erez[76]认为这种高Mg方解石来源于富Mg矿物颗粒,并且与有机层结合紧密,而低Mg方解石是从海水中吸收进而沉淀到有机层的外侧,因此壳体内部的Mg/Ca不均匀分布可能是由于生物矿化机制的不同造成的。前人的研究表明P.obliquiloculata和G.inflata中的高Mg/Ca比部分与有机成分相关[20,46],而在本研究对G.inflata和P.obliquiloculata进行的电子探针面扫描测试中,壳壁的中部和最内层同样显示了两条清晰的高Mg条带(图4a2、 b2)。因此认为,本研究中这两种有孔虫出现的高Mg条带,很可能是其自身生理过程的调节引起的。
对于同属种不同有孔虫个体之间Mg/Ca比的差异也有诸多影响因素。尤其在利用Mg/Ca比进行海水温度重建时,需要选择尽可能多的个体来避免季节效应对测试产生的误差[77]。同一属种不同基因型的有孔虫也能造成δ18O和Mg/Ca比的明显差异,如:G.rubersensu stricto (s.s.)和G.rubersensu lato(s.l.)具有不同的Mg/Ca、δ18O和δ13C,且利用这两种形态的G.ruber恢复的温度差异可高达5 °C[63,78-79]。但也有研究认为,不同形态的有孔虫对δ18O和Mg/Ca比没有十分显著的影响[30,57,80]。目前,大家还未有统一的结论,还需要进一步研究,但本研究选择的3个G.ruber个体,均属于G.rubers.s.形态,因此认为不存在由于形态差异导致的个体间测试结果的不同。此外,不同发育阶段的有孔虫也会产生不同的Mg/Ca比,如3个腔室的G.inflata个体会比4个腔室的个体具有更高的Mg/Ca比,其差值可高达 1 mmol·mol-1[46]。在本研究选择的G.inflata中,GI未发育4个腔室,GI已发育3个腔室,两个体的平均 Mg/Ca 比相差较小(0.19 mmol·mol-1),但由于两个体的清洗条件不同,因此自身生长差异对G.inflata壳体Mg/Ca比值的影响还需更多的个体来论证。有孔虫壳体的大小同样对Mg/Ca结果具有影响,Elderfield等[81]通过对17种有孔虫的测试,发现大多数有孔虫随着个体大小的增大Mg/Ca比升高,并认为这可能是不同大小个体钙化率的不同导致的;Friedrich等[82]的实验也表明大多数有孔虫随着个体的减小其Mg/Ca比随之下降,可能与其配子成因方解石壳占比较大有关。随着有孔虫个体的增大,其表面共生体的密度也随之增加,也会进一步导致不同个体微环境的改变[83-84]。在本研究中,我们挑选的同属种的有孔虫个体均在相近的大小范围内,不同个体间Mg/Ca比的差异受个体大小变化的影响较小。综上,在进行有孔虫的挑选时,要尽量选择大小和形态一致的有孔虫个体,避免使测试结果产生偏差。
3.2.6 污染相的影响
有孔虫在海底被沉积物埋藏之后的成岩作用过程中,其表面会沉淀其他矿物,污染有孔虫壳体的Mg/Ca比。这些污染组分可能来自吸附的黏土颗粒、沉淀的Fe-Mn氧化物和富Mn碳酸盐等[85],污染组分会改变有孔虫壳体的整体Mg/Ca比,甚至出现异常高值[14]。富Mn的污染组分非常常见,尤其在海底热液和上升流发育的地区,大量生物成因有机碳会耗尽沉积物和水界面附近的氧气,在这种还原条件下形成了富Mn碳酸盐沉淀,最终导致有孔虫壳体中富含Mn元素[86]。这些富Mn的污染更易进入表面多孔且孔隙的穿透性更强的有孔虫属种的内部,如G.ruber[31]。应用LA-ICP-MS进行测试时,由于束斑的直径远大于有孔虫表面孔隙,所以测试中很可能包含了这些孔内的污染组分。因此,在测试之前,最好先去除这些污染相。机械清洗过程可以去除一部分与有孔虫方解石结合较弱的污染组分,而还原清洗则可以更好地去除Mn的氧化物,但不能有效去除富Mn的碳酸盐[31,87]。因此,即便使用更为繁琐、复杂的清洗步骤,可能也无法完全去除污染组分的影响。不过,相对溶液法,LA-ICP-MS分析可以更为直观地评估测试结果受到污染组分改造的程度。此外,在测试之前进行3~5个脉冲的预剥蚀,也可以有效地除去有孔虫表面污染组分的影响[63]。
测试中,Al元素的含量常用来指示有孔虫表面黏土颗粒的污染,而Mn元素的含量则可以指示富Mn碳酸盐、Mn的氧化物和氢氧化物的污染程度[30,88]。本研究中,各属种壳体的Mn/Ca比值均较低(表2),除 Gr1未和 Po已(r2=0.67;r2=0.73)外,其余有孔虫Mn/Ca与Mg/Ca的相关性均较差(r2≤0.5),表明有孔虫样品没有受到严重的富Mn矿物的污染,或者是样品的清洗已去除了部分Mn的污染。此外,LA-ICP-MS测试结果表明,未经过甲醇清洗的有孔虫个体具有更高的Mg/Ca比值。其中,未清洗的 GR未1(5.16 mmol·mol-1)和 GR未2(4.62 mmol·mol-1)比清洗的 GR已(2.66 mmol·mol-1)的 Mg/Ca 比更高,其差值分别为2.50和1.96 mmol·mol-1,而在P.obliquiloculata和N.dutertrei中差值分别为2.01和1.35 mmol·mol-1,这可能与壳体表面吸附的黏土矿物有关。在本研究中,G.ruber比其他属种的有孔虫受到污染更多,比如未清洗的GR未1受黏土污染最为严重,整体Al/Ca平均值高达4.1 mmol·mol-1。已清洗过的GR已与未清洗的GR未1相比,其Al/Ca值为0.09 mmol·mol-1,降低了 98 % 之多(图8)。虽然不同个体的Mg/Ca比值的不同可能是受到其自身生理差异的影响,但前人的研究结果表明,使用甲醇溶液超声清洗过的O.universa具有更低的Mg/Ca比[89]。因此,即使应用原位分析法,也需要对有孔虫样品进行多次甲醇超声处理,以除去黏土矿物对测试结果的影响。其次,在挑选样品时,也要选择表面干净的样品,并且在最终处理数据时要注意剔除污染部分,降低污染对Mg/Ca结果的干扰。

图8 G.ruber不同分析位置的Al/Ca、Mn/Ca平均值红色符号为Al/Ca比值,蓝色符号为Mn/Ca。Fig.8 Mean values of Al/Ca and Mn/Ca at different analysis positions of G.ruberThe red symbol is Al/Ca ratios and the blue symbol is Mn/Ca ratios.
4 结论
(1)通过SEM对来自南海东北部DZ5站位表层沉积物中的浮游有孔虫观察发现,其壳体保存较好,认为可以很好地记录环境中的地球化学信息。利用EPMA和LA-ICP-MS测试对4种浮游有孔虫G.ruber、N.dutertrei、P.obliquiloculata和G.inflata进行了原位微区分析,结果显示Mg/Ca比值均存在较大的变化。
(2)利用Mg/Ca比与温度方程进行海水温度恢复发现,除海水温度外,可能存在其他因素影响了有孔虫壳体的Mg/Ca比。对于共生种G.ruber,壳体表面的共生藻类会影响其壳体的Mg/Ca比。而N.dutertrei、P.obliquiloculata和G.inflata壳体的Mg/Ca比在深度上以及不同腔室间的变化,则可能受到壳体外部低Mg方解石壳的制约,有孔虫自身矿化过程可能影响了P.obliquiloculata和G.inflata壳体有机层附近高Mg分布。此外,个体发育情况也会使壳体的Mg/Ca比产生差异。
(3)将同属种进行甲醇清洗与未进行的个体之间进行对比,结果表明,污染相的存在会导致Mg/Ca测试结果偏高,使用甲醇对样品进行超声清洗并结合LA-ICP-MS测试可以获得较好的Mg/Ca比结果。
致谢:感谢中国海洋大学海底科学与探测技术教育部重点实验室张洋老师协助进行有孔虫的LA-ICP-MS测试,感谢中国科学技术大学中国科学院壳幔物质与环境重点实验室张少兵老师、李万财老师以及夏梅老师在样品测试过程中给予的指导和帮助,感谢评审专家提出的宝贵意见。

