稀土矿浮选中Ce3+离子活化方解石去活机理研究
屈奇奇,仝志斌
(晋能控股煤业集团煤炭洗选大地选煤工程有限责任公司马道头选煤厂,山西大同037000)
稀土素有“工业维生素”的美誉,是国民经济发展重要的战略金属资源[1]。
磁浮联合工艺是稀土选矿最常见、最有效的方法。选矿厂采用复合药剂(捕收剂+抑制剂),经“弱磁选-强磁选-浮选”工艺流程,获得一定品位、回收率的稀土精矿[2]。在稀土选矿中常伴随大量脉石矿物,主要以钙类矿物(方解石、萤石)为主,稀土和钙类矿物在磨矿时易产生大量难免金属离子,难免离子在矿物表面吸附和转化会改变其原来的表面性质和可浮性,严重影响稀土精矿的浮选,从而降低浮选精矿的品质[3]。
为了消除难免金属离子对这类脉石矿物的活化作用,本文以主要稀土矿物氟碳铈矿和钙类矿物方解石为研究对象,通过添加络合剂来络合去除难免金属离子对方解石的活化,恢复其表面性质和可浮性,达到提高氟碳铈矿浮选指标的目的。
1 Ce3+离子活化方解石的去活作用机理
稀土矿浮选过程中产生的难免金属Ce3+离子容易在方解石表面作用形成活性位点,捕收剂可与方解石表面的Ce3+离子活性位点产生络合吸附,进而增大其可浮性。为了消除Ce3+离子对方解石的活化,添加络合剂EDTA与溶液中Ce3+离子发生反应,形成一种稳定的络合物,可去除e3+离子对方解石的活化作用。
2 矿物浮选试验与分析测试方案
试验采用单矿物浮选试验研究络合剂EDTA对Ce3+离子活化方解石的去活规律;采用红外光谱分析仪和Zeta电位测试手段研究EDTA对活化方解石的去活作用机理。分析稀土矿浮选分离的发展过程,对稀土矿的开发和拓展具有重要的理论支撑和指导意义[4]。
(1)单矿物浮选
单矿物浮选采用XFGCⅡ-35型挂槽浮选机,浮选转速固定为1 992 r/min,浮选温度保持在室温。每次试验称取矿样2.000 g(误差±0.002 g),加入30 mL的去离子水,调浆后按照一定浓度和加药顺序依次加入浮选药剂,每次加药剂调整2 min,捕收剂可延长至3 min,浮选手工刮泡4 min,将泡沫产物进行烘干、称重,并计算浮选指标。
(2)红外光谱分析
矿样红外光谱采用Bruker VERTEX 70型傅里叶转换红外光谱仪进行测试。先将纯矿物样品研磨至粒径-5μm,称取1 g置于烧杯中,加入一定浓度的药剂后调节pH值,在磁力搅拌器上充分搅拌10 min后进行过滤,过滤样品再经真空干燥箱烘干,之后将处理好的样品与溴化钾混匀、压片,最后放置在红外光谱仪上进行测试。
(3)Zeta电位测试
矿样Zeta电位采用布鲁克海文ZetaPlus电位仪进行测试。将少量方解石单矿物研磨至粒径-5μm,称取5 mg置于烧杯中,按照浮选加药顺序加入一定浓度的药剂后采用HCl或NaOH调节pH值,在搅拌器上搅拌5 min后,吸取少量样品置于样品槽中进行测试,测得3次Zeta电位值并计算出平均值。
3 络合剂对Ce3+离子活化方解石去活效果评价
3.1 EDTA对Ce3+离子活化方解石浮选的影响
方解石单矿物浮选试验研究结果显示,在pH值9~10范围条件下,捕收剂OHA浓度为2.5×10-4mol/L,方解石浮选回收率会随pH值的增大呈先增加后减小的趋势。不添加Ce3+离子时,方解石浮选回收率最大值为80%;当Ce3+离子浓度增加至1×10-4mol/L时,方解石最大回收率可提升到95.5%。主要原因是Ce3+离子在方解石表面作用形成活性位点,可增强捕收剂辛基异羟肟酸OHA吸附能力。由此,固定Ce3+离子浓度为1×10-4mol/L,考察络合剂EDTA用量对Ce3+离子活化方解石浮选回收率的影响,试验结果如图1所示。由图1可知,络合剂EDTA对Ce3+离子活化后方解石的浮选有明显的抑制作用。不添加EDTA条件下方解石浮选回收率可达到95.5%;随着EDTA用量的持续增大方解石回收率呈快速下降趋势,当EDTA用量增加至2.4×10-3mol/L时,方解石浮选回收率可降低为32.5%。试验结果表明,EDTA可作用于受Ce3+离子活化后方解石表面,使方解石的浮选受到抑制。
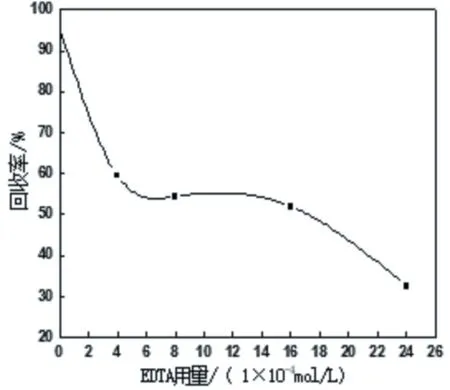
图1 EDTA用量对Ce3+离子活化方解石浮选回收率的影响
3.2 EDTA对氟碳铈矿和方解石单矿物浮选的影响
络合剂EDTA可去除Ce3+离子对方解石的活化作用,通过抑制方解石的浮选来提升氟碳铈精矿的质量指标。为了确保EDTA对去活脉石矿物方解石的影响,达到两矿物浮选分离的效果,进一步考察了EDTA对氟碳铈矿和方解石单矿物浮选回收率的影响,试验结果如图2所示。
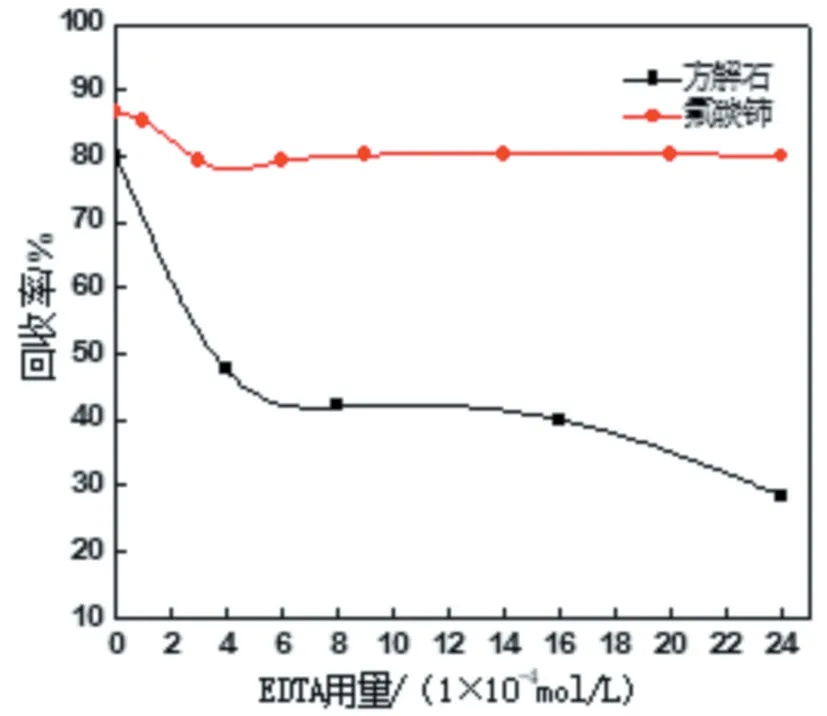
图2 EDTA用量对氟碳铈矿和方解石单矿物浮选回收率的影响
由图2可知,络合剂EDTA对氟碳铈矿浮选回收率的影响较小。只添加捕收剂OHA条件下,氟碳铈矿、方解石浮选回收率分别达到80%和86.7%;增加EDTA用量为3×10-4mol/L时,氟碳铈矿浮选回收率降低至79.5%;持续增大EDTA用量氟碳铈矿浮选回收率可保持在80%左右,降低幅度较小;当EDTA用量增大至2.4×10-3mol/L后,方解石浮选回收率可降低至30%以下,且方解石的回收率呈持续下降趋势。试验结果表明,EDTA可作为氟碳铈矿和方解石两矿物浮选分离的有效去活剂。
3.3 EDTA对Ce3+离子活化方解石前后红外光谱分析
为研究络合剂EDTA对Ce3+离子活化前后方解石的作用影响,采用红外光谱进行测试分析,结果如图3所示。
下图3所示分别为络合剂EDTA、捕收剂OHA及其两者共同作用于Ce3+离子活化方解石表面的红外光谱图。由图3可知,OHA在Ce3+离子活化后方解石表面作用时,在1 609.67 cm-1处出现较强的-C=O伸缩振动峰;OHA在EDTA去活后方解石表面作用时,在1 798.51 cm-1处出现了-C=O伸缩振动峰;主要原因是EDTA和方解石表面Ce3+离子作用时,吸电子的诱导效应使Ce3+离子发生偏移,红外吸收波数提高,使得-C=O双键键能增强,表明了EDTA在方解石表面发生了吸附作用,生成一种稳定的络合物,降低了Ce3+离子对方解石的活化;在2 975.69 cm-1、2 876.56 cm-1处出现了OHA分子中的CH2-/-CH3的伸缩振动峰,表明OHA可在EDTA去活后方解石表面产生一定的吸附作用。
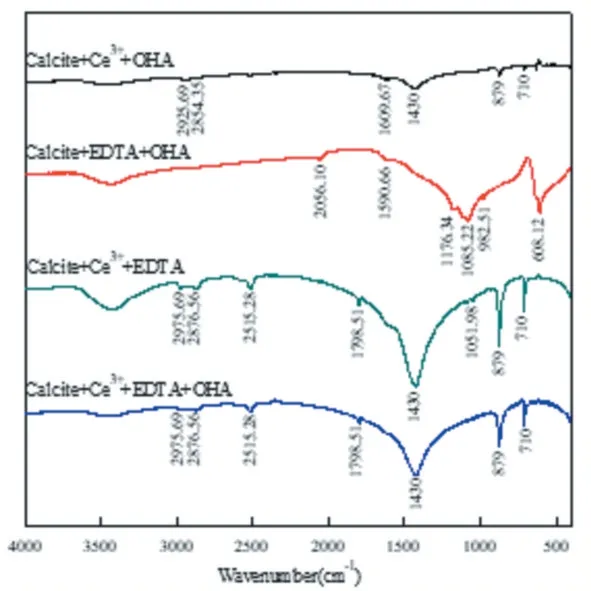
图3 EDTA对Ce3+离活化方解石作用前后红外光谱图
3.4 EDTA对Ce3+离子活化方解石前后Zeta电位
为研究络合剂EDTA对Ce3+离子活化方解石后的表面电性作用,测试了Ce3+离子活化前后方解石的Zeta电位,试验结果如图4所示。

图4 EDTA对Ce3+离子活化方解石前后Zeta电位图
图4 所示分别为Ce3+离子单独作用、Ce3+离子与捕收剂OHA、络合剂EDTA作用以及三者共同作用前后方解石的Zeta电位图。由图4可知,未与Ce3+离子、OHA及EDTA作用时,方解石Zeta电位随pH值的增大而减小,等电点为pH=7.2;当溶液中加入浓度1×10-4mol/L Ce3+离子后,方解石Zeta电位发生正移,其等电点向右偏移,表明Ce3+离子吸附在方解石表面,增强了方解石表面的正电性;当溶液中依次加入浓度1×10-4mol/L Ce3+离子和8×10-4mol/L EDTA后,方解石Zeta电位在只与Ce3+离子作用基础上发生了负移,等电点由pH=8.6变化至pH=5.7,表明EDTA可在Ce3+离子作用后方解石的表面产生吸附,降低其表面Zeta电位;当溶液中加入浓度1×10-4mol/L Ce3+离子和2.5×10-4mol/L OHA后,方解石等电点由pH=8.6负移至pH=7.8,表明OHA也可在Ce3+离子作用后的方解石表面产生吸附,相对Ce3+离子单独作用降低了方解石Zeta电位;当溶液中依次加入浓度1×10-4mol/L Ce3+离子、8×10-4mol/L EDTA和2.5×10-4mol/L OHA后,方解石Zeta电位相对Ce3+离子、EDTA共同作用时向右发生正移,同时等电点小于OHA与Ce3+离子共同作用方解石的等电点,由此可进一步表明EDTA在Ce3+离子作用方解石表面发生了一定程度的吸附作用。
4 结论
(1)采用络合剂EDTA可消除矿浆中Ce3+离子对方解石的的活化作用,从而达到抑制其浮选的目的。
(2)络合剂EDTA能与方解石表面的Ce3+离子生成一种稳定的络合物,可去除Ce3+离子对方解石的活化作用。
(3)矿浆中Ce3+离子存在会增加方解石表面的Zeta电位,EDTA可在Ce3+离子作用后方解石的表面产生吸附,降低其表面Zeta电位。

