环糊精酶改性对淀粉结构及消化特性的影响
纪杭燕,金征宇*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122;3.江南大学食品营养与安全协同创新中心,江苏 无锡 214122)
淀粉是自然界中来源最为广泛的碳水化合物资源之一,在小麦、玉米等谷物的种子和甘薯、木薯等块根中储存丰富。淀粉是人类主要的膳食碳水化合物,对维持能量代谢水平和保证机体健康有重要作用。淀粉消化是餐后重要的代谢反应之一,对餐后血糖水平和胰岛素调节至关重要,选择性的摄入慢消化速率淀粉对各类糖代谢疾病的预防和缓解具有重要意义[1-2]。淀粉依据其营养消化组分通常被划分为快消化淀粉 (Rapidly Digestible Starch,RDS)、慢消化淀粉(Slowly Digestible Starch,SDS)、抗性淀粉(Resistant Starch,RS)等3 类组分[3]。在不同的淀粉中RDS 的质量分数比例通常可达70%~80%,增加淀粉的慢消化和抗性组分对淀粉营养品质的提升具有重要价值[4-5]。
淀粉是由交替的“生长环”的无定形和半结晶层组成,其无定形和半结晶层分别主要由直链淀粉(质量分数15%~35%)和支链淀粉(质量分数65%~85%)构成。为了提升淀粉的营养品质,通常采用物理、化学和生物等手段对淀粉结构进行修饰,其中湿热处理、脉冲电场以及酶法催化由于其环境友好特性而受到广泛关注[6-7]。相比于其他方法,淀粉的酶法改性还具有反应机理明晰、催化效率高以及专一性强等优势[8-9]。α-葡萄糖基转移酶 (α-Glucanotransferase,AGTase)是一类能够通过转苷的作用方式对淀粉糖链排列和连接方式进行重构从而达到提升淀粉原有特性的酶类[10-11]。近年来,越来越多的报道表明,AGTase 在提升淀粉基食品的营养消化品质、控制其在体内消化产生的葡萄糖的释放具有十分重要的作用。环糊精葡糖基转移酶(Cyclodextrin glucosyltransferase,CGTase)是一类通过环化活力将淀粉及其衍生物转化为环糊精(Cyclodextrin,CD)的酶类。作为典型的AGTase,该酶在改性淀粉中的应用效果良好。据报道,CGTase可与分支酶协同作用淀粉以提升淀粉的慢消化性质[12]。此外,CGTase 在糊化温度以下处理颗粒淀粉,所得到的产物有利于维持小鼠的餐后血糖水平[13]。
在CGTase 改性淀粉的过程中,通常会有高比例的CD 产生,过量的CD 可能会有导致肾毒性的风险[14]。此外,CD 作为底物还会对CGTase 具有一定的抑制作用,降低酶反应效率[15]。环糊精水解酶(Cyclodextrinase,CDase)是一类具有高度CD 水解特异性的酶类。因此,将CGTase 和CDase 协同改性淀粉,一方面降低反应体系中CD 的含量,另一方面CDase 可以将CD 水解为具有益生效果的麦芽低聚糖来进一步提升淀粉的营养品质。作者利用CGTase和CDase 协同改性淀粉,系统探究了酶改性对淀粉的结构、环状和低聚糖组成、消化特性的影响,旨在为提升淀粉营养消化特性提供一种新的酶法改性途径。
1 材料与方法
1.1 材料与试剂
CGTase (来源于Thermoanaerobactersp.,β-CGTase):Novozymes 有限公司(中国);异淀粉酶(来源于Pseudomonassp.):Megazyme 有限公司 (爱尔兰);葡萄糖测定试剂盒(GOPOD 试剂盒,葡萄糖氧化酶法):北京利德曼生化股份有限公司;普通和高直链玉米淀粉 (直链淀粉质量分数分别为25%和45%):杭州普罗星淀粉有限公司;α-淀粉酶(来源于猪胰腺,50 U/mg)和淀粉葡萄糖苷酶(来源于黑曲霉,70 U/mg):美国Sigma-Aldrich 公司。麦芽低聚糖标准品(麦芽三糖(G3)、麦芽四糖(G4)、麦芽五糖(G5)、麦芽六糖(G6)、麦芽七糖(G7)、麦芽八糖(G8)):英国卡博森斯化学科技有限公司;葡萄糖(G1)、麦芽糖(G2)等其他分析纯生化试剂:国药集团化学试剂有限公司。
1.2 仪器与设备
高效液相色谱仪(HPLC):日本岛津公司产品;氨基柱 (APS-2HYPERSIL 柱,250 mm × 4.6 mm,5 μm):美国赛默飞世尔科技公司产品;高压反应釜:上海霍桐实验仪器有限公司产品;多角度激光散射凝胶色谱系统 (HPSEC-MALLS-RI 系统、Waters 1525 泵):美国Waters 公司产品;多角度激光散射检测器(Dawn Heleos-Ⅱ):美国Wyatt 公司产品;示差折光检测器(Optilab T-rEX):美国Wyatt 公司产品;尺寸排阻色谱柱(Shodex OHpak SB-806 HQ 和SB-804 HQ):日本Shodex 公司产品;离子色谱仪ICS-5000(GP40 梯度泵,脉冲安培检测器和电化学法检测器,Chromeleon 6.8 色谱分析工作站):美国戴安公司产品;阴离子交换色谱柱CarboPac PA20(250 mm × 3 mm):美国戴安公司产品。
1.3 实验方法
1.3.1 CDase 及CGTase 的制备及酶活测定CDase 的制备及酶活测定参考Ji[16]等的方法。挑取宿主菌株E.coliBL21 (DE3)于LB 液体培养基中(含100 μg/mL 氨苄青霉素),在37 ℃、200 r/min 培养8~10 h。以1%的接种体积分数将上述培养液扩大培养,OD600为0.4~0.6 时加入终摩尔浓度为0.4 mmol/L 的IPTG,于25 ℃、160 r/min 诱导8~10 h。将发酵液在10 000g、4 ℃条件下离心15 min,收集菌体沉淀。使用pH 7.5 的20 mmol/L Tris-HCl 缓冲液重悬菌体,随后超声20 min 破壁,超声功率为260 W,每超声2 s 停顿3 s,离心、收集破壁菌体悬浮液的上清液(即粗酶液)。采用70 ℃保温20 min 热处理和镍层析两步法对CDase 粗酶液进行纯化。参照文献[17]用3,5-二硝基水杨酸(DNS)法测定CDase酶活,在最适反应条件下,每分钟从环糊精中释放1 μmol 还原末端所需要的酶量定义为一个酶活单位(U)。将购买的CGTase 稀释到适当酶浓度,采用酚酞法测定β-CD 的含量,计算CGTase 的酶活[18]。一个酶活单位(U)定义为每分钟生成1 μmol β-CD 所需要酶的添加量。
1.3.2 CGTase 和CDase 改性淀粉样品的制备使用磷酸盐缓冲液(pH 6.0,20 mmol/L)配制质量分数5%的普通/高直链玉米淀粉底物溶液。利用高压反应釜在121 ℃、160 r/min 条件下充分糊化30 min,随后将糊化后的淀粉溶液降温至反应温度75 ℃。本研究中使用的CDase 对CD 具有高度水解特异性而对淀粉无水解活力,因此,按如下方式利用CGTase 和CDase 制备改性淀粉。1)CGTase:CGTase(3.8 U/g 干基淀粉)与淀粉底物保温6 h;2)CDase/CGTase:将CDase(14.2 U/g 干基淀粉)和CGTase(3.8 U/g 干基淀粉)共同与淀粉底物保温6 h;3)CGTase+CDase:CGTase(3.8 U/g 干基淀粉)与淀粉底物保温6 h,沸水浴30 min 灭酶,将反应产物与CDase(14.2 U/g 干基淀粉)保温6 h。酶反应结束后均采用沸水浴1 h 灭酶,将产物冷冻干燥、研磨、过100 目筛备用。空白对照为不添加酶液制备的样品。
1.3.3 改性淀粉中环状和线性低聚糖的组成测定参考Xia[19]等报道的方法使用HPLC 对改性淀粉样品中CD 和线性麦芽低聚糖的组成进行分析。使用的分析柱为X-Bridge BEH 氨基柱 (250 mm × 4.6 mm,Waters),流动相为体积分数65%乙腈溶液,流速设定为0.8 mL/min,进样量为20 μL,柱温维持在30 ℃。
1.3.4 改性淀粉的分子结构测定将改性的淀粉样品参考Ji[20]等的方法用HPSEC-MALLS-RI 系统进行分子结构的测定。将样品分散于体积分数90%的二甲亚砜溶液中,使得终质量分数为0.5%,沸水浴1 h 充分溶解样品。随后将样品置于37 ℃、160 r/min 下恒温振荡48 h。向样品溶液中加入9 倍体积的无水乙醇,10 000g、4 ℃下离心10 min,沉淀用无水乙醇洗涤2 次。测定前将无水乙醇蒸干,用流动相复溶,过0.45 μm 滤膜。流动相使用0.1 mol/L NaNO3(含质量分数0.02%NaN3),流量为0.6 mL/min,柱温保持50 ℃,所得数据使用Astra(Version 5.3.4,Wyatt Technologies)进行分析。
1.3.5 改性淀粉的链长分布测定将改性的淀粉样品参考Ji[21]等的方法使用HPAEC-PAD 系统进行链长分布的测定。将样品溶解在乙酸钠缓冲溶液中(50 mmol/L,pH 4.5)使得终质量分数为0.2%,沸水浴30 min 充分分散。随后将样品溶液置于42 ℃保温,加入2 U 异淀粉酶脱支处理24 h,沸水浴20 min 灭酶。在10 000g下离心10 min,取上清液过0.22 μm 滤膜。测定流量为0.4 mL/min,柱温保持30 ℃,流动相用150 mmol/L NaOH 和40~400 mmol/L梯度NaOAc 进行洗脱。
1.3.6 改性淀粉的体外消化性测定参考Englyst[22]等报道的方法并稍做修改测定改进淀粉的体外消化性。使用淀粉葡萄糖苷酶和猪胰腺α-淀粉酶以去离子水配制小肠模拟溶液,其中猪胰腺α-淀粉酶的酶活力为150 U/mL,淀粉葡萄糖苷酶的酶活力为80 U/mL。将200 mg 样品分散于15 mL、0.2 mol/L乙酸钠缓冲液中(1 mmol/L CaCl2、pH 5.2)。在37 ℃平衡5 min 后,在充分分散的样品溶液中加入5 mL的小肠模拟溶液,37 ℃、200 r/min 水浴条件下酶解。随后在0、20、120 min 分别取200 μL 水解反应液,立即加入9 倍体积的无水乙醇灭酶。将样品液在10 000g离心5 min,取上清液利用GOPOD 试剂盒测定其中的葡萄糖质量分数。RDS、SDS 和RS 的比例根据游离葡萄糖的质量分数(G0)、酶解20 min 的葡萄糖质量分数(G20)和酶解120 min 的葡萄糖质量分数(G120)见式(1)~(3)。

1.3.7 数据处理实验结果均重复3 次,计算标准偏差作为其误差限。数据的显著性分析使用SPSS 19.0 进行,P<0.05 表明实验数据差异显著。
2 结果与分析
2.1 双酶改性淀粉产物的环糊精组成分析
为了探究CGTase 与CDase 复合改性淀粉的效果,基于CGTase 主导的环化活力,首先对产物中的CD 组成进行分析。如图1所示,相比于CGTase 单独转化淀粉底物,经CGTase 和CDase 双酶复合改性后产物中的α-CD、β-CD 和γ-CD 均有不同程度的下降。该结果表明在双酶复合改性的过程中,CDase 能充分发挥CD 的水解作用。此外,使用不同的淀粉底物以及不同的双酶改性方式时,产物中不同CD 的剩余比例不同,这可能是由CGTase 的产物特异性和CDase 的底物选择性共同导致的[23-24]。相比于CGTase 和CDase 双酶顺序添加,双酶同时添加的改性方式具有更为显著的CD 水解效果。相比于使用高直链玉米淀粉为底物,以普通玉米淀粉为底物不同双酶改性方式的CD 产物差异更显著。

图1 双酶改性对产物中CD 质量浓度的影响Fig.1 Effects of dual-enzyme modification on the content of CD in products
2.2 双酶改性淀粉产物中麦芽低聚糖组成分析
麦芽低聚糖是一类由α-1,4 糖苷键连接聚合度范围为2~10 个葡萄糖单元的低聚寡糖,具有良好保湿性、适中黏度以及调节肠道菌群等益生功能[25-26]。利用具有CD 水解活力的CDase 以CD 为底物,可以高效制备具有特定聚合度的麦芽低聚糖[27-28]。因此,麦芽低聚糖是CGTase 与CDase 复合改性淀粉的重要产物。如图2所示,相比于CGTase 单独改性,CGTase 和CDase 复合改性显著提升了淀粉产物中的麦芽低聚糖质量浓度,不同聚合度的低聚糖比例也有明显差异。单独使用CGTase 时,产物中仅有少量的G2、G3 和G6~G8 生成。当使用双酶改性时,产物中的G2~G8 比例均显著提升,其中G6 和G7质量浓度最高。这可能是由于本研究中使用的CDase 对α-CD 和β-CD 具有高效的水解活力,而对麦芽低聚糖的水解则相对缓慢[29]。因此,CDase 将体系中的α-CD 和β-CD 主要水解为G6 和G7,这也与图1中的CD 下降比例相一致。同样,淀粉底物以及双酶改性方式对产物中麦芽低聚糖组成也具有显著影响。当以普通玉米淀粉为底物时,淀粉产物中麦芽低聚糖的得率更高,且双酶顺序添加改性生成的麦芽低聚糖质量浓度高于双酶同时添加改性。当以高直链玉米淀粉为底物时,产物中不同的双酶改性方式所得麦芽低聚糖组成则相对较为接近。

图2 双酶改性对产物中麦芽低聚糖质量浓度的影响Fig.2 Effects of dual-enzyme modification on the content of malto-oligosaccharides in products
2.3 双酶改性淀粉产物的相对分子质量分布表征
淀粉的分子结构对其性质具有重要影响,相对分子质量分布是其重要的分子结构特征[30]。如图3和表1所示,当以不同玉米淀粉为底物时,经酶改性后的分子结构变化规律较为一致。经CGTase 改性后产物相对分子质量分布曲线均显著右移,其中普通玉米淀粉相对分子质量由158.4×105下降至0.5×105,高直链玉米淀粉相对分子质量由11.7×105下降至0.7×105,表明2 种淀粉结构均发生明显降解。此外,经CDase 和CGTase 双酶改性后产物相对分子质量与经CGTase 单独改性后接近,双酶顺序改性比双酶同时改性对淀粉结构降解效果更显著,这与上述体系中CD 和麦芽低聚糖的测定结果一致。可能是由于双酶顺序改性时,经CGTase 改性后的产物具有更多的短链结构,更利于CDase 的进一步水解。CDase 对淀粉几乎无水解作用,但可缓慢水解低聚寡糖,因此在顺序改性过程中促进了淀粉分子结构的降解。此外,淀粉分子多分散系数(PDI)也能有效反映淀粉相对分子质量分布特征[31]。如表1所示,相比于原玉米淀粉,酶改性后产物的PDI 值均增加,这表明改性淀粉样品的相对分子质量差异更大。然而,当以高直链玉米淀粉为底物时,与双酶同时改性相比,另两种改性方法会使得产物的相对分子质量分布差异性增大[32],相对分子质量的分布特征会显著影响淀粉酶解产物的理化及营养特性。

图3 双酶改性对淀粉分子结构的影响Fig.3 Effects of dual-enzyme modification on starch molecular structure

表1 双酶改性淀粉产物的重均相对分子质量(Mw)和尺寸参数Table 1 Weight-average molecular weight(Mw)and size parameters of dual-enzyme modified starch products
2.4 双酶改性淀粉的精细结构表征
依据支链淀粉链长比例的周期性分布模式,淀粉链长通常被分为DP<6、DP 6~12、DP 13~24、DP 25~36、DP >36 共5 个组分,分别与淀粉A、B1、B2、B3 和更长链对应[33]。淀粉不同链长比例反映了其内在精细结构且与淀粉性质密切相关[34]。如图4和表2所示,经CGTase 单独和双酶改性的不同玉米淀粉链长分布均呈现明显左移,表明淀粉结构显著降解,对应的链长组分DP 13~24、DP 25~36 和DP >36 的比例显著下降。当以普通玉米淀粉为底物时,CGTase 改性将DP <13 的葡萄糖链比例提升了约40%以上。当使用CGTase 和CDase 复合改性时,对应的葡萄糖链比例进一步提升约20%左右,并且双酶顺序改性比双酶同时改性对短链比例的提升效果更显著。当以高直链玉米淀粉为底物时,改性淀粉链长比例具有类似的组成,CGTase 和CDase 的不同复合改性方式的产物链长比例组成差异不大,因此,双酶改性淀粉的精细结构测定结果与上述的环状、线性麦芽低聚糖质量浓度和相对分子质量分布结论一致。此外,由于测定的样品是由酶改性淀粉产物经脱支处理后侧链和CD 经CDase 降解得到的麦芽低聚糖组成,可以看出经酶改性后的淀粉产物主要以短支链结构为主。
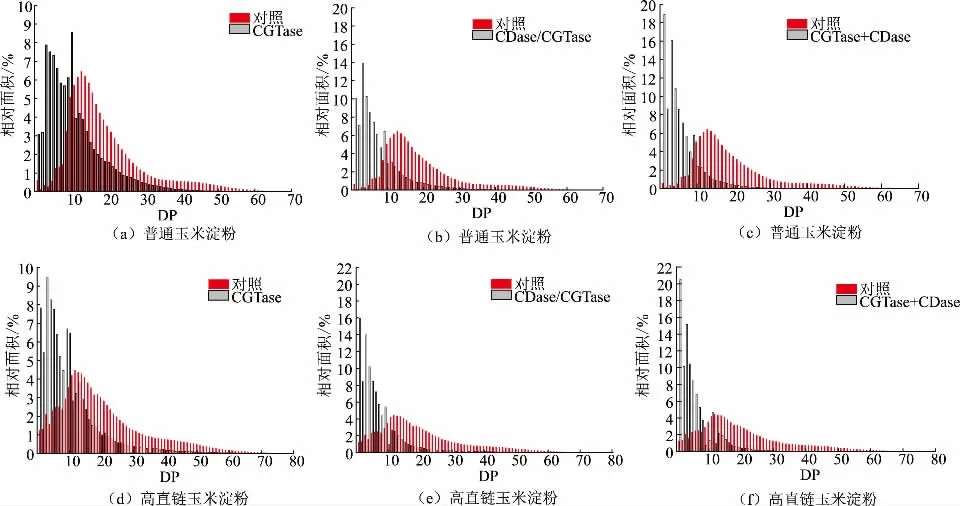
图4 双酶改性对淀粉链长分布的影响Fig.4 Effects of dual-enzyme modification on the chain length distribution of starch

表2 双酶改性淀粉产物的链长比例Table 2 Chain length distribution ratio of dual-enzyme modified starch products
2.5 双酶改性淀粉的体外消化性分析
使用改进的Englyst 体外模拟消化法对酶改性淀粉样品的营养组分进行测定。如图5所示,经充分糊化的普通玉米淀粉和高直链玉米淀粉中RS 质量分数分别为15.6%和31.0%。可以看出,当以不同淀粉为底物时,经CGTase 和双酶改性后产物中RS的比例均显著提升。其中,以普通玉米淀粉为底物时,经CGTase 单独酶改性可以获得最高的RS 质量分数为39.0%。结合上述分子结构的测定结果,这可能是由于经CGTase 作用后淀粉样品的相对分子质量显著下降,分子尺寸减小,DP <13 的葡萄糖链长比例显著增加。据报道,高比例DP <13 的葡萄糖侧链能有效提升淀粉的抗酶解性。CD 通过强氢键稳定环结构来抵抗水解,因而改性样品中高比例的CD 也对其抗消化性具有重要的贡献作用。当使用CGTase 和CDase 双酶同时和顺序改性时,RS 质量分数分别为35.4%和34.2%,与原淀粉相比明显提升但低于CGTase 单独改性。这可能是由于双酶改性将淀粉产物中CD 转化为高比例的麦芽低聚糖。其中高聚合度的麦芽低聚糖如G4—G8,可以相对容易被α-淀粉酶和淀粉葡萄糖苷酶水解,直至不能被进一步利用。当以高直链玉米淀粉为底物时,经CGTase、CGTase 和CDase 同时添加和顺序添加,改性后淀粉产物中的RS 质量分数分别为59.3%、49.7%和52.3%,RS 的变化与普通玉米淀粉规律一致。

图5 双酶改性对淀粉中营养消化组分的影响Fig.5 Effects of dual-enzyme modification on nutrient digestible components in starch
以CGTase 改性不同淀粉能够显著增加淀粉的抗性组分比例,提升淀粉的营养消化品质。然而,产物体系中高比例的CD 可能会对人体造成一定的肾毒性危害。在双酶改性过程中,高比例的CD 被CDase 水解转化为麦芽低聚糖,并且CGTase 单独改性淀粉与双酶改性产物具有相近的体外消化性。这可能是由于麦芽低聚糖本身也是具有良好的益生效果的功能性寡糖[35]。因此,CGTase 与CGTase 复合改性是一种有效提升淀粉营养消化品质的方法,具有良好的应用前景。
3 结 语
在利用以CGTase 主导的双酶改性普通和高直链玉米淀粉时,发现CGTase 与CDase 具有明显的协同改性效果。经CDase 的水解作用,产物中CD 比例显著下降而麦芽低聚糖比例显著提升。此外,CGTase 和双酶改性使得淀粉相对分子质量和分子尺寸显著下降,DP 13~24,DP 25~36 和DP >37 的链长比例显著下降,而DP <13 的链长比例显著提升。经CGTase 和双酶改性后淀粉中RS 的比例显著提升,这与淀粉产物组成和分子结构相对应。综上可知,利用CGTase 和CDase 可通过产物组成和分子结构的修饰显著提升淀粉的营养消化品质。
——中核工程创新驱动改革,奋力打造核工程产业链“链长”

