铬元素的前世今生
——第54届国际化学奥林匹克试题第2题解析
马建功,邱晓航
南开大学化学学院,天津 300071
铬的原子序数为24,在地壳中丰度列第21位,含量约为1.02 × 10-5g·kg-1。它是元素周期表第VIB族中的第一个元素,原子量为52.00,密度为7.19 g·cm-3。铬单质是一种坚硬、有光泽的钢灰色金属,与它同族的钼、钨金属一样,它具有高熔点(1907 °C)和高沸点(2671 °C)。基态铬原子电子组态为3d54s1,是周期表中第一个出现“反常”电子排布的元素。铬的磁性是其最显著的特征之一,温度高于38 °C时呈现顺磁性,而在室温及以下,它是唯一显示出反铁磁有序性的元素。
1797年,法国化学家尼古拉斯∙路易斯∙沃克林(Nicolas-Louis Vauquelin)从一种矿物铬酸铅样品中发现了铬。1798年,他将三氧化二铬(Cr2O3)与木炭(碳)反应,得到了一种金属,同年,他在研究秘鲁祖母绿矿物时,认为其绿色源于这种元素。虽然铬作为一种元素被人们发现是在18世纪,但含铬化合物的使用已有数千年的历史。中国的考古学家发现在陕西兵马俑坑中出土的秦朝武器就含有铬元素[1],虽然无法确定2000多年前的人们使用铬化合物的初衷,但这种金属确实保护了武器避免锈蚀而保持锋利。现代商业生产的铬中,约75%-85%用于制造合金,如不锈钢。剩余的大部分用于化学工业、铸造厂和耐火材料。铬在空气中被氧钝化,形成了一层保护层,因而被用作装饰和保护金属涂层,在箱包、汽车等物品上常常能够看见闪亮的镀铬装饰[2]。
1 出题依据
铬元素的名称来自希腊语“chroma”,是“颜色”的意思。法国化学家安托万∙弗朗索瓦∙德∙福克罗伊(Antoine-François de Fourcroy)和勒内∙胡斯∙浩羽依(René-Just Haüy)提出以“chromium”命名铬元素,用以体现铬化合物丰富多彩的颜色。铬具有多种氧化态,其中+3、+6价最为常见,不同氧化态的铬化合物会展现出相应的特征颜色。在遥远的古代,人们就将各种铬化合物用于制备颜料(包括黄色、红色、绿色、黑色)、玻璃绿色、宝石红色和祖母绿。而在现代化学和化工中,铬因其不同价态和价态间的互变而被广泛用作催化剂。
第54届国际化学奥林匹克试题中第2题以“铬元素的前世今生(Chromium in Ancient and Modern Times)”[3]为题,围绕铬化合物的结构、色彩、元素氧化态,考查了化学计量、氧化还原反应、晶体场理论、配合物磁性等。
2 题目及解析
2.1 题目
黑釉瓷是一类特殊的中国瓷器,出现于东汉时期,在唐宋时期盛行。黑釉瓷釉面呈黑色或黑褐色,是传统瓷器釉色之一。其黑釉主要呈色剂为氧化铁,并辅以铬、锰、钴、铜等氧化着色剂,表现出不同的颜色包括赤褐色、暗棕色、深棕色或黑色。通常所见的赤褐色或暗褐色瓷器,釉料中氧化铁比例为8%左右,如将釉层加厚到1.5 mm时,烧成的釉色即呈纯黑。现代陶瓷装饰材料中,黑色陶瓷因其纯正、典雅、高贵成为陶瓷装饰材料中用量最大的一类。下图展示了故宫博物院馆藏黑釉瓷器。

左:金代山西窑黑釉剔花缸[4];右:宋代福清窑黑釉盏[5]
研究发现,黑色陶瓷颜料的主要物相为尖晶石。尖晶石晶体的通式表示为AB2O4,其结构由立方紧密堆积的O2-离子组成,其中A阳离子占据八分之一的四面体空位,B阳离子占据八面体空位的一半(图2.1(a))。尖晶石的1个立方晶胞可划分为8个小的立方单元,分别由4个I型小单元和4个II型小单元组合在一起(图2.1(b)),其中虚线表示小单元的棱边。相邻的I型单元和II型单元结构如图2.1(c)所示。

图2.1 尖晶石晶体结构
2-1 (2分) 每个尖晶石晶胞中分别有多少个A离子和B离子?
在还原气氛中焙烧按一定比例混合的Fe2O3与Cr2O3,可生成具有尖晶石结构的黑色陶瓷颜料(反应I)。当投料质量比Fe2O3: Cr2O3= 63.6 : 36.4且二者反应完全,转化得到的晶体中,占据四面体空隙的阳离子都是铁离子。
2-2 (1分) 在反应I中,哪种元素被还原?
2-3 (6分) 计算每个晶胞中,占据B位置的Fe3+和Cr3+阳离子数目。
除了在黑色陶瓷釉中掺杂外,颜色各异的含铬化合物还用于绘画和印刷,其丰富的颜色来源于铬元素的不同氧化态。铬绿(Cr2O3)在下列过程中转化为颜色不同的含铬化合物(D-H),其中E、F、G分别为黄色、橙色和红色。

2-4 (1分) 写出E的化学式。
2-5 (2分) 写出由F生成G的反应方程式。
2-6 (1分) 试剂H可能是:
(A) FeSO4;(B) FeCl3;(C) ZnSO4;(D) NiSO4
铬的可变化合价不仅对颜料的生产很重要,在催化剂中也有重要应用。例如,用于乙烯聚合的典型Phillips催化剂就是将氧-铬单元接枝到多孔载体材料上(通常为无定形二氧化硅)。催化剂前体(1)以四配位Cr(VI)为核心,在反应初始时迅速被乙烯分子还原,得到还原态的催化剂(2),其中Cr(II)配位数为6。2与乙烯分子进一步反应以催化乙烯分子聚合。
2-7 (1分) 1与乙烯的反应可以通过紫外-可见光谱进行追踪。在光谱的可见光区域,1在21500 cm-1处出现最大吸收峰,2的吸收峰在16700 cm-1处。根据吸收光谱数据,判断1和2的颜色可能为:
(A) 橙色和白色;(B) 橙色和蓝色;(C) 蓝色和橙色;(D) 蓝色和白色
2-8 (5分) 假设2中的Cr(II)位于具有分裂能(Δo)为16000 cm-1的正八面体晶体场中,画出Cr(II)的d电子构型,并计算2中的Cr(II)的晶体场稳定化能(CFSE)。(注:2中Cr(II)的电子成对能P为23500 cm-1)
2-9 (6分) 配位化合物/离子在含有未配对电子时表现出顺磁性。对于过渡金属,相应的磁矩(μ)可根据未配对电子的数目n由公式计算。计算2中Cr(II)的磁矩。
2.2 答案与解析
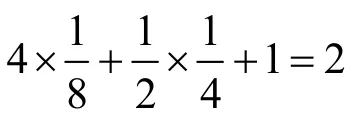
2-2小题进一步区分尖晶石晶体中四面体和八面体空隙的占据情况和元素价态。AB2O4中,通常A为+2,B为+3。原料中两种金属都是+3价,在还原气氛下焙烧,被还原为+2价的金属离子即为通式中的A。题目给出“占据四面体空隙的阳离子都是铁离子”,即被还原的元素是Fe。而由题中投料比可计算产物中两种金属的物质的量之比,显然大于A/B,这就说明产物中的Fe除了充当A的角色之外,必然有一部分未被还原,与Cr共同占据B的位置。
2-3小题要求计算出每个晶胞中占据B位置的两种离子个数,可以有多种不同的解题方法。但首先必须将题目中的投料质量比换算为两种金属的物质的量之比,假设每个晶胞中铁离子(包括Fe2+和Fe3+)数为x,Cr3+为y,则:
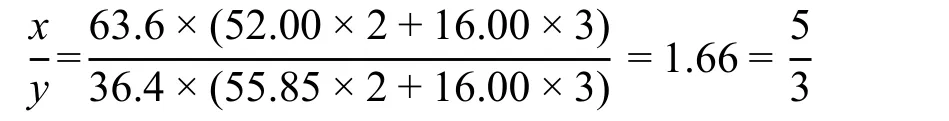
由2-1已知每个晶胞中金属离子总数为24,则:
(1 + 1.66)y = 24
解得y = 9,即Cr3+的个数为9,因B位置共有16个,则占据B位的Fe3+数为7个。
也可由化学式出发进行计算。尖晶石通式为AB2O4,设化学式中铁离子(包括Fe2+和Fe3+)数为x,则该化学式可写为Fe[Fex-1Cr2-(x-1)]O4,前面已求出铁离子和铬离子的比例为5 : 3,有:

解得x = 15/8,已知Fe2+数目为1,则Fe3+“个数”为7/8,Cr3+为9/8,换算为每个晶胞中的离子数,需乘以系数8,即可得到正确结果。
接下来的三个小题考查含铬化合物之间的转化关系。Cr2O3是两性氧化物,在碱性条件下先生成Cr(OH)3沉淀,该沉淀可溶于过量碱,当加入双氧水时,则被氧化至+6价,存在形式为Na2CrO4;酸化后转化为重铬酸盐,重铬酸盐为强氧化剂,与还原性物质反应时,自身被还原至+3价。
答案分别为:
2-4 Na2CrO4
2-5 Na2Cr2O7+ H2SO4→ 2CrO3+ H2O + Na2SO4
2-6 A
在现代工业中,铬化合物的氧化还原性质被用于重要的催化反应。聚乙烯(PE)是使用最广泛的聚烯烃,其结构单元-CH2-非常简单,但可构成不同支链数、不同长度、不同密度和分子量分布的数百种产品,不同性能的聚乙烯产品遍布现代生活的每个角落。生产聚乙烯的过程中,催化剂的作用至关重要。1951年Phillips石油公司的Hogan和Banks发现了一种含铬催化剂,可用于高密度聚乙烯(HDPE)合成,该催化剂被称为Phillips催化剂,每年的经济营业额约为1000亿美元。
题目描述了Phillips催化剂在反应中的变化:1是催化剂前体,以四配位Cr(VI)为核心。在反应一开始就被乙烯分子还原,转变为还原态的2。2是真正起作用的催化中心,催化乙烯分子聚合[6]。在催化过程中,Phillips催化剂中铬的氧化态、配位模式发生改变,涉及了晶体场理论的相关知识。
2-7小题考查吸收光谱与化合物颜色的关系,根据色轮可以很容易地找到吸收光对应的互补色波长,进而得出化合物的颜色信息。答案为B。
2-8小题给出了晶体场分裂能以及电子成对能,二者相比较可得出结论:具有d4组态的Cr(II),在八面体场中具有高自旋态,d电子排布为:


3 结语
晶体场稳定化能为:
CFSE = 0 - Eocta= 0 - [(-2/5Δo) × 3 + 3/5Δo] = 3/5Δo= 9600 cm-1
2-9提供了计算磁矩的方法,确定了Cr(II)的d电子排布后,将未成对电子数带入公式,即可作答:
本题作为整个试卷的第二道题,考查无机化学中晶体、氧化态、配位化合物等基本概念,难度适中。题目以铬为中心,从含铬釉料和颜料谈起,到现代工业中含铬催化剂的重要角色,从化学角度讲述了铬化合物之间相互转化的科学故事。在Icho 2022预备题中,晶胞结构(problem 1)、尖晶石结构(problem 5)、晶体场理论(problem 5)、磁性计算(problem 5)等知识点都有涉及,选手通过预备题可以在正式比赛中有的放矢,沉着应答。

