介入治疗胃肠道恶性肿瘤肝转移瘤的效果分析
钱震 祝子祎 袁牧
胃肠道恶性肿瘤发展至晚期常发生肝转移,主要是由于消化道血流汇入门静脉,使得肿瘤细胞可随血流经门静脉进入肝脏并定植,形成肝转移瘤。因此,肝脏是胃肠道恶性肿瘤早期转移的主要部位[1]。临床研究显示,约10%~25%结肠癌、30%~40%直肠癌在临床确诊时已发生肝转移,20%~25%直肠癌在术后发生肝转移,而胃肠道恶性肿瘤的肝转移率高达50%[2]。而肝转移的发生常提示胃肠道恶性肿瘤进展迅速,预后较差。目前,临床尚缺乏特效治疗手段,>80%的转移瘤无法进行手术根治,全身化疗仍是临床首选治疗方案,但整体疗效不佳,中位生存期<10 个月[3]。近年来,介入治疗在肝癌及肝转移瘤的治疗中得到推广应用,通过微创置管,向肝内肿瘤的供血动脉直接灌注化疗药物,具有创伤小、操作简便、可重复操作、减轻全身毒副反应等优势[4]。与全身化疗相比,局部介入治疗可达到更好的药代动力学,有助于提高对肿瘤的抑制力[5]。本研究进一步分析介入治疗胃肠道恶性肿瘤肝转移瘤的效果,现报告如下。
1 资料与方法
1.1 一般资料 选取2018 年1 月~2021 年1 月在本院治疗的60 例胃肠道恶性肿瘤肝转移瘤患者,随机分为观察组和对照组,每组30 例。观察组男17 例,女13 例;年龄35~78 岁,平均年龄(54.67±11.25)岁;肿瘤类型:胃癌16 例,结直肠癌14 例;TNM 分期:Ⅲb 期19 例,Ⅳ期11 例。对照组男18 例,女12 例;年龄33~79 岁,平均年龄(55.02±11.73)岁;肿瘤类型:胃癌17 例,结直肠癌13 例;TNM 分期:Ⅲb 期20 例,Ⅳ期10 例。两组患者的性别、年龄、肿瘤类型、TNM 分期等一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:①符合《内科肿瘤学》[6]中胃肠道恶性肿瘤肝转移瘤诊断标准;②手术病理或组织活检确诊为胃肠道恶性肿瘤,经CT、磁共振成像(MRI)等检查确诊肝脏存在可测量病灶;③肝转移瘤直径2~8 cm,转移灶1~8 个;④TNM 分期在Ⅲb~Ⅳ期;⑤无法进行手术切除;⑥美国东部肿瘤协作组(ECOG)评分1~2 分;⑦均自愿加入研究,签署知情同意书。排除标准:①严重肝肾功能障碍;②无法耐受化疗;③严重神经系统疾病;④无法配合治疗后随访。
1.2 方法 对照组使用FOLFOX 方案进行全身化疗,奥沙利铂静脉滴注130 mg/m2,时间为2 h;亚叶酸钙静脉滴注400 mg/m2,时间为2 h;5-氟尿嘧啶2400 mg/m2,持续静脉滴注46 h,2周为1个化疗周期,治疗3个周期。观察组在对照组基础上使用HAIC 进行介入治疗,采用Seldinger 法经股动脉穿刺,将导管插入并分别在腹腔干和肠系膜上动脉进行动脉造影检查;根据肿瘤的动脉供血情况,选择性地将导管置入肿瘤供血动脉。导管外露部分用无菌医用纱布、透明敷贴固定在右腹股沟和右下腹的皮肤上。使用微量泵泵入化疗药物,方案为奥沙利铂130 mg/m2动脉滴注3 h,亚叶酸钙200 mg/m2动脉滴注2 h,再联合5-氟尿嘧啶400 mg/m2动脉团注,5-氟尿嘧啶2400 mg/m2动脉滴注46 h。HAIC 常规每3 周重复1 次,治疗2 个周期。
1.3 观察指标 比较两组的近期疗效、肿瘤标志物、肝功能及其他血生化指标、毒副反应发生情况、生存指标。①测定血清肿标志物,抽取外周静脉血3 ml,离心3000 r/min,10 min 后获得血清,采用酶联免疫吸附剂试验(ELISA)法测定CA19-9、CA125、Cyfra21-1、CEA、VEGF;②测定肝功能及其他血生化指标,抽取外周静脉血3 ml,离心获取血清,使用贝克曼库尔特AU5800 型全自动生化分析仪测定ALT、AST、TBIL、ALB、Hb、WBC;③统计毒副反应发生情况,包括胃肠道反应、腹泻、手足综合征、感觉神经障碍、肾功能异常、白细胞减少、血小板减少等;④随访1.5 年,记录无进展生存时间、总生存时间、1 年生存率。
1.4 疗效判定标准 根据实体瘤的疗效评价标准(RECIST)1.1 标准[8]评价近期疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),靶病灶最长径之和减少100%为CR;减少21%~99%为PR;减少≤20%或增大<20%为SD;增大≥20%或出现新病灶为PD。治疗有效率=(CR+PR)/总例数×100%;临床控制率=(CR+PR+SD)/总例数×100%。
1.5 统计学方法 采用SPSS21.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组近期疗效比较 观察组治疗有效率为40.00%、临床控制率为76.67%,明显高于对照组的13.33%、46.67%,差异具有统计学意义(P<0.05)。见表1。

表1 两组近期疗效比较[n(%)]
2.2 两组肿瘤标志物水平比较 治疗前,两组血清CA19-9、CA125、Cyfra21-1、CEA、VEGF 水平比较差异无统计学意义(P>0.05);治疗后,观察组血清CA19-9、CA125、Cyfra21-1、CEA、VEGF 水平均低于对照组,差异具有统计学意义(P<0.05)。见表2。
表2 两组肿瘤标志物水平比较()

表2 两组肿瘤标志物水平比较()
注:与对照组治疗后比较,aP<0.05
2.3 两组肝功能及其他血生化指标比较 治疗前后,两组血清ALT、AST、TBIL、ALB、Hb、WBC 水平组间比较差异均无统计学意义(P>0.05)。见表3。
表3 两组肝功能及其他血生化指标比较()

表3 两组肝功能及其他血生化指标比较()
注:两组比较,P>0.05
2.4 两组毒副反应发生情况比较 两组胃肠道反应、腹泻、手足综合征、感觉神经障碍、肾功能异常、白细胞减少、血小板减少发生率比较差异均无统计学意义(P>0.05)。见表4。

表4 两组毒副反应发生情况比较[n(%)]
2.5 两组生存指标比较 观察组无进展生存时间、总生存时间长于对照组,1 年生存率高于对照组,差异具有统计学意义(P<0.05)。见表5。
表5 两组生存指标比较[ ,n(%)]
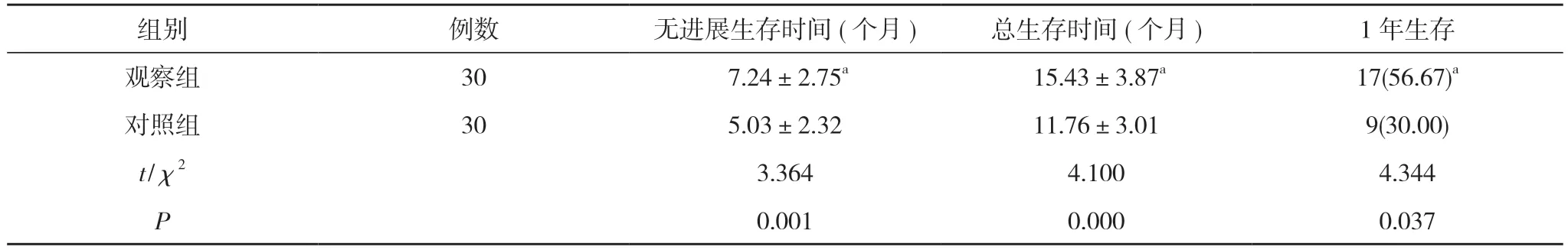
表5 两组生存指标比较[ ,n(%)]
注:与对照组比较,aP<0.05
3 讨论
胃肠道恶性肿瘤是临床难治性恶性肿瘤类型,早期手术根治是改善预后的关键。但临床实践显示,部分胃肠道恶性肿瘤术后复发率及转移率高,加之部分患者确诊时已处于中晚期,发生转移的几率更高[9]。由于胃肠道恶性肿瘤血液循环均需通过门静脉,导致肿瘤细胞可经门静脉进入肝脏,造成肝转移。
胃肠道恶性肿瘤肝转移瘤治疗困难,临床缺乏高效治疗方法,总体预后差,死亡率高。目前,全身化疗仍是首选治疗方法[10]。研究显示,FOLFOX 化疗方案对胃肠道恶性肿瘤的敏感性较高,对于胃肠道恶性肿瘤肝转移瘤亦有一定治疗效果,可提高局部控制率,使小部分肝转移瘤从不可切除缩小至可切除,从而提高整体疗效[11,12]。奥沙利铂为第三代铂类,通过抑制肿瘤细胞DNA 的复制,诱导肿瘤细胞凋亡,达到抗肿瘤作用[13]。但单一全身化疗的作用有限,无法明显延长总生存时间。
临床研究显示,全身化疗联合介入治疗能提高对肝转移灶的控制效果,提升局部缓解率[10]。HAIC 是主要的肝内介入治疗方式,通过股动脉穿刺置入导管至肝动脉内,直接灌注化疗药物,达到局部治疗目的[14]。研究证实,通过肝动脉给药明显提高肝转移瘤内药物浓度,其药物浓度是静脉给药的100~400 倍,达到提升了抗肿瘤效果,也避免了全身用药严重的毒副反应[14]。一项临床研究显示,HAIC 通过注入氟尿嘧啶脱氧核苷治疗无法切除的肝转移瘤病灶,其有效率为41%~62%,优于单纯静脉化疗的9%~27%[15]。本研究结果显示,观察组治疗有效率为40.00%、临床控制率为76.67%,明显高于对照组的13.33%、46.67%,差异具有统计学意义(P<0.05)。证实了介入治疗联合全身化疗能提高胃肠道恶性肿瘤肝转移瘤临床获益,提高肝转移灶控制率。而在毒副反应方面,两组胃肠道反应、腹泻、手足综合征、感觉神经障碍、肾功能异常、白细胞减少、血小板减少发生率比较差异均无统计学意义(P>0.05)。说明介入治疗总体的安全性较高,灌注进入肝转移灶的化疗药物作用较为局限,对全身的影响相对较小。
肿瘤标志物是评估肿瘤病情及预后的重要指标。VEGF 在肿瘤内呈高表达,可促进肿瘤新生血管的无序、大量增殖,并提高肿瘤的侵袭和转移能力[16]。CA19-9、CA125 等均是常用的肿瘤标志物,均在肿瘤发展过程中保持高度特异性,与肿瘤增殖情况呈正相关[17]。Cyfra21-1 也在肿瘤组织内呈高表达,存在于肿瘤上皮细胞中,随肿瘤进展而升高。本研究中,治疗后,观察组血清CA19-9、CA125、Cyfra21-1、CEA、VEGF 水平均低于对照组,差异具有统计学意义(P<0.05)。证实了介入治疗能更好地发挥肿瘤抑制作用,降低肿瘤标志物的表达。而在肝功能及其他血生化指标方面,治疗前后,两组血清ALT、AST、TBIL、ALB、Hb、WBC 水平组间比较差异均无统计学意义(P>0.05)。说明介入治疗对肝脏的损伤较小,也不增加对造血功能的抑制。观察组无进展生存时间(7.24±2.75)个月、总生存时间(15.43±3.87)个月长于对照组的(5.03±2.32)、(11.76±3.01)个月,1 年生存率56.67%高于对照组的30.00%,差异具有统计学意义(P<0.05)。证实介入治疗能提高胃肠道恶性肿瘤肝转移瘤患者的生存率,在一定程度上延长了生存时间。随着靶向治疗药物的开发及应用,胃肠道恶性肿瘤肝转移瘤有望进一步提升疗效并延长生存时间[18]。
综上所述,介入治疗胃肠道恶性肿瘤肝转移瘤的效果良好,能明显降低肿瘤标志物水平,生存获益更多,不增加毒副反应,值得推广使用。

