前列腺体积和手术时间与老年患者经尿道前列腺汽化电切术后尿道狭窄的相关性分析
生文龙,沈玉霞,李娟
上海交通大学医学院苏州九龙医院手术室,江苏 苏州 215028
良性前列腺增生是1 种常见的良性疾病,在老年男性中非常常见[1]。 经尿道前列腺汽化电切术(transurethral electro vaporization prostatectomy, TUVP) 治疗良性前列腺增生具有较高的安全性和有效性,可以显著缓解症状,降低国际前列腺症状评分(international prostate symptom score, IPSS)[2-3]。 TUVP 适应症相对其他电切术更加广泛。 目前内窥镜尿道手术后尿道狭窄的病因尚不清楚,但患者前列腺体积、术中发生的医源性创伤和感染是最常见的相关因素。 此外,也有研究表明,术中内窥镜停留在尿道内的时间延长可能损害尿道组织,引起输尿管上皮紊乱[4],从而诱发尿道狭窄。 尿道狭窄在行电切术治疗的前列腺良性增生的患者中并不罕见。 筛选TUVP 术后尿道狭窄发病的独立危险因素,具有重要临床意义。 本研究旨在评估经TUVP 治疗的老年患者术后尿道狭窄的危险因素,为预防干预提供参考依据。
1 资料与方法
1.1 一般资料回顾性分析2019年7月—2022年2月在上海交通大学医学院苏州九龙医院行TUVP 治疗的老年良性前列腺增生患者病例资料。 本研究为病例对照研究,观察组和对照组病例数设置为1∶2。 样本量计算公式:n1= 1/2*n2= [Zα/2 + Zβp(1 -p)1/2]2/[(p-1)2(p0q1+ p1q0)]。 本研究观察组最终纳入术后尿道狭窄病例34例,对照组纳入术后尿道无狭窄病例68例。
1.2 纳入和排除标准纳入标准:(1)患者年龄≥60岁的男性; (2)患者存在下尿路梗阻症状,直肠指诊、前列腺指诊及术后病理均提示为前列腺良性增生;(3)患者行 TUVP 治疗; (4)手术治疗后无内窥镜泌尿系统干预史,无泌尿系统损伤史; (5)病例资料完善,患者随访时间超过6 个月; (6)观察组患者在随访过程中确诊为术后尿道狭窄,对照组患者在随访过程中无尿道狭窄。 符合上述所有标准的病例纳入本研究。 排除标准: (1)患者术后病理提示为前列腺癌;(2)患者合并存在输尿管狭窄; (3)患者既往患有或合并患有泌尿系统恶性肿瘤; (4)患者合并患有结石、肾炎、肾功能衰竭、膀胱炎、盆腔脂肪增多症、先天性畸形等泌尿系统疾病; (5)患者有既往泌尿系统手术史; (6)患者合并患有严重的基础疾病; (7)患者合并患有精神障碍,无法自主排尿; (8)患者参与其他临床研究。 具有上述任意1 标准的患者不纳入本研究。
1.3 方法尿道狭窄诊断患者行TUVP 术后在随访过程中出现下尿路梗阻症状或经尿流量测量可疑狭窄,经尿道内镜或尿道造影,明确诊断为尿道狭窄。
1.4 观察指标与方法收集患者的一般临床资料,包括患者年龄、体质量指数、病程、吸烟史、酗酒史、是否合并高血压病、糖尿病、既往导尿史等。 收集患者围手术期相关临床资料,即国际前列腺症状评分(IPSS)[5]术前是否合并尿路感染、前列腺体积、术中切除组织重量、手术时间、术中失血量、导尿管留置时间。前列腺体积数据从术前超声报告中获取。 手术时间定义为内窥镜插入尿道到导尿管插入的时间。 术中切除的组织量定义为切除的前列腺标本的质量,在过滤标本的液体后用精密刻度测量。
1.5 统计学分析数据分析使用SPSS 24.0 版本。计量资料以均数±标准差()表示,组间差异比较采用t检验;计数资料以例数和百分率表示,组间差异比较采用χ2检验;采用单因素Logistic 回归分析评估临床参数与尿道狭窄的关系,对单因素Logistic 分析中尿道狭窄相关危险因素进行多因素Logistic 回归分析;采用受试者工作特征曲线(receiver operator characteristic curve, ROC)的曲线下面积(area under curve,AUC)评估参数对尿道狭窄的预测效能。P<0.05 表示差异有统计学意义。
2 结果
2.1 2 组患者临床参数比较观察组患者体质量指数高于对照组(P=0.043)。 观察组既往有导尿史患者比例(P=0.021)、术前导尿患者比例(P=0.037)、术前合并尿路感染患者比例(P=0.010)、既往有糖尿病病史患者比例(P=0.033)高于对照组。 观察组患者前列腺体积(P=0.049)、 IPSS 评分(P<0.001)、术中出血量(P=0.010)、术中切除前列腺组织质量(P=0.030)、手术时间(P< 0.001)、术后留置导尿管时间(P<0.001)、术后导尿管牵拉时间(P=0.012)高于对照组。 观察组和对照组患者在年龄、病程、高血压病史等方面差异无统计学意义(P>0.05)。 见表 1。

表1 观察组和对照组临床参数比较
2.2 术后尿道狭窄危险因素筛选单因素Logistic 回归显示,既往导尿史(OR =1.08,P=0.038)、术前导尿(OR =1.65,P= 0.026)、术前合并尿路感染(OR =1.19,P= 0. 007)、糖尿病病史 ( OR = 1. 57,P=0.049)、前列腺体积(OR =1.86,P=0.009)、 IPSS 评分(OR = 1. 71,P= 0. 005)、术中切除质量(OR =1.31,P=0.003)、手术时间(OR = 1.83,P= 0.002)以及术后留置导尿管时间(OR =1.32,P=0.025)是前列腺电切术后尿道狭窄的危险因素。 见表2。

表2 单因素Logistic 回归分析筛选术后尿道狭窄危险因素
2.3 术后尿道狭窄独立危险因素筛选多因素Logistic 回归显示,前列腺体积(OR = 1.64,P= 0.014)和手术时间(OR = 1.57,P= 0.004)是前列腺电切术后尿道狭窄的独立危险因素。 见表3。
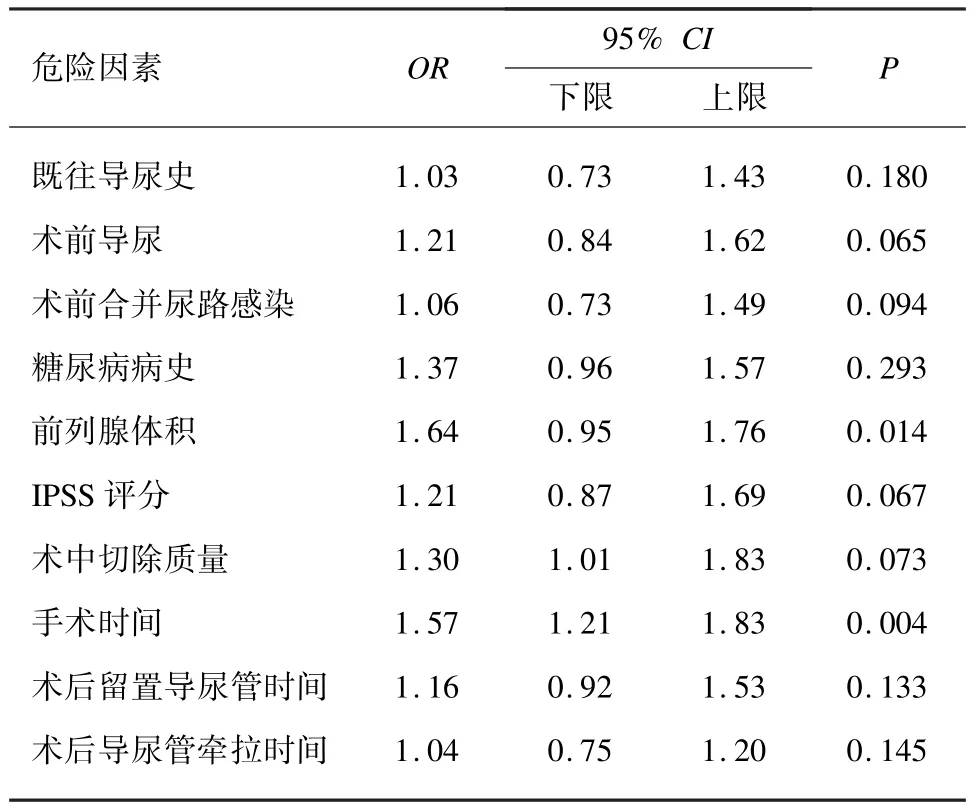
表3 多因素Logistic 回归分析筛选术后尿道狭窄独立危险因素
2.4 独立危险因素对术后尿道狭窄的预测效能评估ROC 曲线显示,前列腺体积、手术时间以及两者联合指标 AUC 分别为 0. 62(P= 0. 021), 0. 56(P=0.037)和 0.78(P=0.006)。 见表 4。

表4 独立危险因素对术后尿道狭窄的预测效能评估
3 讨论
TUVP 是治疗前列腺增生的经典术式,并且其适应症相对较宽。 有研究认为, TUVP 优于等离子电切术[6]。 但是,尿道狭窄仍然是 TUVP 手术的一个常见的并发症。 经尿道前列腺电切术后尿道狭窄的发病率从 1.7% 到 9.8% 不等[7-8]。 这种差异可能与手术方式选择、随访时间以及当地医疗水平有关。 Gur 等[8]研究指出,在经尿道前列腺电切术后至少12 个月的随访期结束时,大约4%的患者会出现尿道狭窄。 冯伟等[9]对患者进行了6 个月的随访,有5.83%的患者在术后发生了尿道狭窄。 Michielsen 等[10]研究表明,在594 名患者中,有17 名(2.9%)出现了术后尿路狭窄。尿道狭窄在行电切术治疗的前列腺良性增生的患者中并不罕见。 筛选其发病的独立危险因素,可以为预防干预提供参考依据。
本研究通过病例对照研究发现,与无尿道狭窄的患者相比,在术后尿道狭窄的患者中,一些临床参数,包括体质量指数、导尿史、术前导尿、术前合并尿路感染、糖尿病病史、前列腺体积、 IPSS 评分、术中出血量、术中切除前列腺组织质量、手术时间、术后留置导尿管时间等,呈现出比例升高或者数值增加的趋势。 本研究进一步筛选了尿路狭窄的危险因素和独立危险因素。 手术时间和前列腺体积是TUVP 术后尿路狭窄的独立危险因素。 这与既往的一些研究结果相符。 1项国外的研究[8]表明,延长手术时间和既往患有基础疾病的数目是经尿道前列腺电切术后尿道狭窄发展的独立危险因素。 Komura 等[11]研究表明延长手术时间增加了发生尿道狭窄的风险。 手术操作持续时间超过60 min 后,尿道狭窄的风险显著增加。 同样,Tao 等[12]研究表明,缓慢的切除前列腺组织增加了发生尿道狭窄的风险。 延长手术时间在经尿道前列腺电切术后尿道狭窄的发病机制中具有重要作用[13]。长时间使用切除镜会导致尿道炎症和尿道黏膜缺血,从而引起黏膜损伤,导致上皮下纤维化,增加TURP 后尿道狭窄的风险[14]。 舒文云等[15]研究认为,前列腺体积与术后尿道狭窄有关。 前列腺体积大小与临床症状存在相关性。 前列腺体积大的患者在术前往往接受了更多的导尿这种侵入性操作,以及需要面对更高的尿路感染风险。 这些都是前列腺体积成为术后尿道狭窄独立危险因素的潜在原因。 ROC 曲线表明,联合指标曲线下面积大于前列腺体积和手术时间单独曲线下面积。 这表明,相比于手术时间和前列腺体积单独应用,联合指标对TUVP 术后尿道狭窄具有更好的预测效能。
本研究通过病例对照研究分析了老年患者TUVP 术后尿道狭窄的独立危险因素。 本研究还构建了术后狭窄预测的联合指标,该联合指标具有较好的预测效能。 但是,本研究在几个方面受到了限制。首先,本研究属于回顾性分析,并且样本量较小,仍然需要大样本量的前瞻性研究进一步验证完善本研究的结论。 其次, TURP 术后发生尿路狭窄的其他因素,如漏电和使用冲洗液的温度,未被纳入本研究中。 今后需要纳入更加全面的临床参数进行分析,以完善本研究。
综上所述,前列腺体积大小和手术操作时间是TUVP 术后尿道狭窄的独立危险因素。 两者联合指标对TUVP 术后尿道狭窄具有较好的预测效能,具有一定临床应用价值。

