补体C5a受体1拮抗剂对小鼠脑缺血/再灌注的保护作用
石艳超, 韩 晋, 李 强, 孟虹媛
卒中是当今世界最常见的疾病之一,也是人类致残和死亡的主要原因。缺血性脑血管病占卒中的70%~80%,与脑出血相比,其发病机制复杂、多样。脑梗死引起的一系列病理生理过程会加重脑损伤,从而导致更严重的神经功能缺损、认知障碍。但是,目前脑梗死的确切分子学机制尚不完全明确[1,2]。对脑梗死患者的脑组织活检发现,多种补体在梗死脑组织局部沉积,提示补体参与脑梗死的发病[3]。有研究发现,补体C3-C3aR在慢性脑缺血低灌注过程中可加重脑白质损伤[4],脑梗死后包含C5a在内的补体系统激活了多种生物活性分子,进一步加重脑梗死病情[5]。补体C5a主要通过与膜结合的G蛋白偶联受体-C5a受体1(C5aR1)结合来发挥作用[6],补体将免疫细胞招募到受损组织后激活免疫细胞,诱导炎症反应加重组织损伤[6]。补体C5a还可诱导体外培养的神经细胞自噬和凋亡,并且降低PI3K/Akt/mTOR通路相关蛋白的表达[7]。本文旨在探讨C5aR1拮抗剂对脑缺血再灌注(cerebral ischemia-reperfusion,CIR)的保护作用,以期为缺血性脑血管病治疗提供新的靶点。
1 材料与方法
1.1 主要试剂及仪器 C5aR1拮抗剂PMX53、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)、Trizol、紧密连接蛋白-1(zonula occludens-1,ZO-1)、激光多普勒血流仪(PF5010,Perrimed AB,中国北京)、鱼线(北京沙东生物)。
1.2 实验动物和分组 8~10周龄健康C57BL/6小鼠,体重(20±2)g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006]。将小鼠随机分为假手术组、CIR组(模型组)和C5aR1拮抗剂组(PMX53组),假手术组32只,其余两组各40只。造模前3 h、再灌注24 h及再灌注48 h,PMX53组予腹腔注射PMX53(1 mg/kg),假手术组及模型组予腹腔注射同体积生理盐水。再灌注72 h处死小鼠,留取脑组织。
1.3 大脑中动脉CIR模型建立 参照Longa法建立大脑中动脉CIR模型[8]。以10%水合氯醛腹腔注射麻醉,仰卧位固定于恒温电热板上、覆盖恒温毯。颈部正中切口,分离右侧颈总动脉、颈内动脉及颈外动脉。结扎颈总动脉近心端,夹闭颈总动脉远心端及颈外动脉近心端,于颈总动脉分叉下方向颈内动脉插入头端钝化的鱼线,推进约8~9 mm,感觉有阻力时停止,固定于颈总动脉60 min,取出线栓恢复血流。使用激光多普勒血流仪检测术侧额顶皮质区脑血流量(cerebral blood flow,CBF),评估大脑中动脉CIR造模成功与否。大脑中动脉CIR模型定义为:缺血时CBF较缺血前下降85%,再灌注时CBF较基线时升高80%[9]。假手术组仅做颈部正中切口,以及分离右侧颈总动脉、颈内动脉及颈外动脉。
1.4 小鼠神经功能评分、脑梗死体积和脑组织含水量测定 采用改良Longa方法评估神经功能:0分,无神经功能缺损;1分,左前肢屈曲;2分,自发左旋;3分,向左倾倒;4分,意识丧失或无自发运动;5分,死亡。本研究中,对照组32只、模型组和PMX53组各40只,模型组及PMX53组采用评分1~3分的小鼠。脑再灌注72 h进行神经功能评分后,取对照组8只、模型组和PMX53组各10只,10%水合氯醛腹腔注射麻醉,20 ml 冰PBS(pH 7.4,4 ℃)经左心房灌洗后快速取脑组织。于视交叉水平,连续切取厚2 mm冠状位的脑组织切片5片,浸泡于37 ℃环境2% TTC溶液中20 min,然后室温下置于4%多聚甲醛溶液中1 h。正常脑组织呈红色,梗死组织呈白色。对脑切片进行拍照,利用Image 软件对各切片进行分析量化。脑梗死体积公式为:脑梗死体积(%)=[总的梗死体积-(同侧半球体积-对侧半球体积)]/对侧半球体积×100%[10]。用干湿重法测定脑含水量作为脑水肿程度的指标,取对照组8只、模型组和PMX53组各10只小鼠的缺血侧大脑半球,缺血侧大脑半球脑组织含水量(%)=[(湿重-干重)/湿重]×100%[11]。以上由不同的人员盲法进行。
1.5 RT-PCR实验 脑再灌注72 h,取对照组8只、模型组和PMX53组各10只小鼠,使用Trizol法进行缺血侧大脑半球总RNA提取纯化,用酶标仪测定RNA浓度后,取2 ug总RNA为模板,将RNA逆转录合成cDNA,取1 μl cDNA作为模板进行RT-PCR扩增反应。引物由上海碧云天生物有限公司合成,引物序列(见表1)。反应参数:95 ℃预变性30 s,接着95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸15 s,共40个循环。以β-actin为内参,按2-△Ct方法,分别计算出IL-1β、TNF-α和内参β-actin mRNA的相对表达水平。每样本重复检测3次,求得平均值作为分析结果。β-actin mRNA的表达水平设定为1。
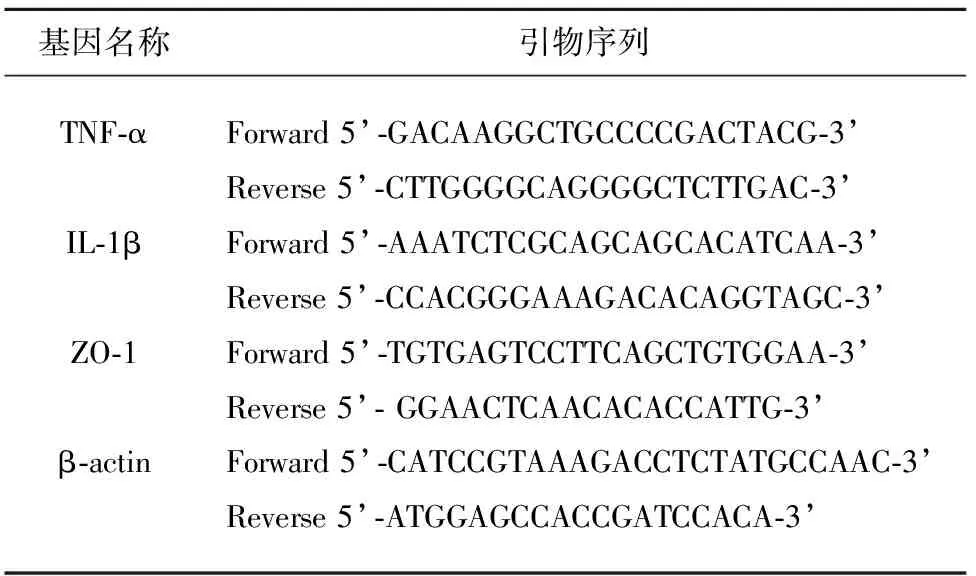
表1 引物序列
1.6 Western blot法检测缺血侧脑组织ZO-1的表达 脑再灌注72 h,取对照组8只、模型组和PMX53组各10只小鼠,腹腔注射麻醉后,冰PBS心脏灌流,提取缺血侧大脑半球蛋白。取等量蛋白样品(25 μg/孔)在10%SDS-PAGE上电泳分离,转移到PVDF膜上,室温下在1.5%脱脂牛奶中封闭1 h,然后与一抗在4 ℃下孵育过夜。随后,将膜与辣根过氧化物酶结合的二抗一起室温下孵育2 h。最后,使用增强化学发光剂对免疫条带进行可视化处理。

2 结 果
2.1 神经功能评分 脑再灌注72 h,假手术组未出现神经功能缺损,3组间比较神经功能评分有显著差异(P<0.05);与模型组比较,PMX53组神经功能评分降低,神经功能缺损症状减轻(P<0.05)(见表2)。

表2 脑再灌注72 h各组小鼠神经功能评分
2.2 脑梗死体积和脑含水量 假手术组小鼠未见脑梗死灶,模型组可见明显脑梗死灶(P<0.05),与模型组相比,PMX53组梗死灶体积明显减小(P<0.05)(见表3、图1);3组间脑含水量有明显差异(P<0.05),PMX53组脑含水量较模型组低(P<0.05) (见表3)。

表3 脑再灌注72 h各组小鼠脑梗死体积及脑含水量比较
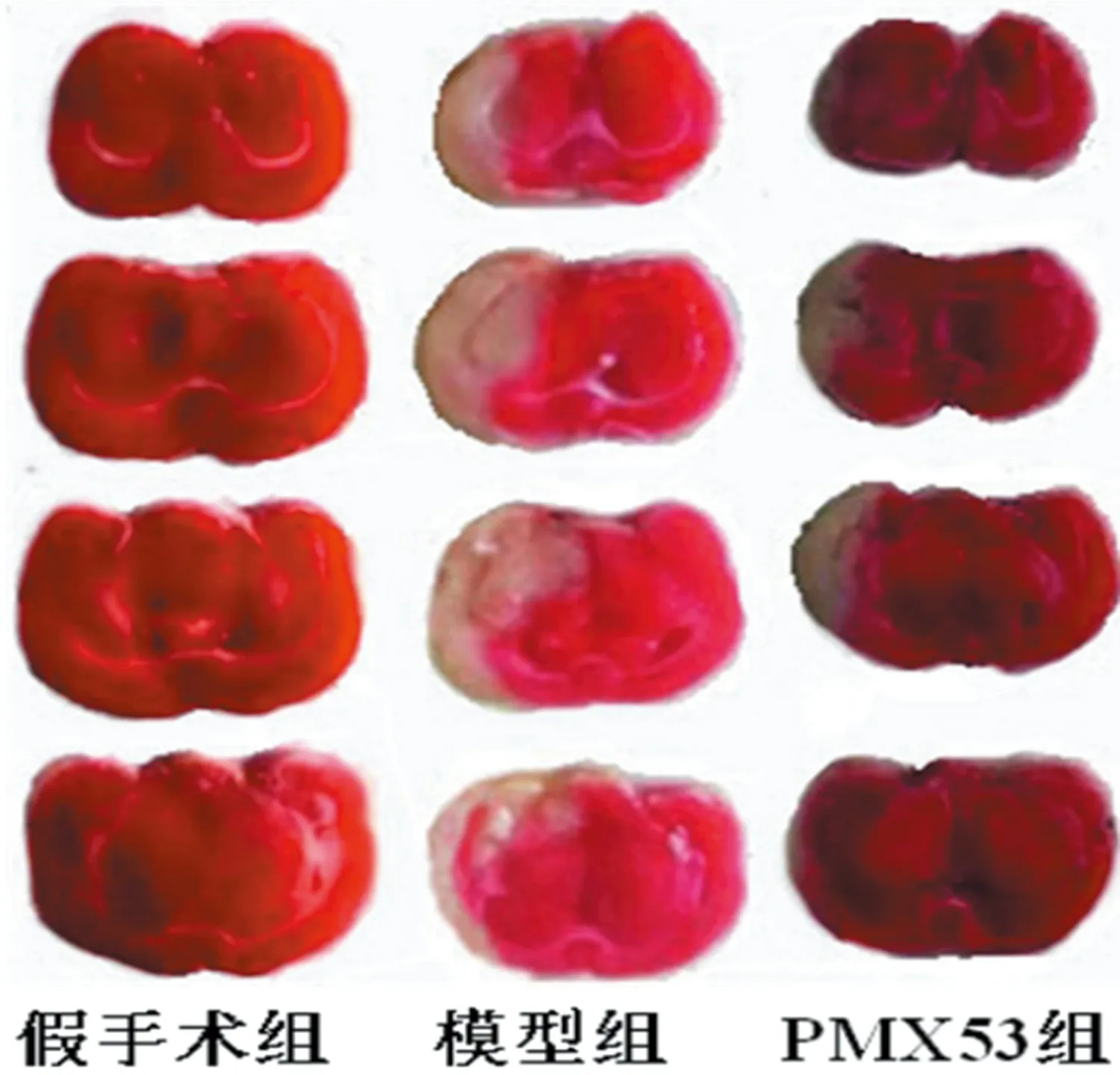
图1 脑再灌注72 h各组小鼠脑梗死图像
2.3 IL-1β和TNF-α mRNA的表达 3组间IL-1β和TNF-α mRNA相对表达有显著差异(P<0.05),与模型组比较,PMX53组的IL-1β和TNF-α mRNA相对表达量明显降低(均P<0.05)(见表4)。

表4 脑再灌注72 h各组小鼠脑组织IL-1β mRNA和 TNF-α mRNA相对表达量
2.4 ZO-1 蛋白的表达量 与假手术组比较,模型组和PMX53组的ZO-1表达明显减少(P<0.05);与模型组比较,治疗组ZO-1的表达增加(P<0.05)(见表5、图2)。
表5 脑再灌注72 h各组小鼠脑组织ZO-1的相对表达量

图2 脑再灌注72 h各组小鼠梗死侧脑组织ZO-1印迹条带
3 讨 论
补体系统是固有免疫反应的必要条件,在宿主防御和组织稳态中起着重要作用[12]。补体系统参与多种病理生理过程,越来越多的研究表明,补体系统的功能复杂、多样,涉及多种免疫、炎症、神经退行性、年龄相关性和缺血性疾病[2]。补体系统在缺血性卒中发病过程中起着至关重要的作用[13]。脑缺血、脑梗死后,由局部活化的内皮细胞、神经元和胶质细胞合成的补体成分,以及来自白细胞的补体,与疾病的进展密切相关[14]。2021年一项研究表明,缺血性卒中急性期血清补体C3升高与3个月不良临床结局风险增加相关[15]。
补体C5a是一种高活性炎性肽,在内源性免疫反应中发挥着重要作用[16]。C5a可促进中性粒细胞和单核细胞向损伤或炎症部位迁移,可增加促炎因子干扰素-γ的生成,加重组织损伤。C5a与C5aR1结合后可作用于多核细胞、单核细胞和巨噬细胞,诱导吞噬细胞释放溶酶体酶、诱导促炎性细胞因子的分泌和促进活性氧的生成[1,17]。与C5aR1不同,C5a与C5aR2结合后,不能诱导经典的信号转导(诱导细胞内钙瞬间释放)或生物细胞反应[18]。
脑梗死后C5a表达增加,过度表达的C5a与C5aR1结合后,导致单核细胞、巨噬细胞、嗜碱性粒细胞和中性粒细胞释放促炎细胞因子(如TNF-α、IL-1β和IL-6),加重炎性反应[17,19]。两项针对C5缺陷小鼠实施脑梗死的研究表明,C5缺陷对脑梗死神经细胞的损伤具有保护作用,可改善神经功能评分[20,21]。对C5aR1(-/-)脑梗死小鼠的研究也得出了同样结论[22]。上述研究提示,阻断C5aR1对神经细胞具有保护作用。本研究通过对CIR小鼠使用C5aR1拮抗剂PMX53后,发现小鼠神经功能障碍有所改善,脑梗死体积缩小,脑水肿程度减轻,促炎性因子生成减少。ZO-1是一种细胞质附着蛋白,位于脊椎动物紧密连接内皮细胞的胞质面。ZO-1表达下调常提示BBB的完整性受到损伤。本研究中,我们发现与模型组相比,PMX53组ZO-1蛋白表达上调,脑水肿程度减轻,提示C5aR1拮抗剂PMX53对BBB具有保护作用。
总之,诸多研究表明,补体系统作为机体固有免疫的重要组成部分,在组织损伤中起着重要作用[2,5,6,14]。因此,研究人员开发出了大量补体靶向药物来调节补体激活,减轻组织损伤[2]。基于以上研究,本研究发现,C5aR1拮抗剂PMX53可减轻小鼠CIR损伤的程度,为临床缺血性脑血管病的治疗带来了新的希望,但其在缺血性脑血管病患者中的作用尚不清楚,仍需进一步的研究。

