具有苹果枝条降解及生防能力真菌的筛选与鉴定
杜文彪,刘尚巧,冒霞,朵虎,赵丹,王超,左存武,3
(1.甘肃农业大学园艺学院,甘肃 兰州 730070;2.永靖县园林绿化中心,甘肃临夏 731600;3.甘肃省干旱生境作物学国家重点实验室,甘肃 兰州 730070)
由于连年生产和化肥的使用,使得我国苹果园土壤日益贫瘠,有机质含量普遍偏低,也造成了果园生态环境恶化,导致树体衰弱,肥水失衡,成龄果园腐烂病严重等情况[1]。然而,我国现有成龄苹果园在冬春剪时产生大量的废弃枝条未进行科学处理,大多在果园角落堆或就地焚烧,占用田间道路和果园空间,严重影响当地果树的绿色、安全生产。同时,废弃枝条也是致病微生物和害虫越冬的主要场所之一,易造成果园病虫害大面积爆发[2]。
利用好农业废弃物,是发展智慧循环农业的一个重要环节。近年来,农业废弃资源的利用被广泛重视,“绿色农业”和“生态农业”日益成为该领域研究的重点。在苹果生产中,许多学者也做了许多相关研究,育苗盆土中添加苹果枝条碎片能够显著提高栽培基质中的有机质[3]。以苹果枝条为原料制备的生物炭能增加土壤有机碳和微生物碳、磷的含量[4]。此外,苹果枝条内的养分回流能够改善果园生态条件,减少化肥使用,促进绿色生产[5]。纤维素降解菌因降解效果好、产酶高和适应性强等特点,在农业废弃物资源利用的研究中备受关注[6]。自然界中纤维素降解菌主要从土壤和枝条中分离获得,其研究多集中于菌株的耐温生长、产酶条件和纤维素降解能力等方面[7-8]。目前,经学者筛选研究已获得部分可应用于秸秆、桑枝等废弃枝干的高效降解菌株[9]。然而,可用于苹果枝条韧皮部和木质部降解的专用菌株很少,具有生防潜力的纤维素降解菌株的报道更少,因此,探究苹果枝条的资源化利用具有较好的前景。
本试验以废弃苹果枝条为分离功能菌的材料,经初筛、复筛和纤维素酶活性测定,获得4株具有纤维素降解能力的真菌菌株。在此基础上,通过平板对峙试验,测定了以上4株菌株对腐烂病的生防能力。结合形态特征和基因序列的同源性分析,对其进行鉴定,明确4株菌株的分类地位。
1 材料与方法
1.1 试验材料
1.1.1 试验样品供试真菌菌株分离自甘肃农业大学天水园艺学院天水试验基地苹果园区(E 105°69'17.77''E,N 34°54'53.29'')的废弃枝条。腐烂病菌菌株JN-01B为本实验室分离鉴定[10]。
1.1.2 供试培养基初筛培养基包括固体培养基(potato dextrose agar,PDA)、液体培养基(Potato Dextrose Broth,PDB)和羧甲基刚果红培养基[11]。复筛培养基:烘干苹果枝粉(过40目筛)40 g,麸皮粉2 g,NaNO32.5 g,NaNO20.1 g,MnSO4·H2O 0.3 g,KH2PO41.0 g,FeCl3·H20 0.017 g,琼 脂8 g,水500 mL,pH=7.0。发 酵 培 养 基:NaNO32.5 g,NaNO20.1 g,MnSO4·H2O 0.3 g,KH2PO41.0 g,FeCl3·H2O 0.017 g,琼脂8 g,水500 mL。产酶培养基:CMC-Na 15.0 g,酵母粉5.0 g,KH2PO42.0 g,pH=7.0。
1.2 试验方法
1.2.1 菌株的分离和初筛利用刚果红纤维素培养基对纯化菌株进行初筛[12]。在单孢分离的菌株制作菌饼接种至羧甲基刚果红培养基平板上,28℃培养72 h后,观察菌株菌落周围有无水解效果。统计透明圈直径(D)与菌落圈直径(d)的比值,选择产生水解效果的菌株进行复筛。
1.2.2 菌株的复筛将初筛培养得到的纯化菌株接种于复筛培养基(苹果枝粉)平板上,在28℃条件下培养4 d,观察菌株生长情况。
1.2.3 菌株生长特性的测定将获得的菌株在28℃恒温下接种至不同pH值(5、6、7、8和9)的复筛培养基平板,测定其最适生长pH;同样的将其接种至pH为7的复筛培养基平板置于梯度温度(25、28、30、32、35、37℃)的恒温培养箱中。每个处理设置3个重复,培养4 d后测量并统计菌落直径大小。
1.2.4 纤维素酶活性的测定各菌株纯化培养后,使用5 mm打孔器在菌落四周打菌饼4个。将菌饼接种到装有50 mL的产酶培养基的三角瓶中,32℃条件下120 r/min振荡培养2 d后,间隔48 h取样。发酵液于4℃10 000 r/min离心10 min后取上清液。
试验采用DNS法进行酶活力的测定。滤纸酶(filter paper enzyme,FPAase)、羧甲基纤维素酶(car‐boxymethyl cellulase,CMCase)和β-葡萄糖苷酶(βglucosidase)可代表纤维素的酶活力。因此,其测定的反应底物分别为1 cm×6 cm新华一号定量滤纸条(约50 mg,折成M形)、0.5%CMC-Na溶液和0.5%水杨苷(水杨素)溶液。通过葡萄糖标准曲线计算得出酶活力[13],将酶活力单位定义为在温度条件47℃下,在1 min内能转化1 μmol/L底物的酶量或转化底物中1 μmol/L的有关基团的酶量,定义为一个酶活力单位(U)。酶活力(U/mL)计算公式如下:
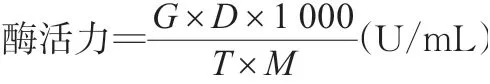
式中:G为吸光值对应葡萄糖质量(mg);D为反应体积的稀释倍数;M为葡萄糖的摩尔质量180 g/mol;T为反应时间(min)。
1.2.5 菌株苹果枝条降解能力的测定将获得的菌株接种到PDB中,在28℃条件下150 r/min振荡培养4 d,将菌株培养液作为菌株种子液。取10 mL菌株种子液接种到50 g发酵培养基,搅拌混匀。封口置于28℃静置培养(湿度60%),每个处理设3个生物学重复及对照(CK)。50 d后观察枝段颜色变化、腐烂情况及其表面菌丝生长情况,取样烘干并利用失重法测定枝条降解率。
1.2.6 菌株生防效果的测定利用现有的苹果腐烂病病原菌(Valsa mali,Vm)与各菌株对称点接至PDA培养基。在28℃恒温培养72 h后,观察是否出现抑菌带或重寄生等代表生防菌的特征现象。
1.2.7 菌株的鉴定本试验通过形态学观察和分子鉴定进行菌株鉴定,其中形态学观察是在PDA培养基上接种菌株在28℃恒温培养箱生长培养4 d后拍摄菌落基本形态;在显微镜下观察菌株的菌丝及孢子形态特征。参照《真菌鉴定手册》[14]进行初步鉴定。
分子鉴定使用CTAB法提取培养72 h后的菌株DNA为模板,扩增内源转录间隔区(internal tran‐scribed spacer,ITS)和小核糖体亚基(the small ribo‐some subunit,TR)序列,将目的片段连T载体,转大肠杆菌,筛选阳性克隆验证后送至北京擎科生物技术有限公司进行测。ITS序列所用上、下游引物分别为5′-TCCGTAGGTGAACCTGCGG-3′和5′-TCCTCCGCTTATTGATATGC-3′;TR序列分别 为5′-GTTTCTAGGACCGCCGTA-3′和5′-CTCAAACTTCCATCGACTTG-3′[15]。测 序 结果上传至NCBI数据库中进行BLAST序列同源性序列比对,并下载同源性相近的序列在软件MEGA 5.0(http://www.megasoftware.net)下 进行多序列比对并构建进化树,确定该菌株的系统发育学地位。
1.3 统计分析
原始数据在Microsoft Excel 2019软件整理,差异显著性分析采用SPSS软件及t-test法分析,图形可视化采用Origin 9.0软件,所有数值均表示为xˉ±s标准差。
2 结果与分析
2.1 菌株的分离和初筛
从采集的苹果果园带菌枝条经过单孢分离纯化出9种真菌,随后将各菌株菌饼接种至刚果红纤维素培养基在28℃恒温培养72 h后,共发现4株真菌具有纤维素降解能力,分别命名为MM1、MX-1、MX-2和Z-2-1。
各菌株水解圈及菌落直径进见表1。其中MX-2的水解圈直径最大,为(39.94±0.77)mm;其次为MM1和Z-2-1,分别为(24.63±0.18)和(21.61±0.49)mm。MX-2的菌落直径最大,为(22.15±0.53)mm;MM1次之,为(16.7±0.71)mm。4株菌株的直径比由大到小依次为Z-2-1、MX-1、MX-2和MM1,分别为2.18、1.88、1.80和1.48(图1)。

表1 真菌羧甲基刚果红染色的水解圈大小(n=3)Table 1 The hydrolysis fungus ring size of carboxymethyl Congo red staining(n=3)

图1 各菌株在CMC-Na刚果红培养基产生的水解效果Figure 1 Hydrolysis effect of each strain in CMC-Na Congo red medium
2.2 菌株的复筛
将初筛获得的4株菌株接种到固体复筛(苹果枝粉)培养基上,28℃恒温培养4 d后(图2)。各菌株在复筛培养基上的菌落直径均在5 cm以上,气生菌丝生长旺盛,菌丝形态正常。可用于纤维素降解能力的进一步分析。

图2 菌株在复筛培养基平板的生长情况Figure 2 The growth of strains on the rescreening me‐dium plate
2.3 菌株的生长特性
MM1、MX-1、MX-2和Z-2-1的最适生长pH值分别在5.0、7.0、6.0和8.0左右(图3-A)。MM1在pH为5.0时菌落直径为(83.84±0.38)mm;MX-2在pH为6.0时为(82.04±0.66)mm;MX-1在pH为7.0时 为(85.53±0.30)mm;Z-2-1在pH为8.0时为(52.12±1.89)mm。
MM1在28℃左右菌落直径最大,为(83.93±0.92)mm;MX-1、MX-2的菌落直径均在30℃左右最大,分别为(83.96±1.26)、(82.36±1.09)mm;Z-2-1在32℃左右菌落直径最大,为(54.77±0.86)mm(图3-B)。
2.4 菌株纤维素酶活性
随着液体培养时间的增加,MX-2的3种酶活性均高于其他3株真菌,MM1和MM2表现出较高的酶活力,MX-1酶活力较低(图4)。
MX-2的滤纸酶活力变化呈现持续的增长趋势,MM1、Z-2-1和MX-1的滤纸酶活力变化呈先增长后降低的趋势(图4-A)。其中MM1在第8 d时达到酶活力高峰,为(10.08±0.01)U/mL;MX-1和Z-2-1均在第10 d达到酶活力高峰,分别为(6.16±0.15)、(10.47±0.18)U/mL;MX-2在第12天达到酶活力高峰为(12.96±0.02)U/mL。
CMCase酶活力变化均呈先增长后降低的趋势(图4-B)。其中MM1和MX-1在第10天达到酶活力高峰,分别为(6.04±0.01)、(4.62±0.08)U/mL;MX-2和Z-2-1在第8天达到酶活力高峰,分别为(6.94±0.01)(5.51±0.04)U/mL。
MX-2的β-glucosidase活力变化呈现先增长后下降的趋势,在第10天达到酶活力高峰,为(9.87±0.04)U/mL;MM1、MX-1和Z-2-1酶活力的变化呈现持续增长趋势,均在第12天达到酶活力高峰,分别为(7.32±0.08)(4.26±0.03)(6.73±0.03)U/mL(图4-C)。
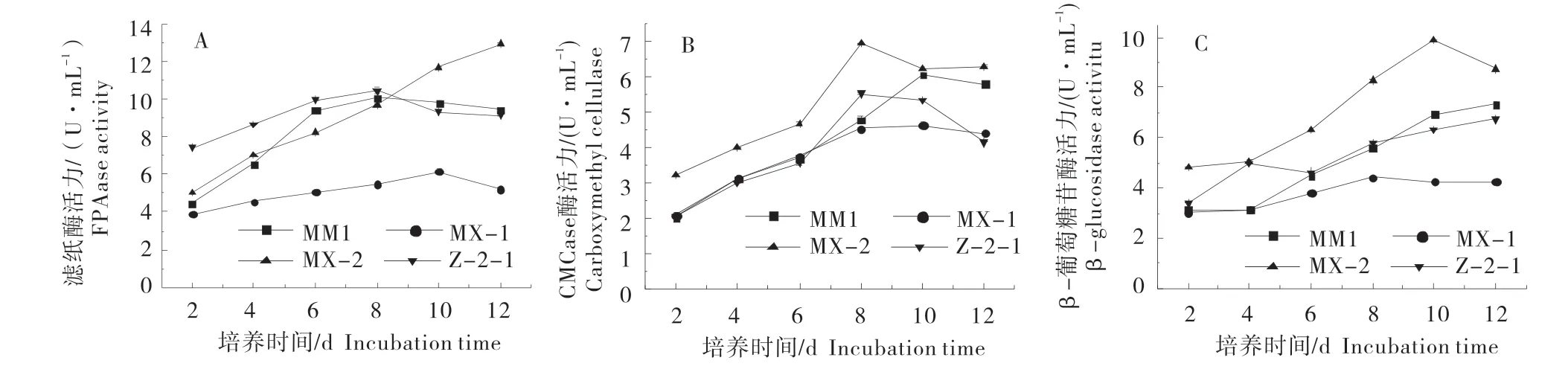
图4 各菌株不同纤维素活性变化Figure 4 Changes of cellulose activity in different strains

图3不同pH和温度对各纤维降解菌株的生长状况的影响Figure 3 Different pH and temperature on the effects of fiber degradation bacterium growth
2.5 菌株对苹果枝条的降解能力
发酵50 d后,不同菌株对枝段均呈现不同程度的降解效果(图5)。与CK处理相比可得降解效果最佳为MX-2,枝段碳化变黑,且部分被降解;Z-2-1和MM1效果良好,菌丝已侵入枝段表皮木质部,枝段变软变酥;MX-1降解效果一般,菌丝缠绕于枝条段上,仅部分菌丝侵入木质部。

图5 各菌株发酵培养生长情况及苹果枝条段的腐烂情况Figure 5 Growth condition of fermentation culture of each strain and rot condition of apple branch segment
MX-2菌株的枝条纤维素降解率明显高于其他3种菌株(图6)。MX-2的枝条纤维素降解率最高,为(21.27±0.56)%;Z-2-1次 之,为(14.65±0.35)%;MM1其次,为(12.73±0.91)%;MX-1最低,达(9.75±0.89)%。

图6 各菌株发酵培养50 d后苹果枝条段降解率Figure 6 Strains fermentation cultivation 50 d apple branch after degradation rate
2.6 菌株的生防效果
筛选出的菌株与VM对峙培养达72 h后。4株真菌对苹果腐烂病的生防能力如下(图7)。培养同等时间条件下,从图中直观可得Z-2-1虽生长缓慢,但对VM具有一点拮抗能力,与病原菌产生了抑菌带[10]。MM1与之进行对峙试验后,抑制了VM的生长速度,其生长的菌落面积小于CK。MX-2和MX-1并不具备明显的拮抗能力,作用方式可能是重寄生现象或其他方式,待后续研究。

图7 各菌株对黑腐皮壳菌生长的影响Figure 7 Effects of each strain on the growth of Valsa mali
2.7 菌株的形态特征
培养4 d后,各菌株表现不同的形态特征(图8)。其中MM1初生菌丝呈乳白色,菌丝生长呈不定型棉絮状或致密丛束状,气生菌丝发达,菌落颜色仍为微黄乳白色。显微观察发现,菌丝有隔分枝,分生孢子无色,簇生于小梗顶端,孢子梗产孢,大小约为(1.5~2.2)μm×(0.3~1.7)μm。MX-1初生菌丝乳白透明,菌落颜色为浅黄白色。显微观察发现,其菌丝总状分支;孢子囊球形,表面微刺,直径约为(5.5~7.2)μm。MX-2菌丝生长迅速,质地绵密细丝,菌落颜色为灰黑色。显微观察发现菌丝透明;孢子为顶囊球形,直径为(2.7~3.48)μm,孢壁粗糙。Z-2-1菌丝细小丛生,菌落黑白相间呈丝绒状。显微观察发现,分生孢子正直呈椭圆形,大小约为(6~10×3.5~5.6)µm。
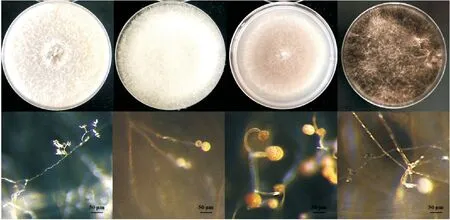
图8 MM1、MX-1、MX-2、Z-2-1菌株菌落及菌落特征显微观察形态特征Figure 8 Colony and colony characteristics of MM1、MX-1、MX-2 and Z-2-1 strains were observed by microscope
2.8 菌株基于ITS、TR基因序列分析及系统发育树的构建
通过提取的DNA进行PCR扩增各菌株ITS和TR目的片段,分别获得了约600 bp和581 bp的DNA片段,将测序后获得的序列输入NCBI数据库进行BLAST比对,并下载与其相近的物种同源序列构建系统发育树(图9)。
结合菌株形态特征及其18S rDNA系统发育树可得,菌株MM1与深绿木霉(Trichoderma atro⁃viride)的亲缘关系最近(图9-A),序列同源性达99.25%,推断该菌株为深绿木霉。菌株MX-1与雅致放射毛霉(Actinomucor elegans)的亲缘关系最近(图9-B),达100%,推断该菌株为雅致放射毛霉。菌株MX-2与黑曲霉(Aspergillus niger)的序列聚为一类(图9-C),且与黑曲霉的亲缘关系最近,达99%,初步判断该菌株为曲霉属,进一步分析其形态特征,推断该菌株为黑曲霉。菌株Z-2-1与穗状弯孢霉菌(Curvularia spicifera)的亲缘关系最近,达99.75%,推断该菌株为穗状弯孢霉菌(图9-D)。

图9 基于18S rDNA序列构建的菌株系统发育树Figure 9 Strain phylogenetic tree constructed based on the 18S rDNA sequence
3 讨论
农业生产中每年都产生了巨大的可再生资源,如废弃枝条、秸秆和麸皮等;这些农业废弃物的利用都需要微生物的参与,如微生物发酵、堆肥生产和微生物降解等;果园清洁生产技术是促进农业的可持续发展,利用和保护资源的手段。
已发现的对纤维素和半纤维素具有降解作用的真菌主要为木霉属(Trichoderma)、曲霉属(Asper⁃gillus)、青霉属(Penicillium)等[16-18]。前人研究测定了深绿木霉的滤纸酶活性,约为4 U/mL,其主要由滤纸酶起降解作用且能降解微晶纤维素[19-20]。本试验发现的深绿木霉MM1的滤纸酶活最高可达(10.08±0.01)U/mL,且对苹果枝条具有较好的降解效果。黑曲霉与纤维素降解相关的研究较多,部分菌株的滤纸酶和CMCase酶活性分别达9.29、2.24 U/mL[21-22]。本研究中,黑曲霉菌株MX-2滤纸酶活性最高可达(12.96±0.02)U/mL,CMCase酶活达(6.94±0.01)U/mL,且可促进枝条纤维素的降解和腐烂。穗状弯孢菌纤维素降解能力的报道较少,部分菌株培养5 d时滤纸酶活性仅为1.71 U/mL[23];而本试验发现的Z-2-1在5 d时的滤纸酶活性约为(9.32±0.16)U/mL。雅致毛霉的纤维素降解能力也被证实,其能产生纤维素水解酶[24]。但菌株MX-1纤维素降解能力一般。因此,黑曲霉MX-2的酶活力和纤维素降解效果显著高于其余菌株。
黑腐皮壳菌(Valsa mali,VM)是引起苹果腐烂病(Valsacanker)的真菌性病害。同时,苹果腐烂病菌是典型的腐生菌[25],可在离体的废弃枝条中生长。本试验中Z-2-1可与病原菌形成抑菌带,MX-2及其余菌株可与之形成重寄生现象或其他现象。因此,土壤中施入了添加菌剂的枝条发酵肥,其菌株在枝条降解过程中可抑制或杀死土壤中的病原菌;具有抑制土壤中其他真细菌等有害物质的效果,还能激发植物的抗性反应[26],这为苹果的“健身栽培”提供了较好的方向。
关于深绿木霉、黑曲霉和弯孢霉对植物的致病性,相关学者开展了一些研究。郭孟配[27]等研究深绿木霉MM1对香菇菌丝具有较强的致病性;色买提等发现黑曲霉MX-2是新疆枣果果实霉烂病的病原菌之一[28];弯孢霉Z-2-1常见于玉米叶斑病,雅致毛霉菌MX-1对其他植物的致病性未见报道。但以上4株真菌针对苹果组织的致病性均未见相关报道。因此,从苹果枝条中分离的各菌株,理论上其在苹果树体内具有先天优势,故筛选的菌株对苹果组织无致病性。目前,本试验只研究了对苹果枝条韧皮部和木质部具有降解作用的专用真菌,后续研究将重点探索微生物互作效应及混合菌剂的开发。
4 结论
本试验通过菌株分离培养、CMC-Na刚果红水解圈和苹果枝粉筛选出4株真菌菌株,MX-2枝条纤维素降解能力最强,降解率高达(21.27±0.56)%,Z-2-1和MM1分 别 为(14.65±0.35)%和(12.73±0.91)%,MX-1最低。Z-2-1对VM形成了抑菌带,具有一定的拮抗作用,MM1与MX-1抑制了VM的生长。经鉴定菌株形态和分子鉴定MM1、MX-1、MX-2和Z-2-1分别为深绿木霉(Trichoderma atro⁃viride)、雅致放射毛霉(Actinomucor elegans)、黑曲霉(Aspergillus niger)和穗状弯孢菌(Curvularia spicifera)。筛选的MX-2纤维素降解效果较好,MM1和Z-2-1生防效果佳,且在纤维素降解方面研究较少,后续可作进一步研究等。

