干式化学滤料吸附硫化氢气体的研究
张建兵,吴升坚,袁仲杨,范淑珍
(浙江爱科乐环保有限公司,杭州 310003)
硫化氢(H2S)是强烈的神经毒素,对呼吸道黏膜有强烈刺激作用,吸入的H2S会与血液中的酶反应,抑制细胞呼吸导致肺瘫痪,从而使人死亡。人持续暴露在含低浓度H2S的环境中,会产生头痛、头昏、恶心等症状;高浓度H2S会导致人昏迷失去意识;在超过700 mL/L的浓度环境下暴露30 min以上,会导致死亡[1]。石油提炼厂、污水处理厂、纸和纸浆制造厂、食品加工厂、养猪场和橡胶厂等都是产生H2S气体的重要场所。若不经过处理就直接排放到大气中,不仅会危害人们的身体健康,还会对环境造成污染。干式化学滤料吸附法处理H2S主要是通过滤料中的化学品与H2S发生反应,在滤料的表面形成固体盐等稳定化合物,这些化合物以无机盐或有机盐的形式不可逆转地与滤材结合。通常情况下,这些反应在环境条件下是不可逆的,从而消除了脱附的可能性。
本实验通过分析滤料颗粒粒径、温湿度及停留时间对H2S去除率的影响,探讨提高化学滤料去除H2S效率的可行途径。同时,研究化学滤料对H2S的吸附容量,为化学滤料在实际工程应用提供设计和工艺控制必需的实验数据。
1 实验材料与方法
1.1 实验气源
用离心风机(风量300 m3/h,风压600 Pa)直接抽取某燃料沥青厂的常压塔顶外排的工业废气作为实验气源。实验气源中H2S的浓度约为300~350 mg/m3,气体的温度为30~35℃,压力为常压,相对湿度为80%~85%。
1.2 实验装置与滤料
实验用的化学滤料采用美国普拉飞公司生产的OCBU型化学滤料,滤料的颗粒直径约为2~6 mm,滤料的基材为活性氧化铝,化学介质为氧化镁和氢氧化钾,其中氧化镁含量约为12%,氢氧化钾含量约为4%,pH值9.5,滤料堆积密度为0.64 g/cm3。吸附装置采用浙江爱科乐环保有限公司生产的DS300型干式化学滤料吸附装置。装置采用塔形结构,材质为玻璃钢,塔的内径为500 mm,高度为1 200 mm,滤料的填充高度为60 cm。H2S检测仪采用深圳市安帕尔科技有限公司生产的型号为APEG-TH2S-B的检测仪,检测仪的测量范围为0~500 mg/m3,显示分辨率为0.1 mg/m3。温度和湿度检测仪采用深圳市华汉维科技有限公司TH40W型数字温度湿度计,温度范围为-20~80℃,湿度测量范围为0~100%,装置连接图如图1所示。
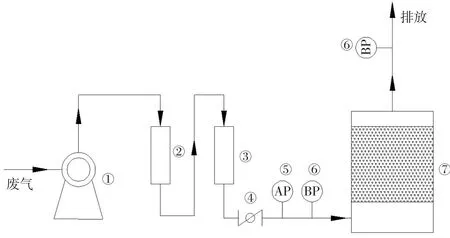
图1 实验装置示意图Fig.1 Schematic diagram of the test device
2 结果与讨论
2.1 滤料粒径对H2S去除率的影响
滤料颗粒粒径的大小会影响气固相的反应速率以及内扩散速率。本文实验时,将滤料分为粒径1~2 mm、3~4 mm、4~6 mm和2~6 mm四种规格。四种规格粒径的化学滤料对H2S去除率的影响如图2所示。
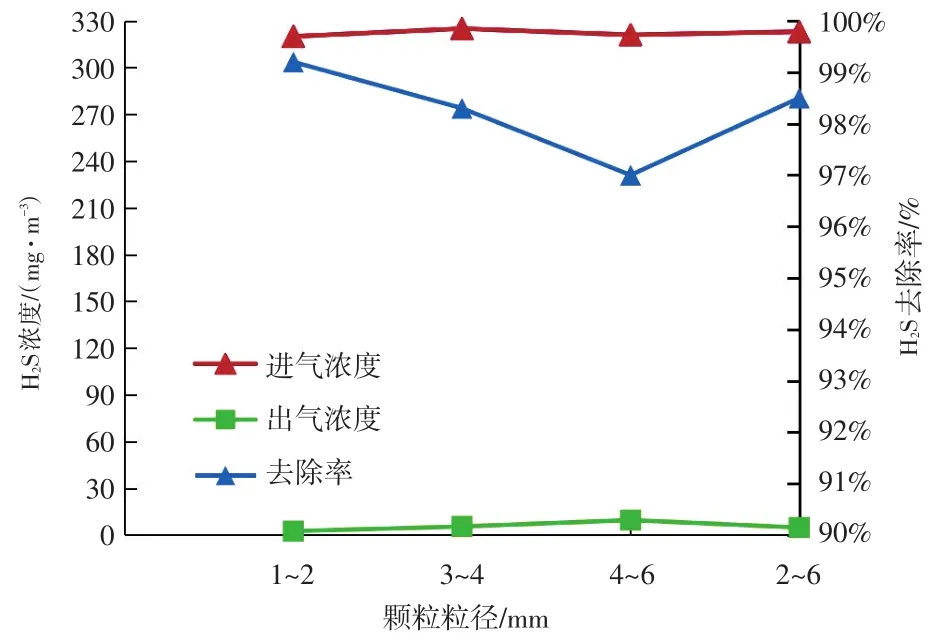
图2 粒径对H2S去除率的影响Fig.2 Effect of particle size on H2S removal rate
由图2可以看出,在四种颗粒粒径规格的滤料中,不同粒径滤料对H2S的去除效率由高到底排序为:1~2 mm>3~4 mm>2~6 mm>4~6 mm。这是因为颗粒粒径的减小,增加了颗粒的比表面积,增大了气固相的接触面积,提高了反应速率,同时也提高了气体的内扩散速率,从而使表观反应速率得以提高。在两方面同时作用下,去除率随着粒径的减小而增加。但是粒径越小,滤料间的空隙率也会越小,导致气体通过滤料层的阻力增加,在实际工程应用中会影响能耗。综合考虑了滤料的吸附性能和气体透过性能,本文后续实验最终选择颗粒粒径为2~6 mm化学滤料作为实验滤料。
2.2 湿度对H2S去除率的影响
Furimsky[2]研究认为采用NaOH改性的活性炭在有水的情况下吸附H2S的效果较好。其主要原因是含氧基团和O2对H2S的氧化导致OH-和O2-两种自由基的生成,这些自由基和H2S作用加快了氧化的反应速度,有利于H2S的去除。裴晶晶等[3]研究建议化学滤料在相对湿度为20%~80%的范围内工作,以便实现最佳性能。本次实验通过在实验装置前端安装干燥器对进气的相对湿度进行调节,在停留时间0.8 s的情况下,测试不同湿度下所得的H2S的去除率,结果如表1所示。

表1 湿度对H2S去除率的影响Table 1 Influence of humidity on H2S removal rate
由表1可知,随着气体相对湿度的提高,H2S的去除效率也随之提高,但气体相对湿度达到80%后,去除效率有所下降,气体相对湿度在20%以下时,去除效率明显低于相对湿度在20%以上,相对湿度在20%~95%,去除效率都维持在90%以上,且相对稳定。对活性炭的物理吸附,在较低湿度条件下,相对湿度对吸附量的影响不大;当相对湿度高于70%~80%时,水蒸气会与不溶于水的化合物产生竞争吸附,从而降低对该化合物的吸附量,而对有水参与反应的化学吸附过程,湿度越高,对吸附的促进效果越好[4]。由此可见,相对湿度小于20%或大于80%的情况下化学滤料对H2S的去除效率较低,主要原因是:“干燥”的气体导致滤料中的化学浸渍从溶液中流出,不利于化学反应;气体的相对湿度过高,导致化学滤料表面形成大量的水膜,而这些水膜隔断了滤料中化学成分与气体的接触,同时由于滤料湿度增加后易出现滤料的沉降,滤料间挤压得更紧,减少了滤料与气体接触的比表面积,这些都会影响到滤料对H2S的去除效率。
2.3 停留时间和温度对H2S去除率的影响
张文俊等[5]用含次氯酸钙的化学吸附剂吸附PH3,发现随着停留时间的增加,穿透时间和穿透吸附容量均增加,即吸附性能增加,但穿透吸附容量的增加趋势逐渐趋于平缓。陈凡植等[6]利用臭氧氧化处理H2S和硫醇废气,发现臭氧氧化法随着停留时间的延长,H2S和硫醇的去除率增高,当停留时间为1 s时已基本达到氧化反应的化学平衡状态。
本实验综合考虑温度和停留时间对H2S去除率的影响,保持化学滤料厚度不变,通过改变进气的气体流量来调整气体在滤料层的停留时间;通过进气端的加热器对气体进行加温,考虑到实验气源的正常工况温度为30~35℃,故采用加温的方式来改变温度,实施三种温度下去除率的测试,本次测试温度分别为30℃、50℃和70℃,通过在三种温度下进行测试,可以得出停留时间、温度与去除率的关系,见图3。
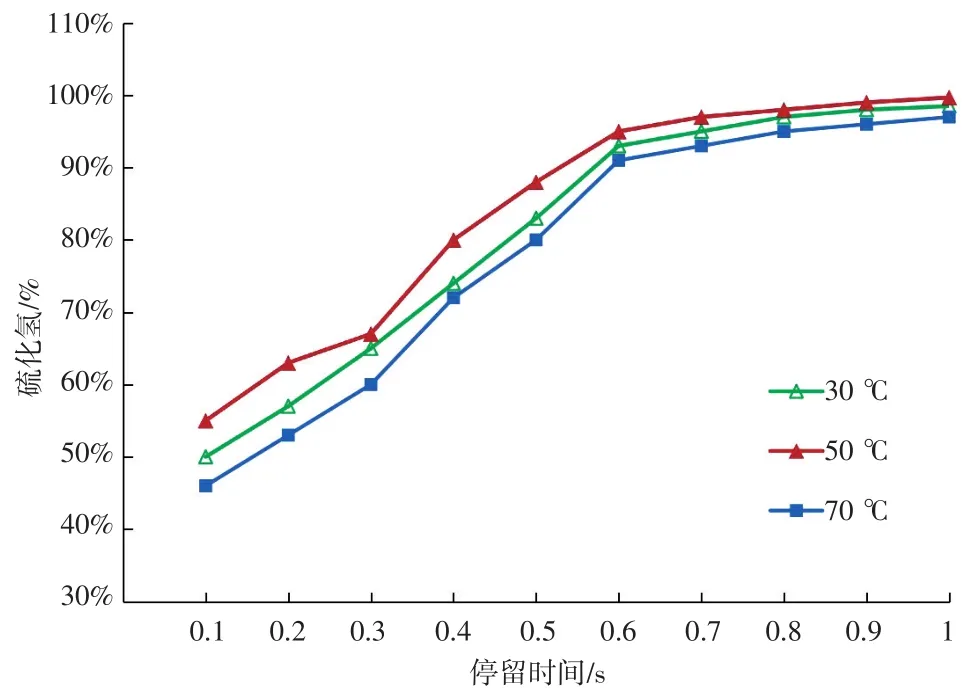
图3 停留时间对H2S去除率的影响Fig.3 Influence of residence time on H2S removal efficiency
由图3可知,随着气体在滤料层停留时间的增加,在三种不同的温度下,化学滤料对H2S的去除率都明显提高,三种温度下去除率的曲线走向基本保持一致,当停留时间达到0.8 s后,H2S的去除率基本稳定在同一水平上。主要原因是,当停留时间不足时,H2S气体与化学滤料的接触不充分,部分H2S气体还没有与化学成分反应就穿透过滤料层,导致去除率不高。随着停留时间的增加,H2S气体与化学滤料的接触越来越充分,H2S的去除率逐渐提高,但当达到足够的接触时间后,受化学滤料的吸附容量和化学吸附平衡状态等因素的影响,去除率提高并不明显。
三种不同温度的工况下,温度为50℃情况下去除率高于30℃和70℃时的去除率,而30℃情况下去除率又高于70℃时的去除率。主要是因为温度高分子运动更剧烈,分子的平均动能增大,分子间碰撞发生键合的概率增大,即在一定的时间内反应进行得更快,有利于提高化学吸附的反应速率。而70℃情况时,温度的升高导致气体相对湿度的降低,这与前文描述的湿度对去除率的影响中得出的“干燥”的气体导致滤料中的化学浸渍从溶液中流出,不利于化学反应,导致去除率降低的结论一致。
2.4 化学滤料吸附容量的评价
吸附容量是评价化学滤料性能的一个重要指标,本实验首先测定H2S穿透滤料时间(H2S的去除率小于50%时视为穿透),再根据该时间计算出滤料的穿透吸附容量,穿透吸附容量的计算公式为:

式中:XB为穿透吸附容量,mg/kg;Q为气体流量,L/min;ρ为进口气体质量浓度,mg/L;t为穿透时间,min;m为化学滤料用量,kg。由于穿透前出口气体的质量浓度极低,在计算时忽略不计。
本实验在常温常压下,气体的停留时间为0.6 s,相对湿度控制在85%左右,通过测试,滤料的穿透时间如图4所示。

图4 H2S穿透时间Fig.4 H2S penetration time
根据图4的数据可以看出,H2S的进气浓度基本维持在320~330 mg/m3,出口的浓度在测试的前23 d内,基本维持在20 mg/m3,去除率保持在90%以上,从第24 d开始,去除率下降明显,当穿透实验到第32 d时,H2S的去除率降50%以下,并趋于平稳。本次实验以第32 d作为穿透时间节点,计算化学滤料对H2S的吸附容量。根据公式(1)计算,得出该化学滤料对H2S的吸附容量为45.3%。该滤料具有较高的吸附容量,主要原因是滤料中有化学介质在吸附过程中并不完全直接参与反应,而是以催化剂的形式为化学反应提供催化条件。氧化镁吸附H2S的化学反应机理推测如下:
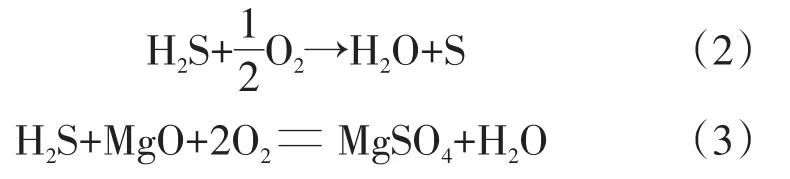
3 结语
(1)随着化学滤料颗粒粒径的减小,化学滤料的吸附性能增强。
(2)随着湿度的提升,H2S的去除效率也相应提高,相对湿度为20%~95%时,去除效率都能维持在90%以上,且相对稳定,相对湿度小于20%或大于80%的情况下化学滤料对H2S的去除效率有所下降。
(3)随着停留时间的增加,H2S的去除效率明显提高,当停留时间达到0.8 s后,去除效率基本达到90%以上,效果较为稳定;同时低温和高温都会降低化学滤料的吸附性能。
(4)含氧化镁的化学滤料有高达45%以上的吸附容量,吸附剂吸附H2S后,生成单质S、MgSO4和水。

