耳蜗毛细胞死亡引发耳蜗内延迟性继发病变的研究
丁大连,李鹏,亓卫东,张建辉,于进涛,吴学文,蒋海燕,孙虹
(1.纽约州立大学布法罗大学,纽约 布法罗 14214;2.中山大学附属第三医院 耳鼻咽喉头颈外科,广东 广州 510230;3.成都市第三人民医院 耳鼻咽喉头颈外科,四川 成都 610014;4.复旦大学附属华山医院 耳鼻咽喉头颈外科,上海 200040;5.华中科技大学同济医学院附属协和医院 耳鼻咽喉头颈外科,湖北 武汉 430022;6.中南大学湘雅医院 耳鼻咽喉头颈外科,湖南 长沙 410008)
1 耳蜗毛细胞和听觉通路简介
耳蜗毛细胞是位于所有脊椎动物耳蜗螺旋器上的听觉感受器。螺旋器是由毛细胞和支持细胞共同组成。坐落在耳蜗基底膜上的螺旋器从内侧向外侧排列的支持细胞依次是内指细胞、内柱细胞、外柱细胞、外指细胞,Hensen’s细胞。螺旋器上一排耳蜗内毛细胞和三排外毛细胞则分别坐落在内指细胞和外指细胞的上方并各自斜靠在内柱细胞的内侧和外柱细胞的外侧。在耳蜗螺旋器网状膜的表面,耳蜗毛细胞的静纤毛插入到覆盖在其上方的盖膜中,听神经末梢则在毛细胞的底部与毛细胞建立起突触联系[1-3]。当声波振动引起鼓阶内的外淋巴液往复流动而导致基底膜发生振动时,盖膜和螺旋器之间的剪切式往复位移使插入到盖膜内的静纤毛发生了弯曲或偏转。毛细胞静纤毛上的机械运动敏感通道也随之发生快速开启或关闭,从而使毛细胞产生去极化并释放出兴奋性神经递质。释放到毛细胞底部突触间隙内的神经递质通过刺激突触后膜产生的兴奋性突触后电位激发出听神经纤维的神经动作电位被传送到螺旋神经节的细胞体,再经螺旋神经节的中枢端轴突神经纤维传送到脑干听觉中枢的耳蜗核,然后依次传送到上橄榄核、外侧丘系核、下丘核、丘脑的内侧膝状体、大脑皮层颞叶的听觉皮层等[1-3]。由此可见,耳蜗毛细胞是产生听觉电信号的唯一来源。一旦耳蜗毛细胞遭到破坏,即使听觉外周通路的其他部分和听觉中枢通路保持正常,永久性听觉丧失还是不可避免。
2 听觉周边神经元与人工电子耳蜗的关系
听觉传导通路上的第一级神经元是位于蜗轴螺旋管内的螺旋神经节。作为一种双极神经元,螺旋神经节的周边端神经纤维通过蜗轴骨性螺旋板上的疆孔进入耳蜗基底膜并与毛细胞建立突触联系,螺旋神经节的中枢端神经纤维穿越蜗轴螺旋管内侧骨壁上的小孔进入蜗轴中心的听神经管并汇集成束把从耳蜗接收到的声刺激信号传递到脑干的耳蜗核[1-3]。耳蜗毛细胞的丧失虽然足以造成永久性耳聋,但是如果丧失毛细胞的蜗轴螺旋管内尚有部分存活的螺旋神经节,人工电子耳蜗植入可将体外言语处理器转换的声音编码电信号传送到螺旋神经节,再由存活螺旋神经节的中枢端神经纤维将声音编码信号传送到听觉中枢,使耳聋患者回归有声世界。然而如果丧失耳蜗毛细胞的蜗轴内不再有存活的螺旋神经节,人工电子耳蜗转换的声音编码电信号将无法传送到听觉中枢。说明人工电子耳蜗只能代替失去的耳蜗毛细胞却无法代替丧失的螺旋神经节。听觉脑干植入与人工耳蜗植入有些相似,但两者之间的不同点在于听觉脑干植入是将体外言语处理器转换的声音编码信号直接传送到脑干的听觉感受区,而人工耳蜗植入是将言语处理器转换的声音编码信号发送给螺旋神经节,再由螺旋神经节把声音转换信号传送到听觉中枢。由此可见,人工电子耳蜗仅适用于单纯丧失耳蜗毛细胞的患者,而听觉脑干植入却适用于同时丧失耳蜗毛细胞和螺旋神经节的患者。如果对准备安装人工听觉植入的耳聋患者在术前常规测试电刺激诱发的听性脑干反应,将有助于在术前预先评估患者是适合人工电子耳蜗植入还是适合听觉脑干植入。
3 耳蜗毛细胞的死亡
造成耳蜗毛细胞死亡的原因和机制牵涉到很多方面,例如内耳微循环障碍引起的耳蜗缺血缺氧性损害[4-7]、衰老引起的内耳氧化/抗氧化失衡和代谢失衡[8-10]、爆震或强噪声引起的耳蜗毛细胞机械性损害和代谢性损伤[11-12]、氨基糖苷类抗生素在耳蜗毛细胞线粒体和溶酶体内的高浓度积聚[13-19]、抗肿瘤铂制剂对细胞膜上死亡因子受体和P53凋亡基因的启动[20-23]、重金属在听觉神经系统的过量积累[24],耳聋相关基因缺陷[25-27],以及支持细胞间外基质破坏引起的锚定依赖丧失所造成的耳蜗毛细胞失巢凋亡[28-30]。人们对各种原因引起的耳蜗毛细胞破坏过程和损害机制及防护措施都有一定的认识,但是对耳蜗毛细胞死亡后引起的继发性内耳破坏却缺少关注。以下将讨论毛细胞死亡之后发生在耳蜗内的一系列延迟性继发病变。见图1~8。
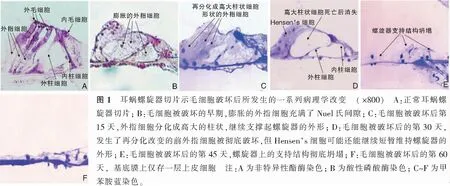
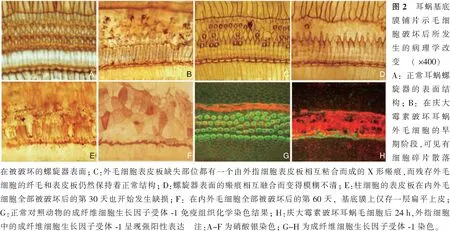

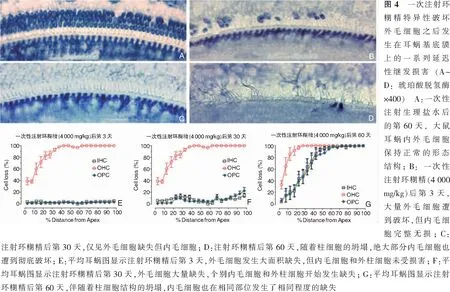
图5 大鼠疆孔内听神经纤维和蜗轴螺旋管内螺旋神经节的切片结果 (甲苯胺蓝 ×400) A:在注射环糊精后第30天,大鼠穿越疆孔的听神经纤维仍然密集成束; B:在注射环糊精后第45天,大鼠疆孔内的听神经纤维数量显著减少; C:在注射环糊精后第30天,大鼠蜗轴螺旋管内的螺旋神经节保持着正常密度; D:在注射环糊精后第45天,大鼠蜗轴螺旋管内的螺旋神经节基本上所剩无几
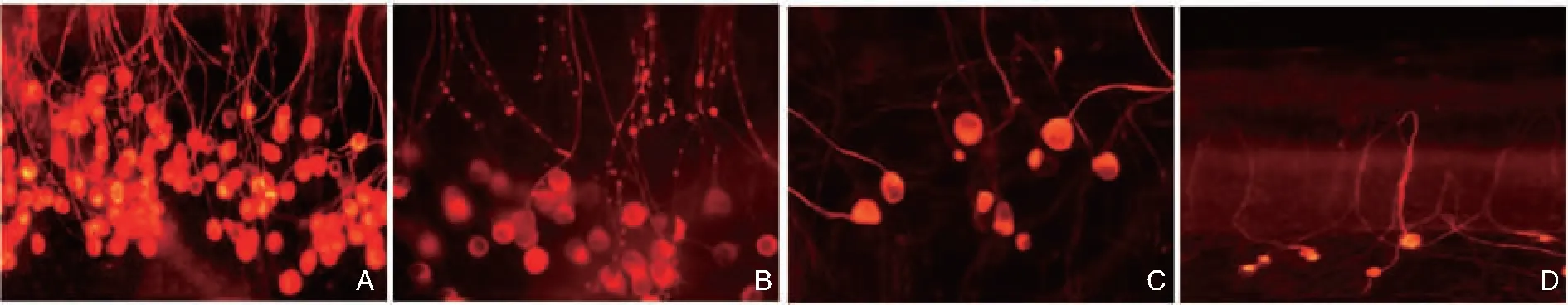
图6 发生在耳蜗器官培养系统内的延迟性螺旋神经节死亡 (神经丝免疫组化 ×630) A:在庆大霉素选择性破坏全耳蜗内外毛细胞后的第1天,螺旋神经节完整无损; B:在全耳蜗内外毛细胞死亡后的第3天,存活螺旋神经节的数量减少约50%; C:在全耳蜗内外毛细胞死亡后的第7天,超过90%的螺旋神经节因延迟性死亡而缺失; D:在全耳蜗内外毛细胞死亡后的第14天,所有的螺旋神经节死亡殆尽
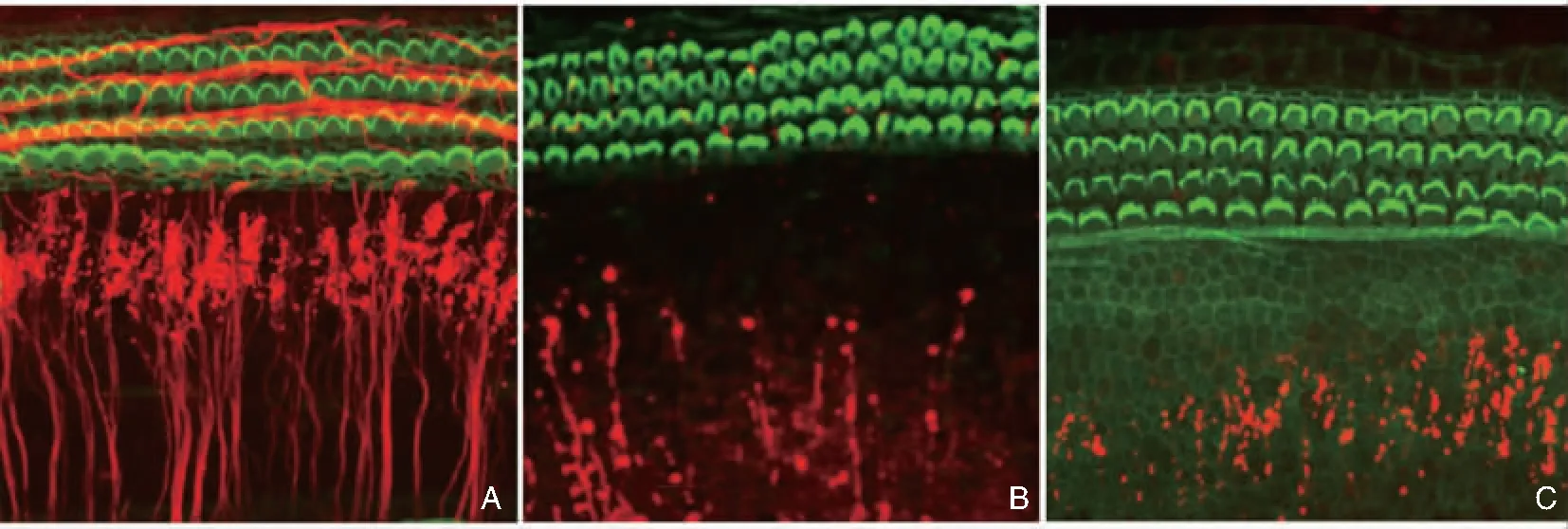
图7 大鼠耳蜗外植体的毛细胞静纤毛和传入神经纤维的双重染色结果 (鬼笔环肽和神经丝 ×630) A:培养72 h的正常大鼠耳蜗外植体显示毛细胞和传入神经纤维及其末梢完整无损; B:耳蜗外植体经50 μM三甲基锡培养24 h,听神经纤维及其末梢发生了严重的破坏,但耳蜗毛细胞未发生缺失; C:耳蜗外植体经 4 mM醋酸铅培养72 h,听神经纤维及其末梢遭到严重破坏,但耳蜗毛细胞保持着正常形态
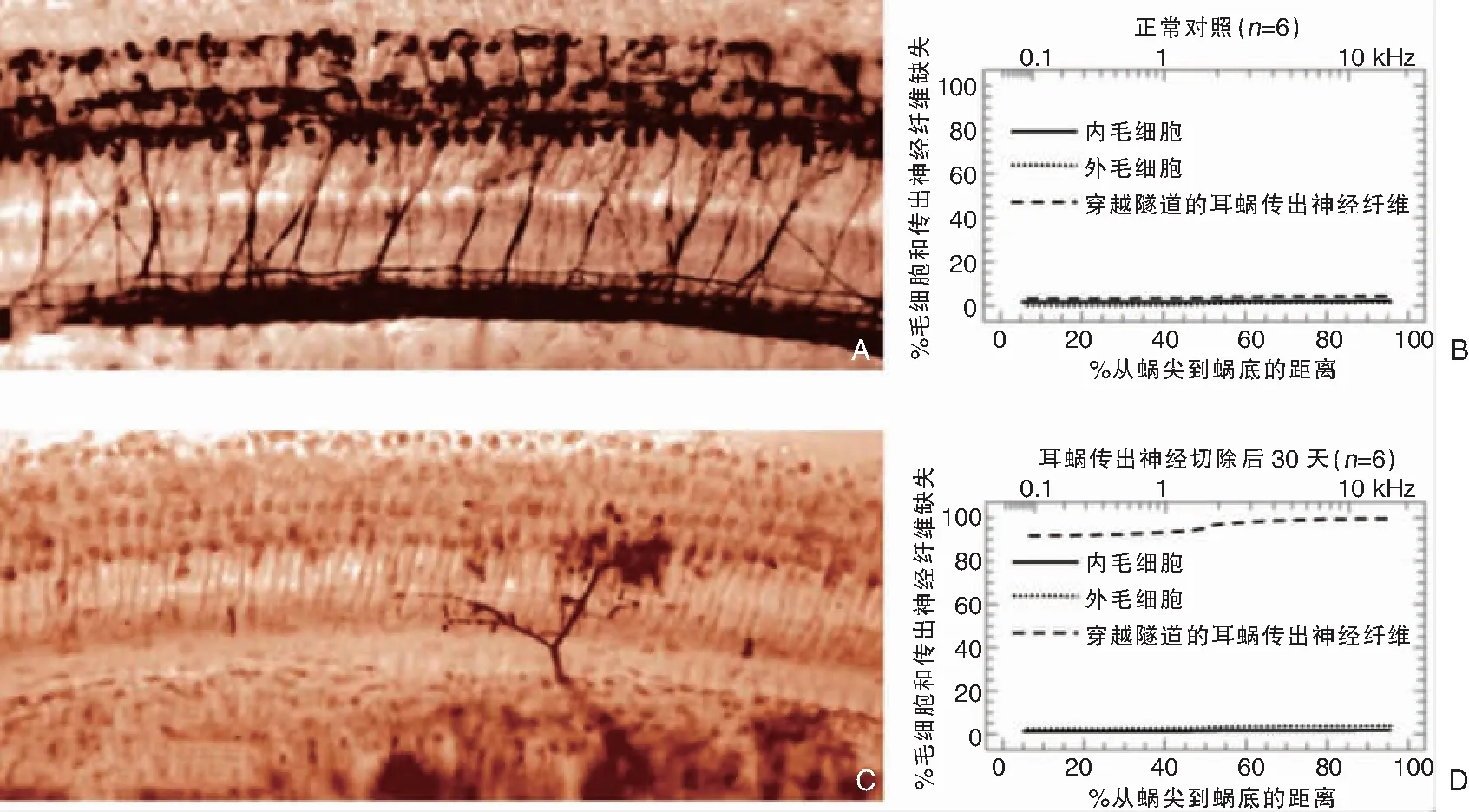
图8 耳蜗传出神经纤维及其末梢以及平均耳蜗图 A:耳蜗传出神经纤维及其末梢在正常南美栗鼠螺旋器的分布 (乙酰胆碱酯酶 ×400); B:来自6只正常对照南美栗鼠耳蜗铺片的平均耳蜗图; C:手术切除耳蜗传出神经后第30天,螺旋器中的耳蜗传出神经基本被切除干净,但耳蜗毛细胞完整无损 (乙酰胆碱酯酶 ×400); D:6只耳蜗传出神经被切除的平均耳蜗图显示,超过90%的穿越螺旋隧道的耳蜗传出神经纤维消失,但是耳蜗内外毛细胞未发生缺损
4 外指细胞在耳蜗外毛细胞破坏过程中的变化
在耳蜗外毛细胞发生病变造成细胞体破裂的早期阶段,遭到破坏的外毛细胞表皮板往往会在毛细胞破裂之后被排挤到耳蜗螺旋器的表面,实验证实当外毛细胞开始发生病变时,位于其底部的外指细胞会像汽车上的安全气囊那样迅速膨胀开来。膨胀的外指细胞的细胞体瞬间充满螺旋器内部的Nuel氏间隙甚至充满整个螺旋隧道(图1B)。外指细胞的类似于安全气囊的即刻膨胀效应,不仅使外毛细胞被破坏后遗留在螺旋器表面的穿孔被及时堵塞而有效阻止了含有高钾浓度的内淋巴液进入到耳蜗螺旋器的内部,而且死亡外毛细胞的表皮板和细胞碎片也被排出到螺旋器的表面(图2B)。如果没有外指细胞的及时膨胀并堵塞螺旋器表面的穿孔,蜗管内的内淋巴液将不可避免地通过螺旋器表面穿孔进入到Nuel氏间隙与Corti淋巴混合,那样势必造成更多相邻毛细胞和支持细胞因钾中毒而死亡。成纤维细胞生长因子受体-1是一类具有促进细胞分裂或促进再分化并反映细胞间相互接触的具有广泛生理功能的多肽类物质,通常在外指细胞呈现低水平表达(图2C),可是在毛细胞被破坏的早期阶段,成纤维细胞生长因子受体-1在外指细胞内立刻呈现高强度表达,说明外指细胞确实在耳蜗毛细胞受损的早期即刻进入到一个剧烈活动的状态(图2H),这一活动很可能与外指细胞的胞体膨胀和随后发生的再分化有着密切的关系[14]。发生在卡那霉素慢性耳中毒过程中的散在性外毛细胞缺失现象足以说明内淋巴液并没有进入到充满Corti淋巴的Nuel氏间隙。因为内淋巴液一旦进入Nuel氏间隙,相邻的毛细胞和支持细胞都必将遭到彻底破坏[16]。在外指细胞充填Nuel氏间隙道之后,耳蜗螺旋器表面外毛细胞缺失处被相邻外指细胞的表皮板相互连接形成X形状的瘢痕(图2C、D)。外毛细胞缺损处的外指细胞随后分化成高大的柱状细胞,其底部坐落在基底膜上,其顶部支撑起耳蜗螺旋器的表面轮廓[14,16,31](图1C)。在卡那霉素造成的耳蜗外毛细胞散在性缺失的实例中,转变成高大柱形细胞的前外指细胞在存活外毛细胞的间隙中永久支撑起外毛细胞缺失的位置,从而确保其周围残存外毛细胞可以继续对声波振动信号进行放大和转换,使受试动物长时期保留残余听力(图2C)[32]。
5 耳蜗内外毛细胞全部死亡引起的延迟性继发病变
在一次性同时注射庆大霉素(125 mg/kg) 和利尿酸钠 (40 mg/kg)的南美栗鼠实验模型中,利尿酸钠暂时阻断了通向蜗管外侧壁的血流,使血管纹上皮细胞因缺血缺氧发生变性而改变血管纹上皮细胞的通透性,从而造成血-迷路屏障的暂时性开放[6];血液中高浓度的庆大霉素则可以在血管纹发生缺氧性病变的时刻穿越血-迷路屏障进入到耳蜗内的液体环境,从而实现对毛细胞的一次性致命攻击[4,6,14,16,19,33]。在造成所有内外毛细胞大面积死亡的实验模型,转变成高大柱状细胞形状的外指细胞在失去周围原始外指细胞和外毛细胞的环境中大约只能存活30 d左右,随后将会发生整个螺旋器结构的崩塌和上皮细胞的死亡(图1D~F)。此现象说明发生了再分化改变的高大柱形细胞只能存活在周围存在原始外指细胞和外毛细胞的环境,却不能在失去所有原始外指细胞和外毛细胞的环境中长期生存(图1D、F,2F)[14,16,31]。支持细胞的继发性死亡造成的耳蜗螺旋器支持结构坍塌使基底膜上最终仅存一层扁平上皮(图1F,2F)。
应用耳蜗毛细胞和螺旋神经节及其神经纤维的联合定量观察技术[34-36],我们发现同时注射庆大霉素和利尿酸钠使南美栗鼠耳蜗内所有的内外毛细胞在24 h之内全部破坏[19],耳蜗内外毛细胞的死亡使耳蜗传出神经和传入神经失去与之相联系的靶细胞,耳蜗传出和传入神经也随之开始启动了延迟性神经破坏的进程。应用乙酰胆碱酯酶组织化学染色技术和耳蜗基底膜铺片技术[37],我们发现耳蜗基底膜上的传出神经纤维在丧失内外毛细胞之后的第3天减少约30%,在丧失内外毛细胞之后的第1周减少约50%,在丧失内外毛细胞之后的第2周减少约80%,在丧失内外毛细胞之后的第3周基本上全部从基底膜上撤离(图3A~D)[14,16,31]。在全耳蜗内外毛细胞被彻底破坏之后的第2周,疆孔内传入神经纤维和传出神经纤维都遭到彻底破坏(图3F)。位于蜗轴螺旋管内的螺旋神经节细胞发生延迟性死亡的时间略迟后于疆孔内听神经纤维的破坏,或许意味着延迟性螺旋神经节的破坏是从神经纤维末梢开始发生并逐渐扩展到神经元的细胞体。颞骨连续切片证实,在全耳蜗内外毛细胞被破坏后的第2周,螺旋神经节发生了明显的病变(图3H),在全耳蜗毛细胞被破坏后的第4周,螺旋神经节的密度减少超过50%(图3I),在全耳蜗毛细胞被破坏后的第8周,绝大部分螺旋神经节都已经消失(图3J)[14,16,31]。鉴于庆大霉素只是破坏内耳的毛细胞却并不直接破坏内耳的外周神经元及其神经纤维,实验结果说明耳蜗传入神经和传出神经的破坏都只是丧失毛细胞后的延迟性继发病变。耳蜗传出神经的撤离应该归因于丧失靶细胞所造成的废用性神经退化,耳蜗螺旋神经节的死亡则应该归因于大量毛细胞缺失造成的神经刺激信号丧失和神经营养因子缺乏所引起的延迟性传入螺旋神经节死亡。
6 单纯外毛细胞死亡引起一系列延迟性继发病变
一次性皮下注射环糊精(4 000 mg/kg)可以在48 h内摧毁大鼠耳蜗底回所有的外毛细胞,但是既不损害内毛细胞也不损害支持细胞(图4B、E)[38]。单纯外毛细胞的大面积死亡同样造成其下方外指细胞从膨胀到再分化成高大柱状细胞并最终在30 d后死亡。构成螺旋隧道的外柱细胞和内柱细胞在其外侧高大柱形细胞死亡后也随即坍塌,使原本依靠在内柱细胞内侧的内毛细胞倒伏死亡(图4F)。在环糊精破坏外毛细胞后的第6周,耳蜗内毛细胞的继发性死亡全部完成,说明继发性内毛细胞死亡的发生阶段是在外毛细胞被彻底破坏后的第30~45天。在注射环糊精后第8周,内毛细胞死亡的位置和程度与内外柱细胞缺失和螺旋隧道坍塌的部位完全一致,说明因单纯丧失外毛细胞所引起的延迟性内毛细胞死亡确实是由螺旋器支持结构的坍塌所引起(图4D、F、G)[39]。在环糊精破坏了大面积外毛细胞四周之后但内毛细胞尚未发生破坏之前,疆孔内的听神经纤维密度保持正常(图5A),但在大面积外毛细胞破坏后第6周,也就是内毛细胞开始发生延迟性死亡2周之后,疆孔内的听神经纤维损失殆尽(图7B)[39-40]。同样,在环糊精破坏大面积外毛细胞4周之后但内毛细胞尚未缺失之前,蜗轴螺旋管内的螺旋神经节密度未见减少(图7C),但在外毛细胞被环糊精大面积破坏6周之后也就是内毛细胞发生延迟性死亡2周之后,蜗轴螺旋管内的螺旋神经节消失殆尽(图7D)[39-40]。从上述事件的发生顺序可以看出,延迟性听神经损害和螺旋神经节死亡都是继发于内毛细胞的死亡,内毛细胞的死亡是继发于螺旋器支持结构的坍塌,而支持结构的坍塌是由于那些再分化成高大柱形细胞的死亡。由螺旋神经节发出的通向脑干耳蜗核的中枢端传入神经纤维在延迟性螺旋神经节死亡的同时也发生崩解,这意味着一旦发生了大面积的外毛细胞死亡,从耳蜗周边到听觉中枢的听神经联系最终将彻底中断[39-40]。
7 延迟性螺旋神经节死亡与丧失神经营养因子之间的关系
耳蜗毛细胞是耳蜗内神经营养因子的主要来源之一。动物实验证实,对彻底清除耳蜗内外毛细胞的豚鼠,无论是补充神经营养因子还是在补充神经营养因子的同时给予电刺激,都可以长时期维持螺旋神经节的生命。但是如果既不对螺旋神经节施行电刺激也不补充神经营养因子,所有的螺旋神经节在数月内必将发生延迟性神经元死亡[41-42]。在彻底摧毁南美栗鼠全耳蜗内外毛细胞之后,我们发现延迟性螺旋神经节死亡的整个进程仅需2~4个月[14,16,31]。临床上人工电子耳蜗的安装大多是在发生永久性耳聋多年之后,提示人类延迟性螺旋神经节死亡的发生似乎需要更长的时间。但也可能是因为有相当一部分患者的耳蜗内尚有部分存活的内毛细胞,从这些散在的存活内毛细胞分泌的神经营养因子经疆孔进入到蜗轴螺旋管将可以继续维持一部分螺旋神经节的生命。这一点或许可以从某些需要安装电子耳蜗的耳聋患者仍然保持一部分低频残余听力的现象中略见一斑。联合应用庆大霉素和利尿酸钠摧毁所有的耳蜗内外毛细胞,但是并不破坏前庭毛细胞[33,43]。那么,从球囊斑毛细胞分泌出来的神经营养因子是否可以通过连和管逆向输入到耳蜗鼓阶再经疆孔抵达蜗轴螺旋管内的螺旋神经节。如果球囊斑的毛细胞可以向耳蜗底回输送神经营养因子,在彻底清除耳蜗内外毛细胞之后,耳蜗底回蜗轴螺旋管内理应出现残存的螺旋神经节。然而,在耳蜗内外毛细胞被彻底清除2个月之后,原先充满螺旋神经节的蜗轴螺旋管变成一条废弃的空管道(图3J),说明球囊斑毛细胞向耳蜗输送神经营养因子的可能性微乎其微[14,16,31]。
8 延迟性螺旋神经节死亡的快捷实验模型
全耳蜗毛细胞死亡引发活体动物延迟性螺旋神经节死亡至少需时2个月。然而,在耳蜗器官培养系统,只要在毛细胞被全部破坏后更换不含神经营养因子的培养液,耳蜗外植体内的螺旋神经节就会因为缺乏神经营养因子很快发生延迟性神经元死亡。我们在实验中发现,在丧失内外毛细胞后第7天,延迟性螺旋神经节的死亡率达到90%(图6)。在耳蜗器官培养系统通过控制培养条件加速延迟性螺旋神经节死亡的进程,为我们提供了一个可供参考的快捷实验模型[14,44]。
9 选择性破坏耳蜗传入神经或传出神经并不影响耳蜗毛细胞的存活
单纯散在性外毛细胞缺失既不影响耳蜗内毛细胞和支持细胞的寿命也不影响耳蜗周边传入神经元及其神经纤维。但是,外毛细胞的大面积死亡将会造成耳蜗螺旋器的延迟性坍塌和内毛细胞死亡,最终导致螺旋神经节及其神经纤维的一系列继发性破坏。那么,单纯破坏听觉周边神经是否会逆向损害耳蜗毛细胞呢?我们在重金属三甲基锡的耳蜗器官培养实验中发现三甲基锡只是选择性破坏螺旋神经节,却并不破坏耳蜗毛细胞(图7B)[45]。在三甲基锡的活体动物实验模型,中等剂量的三甲基锡仍然只是破坏螺旋神经节但很少损害耳蜗毛细胞[46]。我们在醋酸铅损害耳蜗器官外植体的实验中发现,即使大剂量含铅培养液造成了极其严重的螺旋神经节破坏,但耳蜗毛细胞却安然无恙(图7C)[47]。在切断听神经纤维的南美栗鼠实验模型,除了在切断听神经束时因不慎切断迷路动脉而导致个别南美栗鼠因耳蜗供血障碍造成大量上皮细胞死亡之外,保持耳蜗正常供血的受试南美栗鼠的耳蜗内外毛细胞均无缺失,而受到破坏的只是螺旋神经节及其听神经纤维。需要说明的是,这些听神经束被切断的南美栗鼠虽然丧失了耳蜗听神经动作电位和听觉中枢核团的听觉诱发电位,但是却始终保持着正常的耳声发射畸变产物和耳蜗微音器电位[48]。在切断耳蜗传出神经束的实验模型,在所有经病理检查证实耳蜗传出神经被切除的南美栗鼠,耳蜗内外毛细胞的密度与正常对照动物相比均无显著差异(图8),而且这些耳蜗传出神经束被切断的南美栗鼠不仅保持着正常的耳声发射畸变产物和耳蜗微音器电位,而且还保持着正常的听觉中枢诱发电位[49-50]。Sun等[51]应用大剂量海仁酸永久破坏了鸡的螺旋神经节2个月之后,发现鸡的毛细胞始终保持着健康的形态和良好的功能,不仅证明了螺旋神经节的死亡不会影响鸟类毛细胞的存活,而且证明鸟类的螺旋神经节细胞并不具备细胞再生的能力。

