铁酸锌碳热还原动力学及反应机理
李 洋,张建良,袁 骧,刘征建✉,李 飞,郑安阳,李占国
1) 北京科技大学冶金与生态工程学院,北京 100083 2) 北京首钢股份有限公司炼铁作业部,唐山 064404 3) 湖南华菱湘潭钢铁有限公司炼铁厂,湘潭 411101 4) 山西建龙钢铁有限公司,运城 043800
随着我国废钢积蓄量的增加、电力供应的改善以及国家“双碳”政策的提出,我国电炉炼钢的发展将迎来机遇期[1-2].随着电炉炼钢工艺中镀锌废钢使用比例逐渐增大,这将造成含锌电炉粉尘量的增大[3-4].已有研究表明,我国目前含锌电炉粉尘年产量高达百万吨,其中锌元素的质量分数达到10%左右,国外某些钢厂电炉粉尘锌元素质量分数甚至达到40%之多,其被视为一种潜在的二级资源[1,5-7].若不对这些二级资源中锌元素加以回收利用,不仅会造成金属资源的浪费而且会对环境造成污染[8].
电炉粉尘中的锌主要以铁酸锌(ZnFe2O4)的形式存在,铁酸锌属于尖晶石类物质,其氧离子呈紧密堆积状态,晶格具有较大的稳定性,这一特性增大了含锌电炉粉尘中锌、铁等有价元素的回收利用难度[9-12].国内外学者对铁酸锌还原行为进行了深入的研究,诸多学者主要对气相(H2、CO 等气体)还原铁酸锌的热力学及反应机理进行了热力学模拟、实验验证及动力学计算的分析,铁酸锌的气相还原反应遵循逐级还原规律,并且所需还原气体分压较低[11,13-18].也有部分学者对于等温和微波条件下固体碳质还原铁酸锌进行了研究,研究通过热力学计算以及还原实验的方法,详细讨论了配碳量、温度、微波功率和焙烧时间等参数对还原效果的影响规律[8,19-20].
本文作者在之前发表的论文中在对电炉粉尘基础物性充分分析的基础上,研究了温度和还原剂种类对铁酸锌碳热还原的影响,结果表明铁酸锌的碳热还原主要可分为铁酸锌分解段、氧化锌还原段和铁氧化物还原段等三个阶段[21].相较于铁酸锌的气相还原反应而言,其碳热还原反应过程更加复杂,同时包含固-固、气-固以及碳质的气化等多个物理化学反应.为进一步了解铁酸锌碳热还原过程,本文首先对不同温度碳热还原后物相进行了解析,而后通过等转化率法和主曲线拟合法对铁酸锌碳热还原动力学进行了明晰,以期为含锌电炉粉尘中锌元素的高效利用提供理论依据.
1 研究方法
纯ZnFe2O4的制备参考本文作者之前发表论文中的方法[21].为研究不同温度ZnFe2O4碳热还原后的物相,本文选用石墨(分析纯)为碳质来源,按照C/O 摩尔比为1∶1 的比例,将样品压制成团块(高20 mm、直径20 mm、重12 g).实验时将团块放入管式炉中,在850~1250 ℃温度区间内每间隔100 ℃进行15 min 的还原焙烧实验,实验全程通入N2保护.结束后将样品粒度破碎至小于0.074 mm,采用M21X 超大功率X 射线衍射仪进行物相检测,该设备高频发生器的最大功率21 kW,测试角度范围为10~100°,仪器采用铜靶.
在本文作者先前的研究结果中可以看出,由于石墨活性较低,影响ZnFe2O4在反应初期的还原,为减少还原剂活性对ZnFe2O4碳热还原的干扰,因此选用无烟煤为还原剂,采集其在不同升温速率条件下(5、10、15 和20 ℃·min-1)下的还原反应数据[21].将选用的无烟煤在N2气氛下加热1 h,加热温度为900 ℃,去除煤粉中的挥发分,N2气氛下冷却至室温并破碎至0.074 mm 备用,经过处理后,无烟煤固定碳质量分数为88.01%,灰分质量分数为11.99%.将处理后的无烟煤粉与ZnFe2O4样品以C/O 摩尔比为1∶1 混合,压制成高0.5 mm、直径1 mm 的柱状小团块,混合小团块放入WCT-2 型微机差热天平中,同时通入N2保护,以不同升温速率(5、10、15 和20 ℃·min-1)加热至1300 ℃,N2气氛冷却至室温,计算机自动记录实验过程中小团块质量以及体系温度等数据.团块转化率计算如式(1)所示,式中α表示某时刻团块的转化率,%;m0表示团块的初始质量,g;mt表示团块某时刻的质量,g;m∞表示实验结束时团块的质量,g.

2 结果与讨论
2.1 铁酸锌碳热还原XRD 分析
图1 为不同温度下ZnFe2O4碳热还原XRD 结果,从图中可以看到,当温度为850 ℃时,出现ZnO的峰,但峰强较弱,说明此时ZnFe2O4开始分解少量分解.当温度为950 ℃时,ZnO 峰强有所增强,ZnFe2O4峰强显著降低,说明ZnFe2O4已经大量分解,同时出现FeO0.85.xZnO 无定型物质,三价铁氧化物被还原成二价铁氧化物.当温度为1050 ℃时,团块内已经没有锌元素及铁氧化物相的存在,说明在950~1050 ℃温度范围内,ZnFe2O4已经被完全还原.单质锌的沸点为907 ℃,当温度大于此温度时,还原生成锌单质形成气相,从团块内部逸出,当接触炉外空气时,又被迅速冷却成ZnO,因此在实验过程发现炉口产生大量白烟.由不同温度还原焙烧后的XRD 分析结果可以初步判断铁酸锌碳热还原反应物相转变顺序为:
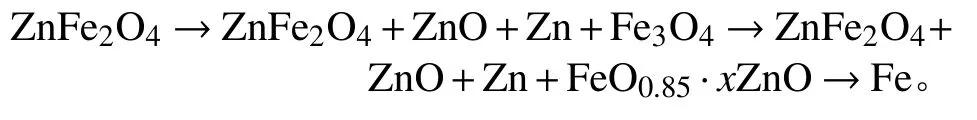

图1 不同温度条件下铁酸锌碳热还原后的XRD 结果Fig.1 XRD analysis result of the products of zinc ferrite carbothermal reduction at different temperatures
2.2 还原转化率与转化速率的关系
为进一步研究铁酸锌碳热还原行为,本文通过热重实验进行了不同升温速率条件下的铁酸锌非等温碳热还原过程的研究.图2 为采用无烟煤为还原剂时ZnFe2O4在不同升温速率条件下还原的转化率变化曲线.从图中可以看到,随着升温速率的逐渐提高,相同温度时ZnFe2O4还原的转化率逐渐降低.为进一步研究其反应历程,本文对还原转化率与转化速率之间的关系进行了研究.

图2 无烟煤还原ZnFe2O4 时转化率变化曲线Fig.2 Conversion ratio curve of ZnFe2O4 reduced by anthracite
图3 为使用无烟煤作为还原剂时,铁酸锌碳热还原转化率与转化速率之间的关系.从图中可以看出随着升温速率的提高,铁酸锌还原的最大转化速率增加,最大转化速率时的转化率α为0.42~0.43 之间.随着还原转化率α的提高,还原转化速率表现出先迅速升高后缓慢升高,再迅速升高后迅速下降,然后迅速上升后迅速下降的过程,整个还原过程形成三个峰,表明铁酸锌的碳热还原过程由不同的反应阶段组成,这与上述XRD 分析结果基本一致.
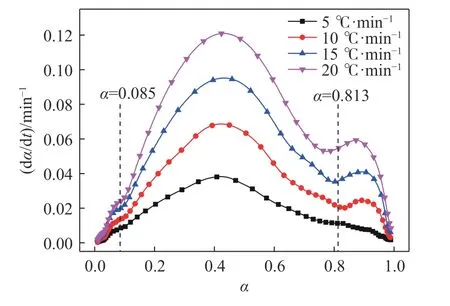
图3 不同升温速率下铁酸锌还原转化率与DTG(Derivative thermogravimetry)的关系Fig.3 Relationship between conversion rate of the zinc ferrite and DTG at different heating rates
图3 中的曲线对时间t求导,可得如图4 所示的不同升温速率条件下铁酸锌还原转化率与DDTG(Derivative derivative thermogravimetry)之间的关系曲线.对比两图中的曲线值,同时结合图2 温度与转化率之间的关系曲线,可以将无烟煤还原铁酸锌的过程分成三个阶段,各阶段划分界点如表1及图3 和图4 中虚线位置所示(图中界点位置为各升温速率下阶段界点转化率的平均值).从表1 中可以看到,随着升温速率提高,各阶段转化率略有降低,同时每个阶段向高温区移动.表中平均指四个升温速率下各阶段分界点转化率和温度的平均值.为后续动力学计算,不同升温速率下的曲线按照各自阶段划分进行研究.
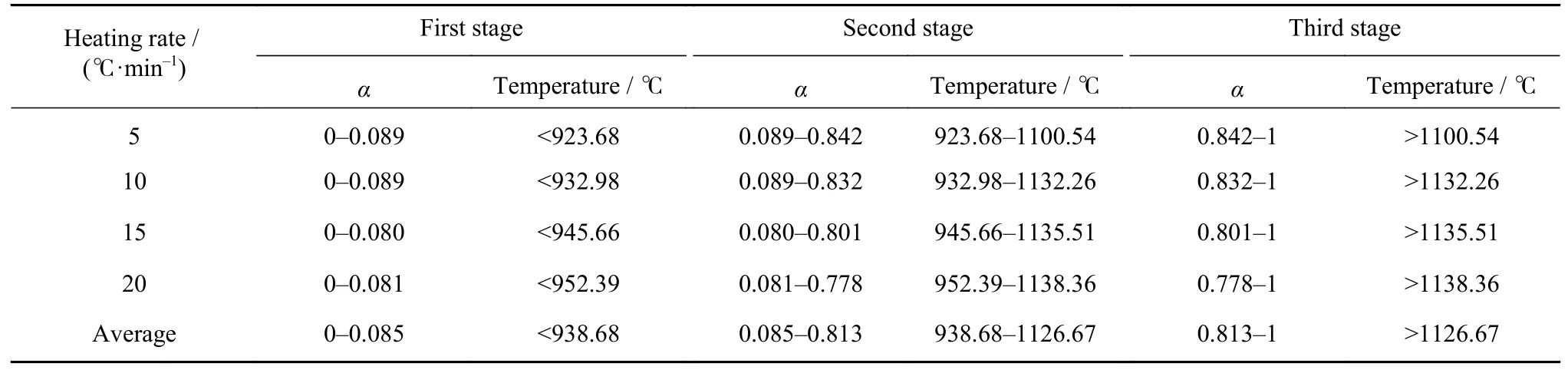
表1 无烟煤还原铁酸锌反应阶段划分Table 1 Reaction stages of zinc ferrite reduced by anthracite

图4 不同升温速率下铁酸锌还原转化率与DDTG 关系Fig.4 Relationship between conversion rate of the zinc ferrite and DDTG at different heating rates

由不同升温速率下,三个反应阶段的TG 数据,计算各阶段的相对转化率α′,计算公式如式(2)所示,式中m0′表示阶段开始时样品的质量,g;mt′表示样品在某温度下的质量,g;m∞′表示阶段结束时样品的质量,g.从图5 中三个阶段的相对转化率与DTG 的关系曲线可以看到,同一阶段的不同升温速率曲线形状相似,可以推断升温速率不改变铁酸锌在各阶段碳热还原的机理.
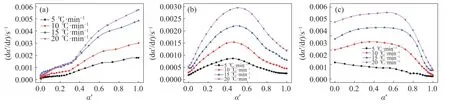
图5 各阶段相对转化率与DTG 关系.(a)第一阶段;(b)第二阶段;(c) 第三阶段Fig.5 Relationship between relative conversion rate and DTG in different reaction stages: (a) first stage;(b) second stage;(c) third stage
2.3 动力学模型
铁酸锌的碳热还原需要经过一系列的复杂物理化学反应,主要为铁酸锌的分解、氧化锌的还原、锌蒸气的挥发和铁氧化物的还原,整个反应过程包括固-固还原反应,中间产物CO 与ZnFe2O4、ZnO 以及铁氧化物发生的气-固还原反应和锌蒸气挥发的物理反应.铁酸锌的碳热还原反应机理可以简述为:铁酸锌→氧化锌+铁氧化物+气相→锌单质+铁单质+气相.
铁酸锌在进行非等温碳热还原时,样品的失重是温度和时间的函数,可以表示为:
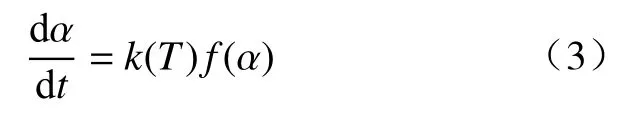
式中:dα/dt表示还原转化速率;k(T)表示特定升温速率T时的还原反应速率常数;f(α)表示还原反应机理函数的微分形式;t表示还原时间,s;α表示还原转化率.k(T)采用Arrhenius 公式表示:
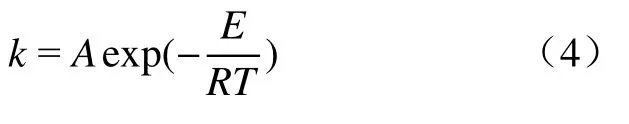
式中:A表示指前因子,s-1;E表示铁酸锌还原反应活化能,kJ·mol-1;R表示标准摩尔气体常数,kJ·(mol·K)-1.指前因子A数值越大,反应速度越快;活化能E反映还原反应的难易程度,是反应物的分子由初始稳定状态变为活化分子所需吸收的最小能量.还原转化率α计算同式(1).将公式(4)带入公式(3)可得:
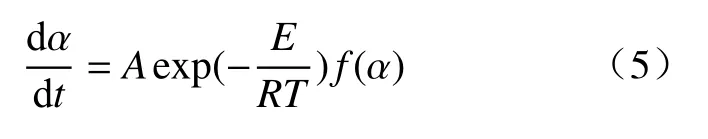
该式可以看作还原转化速率与转化率之间的函数关系式.通过Origin 非线性拟合可以得到不同机理函数条件下的曲线,并求得对应的反应活化能和指前因子.若实验曲线与某条理论曲线重合,则表示该机理函数为最适的机理函数.最适机理函数对应的反应控制机理即为反应机理.固相反应常用的机理函数见表2.

表2 常见的还原反应机理函数[22-24]Table 2 Common mechanism functions in the reduction reaction[22-24]
等转化率法是在热分析动力学研究中普遍采用的活化能计算方法[25].对(5)式进行变形积分可以得到:

同时对等式两边求自然对数,可以得到式(7):

式中y(α)与f(α)成A倍关系,因此,α与y(α)的关系曲线和α与f(α)的关系曲线具有相同的形状,然而y(α)依然是未知的,在本文中,通过对y(α)和f(α)曲线进行0~1 范围内的归一化处理,对比两条曲线即可得到还原反应的机理函数,归一化处理如下:
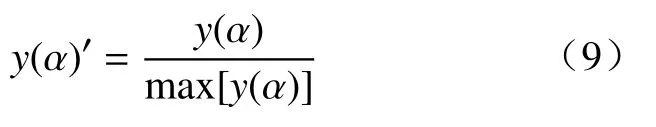
将第二阶段相对转化率α′与y(α)′的关系曲线与常见反应机理模型的标准曲线进行对比,可判断反应的机理函数[24].本文对于铁酸锌碳热还原动力学分析过程中采用等转化率方法对铁酸锌碳热还原活化能进行计算,并分析还原反应的机理函数.
2.4 动力学分析
(1) 反应活化能计算.
采用等转化率法计算各阶段的表观活化能E.通过图5 及表1 中数据可以看到,铁酸锌碳热还原过程中的转化率变化(0.085~0.813)主要发生在第二阶段,因此本文主要对第二阶段进行研究,计算反应活化能.计算过程中相对转化率的取值为0.10 至0.80,共15 个值,取值步长为0.05,找出不同升温速率条件下不同相对转化率对应的反应温度,各转化率下对应的温度如表3 所示.
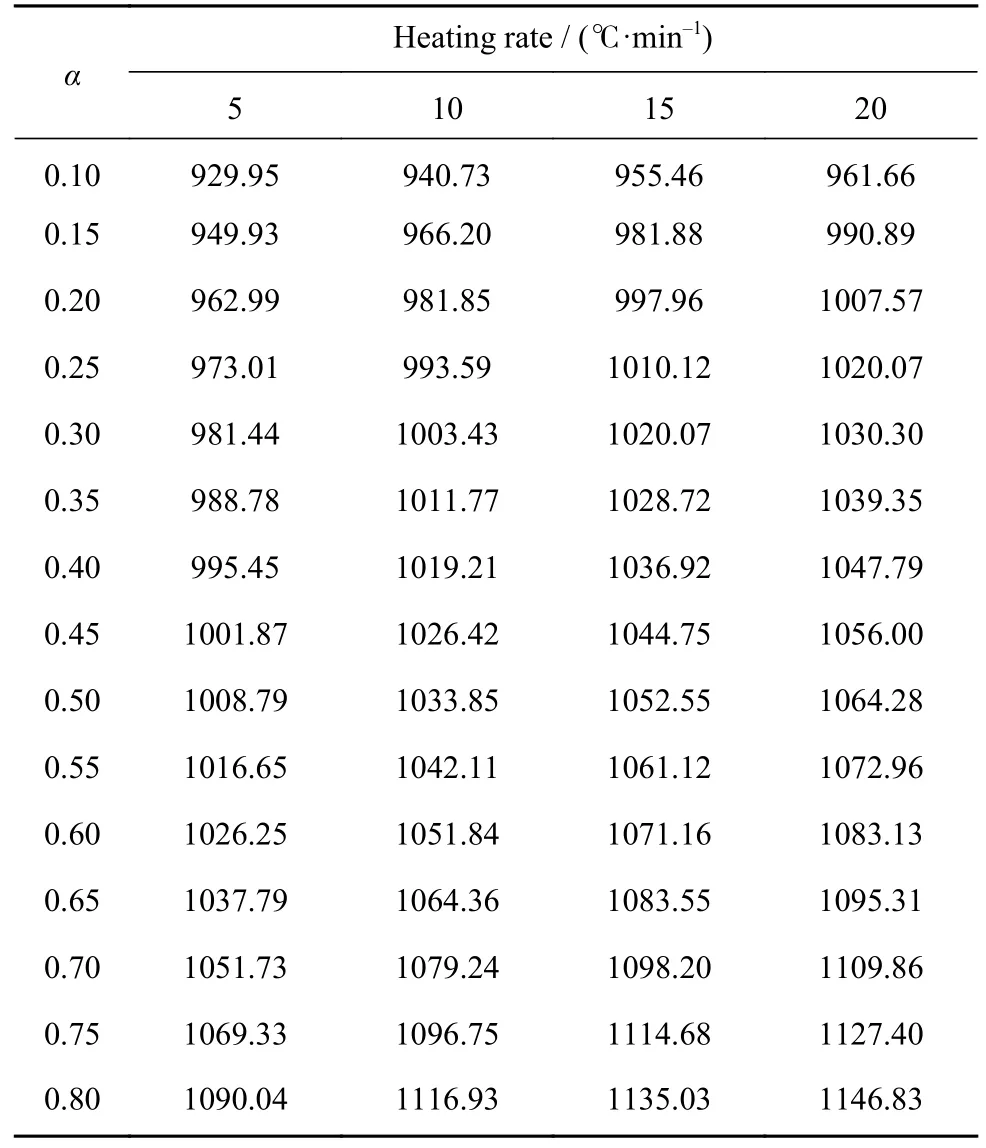
表3不同升温速率条件下各转化率对应的温度Table 3 Reaction temperature corresponding to different conversion rates at different heating rates ℃
用lnt对T-1作图可得图6,图中图形标号为实验数据计算所得,直线为线性拟合所得.通过拟合结果求出不同转化率条件下对应的活化能及第二阶段的平均活化能,结果如表4 所示,通过表中数据可知,各转化率时求得的活化能相关系数均达到0.95 以上,表明拟合度很好,可信度较高.第二阶段的平均活化能为362.16 kJ·mol-1.
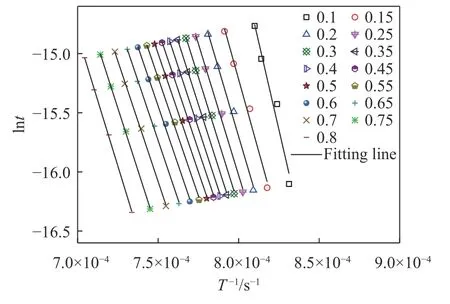
图6 1/T 与lnt 之间的线性关系Fig.6 Relationship between 1/T and lnt
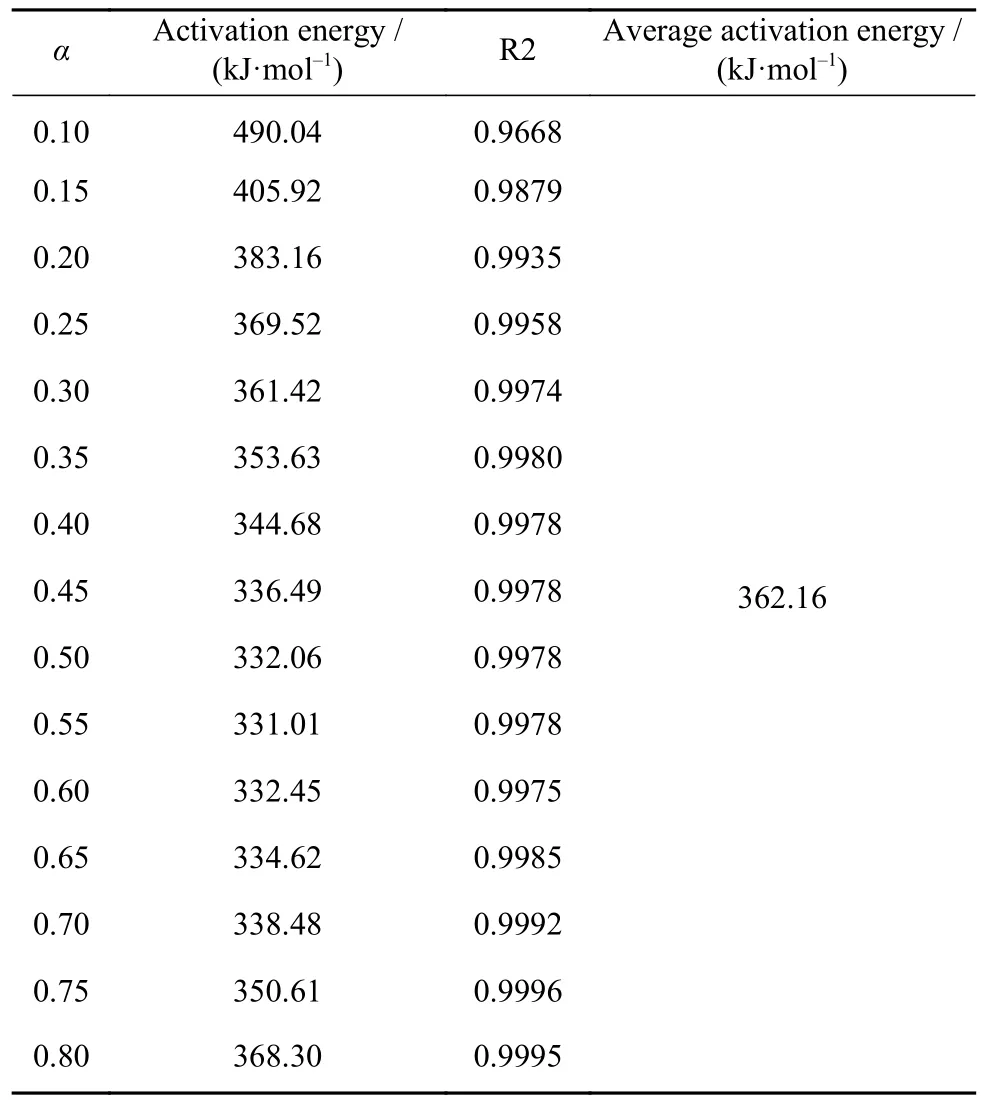
表4 不同转化率时的活化能及第二阶段平均活化能Table 4 Activation energy at different conversion rates and average activation energy of the second stage
图7 为不同转化率时活化能与转化率之间的关系,同图中可以看到,反应初期活化能非常高,随着转化率的提高,活化能逐渐降低,当转化率约为0.55 时活化能达到最低值,与图5(b)的结果相一致.随着转化率继续提高,活化能逐渐提高.第二阶段的活化能在331.01~490.04 kJ·mol-1之间,活化能变化较大,说明第二阶段的发生的反应较为复杂,各反应之间的活化能差异明显.

图7 不同转化率时活化能与转化率的关系Fig.7 Relationship between activation energy and conversion rate
(2) 主要机理函数确定.
通过式(8)和(9)计算不同升温速率条件下y(α)′与第二阶段相对转化率之间的关系,获得的关系曲线与表2 中所列的主要固相反应机理函数所对应的标准转化率与y(α)之间的标准关系曲线对比,即可得到第二阶段反应的机理函数[24],对比结果如图8 所示(图中为契合度较高的三个机理函数的对比结果).通过图8 对比结果可以看到不同升温速率条件下的各曲线与二级化学反应机理函数(F2)的曲线最为相近.但第二阶段相对转化率为0.10~0.60 时,不同升温速率条件下的曲线区别明显,这是由于该阶段反应前期同时存在铁酸锌分解、氧化锌还原、锌蒸气挥发和铁氧化物还原等多个物理化学反应造成的:由XRD 分析结果可知,第二阶段反应初期存在铁酸锌的分解[21];随着温度的升高,逐步发生氧化锌的还原反应,单质锌的沸点为907 ℃,且第二阶段温度均在907 ℃以上(第二阶段平均温度范围为938.68~1126.67 ℃),还原后单质锌会以锌蒸气的形态挥发[20].而当第二阶段相对转化率大于0.60 时,由表3 可知此时温度已经处于1026.25 ℃以上,结合XRD 分析结果可以判断此时氧化锌的还原反应结束,体系内铁氧化物的还原反应为主,仅存在碳-氧反应引起的失重,因此实验值曲线几乎与理论值没有区别.综合考虑上述因素,可以判断二级化学反应是铁酸锌碳热还原第二阶段的主要控速环节.将f(α)=(1-α)2带入式(5),计算得指前因子为2.12×1016s-1,可以得到第二阶段的主要控制方程为:
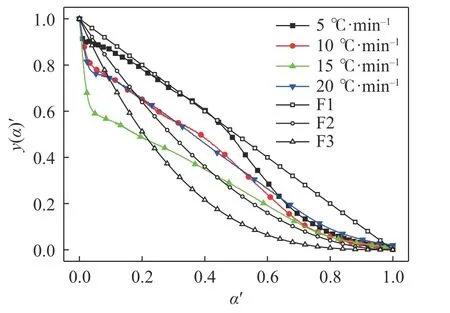
图8 不同升温速率时y(α)′与转化率之间的关系曲线Fig.8 Relationship between y(α)′ and conversion rate at different heating rates
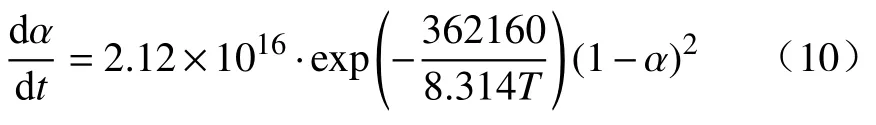
2.5 铁酸锌碳热还原机理解析
铁酸锌碳热还原XRD 物相分析显示在850~950 ℃温度范围内,主要发生铁酸锌的分解反应,铁酸锌大量分解及氧化锌和铁氧化物的碳热还原反应主要发生在大于950 ℃温度范围内,由此可初步判断铁酸锌的碳热还原可分为铁酸锌分解和氧化物还原两个阶段.进一步根据热重实验结果中还原转化率与转化速率的关系可以看出,铁酸锌的非等温碳热还原整个过程形成三个峰(图3),这表明铁酸锌的碳热还原过程由不同的三个反应阶段组成.结合XRD 物相分析结果和热重实验分析结果可以判断铁酸锌非等温碳热还原过程可以分为铁酸锌分解段、氧化锌还原段和铁氧化物还原段等三个阶段.第二阶段平均转化率从0.085 升高至0.813,其对应的转化温度平均值范围是938.68~1126.67 ℃,这一温度区间与由XRD 物相变化确定的主要反应温度区间基本对应.如图9 所示为根据XRD 物相分析及热重实验结果划分的铁酸锌非等温碳热还原过程各阶段及其化学反应示意图.各阶段主要物相生成的化学反应如下:

图9 铁酸锌碳热还原反应各阶段划分及其化学反应示意图Fig.9 Schematic diagram of the stages and chemical reactions of the carbothermal reduction of zinc ferrite
(1) 铁酸锌分解阶段主要发生如下反应:

(2) 氧化锌还原主要发生如下反应:
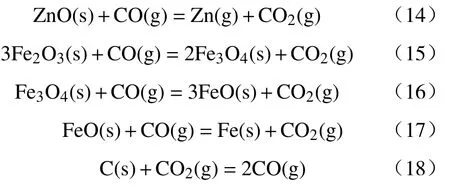
(3) 铁氧化物还原段主要发生如下反应:

反应开始时主要发生反应(11),此时ZnFe2O4被部分分解成ZnO 和Fe2O3,反应开始段的另外两个反应非常缓慢;随着温度的升高,反应(12)和反应(13)反应速率逐渐加快,累积产生一定量的CO后,开始进入氧化锌还原阶段;阶段二主要发生式(14),ZnO 被CO 大量还原,同时部分铁氧化物被还原,几个气-固反应速率比式(12)和(13)两个固-固反应速率大很多,因此第二阶段可以忽略反应(12)和反应(13),另外,碳气化反应(18)同时在此阶段开始发生;当ZnO 被完全还原时,进入第三阶段,主要发生Fe3O4和FeO 等物质的还原以及反应(21),当反应中间产物FeO 含量为0 时,ZnFe2O4碳热还原反应结束.
3 结论
(1) 从铁酸锌碳热还原XRD 物相分析结果可以看出,温度为850 ℃时,ZnFe2O4开始少量分解;温度为950 ℃时,ZnFe2O4大量分解,同时出现FeO0.85·xZnO 无定型物质,Fe3+被还原为Fe2+;温度为1050 ℃时,团块内已经没有锌元素及铁氧化物相的存在,说明铁酸锌碳热还原反应主要发生在950~1050 ℃温度范围内.由此可初步判断ZnFe2O4碳热还原物相转变过程为:ZnFe2O4→ZnFe2O4+ZnO+Zn+Fe3O4→ZnFe2O4+ZnO+Zn+FeO0.85·xZnO→Fe.
(2) 根据还原转化率与转化速率的关系可以看出铁酸锌的非等温碳热还原整个过程由不同的三个反应阶段组成,第二阶段平均转化率变化最大,从0.085 升高至0.813,第二阶段对应的平均转化温度范围是938.68~1126.67 ℃,与XRD 物相变化确定的主要反应温度区间基本对应.同一阶段的不同升温速率曲线形状相似,表明在该实验条件下升温速率不改变铁酸锌在各阶段碳热还原的机理.
(3) 由铁酸锌碳热还原过程XRD 物相变化及还原过程转化率与转化速率的关系,可以将铁酸锌的非等温碳热还原过程可分为铁酸锌分解段、氧化锌还原段和铁氧化物还原段三个阶段.
(4) 通过对铁酸锌碳热还原第二阶段的动力学分析,可以得出第二阶段的活化能在331.01~490.04 kJ·mol-1之间,变化较大,说明第二阶段发生的反应较为复杂,各反应之间的活化能差异明显,平均活化能为362.16 kJ·mol-1,二级化学反应是这一阶段的主要控速环节,第二阶段的主要控速方程为:

