Fe基催化剂物相演变及CO2加氢反应性能影响
梁 洁 , 王欣宇 ,高新华,,* ,田菊 梅 ,段 斌 ,张 伟 ,江永军, ,Prasert Reubroycharoen ,张建利,* ,赵天生
(1.宁夏大学化学化工学院 省部共建煤炭高效利用与绿色化工国家重点实验室, 宁夏 银川 750021;2.国家能源集团宁夏煤业有限责任公司煤炭化学工业技术研究院, 宁夏 银川 750411;3.宁夏计量质量检验检测研究院 国家煤及煤化工产品质量检验检测中心(宁夏), 宁夏 银川 750200;4.朱拉隆功大学理学院化学工艺系 生物能源和可再生化学品催化卓越中心, 泰国 曼谷 10330)
CO2过度排放导致全球气候变暖,如何实现“碳减排”已成研究热点。通过发展绿色能源(生物质、光伏、天然气、核能等)或将CO2资源化利用,有望逐步减少碳排放[1]。采用热催化技术将CO2加氢转化为甲烷(CH4)、甲醇、甲酸,以及低碳烯烃(-)等短链碳氢化物已取得较大进展[2-11]。基于费托合成 (Fischer-Tropsch synthesis,FTS),人们发展了CO2加氢制烃类化合物路径。包括两个步骤:CO2先通过逆水煤气反应(Reverse Water Gas Shift,RWGS)生成一氧化碳 (CO),CO 再通过 FTS反应转化为烃类化合物,称为CO2-FTS路径。Fe基催化剂资源储备丰富、价格低廉且RWGS活性高,被广泛用于CO2-FTS反应研究[12,13]。
Fe基催化剂CO2加氢反应的产物选择性与FTS反应类似,服从Anderson-Schulz-Flory (ASF)分布规律[14],需要加入助剂调控。同时,碱金属助剂可以改变催化剂表面酸碱度、调变催化剂活性位点电子密度,提高CO2吸附量,从而提高反应活性。Zhao等[15]研究了Na、Mn助剂对CO2加氢反应中RWGS和FTS反应活性和产物选择性的影响,发现Na的加入减弱了Fe与Mn之间的强相互作用,使Mn转变成为对CO2加氢转化有利的助剂,提高了CO2的加氢活性和烯烃的选择性。在Fe基催化剂中加入助剂可以显著改善Fe基催化剂性能,调节产物分布。Yao等[16]通过共沉淀法制备了FeNaS催化剂,发现Na改性有助于CO解离和抑制CH4产生,而Na与S共同作用能够降低反应能垒,增强催化剂活性,提高产物选择性。但是,助剂对预处理过程中的还原及碳化机理的相关研究报道较少。
研究认为,CO2加氢Fe基催化剂需同时具有Fe3O4和Fe5C2两种活性相,分别催化RWGS和FTS反应,这两种活性相的比例及协同作用是影响CO2加氢反应活性和产物选择性的关键[15]。在FTS反应中对Fe基催化剂物相的变化展开研究发现,Fe基催化剂的FTS反应还原过程一般分两步进行:第一步Fe2O3被还原为Fe3O4;第二步Fe3O4被缓慢还原为金属铁[17,18]或碳化铁[19]。Fe基催化剂在FTS反应还原过程产生复杂的物相变化[20]。但在CO2加氢反应中对于此类的研究报道则较少,而且就Fe基催化剂在FTS反应中物相的变化来说,CO2加氢反应这一催化体系中,Fe基催化剂的活性相变化更为复杂。因此,研究Fe基催化剂在CO2-FTS反应中的物相演变具有重要意义。
本研究采用等体积浸渍法制备不同Na修饰量的Fe2O3样品,采用原位XRD技术分别对Fe基催化剂在H2或合成气(CO/H2= 1∶2)气氛中的物相演变进行研究,揭示Na助剂和预处理气氛对Fe基催化剂物相控制及CO2加氢反应性能影响规律。
1 实验部分
1.1 催化剂的制备
取适量 Fe(NO3)3·9H2O 置于马弗炉中,400 ℃空气氛围焙烧5 h,得到氧化铁样品,记为Fe2O3。
等体积浸渍法制备Na-Fe2O3,取适量Na2CO3粉末(Fe/Na物质的量比为10∶1或10∶2)配成等体积浸渍液,超声条件下逐滴加至Fe2O3粉末中,继续超声至充分混合,80 ℃干燥12 h。干燥后的样品造粒(20-40目)备用,记作1Na-Fe2O3和2Na-Fe2O3。
1.2 催化剂的表征
催化剂物相由XRD表征,仪器型号为Rigaku SmartLab,Cu Kα 辐射 (λ = 0.154 nm),X 射线管电压40 kV、管电流 40 mA。测试条件:测试 10°-85°、步长 0.02°,扫描速率 6(°)/min。
催化剂还原或反应过程中物相演变由in-situ XRD表征,仪器型号和测试条件与XRD一致。还原气 (H2/合成气 (CO/H2= 1∶2),20 mL/min)或反应气 (CO2+ H2,CO2/H2= 1∶3)在常压下由转子流量计(20 mL/min)通入原位反应池:温度25-450 ℃,升温速率10 ℃/min,在相应温度点停留2 min后XRD线扫。
使用全自动程序升温化学吸附仪(Auto ChemⅡ 2920)进行H2程序升温还原(H2-TPR)表征催化剂还原行为。测试条件:50 mg样品He气氛(30 mL/min)下350 ℃预处理1 h,冷却至50 ℃。通入10% H2/Ar (30 mL/min)进行还原,样品以10 ℃/min的升温速率从50 ℃线性增加至800 °C,由热导检测器(TCD)记录还原曲线。
Fe2O3催化剂样品的合成气程序升温表面反应实验通过微型评价装置仪器进行。催化剂样品首先在300 ℃ Ar气氛下(20 mL/min)预处理1 h,降至室温后通入合成气(CO/H2= 1∶2, 20 mL/min),以10 ℃/min的升温速率升至500 ℃,产物通过QGA气体分析质谱仪在线检测。
1.3 催化剂性能评价
在微型固定床反应器上进行CO2加氢反应性能评价。0.5 g Fe2O3催化剂样品首先在H2或合成气(CO/H2= 1∶2)中 450 ℃ 还原 4 h (1000 h-1,0.1 MPa),继续在还原气氛下降至室温。然后通入原料气(H2/CO2/Ar = 72∶24∶4),反应 温度 320 ℃,3 MPa、1000 h-1进行CO2加氢性能评价。产物经气相色谱仪(GC-2014C)在线分析,有机组分采用Rtx-1(60 m × 0.32 mm)毛细管柱,无机组分采用MS-13X(3 m × 1/8)填充柱,甲烷关联法定量。
1.4 计算方法
反应物转化率和产物选择性计算过程如下:

2 结果与讨论
2.1 热力学计算
在CO2加氢反应体系中,Fe基催化剂前驱体主要物相为Fe2O3,需要经过预处理还原至RWGS反应的活性组分Fe3O4。利用公式(4)-(6)计算得出该反应在不同还原气氛下的反应焓变、吉布斯自由能变以及平衡常数[21],对还原过程进行热力学分析,结果如表1所示。从表1可以看出,两个反应的反应焓变和吉布斯自由能变均小于0,表明反应放热、还原过程热力学可行。

表1 Fe2O3还原反应的热力学分析Table 1 Thermodynamic analysis of Fe2O3 reduction reaction
2.2 催化剂物相(XRD)
图1为不同催化剂样品XRD谱图。由图1可知,Fe2O3催化剂样品在 2θ为 24.1°、33.1°、35.6°、40.8°、49.5°、54.1°、62.5°、64.1°出现 Fe2O3(PDF#33-0664) 特征衍射峰[22],说明本实验制备出晶型结构单一的Fe2O3催化剂样品;经等体积浸渍法制备出的1Na-Fe2O3和2Na-Fe2O3催化剂样品物相并没有发生变化,且未检测出Na2CO3的峰,表明Na在Fe2O3催化剂表面均匀分散,未发生团聚现象。通过JADE Pro (Materials Data)软件对样品的XRD谱图进行精修拟合,得到催化剂样品的晶粒尺寸,如表2所示。结果表明,Na助剂的添加减小了Fe2O3的晶粒尺寸,Na助剂的修饰量为10∶1时,1Na-Fe2O3的晶粒尺寸最小;而修饰量增加至10∶2时,2Na-Fe2O3的晶粒尺寸略有增大。

表2 Fe2O3样品的晶粒尺寸Table 2 Crystal size for different samples

图1 Fe2O3样品的XRD谱图Figure 1 XRD patterns of the Fe2O3 samples
2.3 催化剂还原性能
2.3.1 H2-TPR表征
图2为不同Na助剂修饰量Fe2O3样品的H2-TPR谱图。由图2可知,所有催化剂样品在测试温度范围内表现出三个还原峰,被认为分别对应Fe2O3→ Fe3O4→ FeO → Fe 的 连 续 还 原 过 程[23]。其中,未改性的Fe2O3催化剂样品在300-400 ℃出现第一个还原峰,峰顶温度385 ℃,对应于Fe2O3→Fe3O4的还原。随着Na助剂的加入,1Na-Fe2O3和2Na-Fe2O3催化剂样品的该还原峰峰顶温度向高温偏移,表明Na助剂的修饰提高了Fe2O3物种的初始还原温度。由于Fe3O4→ FeO → Fe物相的还原过程连续同时进行[23,24],FeO物种不能稳定存在,导致未改性的Fe2O3样品后两个还原峰没有明显裂分[25]。加入Na助剂后,1Na-Fe2O3和2Na-Fe2O3催化剂样品第二个还原峰峰顶温度向低温偏移,表明Na的修饰促进Fe3O4物种的还原[26],使后两个还原峰明显裂分。为了直接确认Fe2O3在H2气氛下的物相还原过程,本工作进一步采用in-situXRD进行了研究。

图2 样品的H2-TPR谱图Figure 2 H2-TPR profiles of the samples
2.3.2 In-situ XRD表征
图3为不同Na助剂修饰量Fe2O3样品在H2气氛下还原过程的in-situXRD谱图。如图3(a)所示,未改性的Fe2O3催化剂样品在325 ℃时出现Fe3O4特征衍射峰 (PDF#19-0629)[27];而图3(b)、(c)中,1Na-Fe2O3和2Na-Fe2O3催化剂样品在350 ℃时出现Fe3O4特征衍射峰,表明Na助剂的修饰会提高Fe2O3物种的初始还原温度,这与图2中H2-TPR结果一致。

图3 样品在H2气氛下还原的原位XRD谱图Figure 3 In-situ XRD patterns of the samples under a H2 reduction atmosphere
对Fe2O3催化剂样品继续升温还原,在350 ℃并保持温度60 min时,图3(a)观察到单质Fe的特征衍射峰(PDF#06-0696)[27];继续升高温度时,Fe2O3特征衍射峰逐渐消失,单质Fe成为主要物相;而图3(b)、(c)中,1Na-Fe2O3和 2Na-Fe2O3催化剂样品中Fe2O3的特征衍射峰升温至450 ℃时完全消失,Fe3O4和单质Fe成为主要物相。在原位XRD谱图中未检测到FeO的特征衍射峰(PDF#46-1312),这可能是由于FeO的衍射峰强度较低,或已被还原为单质Fe而未被检测到。此外,发现对于Fe2O3样品(图3(a)),当温度升高至450 ℃只显示出单质Fe的特征衍射峰,说明铁氧化物已被完全还原,这与传统H2-TPR结果分析的“三步还原”过程 (Fe2O3→ Fe3O4→ FeO → Fe)略有不同,因此,对于H2气氛下的Fe2O3还原过程可能为Fe2O3→Fe3O4→ Fe“两步还原”。
图4为不同Na助剂修饰量Fe2O3样品在合成气(CO/H2= 1∶2)气氛下还原过程的in-situXRD谱图。三组催化剂样品在300 ℃时,物相均发生变化,出现Fe3O4特征衍射峰(PDF#19-0629),与H2相比,催化剂样品在合成气气氛下所需初始还原温度更低,说明在相同条件下合成气的还原能力要强于H2。由图4(a)可以看出,在400 ℃保持60 min时,出现Fe5C2特征衍射峰(PDF#51-0997),这被认为是CO2加氢制烯烃的活性物相[28];但图4(b)、4(c)可以看出,1Na-Fe2O3和2Na-Fe2O3催化剂样品在350 ℃保持60 min时就已经出现Fe5C2特征衍射峰,这说明Na助剂可以降低Fe2O3样品的碳化反应温度。继续升温至400 ℃时,三组催化剂样品中Fe2O3的特征衍射峰逐渐消失,Fe5C2和Fe3O4成为主要物相;450 ℃时,在XRD谱图中只能观察到Fe5C2的特征衍射峰,说明Fe3O4已被完全碳化。研究发现,与图3在H2气氛下还原过程不同,采用合成气还原时,并未出现Fe物相,而是直接生成了Fe5C2。因此,Fe2O3在合成气 (CO/H2= 1∶2)气氛下的还原及碳化过程可概括为:Fe2O3→ Fe3O4→ Fe5C2。
2.3.3 TPSR-MS表征
通过图4原位XRD谱图可以清楚观察到,在合成气(CO/H2= 1∶2)气氛下,Fe2O3样品先被还原为Fe3O4,然后发生碳化反应生成Fe5C2,并且在引入Na助剂后,会降低碳化反应的温度,促进表面Fe5C2物种的生成。为进一步探究还原过程中Fe2O3样品复杂物相演变,采用TPSR-MS对铁氧化合物及铁碳化合物的变化进行了研究。

图4 样品在合成气气氛下还原的原位XRD谱图Figure 4 In-situ XRD patterns of the samples under a H2 + CO(CO/H2 = 1∶2) reduction atmosphere
图5为合成气在催化剂样品进行的CO + H2-TPSR-MS 谱图。Fe2O3、1Na-Fe2O3和2Na-Fe2O3三个催化剂样品在300 ℃后出现了H2消耗峰(3Fe2O3+H2= 2Fe3O4+ H2O)和第一个CO消耗峰(3Fe2O3+CO = 2Fe3O4+ CO2),检测到了 H2O 和 CO2,对应Fe2O3→ Fe3O4物相变化;由图5(b)、5(c)可以看出,1Na-Fe2O3和2Na-Fe2O3催化剂样品CO消耗峰温度低于图5(a)中的Fe2O3样品,说明Na修饰有助于CO解离[17];CO消耗量及CO2生成量增加,同时催化剂样品还原温度略有降低,说明Na修饰提高了样品的还原能力。催化剂样品CO第二个消耗峰对应Fe3O4→ Fe5C2的物相变化,由于Fe3O4碳化反应消耗CO生成CO2和Fe5C2,使得气体分压减小,故H2消耗峰面积升高。由图5(b)、5(c)可以看出,1Na-Fe2O3和2Na-Fe2O3催化剂样品CO第二个消耗峰温度低于图5(a)中的Fe2O3样品,且消耗峰面积增加,表明Na修饰促进了样品的碳化。
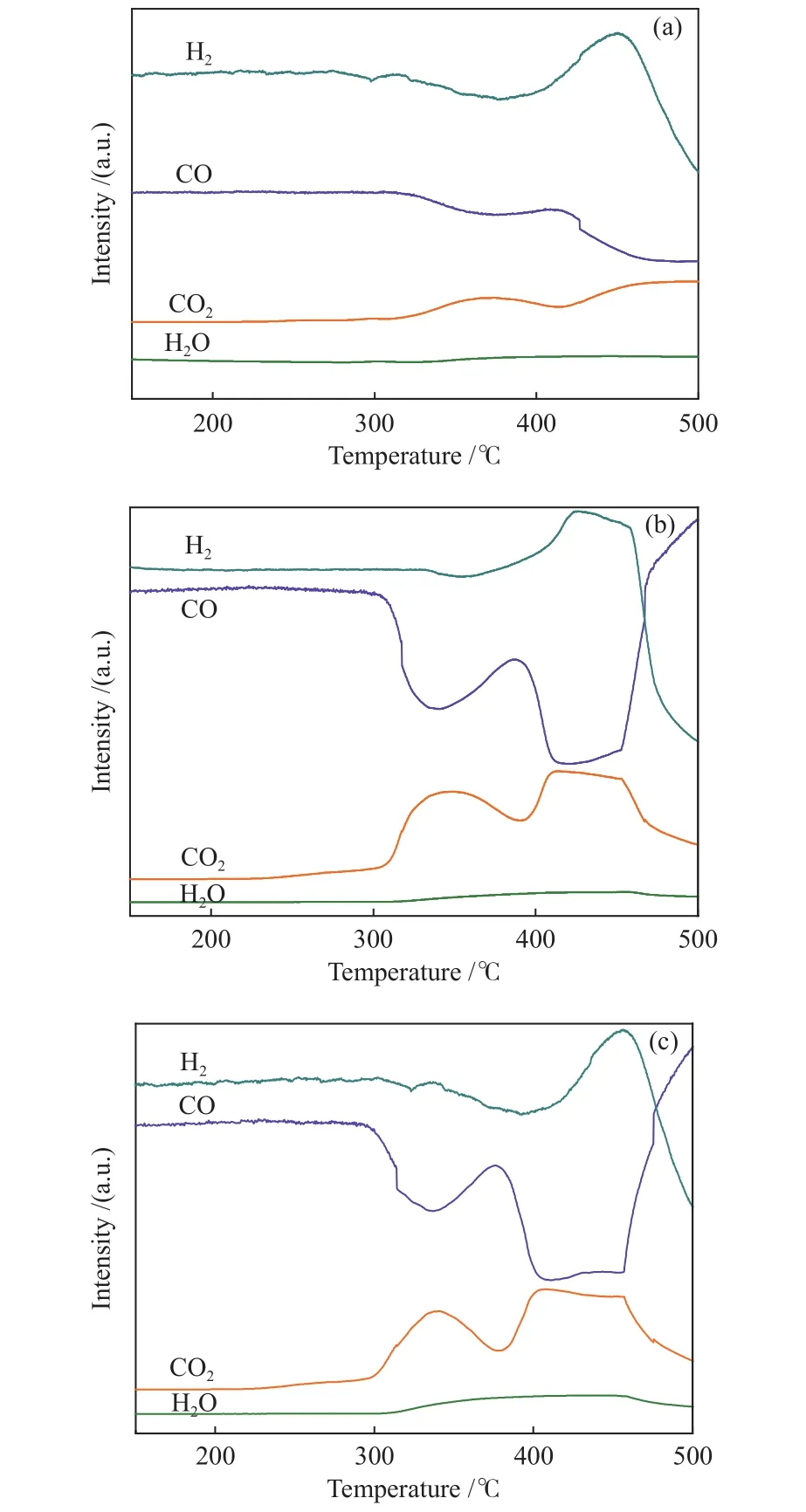
图5 样品的CO + H2-TPSR-MS谱图Figure 5 CO + H2-TPSR-MS profiles of the samples
2.4 催化性能测试
图6和图7分别为不同预处理气氛(H2、合成气)还原后催化剂样品用于CO2加氢性能评价图和对应铁物种含量图。图6 a为采用H2气氛还原后的样品,其CO2转化率7.3%,CH4选择性50.6%,物相以Fe3O4为主(图7);图6 b为采用合成气还原后的样品,其CO2转化率较a催化剂升高至25.8%,CH4选择性降至43.2%,及C5+选择性升高。由于Fe5C2物种有利于C-C偶联,促进C5+的生成,抑制CH4的生成[29],所以催化剂b产物中及C5+含量明显增加。同时发现,与氢气还原相比,经合成气还原后催化剂上CO2转化率明显提升,这可能是因为合成气还原生成了碳化铁物种,有利于CO2经RWGS反应生成的CO迅速进行FTS反应。图6c、6d为Na助剂修饰后的Fe2O3催化剂样品,反应产物中CH4选择性明显降低,C5+选择性明显增加,相对应的图7中c、d催化剂Fe3O4含量降低,Fe5C2含量增加。研究发现[30],在FTS反应中,碱金属Na的修饰可降低CO加氢反应中CH4的选择性。进一步提高助剂Na的添加量后,催化剂的产物选择性并未发生明显变化,但CO2转化率略微降低,这是由于与1Na-Fe2O3样品相比,2Na-Fe2O3样品Fe5C2含量降低,Fe2O3含量略有增加,不利于CO2加氢反应的进行,导致CO2的转化率降低。综上所述,控制Fe基催化剂氧化物与碳化物比例非常关键,Na助剂修饰和合成气预处理都可以促进Fe5C2物种生成,其中,1Na-Fe2O3样品在进行CO2加氢实验时表现出最佳反应性能,CO2转化率达26.0%,C5+选择性42.7%。
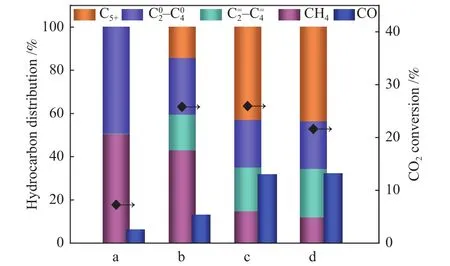
图6 催化剂CO2加氢反应性能Figure 6 Catalytic performance of samples on CO2 hydrogenation

图7 样品预处理后铁物种含量Figure 7 Iron species content of different samples
为了进一步研究催化剂物相在反应中的演变规律,对经合成气(CO/H2= 1∶2)还原后的1Na-Fe2O3样品进行了CO2加氢in-situXRD测试,结果见图8。由图8可以看出,催化剂样品在10 h的测试中,主要物相为Fe3O4和Fe5C2且未发生明显变化,说明催化剂在CO2加氢反应中较为稳定。在Fe基催化剂催化CO2加氢反应中存在多个活性位,一般来说Fe3O4是RWGS反应的活性相,Fe5C2是FTS反应的活性相,两者比例对CO2催化加氢活性及产物选择性至关重要。通过in-situXRD和TPSR-MS等原位表征技术,对Fe基催化剂还原、活化及CO2加氢反应时的物相演变过程进行追踪,结合反应性能评价数据,可以准确构建催化剂结构与性能关系,揭示反应机理。

图8 1Na-Fe2O3样品CO2加氢反应原位XRD谱图Figure 8 In-situ XRD patterns of 1Na-Fe2O3 for CO2 hydrogenation
3 结 论
本实验研究了不同还原气氛对助剂Na改性后Fe2O3催化剂物相演变的影响。研究发现,在相同还原条件下,合成气还原Fe2O3的能力要强于H2,Fe2O3在H2气氛下的还原过程可概括为Fe2O3→Fe3O4→ Fe;在合成气(H2/CO = 2)气氛下的还原及碳化过程可概括为:Fe2O3→ Fe3O4→ Fe5C2。尽管Na助剂的修饰提高了H2气氛下Fe2O3样品的还原温度,但在合成气气氛下还原和渗碳反应过程的温度会降低,并增加Fe5C2物种的含量。实验表明,对CO2加氢Fe基催化剂进行适当的Na助剂修饰并通过合成气预处理,可提高催化剂中Fe5C2含量,进而提高CO2转化率和C5+产物选择性。

