结直肠侧向发育型肿瘤伴结直肠息肉的相关因素分析
张曦予,李未华,徐泉,黄华,赵公芳
结直肠癌(colorectal cancer,CRC)是威胁人类健康的常见肿瘤之一,目前预防CRC的努力主要集中在息肉样病变的发现和切除上。结直肠息肉不但会引起便血、腹痛、腹胀等消化道症状,更严重的是,无临床症状的结直肠息肉容易被忽视,从而可能进展为CRC[1]。然而有研究表明侧向发育型肿瘤(laterally spreading tumors,LST)与CRC关系更为密切,且在3年内可发展为CRC[2]。根据国外相关大规模对照研究显示,LST患者合并CRC的可能性为8.4%~52.5%[3]。LST是呈匍匐状生长的一类表浅型病变,直径通常>1 cm。根据病变的不同形态将LST分为两种类型[4]:颗粒型LST(granulartype,LST-G)和非颗粒型LST(non-granular type,LST-NG)。
LST与结直肠息肉在同一患者中共存现象十分常见。分析LST伴结直肠息肉的相关性研究较少,关于LST伴结直肠息肉的危险因素知之甚少,进一步研究LST伴结直肠息肉的相关因素,对减少LST伴结直肠息肉的漏诊并提供个性化的诊疗具有重要意义。
1 对象与方法
1.1 研究对象
本研究经昆明医科大学第二附属医院伦理委员会审核批准 (伦理批件号:审-PJ-科-2022-59)。收集2016年1月至2021年12月昆明医科大学第二附属医院住院期间接受结肠镜检查并检出LST(由两名高年资内镜医师确认)患者323例,选取符合本研究纳入标准的173例LST病变进行回顾性研究分析。按照是否伴发结直肠息肉分为两组,LST伴结直肠息肉组95例,LST不伴结直肠息肉组78例。
1.2 纳入及排除标准
1.2.1 纳入标准 ①临床资料完整;②签署内镜下息肉切除手术知情同意书;③结肠镜下检查诊断为LST的患者;④结肠镜检查肠道充分,进镜至回盲部。
1.2.2 排除标准 ①具有排除重症感染、原发性脂质代谢异常性疾病以及其他胃肠疾病者(例如炎症性肠病、家族性腺瘤性息肉病等);②病理、内镜及临床资料不全者。
1.3 结肠镜检查及治疗方法
1.3.1 术前准备 排外内镜检查及治疗的禁忌症,签署结肠镜检查及治疗知情同意书,检查前清洁肠道。
1.3.2 治疗 发现LST者接受ESD、EMR或EPMR,病变较大者在内镜下定位后行外科结肠切除术。
1.4 病理诊断
切除的病变送我院病理科明确病理组织学类型,病理报告由我院病理科医师完成并发送报告。
(1)LST的病理组织学类型按照WHO2010年版消化道肿瘤的标准。
(2)LST的内镜下有无颗粒结节样改变分为 LST-G和LST-NG。LST发病部位根据大肠在胚胎起源、血供、分子生物学特征上存在不同,将病变部位分为近端结肠包括盲肠、升结肠和横结肠,远端结肠定义为降结肠、乙状结肠和直肠。
1.5 观察指标
(1)收集所有受试者的人口统计学资料,包括民族、年龄、性别、吸烟史、饮酒史、结直肠息肉病史、首发症状、身高、体重、BMI,以及LST的亚型、大小、部位和病理组织学类型的数据。
(2)实验室检验指标包括:收集调查对象行结肠镜检查及治疗术前8 h的血清中WBC计数、NEUT计数、UA、TC、TG、HDL-C、LDL-C水平。
1.6 统计学处理
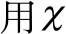
2 结果
2.1 两组组一般资料比较
LST伴结直肠息肉组的年龄、男性、有吸烟史、饮酒史、LST<3 cm、LST位于近端结肠、WBC计数、NEUT计数水平高于LST不伴结直肠息肉组,HDL-C水平低于LST不伴结直肠息肉组,差异有统计学意义(P<0.05);两组间在首发症状、汉族、LST-G、既往有息肉病史、BMI、UA、TC、TG、LDL-C上差异无统计学意义(P>0.05),见表1。
2.2 LST伴结直肠息肉的Logistic回归分析
以LST是否伴结直肠息肉为因变量,将表1单因素分析中具有差异统计学意义的自变量纳入二元Logistic回归分析。结果显示:年龄[比值比(OR)=1.049,95%CI:1.013~1.087],LST直径<3 cm(OR=3.661,95%CI:1.480~9.058)是LST伴结直肠息肉的独立危险因素(P<0.05),见表2。
3 讨论
随着内镜技术的发展,LST的检出率逐渐提高,近年我国LST在结肠镜检查人群中的检出率约为 0.45%~0.8%[5-6],提示LST并非罕见。本研究中LST伴结肠息肉的患者95例,占比约55%,提示 LST伴结直肠息肉的现象十分常见,值得引起临床医师的重视。
本研究得出年龄、男性是LST伴结直肠息肉的危险因素,且年龄是LST伴发结直肠息肉的独立危险因素。与之前对罗马尼亚人、韩国人、意大利人、日本人和中国人的研究结果相似[7]:老年患者(约为60岁)的LST发病率更高。既往研究也证实了年龄与结直肠息肉的形成呈正相关关系,结直肠息肉的发病率随年龄增长而增加[8]。既往研究发现LST在女性中比男性更常见[9],但Shen等人[10]首次提出男性LST患者伴发结直肠息肉的风险高于女性,与本研究结果一致。因此,60岁以上人群行结肠镜检查时应注意LST的发生。随着受检者年龄的增高,尤其是男性群体,要警惕LST同时伴结直肠息肉,避免漏诊。
LST伴结直肠息肉组有吸烟史、饮酒史比例均高于LST不伴结直肠息肉组。既往研究证明各种程度的吸烟都与结直肠息肉有关,吸烟的年限与结直肠息肉之间存在剂量-反应关系[11]。吸烟似乎与结直肠息肉的关系比CRC的发展更为密切,提示吸烟在肿瘤生长的起始阶段发挥作用[12]。一项针对亚洲台湾人的研究显示[13],饮酒者患结直肠息肉的比率比不饮酒的人高2.01倍。我国一项研究提示吸烟及经常饮酒的人患结肠息肉的风险更高[1],吸烟和饮酒可能会导致胃肠道微生物组的变化[14],而肠道微生物群的破坏可能与CRC等疾病有关。吸烟、饮酒往往共同影响许多疾病的发生发展。LST伴发结直肠息肉可能与很多人不健康的生活方式有关。
LST部位与LST有无伴发结直肠息肉有关,当LST位于近端结肠时发生LST伴结直肠息肉的比例高于LST不伴结直肠息肉,推测近端结肠的LST更容易伴发结直肠息肉。此外,LST的直径大小可作为其恶性程度的预测因子之一。我国有研究证明LST≥3 cm时存在高级别上皮内瘤变、浸润癌的百分比分别为42.1%和15.4%[15]。本研究结果显示LST直径<3 cm较LST直径≥3 cm更容易伴发结直肠息肉,二元Logictic回归提示LST直径<3 cm是LST伴结直肠息肉的独立危险因素,LST直径越小时,伴结直肠息肉的风险越大。当LST直径<3 cm时必须注意此患者可能存在LST伴发结直肠息肉,避免漏诊。当LST直径≥3 cm时恶变倾向可能较高,伴结直肠息肉的可能性相对较小,此时应当重点观察LST的腺管、血管结构、以及病变是否存在中央凹陷或大结节颗粒[3]等癌变特征,并采用ESD或外科手术完整切除LST,以减少LST的复发,并尽可能降低LST癌性病变播散的发生率以保证治疗的有效性。

表1 两组一般资料比较 [n(%)]
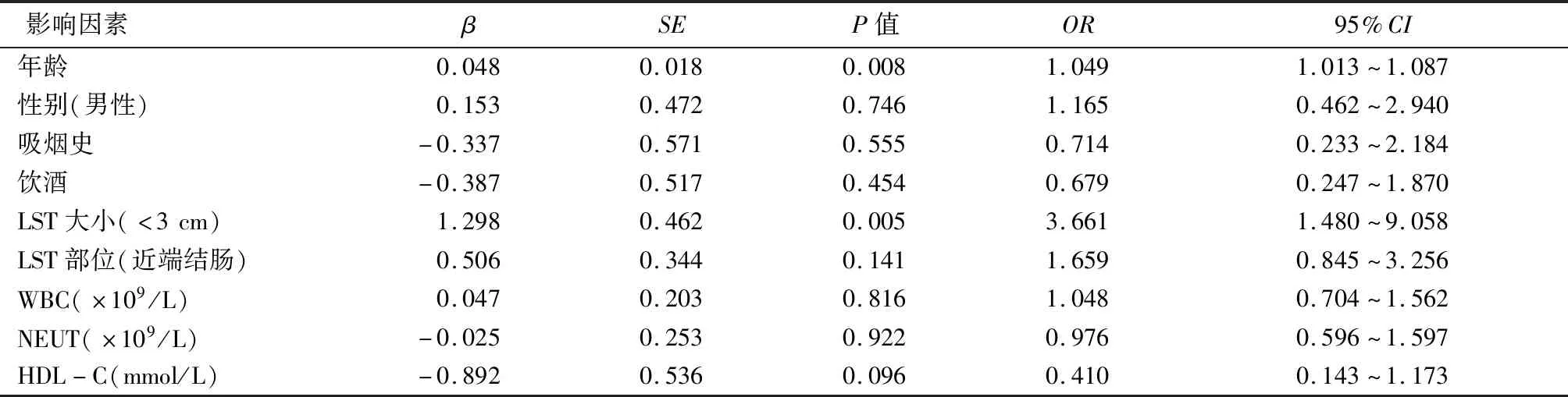
表2 LST伴结直肠息肉危险因素的二元logistic回归分析
LST伴结直肠息肉组的WBC计数、NEUT计数均高于LST不伴结直肠息肉组,HDL-C低于LST无伴结直肠息肉组,差异有统计学意义。近年研究提出炎症细胞在肿瘤微环境中发挥主要协调作用,促进增殖、生存和迁移,是不可或缺的参与者。其中,中性粒细胞、肥大细胞、嗜酸性粒细胞和活化的T淋巴细胞也在一定程度影响肿瘤的发生发展[16]。炎症发生期间,脂质不仅在数量上发生变化,而且在质量上也发生变化。炎症可损害胆固醇的正常运输,刺激代偿性改变,如LDL-C的合成,导致TG在肠道细胞中蓄积引起有害反应,血脂异常可诱导炎性细胞因子如IL-6和TNF-α的产生,并降低抗炎细胞因子如IL-10[17],这些变化为肿瘤微环境创造了有利条件[18]。提示炎症的常用指标是WBC和NEUT,但关于血细胞与LST及结直肠息肉的研究少见。我国一项涉及3066名受试者的横断面研究结果提示,患有结肠直肠息肉受试者的白细胞和红细胞计数、血红蛋白、血浆黏度、肌酐、尿酸和血小板计数高于未患结直肠息肉的受试者,血脂代谢参数TC和TG没有差异[1]。提示结直肠息肉的发生可能与炎症因子影响肠道微循环有关,但目前关于LST与血细胞分析及代谢方面的研究罕见,其关系尚未被阐明。结直肠息肉一般遵循腺瘤-癌序列模型演变为CRC,腺瘤-癌序列的分子改变包括肿瘤的遗传和表观遗传改变,包括抑制基因(APC、TP53和DCC)和致癌基因(KRAS)的激活[19]。一项研究报道了腺瘤性息肉和LST中的BRAF突变[20],结果提示部分LST可能通过锯齿状腺瘤途径发生,但也有报道LST可能通过腺癌-癌序列途径[21]发生。因此,息肉和非息肉样病变的发展及癌变途径可能存在一定的差异。LST与结直肠息肉的炎症及代谢途径是否存在相关性需要更进一步的研究。
综上所述,男性、有吸烟史、饮酒史,LST位于近段结肠、WBC及NUET计数较高、HDL-C计数较低是LST伴结直肠息肉的影响因素,且年龄、LST<3 cm作为LST伴结直肠息肉的独立危险因素,年龄越大,LST直径越小则LST伴结直肠息肉的风险越高。我们可以结合以上因素初步预测LST可能伴结直肠息肉。
利益冲突:所有作者声明不存在利益冲突

